L-酒石酸水溶液结晶介稳区和诱导期的测定
冷一欣,谭倩,黄春香,王俊,韶晖(常州大学石油化工学院,江苏 常州 364;江苏省先进催化与绿色制造协同创新中心,常州大学,江苏 常州 364)
L-酒石酸水溶液结晶介稳区和诱导期的测定
冷一欣1,谭倩1,黄春香2,王俊1,韶晖1
(1常州大学石油化工学院,江苏 常州 213164;2江苏省先进催化与绿色制造协同创新中心,常州大学,江苏 常州 213164)
摘要:在20~60℃温度范围内,采用激光法测定L-酒石酸在水中的结晶介稳区宽度和诱导期,分别研究了饱和温度、冷却速率和搅拌速率对L-酒石酸结晶介稳区宽度的影响以及过饱和度对L-酒石酸诱导期的影响。结果表明:结晶介稳区宽度随着饱和温度、搅拌速率的增大和冷却速率的降低而变窄,并推算出表观成核级数m,给出了成核速率方程,此外实验测定结晶诱导期随过饱和度S增大而变短,基于经典成核理论和诱导期数据,计算出L-酒石酸在水中20℃和25℃下的固液界面张力。
关键词:L-酒石酸;测量;结晶;介稳区宽度;成核;诱导期
2015-07-22收到初稿,2016-03-11收到修改稿。
联系人及第一作者:冷一欣(1961—),女,教授。
Received date: 2015-07-22.
引 言
L-酒石酸(tartaric acid,TA)是一种重要的多功能有机酸,被广泛应用于多个领域[1-3],它可作为饮料、糖果及果酱等食品的酸味剂,亦可用作防腐剂和稳定剂,此外它在制药、电镀、制革等行业也有广泛的用途。L-酒石酸本身有易结块特性,若操作不当,易造成产品粒度分布宽、粒径小,流动性差等问题,加剧结块,影响该产品的使用,故在工业结晶过程中通过改变该产品粒度来延缓结块时间。因此有必要对L-酒石酸结晶的热力学性质进行系统的研究。
在化工行业的发展历程中,结晶是最重要的分离和纯化方法之一。结晶产品的粒度分布、晶形、纯度与工业结晶过程的条件密切相关。要想得到高品质产品,必须避免溶液的自发成核,将结晶操作控制在介稳区内,才能得到晶形完美、粒度均匀的产品。固液体系的介稳区受诸多因素的影响,如温度[4]、搅拌速率[5]、冷却速率[6]、溶液体积[7]等。目前测定介稳区常用的方法有超声波法[8]、电导率法[9]、激光法[10]及聚焦光束反射测量专利技术[11-12]等。其中激光法具有响应快、灵敏度高、准确性好等优点,克服了以往各测定方法的缺陷,能够比较准确地探测到过饱和溶液中首批晶核的出现。
测定介稳区和诱导期的实验数据有利于优化结晶过程和结晶器的设计,从理论上分析冷却结晶过程的固液相平衡关系。然而,到目前为止,除了少数L-酒石酸溶解度数据[13]和DL-酒石酸在水溶液中的介稳区数据[14]以外,还没有关于L-酒石酸在水中介稳区宽度和诱导期的报道。本文运用静态法测定20~60℃下L-酒石酸在水中的溶解度,选择经典的λh理论模型对溶解度数据进行拟合;测定L-酒石酸在水中的介稳区宽度,考察饱和温度、冷却速率、搅拌速率对介稳区宽度的影响;采用激光法测定不同温度下L-酒石酸在水中结晶诱导期数据,这些数据旨在为工业结晶过程提供理论指导。
1 实验材料和方法
1.1材料
L-酒石酸(纯度≥99.9%),常茂生物化学工程股份有限公司;氢氧化钠(AR),国药集团化学试剂有限公司;邻苯二甲酸氢钾(PT),江苏永华化学科技有限公司;去离子水(电导率<5.0 µS·cm−1),自制。
1.2介稳区和诱导期激光测定装置
玻璃材质的夹套结晶器(泰兴市沪可玻璃制品有限公司);电子天平(梅特勒特里多仪器有限公司);DC-1006型低温恒温槽(上海恒平科学仪器有限公司);XMTD-701型恒温磁力搅拌器(丹徒环球机电配件厂);GY-11型激光功率指示仪和He-Ne激光器(天津市拓普仪器有限公司)。
1.3溶解度曲线的测定
采用静态法[15-17]测定L-酒石酸在水中的溶解度。准确称取一定量的L-酒石酸晶体加入带夹套的结晶器中,调节低温恒温槽使结晶器恒定在待测温度,开启磁力搅拌,至少搅拌6 h,使固液两相混合均匀,体系达到溶解平衡,随后停止搅拌,静置2 h,确保未溶晶体已完全沉淀。用预热过的带滤膜的5 ml注射器从上层清液中迅速取样,足量的去离子水稀释样品,用已知浓度的NaOH溶液滴定至微红色。根据滴定所得数据,计算溶液浓度。按照上述步骤平行测量3次,取计算结果平均值,作为该温度下L-酒石酸在该溶剂中的溶解度。体系温度由插入物料中的精密温度计测量,其测量误差为±0.05℃。
1.4结晶过程介稳区宽度测定
如图1所示,根据之前实验测得的溶解度数据准确配制一定浓度的L-酒石酸饱和溶液于右侧结晶器中,开启激光系统,使激光穿过后能在接收器上清晰接收。连通右侧水槽循环水,开启磁力搅拌仪使L-酒石酸全部溶解,调节恒温槽水温高于溶解温度5℃,保证溶质完全溶解,继续恒温30 min至激光记录仪示数基本不变。滴管吸取适量L-酒石酸溶液,用已知浓度的NaOH溶液进行滴定,计算浓度。保持转速不变,以恒定的冷却速率冷却,密切关注激光记录仪示数变化。当数值突然减小时,表示晶核开始析出,记录下此时温度计温度。以上步骤重复3次,取平均值。
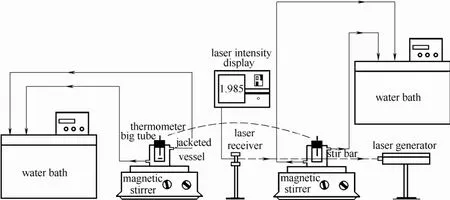
图1 介稳区和诱导期测定装置Fig. 1 Apparatus for metastable zone and induction time width measurements
1. 5结晶过程诱导期测定
在实际的结晶过程中,溶液从过饱和状态形成到新相粒子出现并被检测到的时间通常被定义为诱导期(induction period),诱导期(tind)通常由3部分组成[18-19]
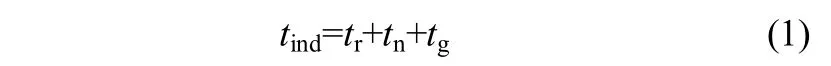
式中,tr为达到准稳态的松弛时间,tn为形成稳态晶核的时间,tg为晶核长到可检测的时间。一般情况下,松弛时间tr极短,常忽略不计,因此式(1)可以写成
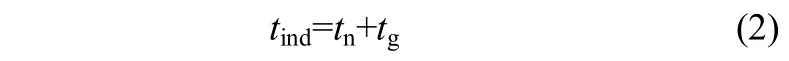
诱导期的波动范围长短不一,通常与介稳区一样,受到温度、过饱和度、搅拌强度及杂质等因素的影响。为了得到准确的数据,必须确定测定条件。本文采用双水浴来控制循环温度,通过激光法测定L-酒石酸在水中20℃和25℃时的诱导期数据。精确配制不同浓度的饱和溶液,在温度高于20℃和25℃的左侧结晶器中充分溶解,恒温30 min以确保体系平衡,迅速放入已经恒温的右侧结晶器中,同时开启秒表记录时间,并快速调整好激光光路,使激光接收器在合适的位置接收激光。随着时间的推移,溶液开始成核,当激光显示器信号突然降低时,停止计时,记录的时间即为该条件下的诱导期,每个实验点重复3次取平均值。
2 实验结果与讨论
2.1溶解度
将实验测定的L-酒石酸在水中的溶解度实验值与文献值[13]比较,由表1可知,实验值与文献值相吻合,表明本实验的测定方法误差小,实验装置和方法是可行的。
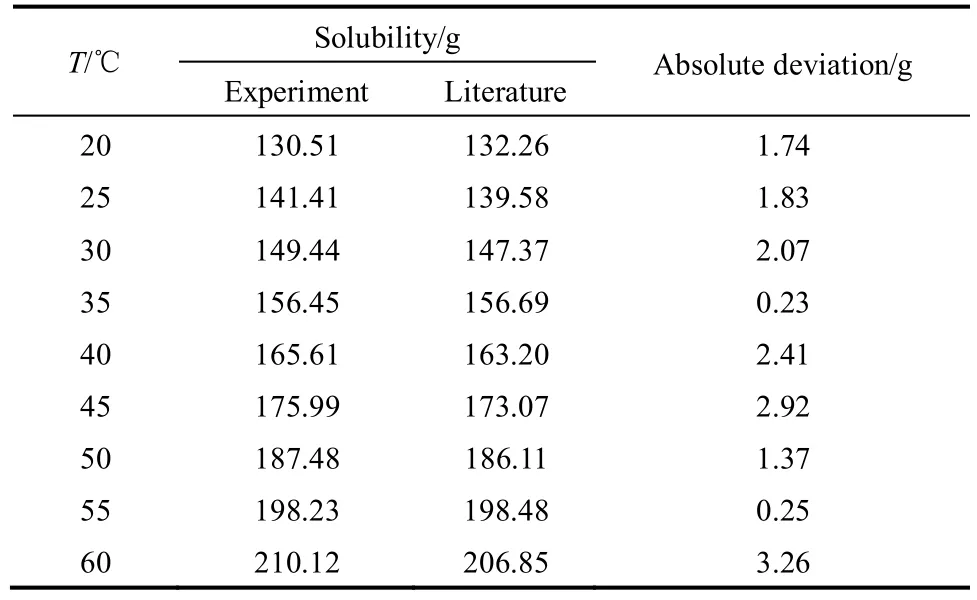
表1 水溶液中L-酒石酸溶解度实验值与文献值的比较Table 1 Comparison of solubility of L-tartaric acid in aqueous solution between experiment and literature
由表1可知,L-酒石酸在水中的溶解度随着温度升高而逐渐增大。溶解度的关联方程有很多,本文采用λh方程对L-酒石酸在水中的溶解度数据进行了关联拟合,见式(3)。Buchowski等[20-21]根据固液溶解相平衡理论提出了著名的λh方程

式中,x为L-酒石酸溶解度的摩尔分数mol·mol−1;T为热力学温度;Tm为L-酒石酸的熔点,K;λ和h是拟合得出的方程模型参数。拟合结果的优劣用相关系数R2和均方根偏差RMSD(root mean square deviations)来判断
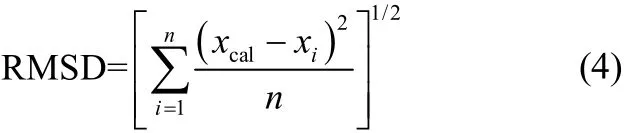
式中,n为实验点数,xcal为溶解度的拟合计算值,xi为溶解度的实验测定值。
拟合结果:λ = 0.014,h = 5202.183,RMSD = 4.749×10−4以及R2= 0.9991。RMSD 和R2表明λh方程可以很好地拟合L-酒石酸的溶解度数据,并且可计算其他温度下L-酒石酸在水中的溶解度,为后续结晶操作提供理论依据。
2.2结晶过程介稳区宽度
介稳区是指物系的超溶解度曲线与溶解度曲线之间的区域,介稳区对控制结晶过程的成核数目和微晶非常重要。本文主要考察饱和温度、冷却速率以及搅拌速率对介稳区宽度的影响。
2.2.1饱和温度(T0)对L-酒石酸在纯水中介稳区的影响实验过程中控制溶液质量分别为80.0 g和60.0 g,冷却速率为3.0℃/5 min,搅拌速率为600 r·min−1。测定L-酒石酸在水中的介稳区宽度,实验结果如图2所示。
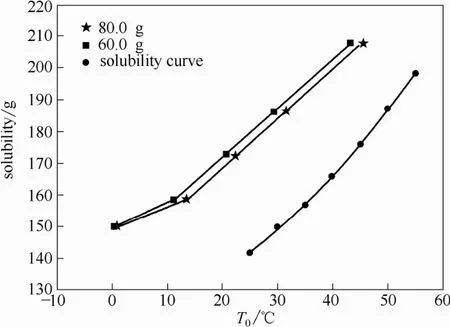
图2 水中L-酒石酸的介稳区Fig.2 Metastable zone of L-tartaric acid in water
图2表明,L-酒石酸在水中的超溶解度随温度的变化趋势与溶解度随温度的变化趋势基本一致,但T0的升高会使介稳区宽度有所减小。产生这种结果主要是因为温度升高,L-酒石酸溶解度增大,单位体积溶液分子密度随之变大,加之分子热运动加剧,使得L-酒石酸分子结合成核的概率增大。由图2还可看出,溶液质量的影响并不十分明显,这是因为尽管质量增加,体积变大,但溶液浓度并没有改变,单位体积溶液中溶质分子个数不变,热量均匀分布,所以若溶液质量小幅度改变,也不会对介稳区产生显著影响。Zhang等[14]测了DL-酒石酸在水溶液中的介稳区,L-酒石酸的介稳区比DL-酒石酸的介稳区宽,这说明在相同冷却结晶操作条件下,降低同样的温度,L-酒石酸的推动力小,不易于成核。
2.2.2冷却速率(b)对介稳区的影响实验中控制溶液质量为60.0 g,搅拌速率为600 r·min−1。测定b分别为2.0℃/5 min、3.0℃/5 min、4.0℃/5 min、5.0℃/5 min和6.0℃/5 min时不同T0下L-酒石酸在水中介稳区宽度。将∆Tmax的对数与b的对数作图,如图3所示。

图3 纯水中冷却速率对L-酒石酸介稳区宽度的影响Fig.3 Effect of cooling rate on metastable zone of L-tartaric acid in water
图3表明,恒定T0时,随着b的增大,介稳区宽度会变大。b一定时,随着T0的减小,介稳区宽度会变大,这是因为T0减小,溶液浓度随之减小,造成溶液中溶质分子之间的距离变大,从而降低它们之间相互碰撞结合成为晶核的概率。
经典的Nývlt模型理论研究表明[22],当搅拌速率一定时,结晶介稳区宽度与冷却速率的关系为
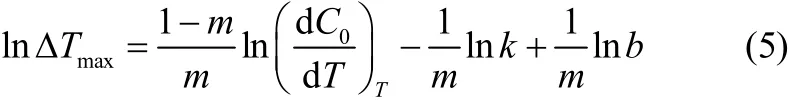
式中,b为冷却速率,℃·h−1;∆Tmax为最大过冷度,℃;C0为溶解度;k为成核速率常数;m为表观成核级数。将不同T0下的L-酒石酸在水中的结晶介稳区宽度实验数据进行拟合
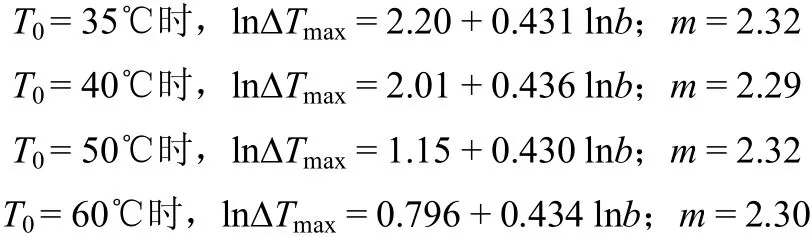
拟合结果显示成核级数m与T0无关,ln∆Tmax与lnb呈线性关系,直线的斜率基本平行但并不是绝对平行的,这主要是由于测量过程中不可避免的误差所致,可以用式(6)进行修正[23]。
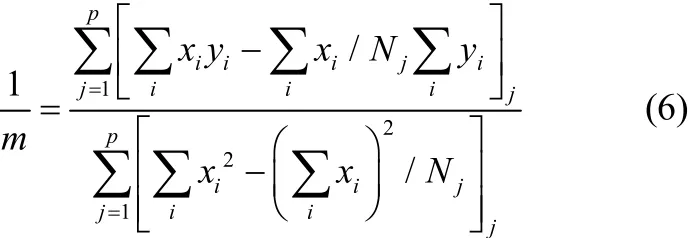
式中,xi代表ln(b)i,yi代表ln(∆Tmax)i,p代表直线的数量,Nj为冷却速率点数。计算值为0.433,据此可知L-酒石酸的表观成核级数为2.31。L-酒石酸水溶液的表观成核级数的值较低表明大量晶核的形成是受爆发成核机理所控制[24]。此外,相对较低的m值也说明了由于溶液中生长单元的聚集很容易形成稳定的3D晶核。当溶质-溶剂相互作用力及溶质浓度较高时,这一现象尤为显著[25]。在L-酒石酸结晶过程中,应根据具体的情况选择最适宜的b,做到既可以避免爆发成核,得到较大的结晶产品,又尽可能地缩短过程时间,提高单位时间的生产能力。
2.2.3搅拌速率对介稳区的影响实验中控制溶液质量为60.0 g,冷却速率为3.0℃/5 min,测定搅拌速率分别为100、200、300、500、700 r·min−1时不同T0下L-酒石酸在水中的介稳区宽度。
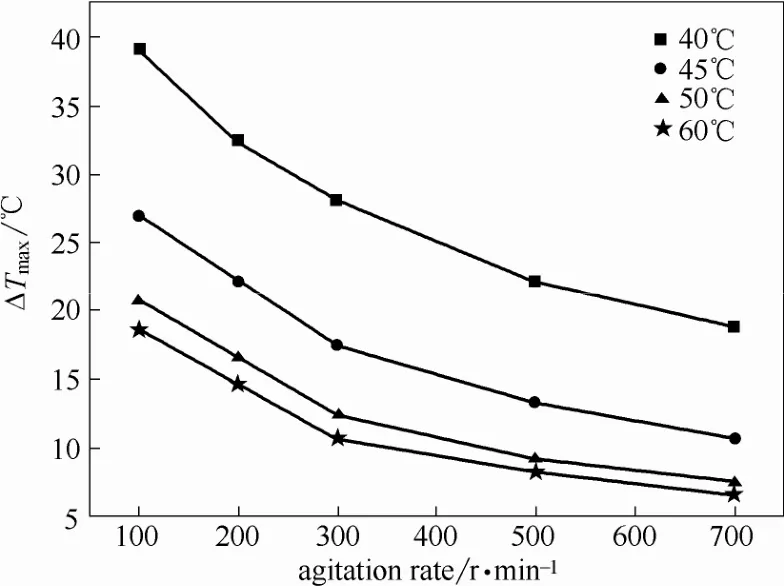
图4 纯水中搅拌速率对L-酒石酸介稳区宽度的影响Fig.4 Effect of agitation rate on metastable zone of L-tartaric acid in water
图4表明,T0一定时,随着搅拌速率的增大,L-酒石酸在水中的介稳区宽度明显减小。这是因为随着搅拌速率的加快,生长单元在搅拌桨周围聚集,这是一种表面诱导非均相成核。此外Kubota[26]指出,当溶液中已形成少量晶核时,搅拌速率的增加使二次成核速率显著提高,因此溶液中可检测到的晶核的密度增加,继而仪器能提前检测到成核现象的发生。
2.3诱导期的测定
实验采用激光法分别测定了L-酒石酸水溶液在20℃和25℃条件下的成核诱导期。
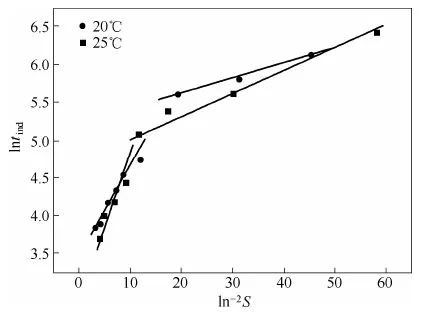
图5 lntind对ln−2S的关系Fig.5 Relationship between lntindwith ln−2S
图5表明,在恒定温度下,随着过饱和度S的增加,L-酒石酸的成核速率增加,结晶诱导期随之减小,晶核出现所需的时间变短。图5中,lntind与ln−2S的关系用两条直线来关联,这两条直线具有不同的斜率,它们分别对应均相成核和非均相成核。在高过饱和度时,初级成核速度很快,成核过程以均相成核为主,在低过饱和度时,则以非均相成核为主。根据Mullin[18]报道,对于均相成核过程,成核诱导期与成核速率呈反比
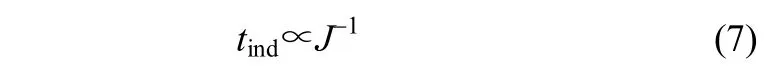
所以经典成核理论下,球状晶核的成核速率可表示为
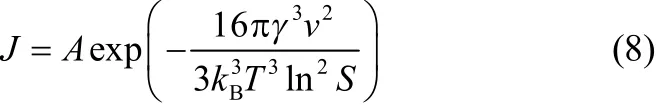
式中,J为成核速率,S为过饱和度(S = C/C0,C为溶质的浓度,C0为溶质的溶解度),v为分子体积,kB为Boltzmann常数,γ为固液界面张力,T为热力学温度。
联立式(7)与式(8),可得诱导期tind与过饱和度S之间的关系
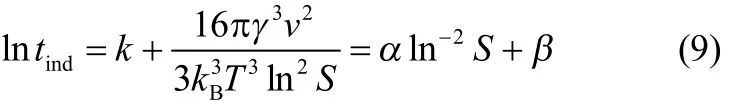
式(9)表明,恒定温度下,lntind和ln−2S的关系是线性关系,其斜率α为

因此,在给定温度及溶剂组成下,体系固液界面张力γ可由诱导期求得
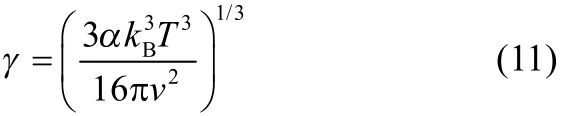
式(9)的拟合参数α和β及相关系数R2列于表2中。在高过饱和度下,结晶成核的方式为均相成核,在文献所述及拟合结果的基础上即可求得L-酒石酸在20℃和25℃下的固液界面张力,其值分别为2.78和3.01 mJ·m−2。在均相成核速率方程中,固液界面张力是影响晶体成核和生长理论的重要影响因素[27]。从成核理论考虑,很大程度上决定着结晶过程中的晶体生长机理。L-酒石酸在水溶液中界面能值相对较小,可能是因为实验中出现了非均相成核。在实际实验过程中,溶液不可能完全纯净,不可避免会包含外界颗粒,如空气和溶液中的灰尘,这些外来颗粒在一定程度上降低成核自由能壁垒,诱导晶核生成,因此初级非均相成核可以发生在比均相成核低得多的过饱和度下[28]。应予指出,利用式(11)得到的固液界面张力估算值只有在比较窄的过饱和度范围内才成立。
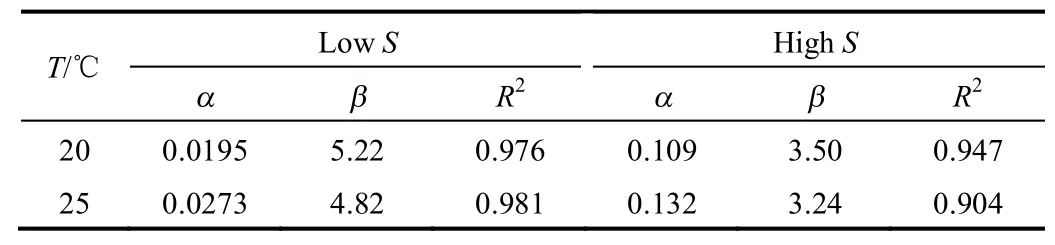
表2 L-酒石酸在水中结晶诱导期的拟合参数Table 2 Fitting parameters of induction period of L-tartaric acid in water
3 结 论
(1)测定了L-酒石酸在水中的溶解度。结果表明L-酒石酸的溶解度随温度的升高而增大。采用经典的λh方程对L-酒石酸的摩尔分数溶解度进行了关联拟合,拟合数据可用于估计L-酒石酸其他温度下的溶解度。
(2)测定了L-酒石酸在水中的介稳区,分别考察了饱和温度、溶液质量、冷却速率及搅拌速率等因素对介稳区宽度的影响。结果表明,L-酒石酸在水中的超溶解度曲线与溶解度曲线变化趋势基本一致,只是随着T0的升高介稳区宽度有所减小,溶液质量对介稳区宽度影响较小;在一定的T0下,其他条件不变时,随着b的增大,介稳区宽度会变宽,而随着搅拌速率的增大,介稳区宽度逐渐变窄。此外,采用经典Nývlt模型对介稳区宽度及b进行拟合,得出表观成核级数m = 2.29~2.32,修正后的值为2.31。
(3)测定了L-酒石酸在水中的结晶诱导期,结果表明过饱和度S越大,结晶诱导期时间越短;将lntind对ln−2S线性拟合,其关系可用两条直线来关联,这两条直线具有不同的斜率,它们分别对应均相成核和非均相成核,基于经典的成核理论,计算出L-酒石酸在水中20℃和25℃下的固液界面张力γ分别为2.78和3.01 mJ·m−2。
符号说明
b——冷却速率,℃·h−1
C0——溶质的溶解度,mol·mol−1
h——λh方程参数
J——成核速率
k——成核速率常数
kB——Boltzmann常数,J·K−1
m——表观成核级数
Nj——冷却速率点数
p——直线的数量
RMSD——均方根偏差
R2——相关系数
S——过饱和度
T——热力学温度,℃
Tm——熔点,K
T0——饱和温度,℃
∆Tmax——最大过冷度,℃
tg——晶核长到可检测的时间,s
tind——诱导期,s
tn——形成稳态晶核的时间,s
tr——松弛时间,s
v——分子体积,m3
x——溶解度,mol·mol−1
xi——ln(b)i
yi——ln(∆Tmax)i
λ——λ h方程参数
γ——固液界面张力,mJ·m−2
References
[1]BUDAVARI S, O’NEAL M J, SMITH A, et al. The Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals [M]. 12th ed. New Jersey: Merck & Co., Inc., 1996: 1433.
[2]YANG W G, WANG K, HU Y H, et al. Solubility of l-tartaric acid in ethanol, propanol, isopropanol, n-butanol, acetone and acetonitrile [J]. J. Solution Chem., 2013, 42(3): 485-493.
[3]WANG X F, ZHANG X Y, BLACK S, et al. Solid-liquid equilibrium of D- and L-tartaric acid and their importance for enantioseparation [J]. J. Chem. Eng. Data, 2012, 57(6): 1779-1786.
[4]张磊, 应汉杰, 吕浩, 等. 乙醇-水混合溶剂中5′-尿苷酸二钠的结晶介稳区 [J]. 化工学报, 2008, 59(6): 1348-1353. ZHANG L, YING H J, LÜ H, et al. Metastable zone of 5′-UMPNa2in ethanol-aqueous mixture [J]. Journal of Chemical Industry and Engineering(China), 2008, 59(6): 1348-1353.
[5]MITCHELL N A, FRAWLEY P J. Nucleation kinetics of paracetamol-ethanol solutions from metastable zone widths [J]. J. Cryst. Growth, 2010, 312(19): 2740-2746.
[6]NI X W, LIAO A T. Effects of cooling rate and solution concentration on solution crystallization of L-glutamic acid in an oscillatory baffled crystallizer [J]. Cryst. Growth Des., 2008, 8(8): 2875-2881.
[7]MIELNICZEK B E. Effect of sample volume on the metastable zone width of potassium nitrate aqueous solutions [J]. J. Cryst. Growth, 2014, 401: 271-274.
[8]TITIZ S S, ULRICH J. Influence of additives on the width of the metastable zone [J]. Cryst. Growth Des., 2002, 2(5): 371-374.
[9]LYCZKO N, ESPITALIER F, LOUISNARD O, et al. Effect of ultrasound on the induction time and the metastable zone widths of potassium sulphate [J]. Chem. Eng. J., 2002, 86(3): 233-241.
[10]李阳, 王保伟, 许根慧, 等. 激光散射法测定草酸结晶介稳区 [J].化工学报, 2000, 51(2): 274-277. LI Y, WANG B W, XU G H, et al. Measurement of crystallizing metastable zone of oxalic acid in aqueous solution with laser scattering method [J]. Journal of Chemical Industry and Engineering(China), 2000, 51(2): 274-277.
[11]BARRETT P, GLENNON B. Characterizing the metastable zone width and solubility curve using lasentec FBRM and PVM [J]. Chem. Eng. Res. Des., 2002, 80(7): 799-805.
[12]王杏, 宋兴福, 许妍霞, 等. 黑钛液中七水硫酸亚铁结晶动力学性质 [J]. 化工学报, 2014, 65(11): 4430-4436. WANG X, SONG X F, XU Y X, et al. Crystallization kinetics of FeSO4·7H2O in black titanium solution [J]. CIESC Journal, 2014, 65(11): 4430-4436.
[13]APELBLAT A, MANZUROLA E. Solubility of oxalic, malonic, succinic, adipic, maleic, malic, citric, and tartaric acids in water from 278.15 to 338.15 K [J]. J. Chem. Thermodyn., 1987, 19(3): 317-320.
[14]ZHANG X Y, WANG X F, HAO L, et al. Solubility and metastable zone width of DL-tartaric acid in aqueous solution [J]. Cryst. Res. Technol., 2012, 47(11): 1153-1163.
[15]PIRES R F, FRANCO J M R. Solubility of salicylic acid in water + salt (NaCl, KCl, NaBr, Na2SO4and K2SO4) at 293.5—313.3 K[J]. Fluid Phase Equilib., 2012, 330(0): 48-51.
[16]YUAN Y, LENG Y X, SHAO H, et al. Solubility of DL-malic acid in water, ethanol and in mixtures of ethanol + water [J]. Fluid Phase Equilib., 2014, 377(15): 27-32.
[17]LENG Y, QI H C. Solubility of aspartame in water, methanol, ethanol and different binary mixtures in the temperature range of (278.15 to 333.15) K [J]. J. Chem. Eng. Data, 2014, 59(5): 1549-1555.
[18]MULLIN J W. Crystallization [M]. 4th ed. London: Butterworth-Heinemann, 2001: 206.
[19]LUNDAGER M H E. Theory of long induction periods [J]. J. Cryst.Growth, 1987, 80(2): 371-377.
[20]BUCHOWSKI H, KSIAZCZAK A, PIETRZYK S. Solvent activity along a saturation line and solubility of hydrogen-bonding solids [J]. J. Phys. Chem., 1980, 84(9): 975-979.
[21]KSIAZCZAK A, MOORTHI K, NAGATA I. Solid-solid transition and solubility of even n-alkanes [J]. Fluid Phase Equilib., 1994, 95(8): 15-29.
[22]NYVLT J. Kinetics of nucleation in solutions [J]. J. Cryst. Growth, 1968, 3/4: 377-383.
[23]李丽丽, 董亚萍, 彭姣玉, 等. 硫酸镁对硼酸介稳区性质的影响[J]. 盐湖研究, 2013, 21(1): 38-43. LI L L, DONG Y P, PENG J Y, et al. The effect of magnesium sulfate on the metastable zone property of boric acid [J]. J. Salt Lake Res., 2013, 21(1): 38-43.
[24]KASHCHIEV D, BORISSOVA A, HAMMIND R B, et al. Effect of cooling rate on the critical undercooling for crystallization [J]. J. Cryst. Growth, 2010, 312(5): 698-704.
[25]SANGWAL K. A novel self-consistent Nývlt-like equation for metastable zone width determined by the polythermal method [J]. Cryst. Res. Technol., 2009, 44(3): 231-247.
[26]KUBOTA N. A new interpretation of metastable zone widths measured for unseeded solutions [J]. J. Cryst. Growth, 2008, 310(3): 629-634.
[27]USHASREE P, MURALIDHARAN R, JAYAVEL R, et al. Metastable zonewidth, induction period and interfacial energy of zinc tris (thiourea) sulfate [J]. J. Cryst. Growth, 2000, 210(4): 741-745.
[28]丁绪淮, 谈遒. 工业结晶 [M]. 北京: 化学工业出版社, 1985: 79. DING X H, TAN Q. Industrial Crystallization [M]. Beijing: Chemical Industry Press, 1985: 79.
Determination of metastable zone width and induction period of L-tartaric acid aqueous solution
LENG Yixin1, TAN Qian1, HUANG Chunxiang2, WANG Jun1, SHAO Hui1
(1School of Petrochemical Engineering, Changzhou University, Changzhou 213164, Jiangsu, China;2Advanced Catalysis and Green Manufacturing Collaborative Innovation Center, Changzhou University, Changzhou 213164, Jiangsu, China)
Abstract:The crystallization metastable zone width and induction period of L-tartaric acid in water were measured by laser method at the temperature range of 20—60℃. The influences of saturation temperature, cooling rate and agitation rate on the metastable zone width and the effect of supersaturation on the induction period were explored, respectively. The results showed that the crystallization metastable zone width became narrow with rising saturation temperature and agitation rate, and decreasing cooling rate. The apparent nucleation series m and the nucleation rate equation were given. Furthermore, the experimentally measured crystallization induction period decreased with increasing supersaturation S. The solid-liquid interfacial tension of L-tartaric acid in water was calculated at 20℃ and 25℃ on basis of the classical nucleation theory and induction period data.
Key words:L-tartaric acid;measurement;crystallization;metastable zone width;nucleation;induction period
中图分类号:TS 202.3
文献标志码:A
文章编号:0438—1157(2016)06—2433—07
DOI:10.11949/j.issn.0438-1157.20151174
Corresponding author:Prof. LENG Yixin, lengyixin61@163.com

