重组毕赤酵母发酵生产α-葡聚糖酶的放大研究
黄曾慰,吴兆鹏,常国炜,黎志德,张九花,曾练强,梁达奉,2*
(1广州甘蔗糖业研究所 广东省甘蔗改良与生物炼制重点实验室,广东广州510316;2广西糖业研发中心,广西南宁530002)
重组毕赤酵母发酵生产α-葡聚糖酶的放大研究
黄曾慰1,吴兆鹏1,常国炜1,黎志德1,张九花1,曾练强1,梁达奉1,2*
(1广州甘蔗糖业研究所 广东省甘蔗改良与生物炼制重点实验室,广东广州510316;2广西糖业研发中心,广西南宁530002)
研究了毕赤酵母高密度发酵组成型表达α-葡聚糖酶,从6.8 L发酵罐逐级放大至5000 L发酵罐的放大工艺。采用恒定pH和控制甘油残留浓度和溶解氧相结合的调控策略,进行了多批次的发酵试验。结果表明:三磷酸甘油醛脱氢酶启动子驱动的α-葡聚糖酶的生成具有生长偶联特征,集中在对数生长期和稳定期。6.8 L发酵罐中上清酶活达1253 U/mL,中试放大至50 L发酵罐中产酶最高达1300 U/mL,500 L发酵罐中酶活为740 U/mL。5000 L规模发酵罐中产酶达到589 U/mL。建立了以甘油作为碳源,发酵调控简单的工艺,避免了使用甲醇带来的安全问题,适合放大生产。
α-葡聚糖酶;毕赤酵母;组成型表达;发酵放大
0 前言
甘蔗制糖生产过程中出现的α-葡聚糖是高分子粘性多糖,又称右旋糖酐,俗称“蔗饭”。其存在导致粘度增大,澄清过滤、蒸发结晶受影响,收回降低,质量下降。在制糖工业中应用α-葡聚糖酶(Dextranase)能快速高效清除蔗汁等物料中的α-葡聚糖,提高糖分收回和产品质量,具有安全高效、用量小的特点[1-2]。
通过基因工程菌异源表达是量产α-葡聚糖酶的较为可行的途径。巴斯德毕赤酵母(Pichia pastoris)能够高效分泌表达外源蛋白,背景蛋白少,分离纯化容易,培养成本低。因此,毕赤酵母真核表达系统在近20年来获得了广泛应用,数百种基因在该系统中成功表达[3-4]。多位学者报道了在毕赤酵母中以AOX(醇氧化酶)启动子驱动α-葡聚糖酶基因表达,此类工程菌须以甲醇作为诱导物[5-7]。然而利用甲醇作为碳源进行较大规模的发酵时,存在生产安全和食品安全隐患。
毕赤酵母的GAP(三磷酸甘油醛脱氢酶)启动子可以不依赖诱导物,利用葡萄糖或甘油等碳源组成型表达外源蛋白[8]。目前基于GAP启动子驱动的表达还未形成通用的发酵调控策略。Kirsten等采用间歇补料,以葡萄糖为碳源发酵产疏水蛋白[9]。Fei等通过恒速流加葡萄糖胞内表达谷胱甘肽合成相关酶[10]。Goodrick等在补料分批发酵和连续发酵过程中恒速流加甘油或葡萄糖[11]。Guan等通过维持DO(溶解氧)25%~40%之间进行发酵[12]。组成型表达在大规模生产方面有很好的应用前景,但是有关中试放大的研究报道较少。Zhao等通过调控pH和指数流加,中试放大至800 L发酵罐[13]。江学斌采用分段控制工艺使木聚糖酶10 m3发酵水平比50 L发酵罐提高了23%[14]。本研究对毕赤酵母工程菌产α-葡聚糖酶进行高密度发酵,探索了从6.8 L至5000 L发酵罐的中试放大工艺。
1 材料与方法
1.1材料和仪器
1.1.1菌株
组成型表达α-葡聚糖酶的重组毕赤酵母(Pichia pastoris),菌株名为KM71H/pGAPZα-dex,由本实验室构建并保藏。其整合表达载体为pGAPZαA,分泌信号肽序列为α-MF,外源基因来源为根据朱黄青霉(Penicillium minioluteum) α-葡聚糖酶氨基酸序列(GenBank GI:37927147),经密码子优化后合成。
1.1.2主要试剂和仪器
Dextran T2000购自Pharmacia公司;其他试剂为国产分析纯;高速离心机购自美国Thermo公司;紫外可见分光光度计为北京普析通用公司产品;全温度培养振荡器为上海苏坤公司产品;LDZS型立式压力蒸汽灭菌器为上海申安医疗器械厂产品;6.8 L BIOSTAT Aplus发酵罐为B.BRAUN公司产品;pH 和DO电极为METTLER TOLEDO公司产品;程序可调式蠕动泵为河北兰格公司生产。
1.1.3培养基
YPD(酵母浸出粉胨葡萄糖琼脂培养基):20 g/L葡萄糖,10 g/L酵母粉,20 g/L蛋白胨,20 g/L琼脂。
YPG(酵母浸出粉胨甘油培养基):10 g/L酵母粉,20 g/L蛋白胨,50 g/L甘油。
PTM1(微量元素)溶液成分为:6.0 g/L CuSO4·5H2O, 0.08 g/L KI,3.0 g/L MnSO4·H2O,0.2 g/L Na2MoO4·2H2O,0.02 g/L H3BO3,0.5 g/L CoCl2,20 g/L ZnCl2,65 g/L FeSO4·7H2O, 0.2 g/L Biotin,5 mL/L 98% H2SO4。
BSM(基础盐培养基):100 g/L Glycerol,0.93 g/L CaSO4·2H2O,18.2 g/L K2SO4,14.9 g/L MgSO4·7H2O,4.13 g/L KOH,26.7 mL/L 85% H3PO4。
补料培养基:100%甘油,12 mL/L PTM1微量元素溶液。流加25%氨水调节培养基pH以及补充氮源。
1.2实验方法
1.2.1种子培养
一级种子:将重组毕赤酵母于YPD斜面划线活化,30℃培养48 h后转接入装有50 mL YPG培养基的250 mL三角瓶中,30℃,200 r/min,摇床培养至OD600=15。
二级种子:取50 mL一级种子接入装有450 mL YPG培养基的2500 mL三角瓶中,30℃,200 r/min,培养至OD600=15。
1.2.26.8 L发酵罐补料分批培养
一级种子培养至OD600=15,将300 mL 种子液接入装有2.7 L BSM培养基的6.8 L发酵罐中,起始体积为3 L。每升BSM培养基中加入4 mL PTM1微量元素溶液。培养条件为30℃,pH 5.5。随着菌体生长,溶氧逐渐降低,此时开始逐步调整通气量与搅拌转速,控制DO 20%~30%。当培养基中甘油浓度低于1% 时,开始流加补料培养基,维持甘油浓度为1%~2.5%,适时调节转速和通气量维持DO 10%~20%,直至发酵终点。
1.2.350 L发酵罐补料分批培养
27 L BSM培养基装于50 L发酵罐中,按10%接种量,将3 L二级种子接入50 L发酵罐,起始体积为30 L。每升培养基中加入4 mL PTM1微量元素溶液。培养条件为30℃,pH 5.5,发酵调控同6.8 L发酵罐。
1.2.4500 L发酵罐补料分批培养
50 L发酵罐接入二级种子后作为三级种子罐,培养至OD600=15即为种子液。270 L BSM培养基装于500 L发酵罐中,按10%接种量,将30 L种子液接入,起始体积为300 L。每升培养基中加入4 mL PTM1微量元素溶液。培养条件为30℃,pH 5.5,发酵调控同6.8 L发酵罐。
1.2.55000 L发酵罐补料分批培养
以500 L发酵罐作为四级种子罐,培养至OD600=15即为种子液。2700 L BSM培养基装于5000 L发酵罐中,按10%接种量,将300 L种子液接入,起始培养体积为3000 L。每升培养基中加入4 mL PTM1微量元素溶液。培养条件为30℃,pH 5.5,发酵调控同6.8 L发酵罐。
1.2.6发酵液细胞湿重测定
取1.0 mL发酵液置于1.5 mL离心管中,12000 r/min离心5 min,弃上清,小心擦去管壁附着的清液后称得总重。总重扣除空离心管质量即为细胞湿重。
1.2.7酶活测定
酶活定义:采用DNS法,在45℃、pH 5.5条件下,每分钟催化底物水解产生1 μmol葡萄糖所需的酶量为1个酶活单位,以U表示。发酵液经12000 r/min离心5 min,取上清液,经稀释适当倍数后作为待测定酶液。取900 μL 0.02 g/mL的Dextran T2000溶液作为反应底物,置于45℃恒温水浴中预热5 min,加入100 μL酶液,反应10 min。加入2 mL DNS试剂以终止反应,沸水浴5 min,然后迅速将其冷却,用蒸馏水定容至25 mL,于540 nm测定吸光值。从标准曲线的回归方程求得相对应的葡萄糖的量,并计算出酶活。
1.2.8甘油浓度的测定
采用高碘酸法。甘油被过量高碘酸氧化后,高碘酸被还原为碘酸。过剩的高碘酸及产物碘酸与碘化钾反应析出碘。用硫代硫酸钠滴定碘,经计算求得甘油含量。
2 结果与分析
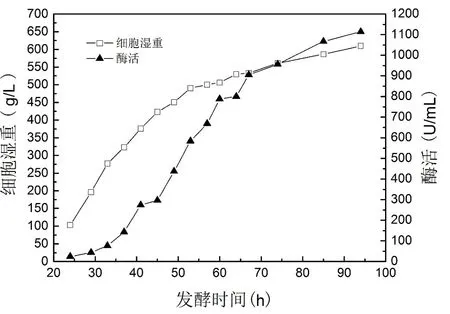
图1 6.8 L发酵罐补料分批培养条件下的生长曲线和酶活曲线
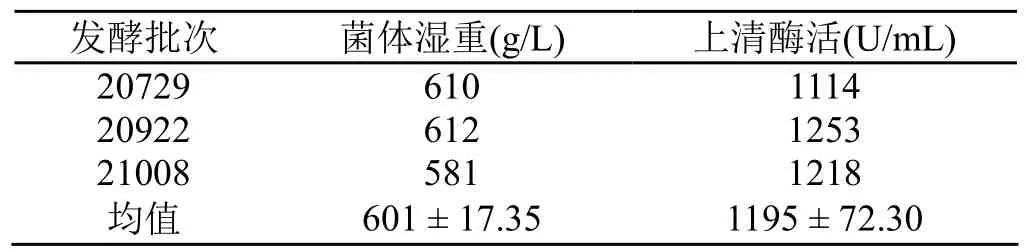
表1 6.8 L发酵罐3批发酵结果
2.250L发酵罐补料分批培养
50 L发酵罐的中试放大结果如图2所示。细胞于30 h后进入对数期,70 h后进入稳定期。至90 h发酵结束,湿重达到709 g/L,发酵上清液中酶活达到1048 U/mL。表2显示了2个批次的50 L发酵罐实验结果。与6.8 L发酵罐培养结果相比,酶活水平接近,但菌体湿重明显提高。
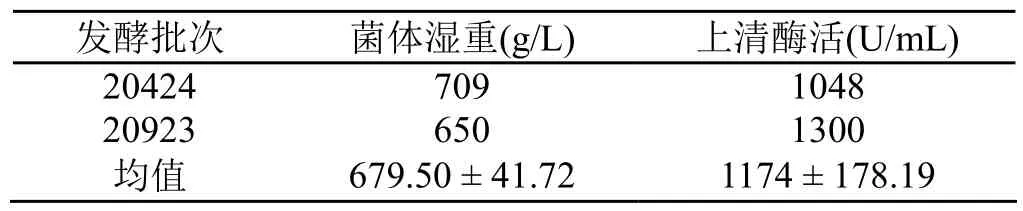
表2 50 L发酵罐2批发酵结果
2.3500L发酵罐补料分批培养
图3显示了500 L发酵罐放大培养过程。细胞生长于20 h后进入对数期,65 h后进入稳定期。至92 h发酵结束,湿重达到469 g/L,发酵上清液中酶活达到640 U/mL。表3显示了3个批次的500 L发酵罐实验结果。与6.8、50 L发酵罐培养结果相比,湿重和酶活均降低。
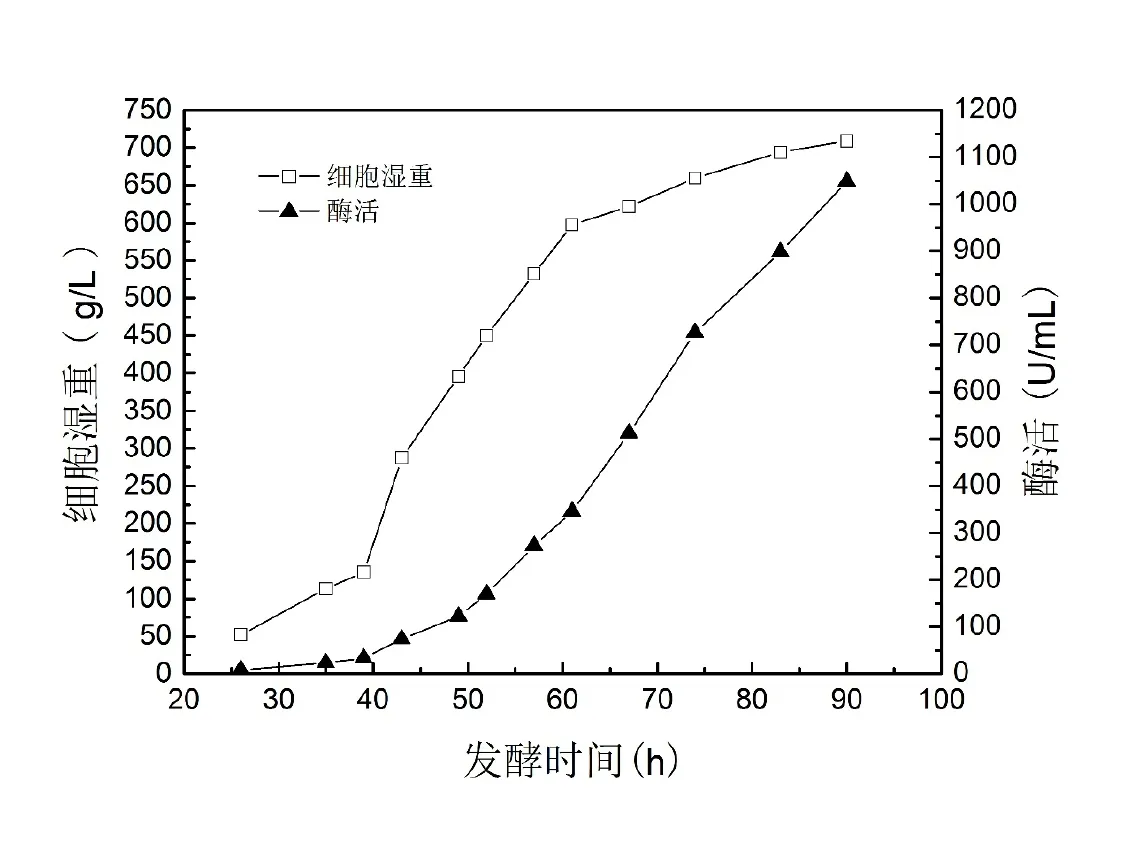
图2 50 L发酵罐补料分批培养条件下的生长曲线和酶活曲线
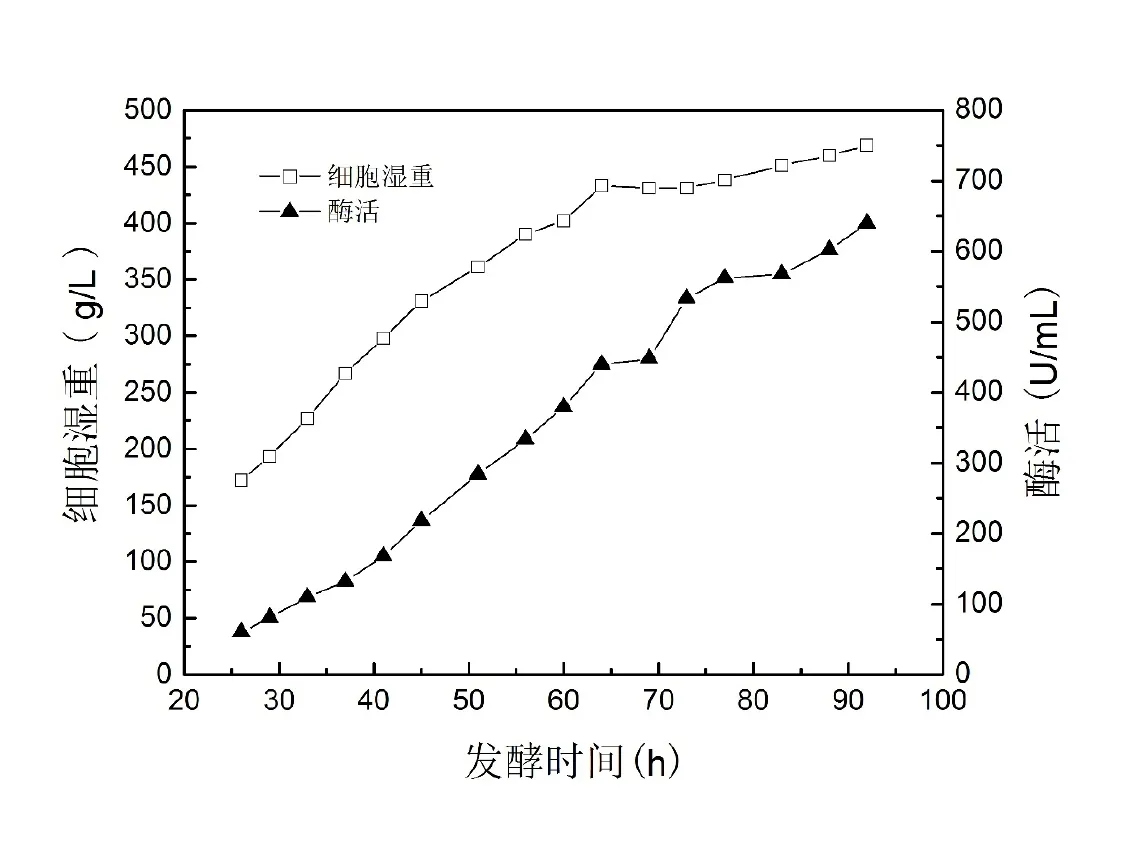
图3 500 L发酵罐补料分批培养条件下的生长曲线和酶活曲线
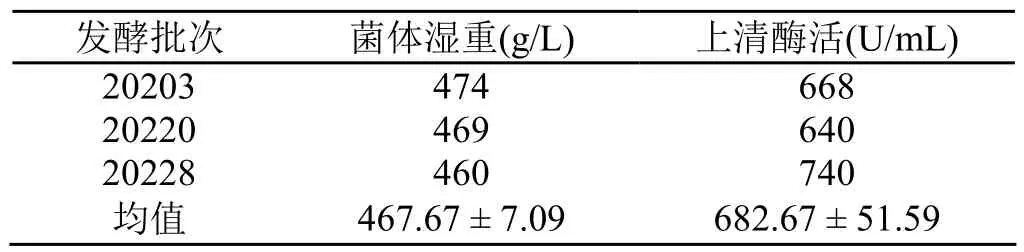
表3 500 L发酵罐3批发酵结果
2.45000L发酵罐补料分批培养
5000 L工业发酵罐培养结果如图4所示。至94 h发酵结束,湿重达到492 g/L,发酵液酶活达到505 U/mL。表4列出了3个批次的5000 L发酵罐实验结果,工艺总体上比较稳定。
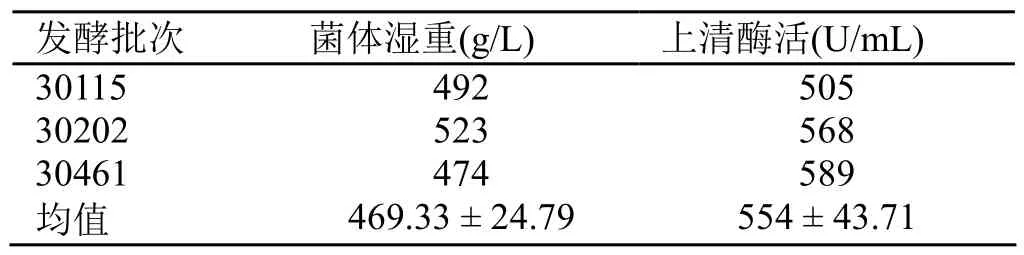
表4 5000 L发酵罐3批发酵结果
GAP启动子驱动表达的补料分批发酵培养基本划分为2个阶段。首先是分批发酵阶段,通常以葡萄糖或甘油作为碳源,从接种至初始碳源耗竭,通常持续20~30 h。此后进入补料流加阶段,流加碳源类型一般与初始碳源相同,不作变动。同时流加氨水以调节pH和补充氮源。细胞逐渐进入高密度发酵阶段,大部分目标产物也在这一阶段产生。高密度发酵后期,细胞的死亡率大幅提高,蛋白酶在发酵液中积累可使产物不同程度地降解。至发酵结束,流加阶段通常持续50~80 h。
综合比较从6.8 L放大至5000 L发酵罐多批次的结果(图5),毕赤酵母工程菌在6.8 L和50 L发酵罐高密度发酵,细胞湿重均值达600 g/L以上,酶活均值超过1100 U/mL。而500 L和5000 L发酵罐中细胞湿重则所有下降,介于450~500 g/L之间,相对应的酶活水平有较大幅度降低。这个变化趋势表明毕赤酵母组成型表达的产物生成水平依赖于生物量的积累。在发酵调控上倾向于获得较高的生物量来提高产量。注意到50 L发酵罐中细胞湿重超过650 g/L,但是酶活相比5 L发酵罐却未见提高,表明过高的生物量积累在后期不利于产物积累,产物增长与生物量增长已不再成正相关。为获得高生物量而进行的高密度发酵将使细胞面临氧受限和环境胁迫,可能导致代谢途径改变、存活率下降和自溶等问题,最终使目标产物产率下降[13]。
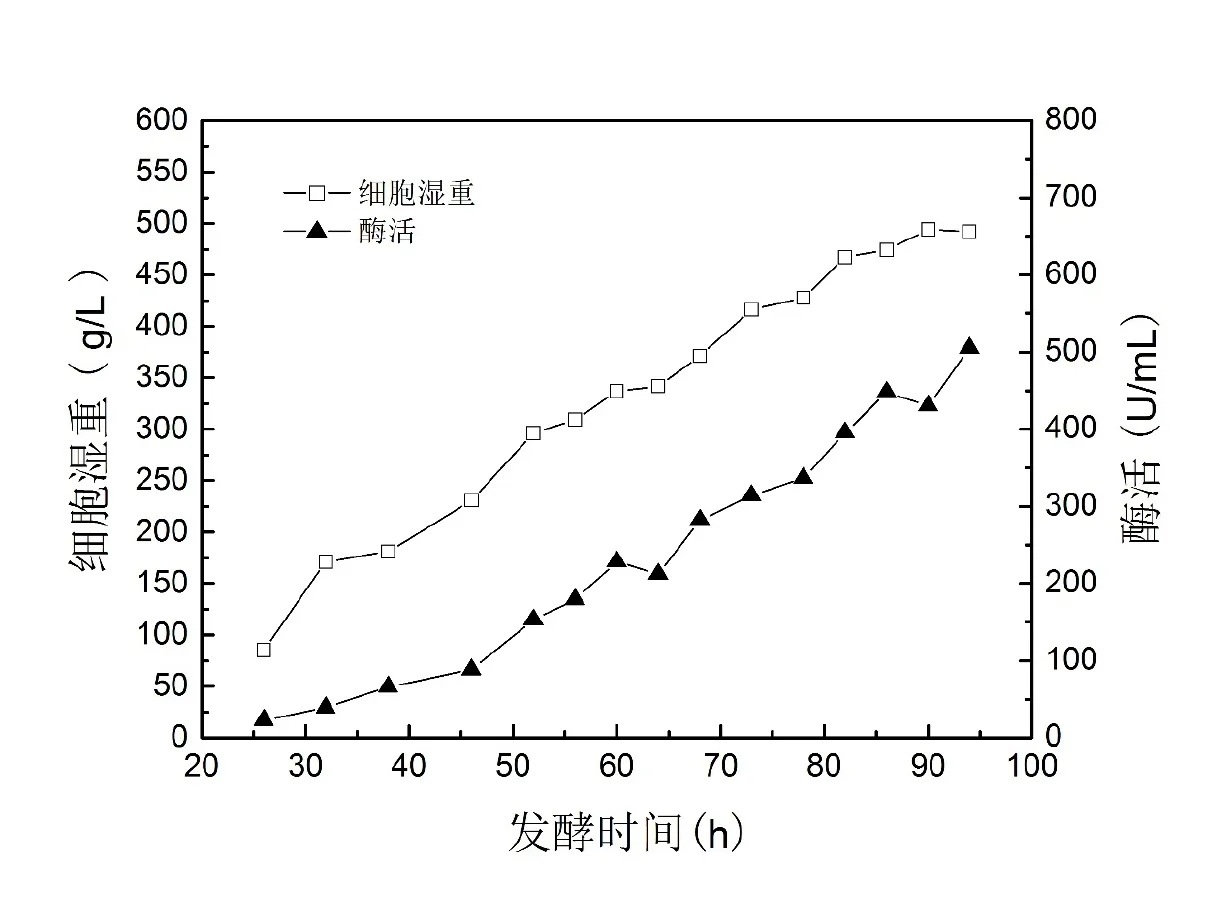
图4 5000 L发酵罐补料分批培养条件下的生长曲线和酶活曲线
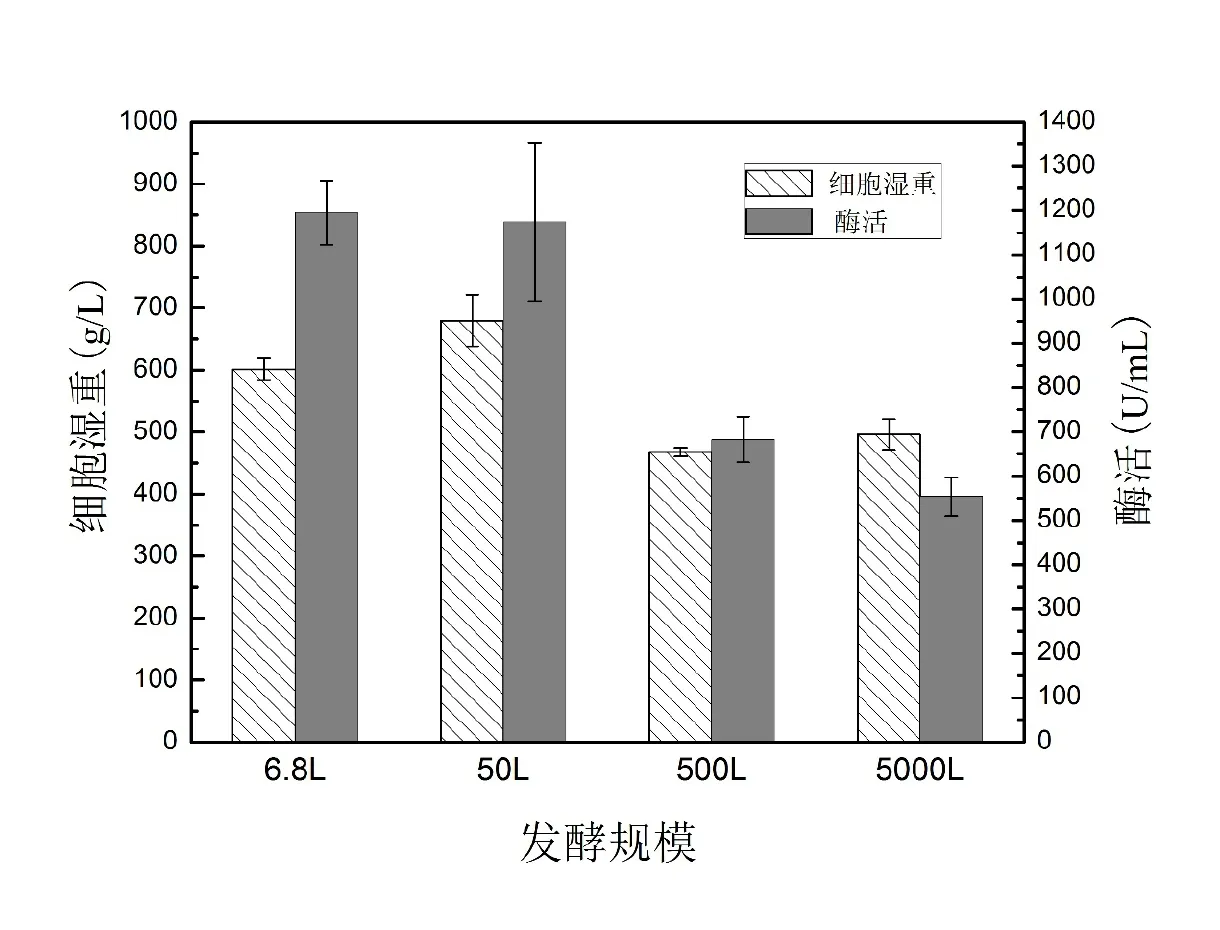
图5 不同发酵规模结果比较
发酵规模扩大,目标产物产量下降,无法重现实验室规模的结果,这种普遍存在的“放大效应”,一般被认为是随着反应器的放大,物料的流动、传热、传质等因素发生了变化所导致。具体到毕赤酵母组成型发酵的放大过程中表达水平出现的差异,其原因尚不明朗。溶氧传质可能是最重要的限制因子,规模放大之后培养液变得不均匀,大型反应器局部可能处于低氧或缺氧状态。500 L和5000 L发酵罐在低密度发酵阶段通入空气可以维持溶氧在20%以上,当发酵进入高密度阶段,设置搅拌转速与通气量至上限也往往无法维持设定的溶氧浓度,某些时段溶氧降低到5%以下,局部细胞在低溶氧甚至缺氧条件下生长。通入富氧空气可能在一定程度缓解缺氧问题,但是大规模发酵的生产成本随之提高。
高密度发酵在放大过程中面临反应器的混合传递性能不能满足工艺需求的问题,组成型较诱导型表现得更为突出[14]。通过指数流加,控制更低的比生长速率也许能达到更好的效果。Zhao等认为将细胞生长率维持在较低水平有利于提高产物水平[13]。此外,Kristin等通过限制溶氧,使毕赤酵母以葡萄糖为碳源兼性厌氧发酵,结果生物量降低,培养周期缩短,比生产速率提高了数倍[15]。这些报道给毕赤酵母组成型表达调控提供了新的思路。
3 结论
在已获得稳定表达α-葡聚糖酶毕赤酵母工程菌基础上,进行了从6.8 L发酵罐逐级放大至5000 L发酵罐的中试研究。产物的生成在各个规模发酵中均显示出生长偶联特征,集中在对数生长期和稳定期。6.8 L发酵罐中酶活达1253 U/mL,50 L发酵罐中产酶达1300 U/mL,超过摇瓶产量的6倍以上。500、5000 L发酵罐中产酶分别达到740、589 U/mL。以甘油作为碳源的组成型表达发酵工艺相对简单易控,可避免甲醇的使用,适合放大生产。
[1] EGGLESTON G, MONGEB A. Optimization of sugarcane factory application of commercial dextranases[J]. Process Biochemistry, 2005, 40(5): 1881-1894.
[2] KHALIKOVA E, SUSI P, KORPELA T. Microbial dextran-hydrolyzing enzymes: fundamentals and applications[J]. Microbiology and Molecular Biology Reviews, 2005, 69(2): 306-325.
[3] AHMAD M, HIRZ M, PICHLER H, et al. Protein expression in Pichia pastoris: recent achievements and perspectives for heterologous protein production[J]. Applied Microbiology and Biotechnology, 2014, 98(12): 5301-5317.
[4] GASSER B, PRIELHOFER R, MARX H, et al. Pichia pastoris: protein production host and model organism for biomedical research[J]. Future Microbiology, 2013, 8(2): 191-208.
[5] CHEN L, ZHOU X, FAN W, et al. Expression, purification and characterization of a recombinant Lipomyces starkey dextranase in Pichia pastoris[J]. Protein Expression and Purification, 2008, 58(1): 87-93.
[6] KANG HK, PARK JY, AHN JS, et al. Cloning of a gene encoding dextranase from Lipomyces starkeyi and its expression in Pichia pastoris[J]. Journal of Microbiology and Biotechnology, 2009, 19(2): 172-177.
[7] ROCA H, GARCIA B, RODRIGUEZ E, et al. Cloning of the Penicillium minioluteum gene encoding dextranase and its expression in Pichia pastoris[J]. Yeast, 1996, 12(12): 1187-1200.
[8] WATERHAM HR, DIGAN ME, KOUTZ PJ, et al. Isolation of the Pichia pastoris glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter[J]. Gene, 1997, 186(1): 37-44.
[9] KIRSTEN K, TOBIAS J G, JOST W, et al. Constitutive expression of hydrophobin HFB1 from Trichoderma reesei in Pichia pastoris and its pre-purification by foam separation during cultivation[J]. Engineering in Life Sciences, 2012, 12(2): 9.
[10] FEI L, WANG Y, CHEN S. Improved glutathione production by gene expression in Pichia pastoris[J]. Bioprocess and Biosystems Engineering, 2009, 32(6): 729-735.
[11] GOODRICK JC, XU M, FINNEGAN R, et al. High-level expression and stabilization of recombinant human chitinase produced in a continuous constitutive Pichia pastoris expression system[J]. Biotechnology and Bioengineering, 2001, 74(6): 492-497.
[12] GUAN B, CHEN F, LEI J, et al. Constitutive expression of a rhIL-2-HSA fusion protein in Pichia pastoris using glucose as carbon source[J]. Applied Biochemistry and Biotechnology, 2013, 171(7): 1792-1804.
[13] ZHAO W, WANG J, DENG R, et al. Scale-up fermentation of recombinant Candida rugosa lipase expressed in Pichia pastoris using the GAP promoter[J]. Journal of Industrial Microbiology and Biotechnology, 2008, 35(3): 189-195.
[14] 江学斌. 基于工业化生产的毕赤酵母高效表达木聚糖酶XYL1的研究[D]. 广州:华南理工大学,2013.
[15] BAUMANN K, MAURER M, DRAGOSITS M, et al. Hypoxic fed-batch cultivation of Pichia pastoris increases specific and volumetric productivity of recombinant proteins[J]. Biotechnology and Bioengineering, 2008, 100(1): 177-183.
(本篇责任编校:朱涤荃)
Scale-up Fermentation of Recombinant Dextranase Expressed in Pichia Pastoris
HUANG Zeng-wei1, WU Zhao-peng1, CHANG Guo-wei1, LI Zhi-de1, ZHANG Jiu-hua1, ZENG Lian-qiang1, LIANG Da-feng1,2
(1Guangzhou Sugarcane Industry Research Institute/Guangdong Key Lab of Sugarcane Improvement & Biorefinery, Guangzhou 510316;2Guangxi Sugarcane Industry R & D Center, Nanning 530002)
The high density fermentation of dextranase in the constitutive Pichia pastoris expression system scaled up from 6.8 to 5000 L in series was studied. By controlling residual concentration of glycerol and dissolved oxygen combined with pH-stat, multi batches of fermentation were performed. Results showed that the dextranase synthesis under GAP promoter is growth-associated and mainly in exponential phase and stationary phase. Activity of dextranase in 6.8 L, 50 L, 500 L and 5000 L fermenter reached 1253, 1300, 740 and 589 U/mL, respectively. A simple and convenient fermentation method using glycerol as carbon source has been developed, which obviates problems related with methanol safety concerns and is suitable for large scale production.
Dextranase; Pichia pastoris; Constitutive expression; Fermentation scale-up
TS244
A
1005-9695(2016)02-0020-07
2016-02-15;修回日期:2016-03-23
现代农业产业技术体系建设专项资金(CARS-20-4-5);八桂学者建设工程专项经费
黄曾慰(1984-),男,工程师,主要从事食品生物技术和制糖工艺研究工作;E-mail: zengwei.huang@gmail.com
*梁达奉(1964-),男,博士,教授级高级工程师,主要从事制糖生物技术研究工作;E-mail: ldfjt@126.com
引文格式:黄曾慰,吴兆鹏,常国炜,等. 重组毕赤酵母发酵生产α-葡聚糖酶的放大研究[J]. 甘蔗糖业,2016(1):20-26.

