手性磷酸催化环状N-磺酰亚胺与2-苯基吲哚的不对称傅克烷基化反应
李天田, 林勇军, 杜丽娜, 康泰然, 刘全忠
(西华师范大学 化学化工学院, 四川 南充 637009)
手性磷酸催化环状N-磺酰亚胺与2-苯基吲哚的不对称傅克烷基化反应
李天田, 林勇军, 杜丽娜, 康泰然, 刘全忠
(西华师范大学 化学化工学院, 四川 南充637009)
摘要:主要研究了环状N-磺酰亚胺与2-苯基吲哚在手性磷酸催化下的不对称傅克烷基化反应。通过对多种催化剂的筛选及反应条件的优化,最终获得较高产率(72%—8%)和中等对映选择性(37%—1%)的不对称傅克烷基化反应产物。
关键词:傅克烷基化反应;环状N-磺酰亚胺;2-苯基吲哚;手性磷酸;对映选择性
光学活性的吲哚类化合物有独特的生物活性,是天然产物和医用药物的重要片段[1-2],如色氨酸、褪黑素和阿洛西隆。吲哚与亚胺的不对称傅克反应能快速构建具光学活性的3-吲哚甲胺衍生物[3]。N-磺酰亚胺是该类反应应用最多的亲电试剂,产物含有具抗菌作用的磺酰胺结构[4]。目前用于催化吲哚与N-磺酰亚胺的不对称傅克反应的催化剂主要有铜等金属-配体络合物[5]和磷酸[6]、硫脲[7]和手性胺[8-9]等有机小分子催化剂,但亚胺部分主要集中于非环状N-磺酰亚胺,而吲哚与环状N-磺酰亚胺的不对称傅克反应尚未报道。由此我们设想:能否通过有机催化剂实现该反应?如果能够实现,产物将同时含有吲哚和环状磺酰胺结构,为此,开展了该课题的相关工作(图1)。

1实验部分
1.1主要仪器与主要试剂
DF-101S集热式恒温磁力搅拌器,旋转蒸发仪,W201B恒温水浴锅,电子天平,核磁共振仪,高效液相色谱仪,质谱仪。使用烟台江友硅胶开发有限公司的薄层色谱板监测反应,用青岛海浪公司硅胶(200—300目)分离纯化产物。除特殊说明外,所用试剂均为国产分析纯溶剂并按照常规方法处理。
1.2实验步骤
向含有搅拌子的干净干燥的反应试管中依次加入环状N-磺酰亚胺(0.1 mmol)、2-苯基吲哚(0.1 mmol)、手性催化剂(0.01 mmol),密封,然后加入1 mL二氯甲烷。25℃下搅拌至原料消失完全。加入5mL饱和碳酸氢钠溶液淬灭反应,二氯甲烷萃取3次,合并有机相,饱和食盐水洗2次,无水硫酸钠干燥,旋干,柱层析(PE∶DCM = 2∶1),得白色固体。
2结果与讨论
2.1反应催化剂的筛选

表1 催化剂的筛选结果a


EntryR14Yield/%bEe/%c1H1a4aa9002CH31a4ba99452CH31b4ba9843CH31c4ba9734CH31d4ba91225CH31e4ba94426CH31f4ba91237CH31g4ba93158CH31h4ba99199CH31i4ba972010CH31j4ba985111CH31k4ba901212C6H51j4ca9565
[a]The reaction was performed with 2 (0.1 mmol), 3a (0.1 mmol),
1 (0.01 mmol) in CHCl3;[b]Isolated yield;[c]Determined by HPLC analysis.
从表1可知,通过催化剂筛选和模版反应筛选,发现以2-苯基吲哚(2c)为模版底物,3,3′位含有3,5-二苯基苯基大位阻基团的(R)-联萘型手性磷酸(1j)为该反应的催化剂,可获得较高的产率(95%)和中等的对映选择性(65%)。
2.2反应条件的优化
表2反应条件的优化a


EntrySolvent Temp/℃Yield/%bEe/%c1dCHCl32593552eCHCl32595583fCHCl325975541,2-DCE2597745CH2Cl22596816CCl42597587Et2O25781581,4-Dioxane2516159Toluene25936810Xylene25866111CH2Cl20816712CH2Cl210867513CH2Cl2359580
[a] Reaction conditions: 2c (0.1 mmol), 3a (0.1 mmol), 1j (0.01 mmol) in solvent (1 mL) for 8-16h;[b] Isolated yield;[c] Determined by HPLC analysis; [d] 0.005 mmol 1j was used;[e] 0.015 mmol 1j was used;[f] 0.020 mmol 1j was used.
从表2可知,增加和减少催化剂用量时,该傅克反应的产率没有明显变化,但对映选择性都有所下降(entries 1—3)。就产率和对映选择性而言,含卤烷烃溶剂可获得较好的结果(entries 4—6),当使用二氯甲烷为溶剂时,可以96%的产率和81%的对映选择性获得目标产物(entry 5)。而乙醚等醚类溶剂不利于该反应的进行(entries 7—8)。苯类溶剂的使用会降低该反应的对映选择性(entries 9—10),此外,降低反应温度,产物的产率和对映选择性都下降(entries 11—12),而升高反应温度,产率和对映选择性没有明显变化(entry 13)。
综上可知,该反应的最优条件是:0.01 mmol手性磷酸1j为催化剂,25℃为反应温度,二氯甲烷为反应溶剂。
2.3反应的底物扩展
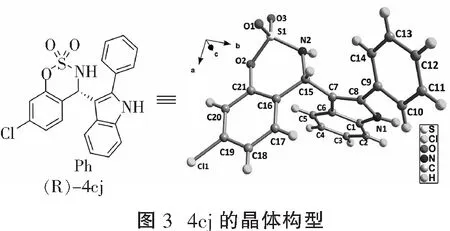
从表3可知,表中所有的底物都可顺利获得目标产物 (entries 1—6)。取代基的位置对该反应有明显的影响。亚胺6位为吸电子基时,产物的对映选择性下降(entries 2—7),但是,亚胺7位为供电子基时,也得到了较低的对映选择性(entries 8—10),亚胺8位的取代基对产率和对映选择性没有明显影响(entries 11—12)。最后,我们利用X-单晶衍射测试了4cj的绝对构型为R-型,由此类推其他傅克产物的绝对构型(见图3)。
表3底物的扩展a

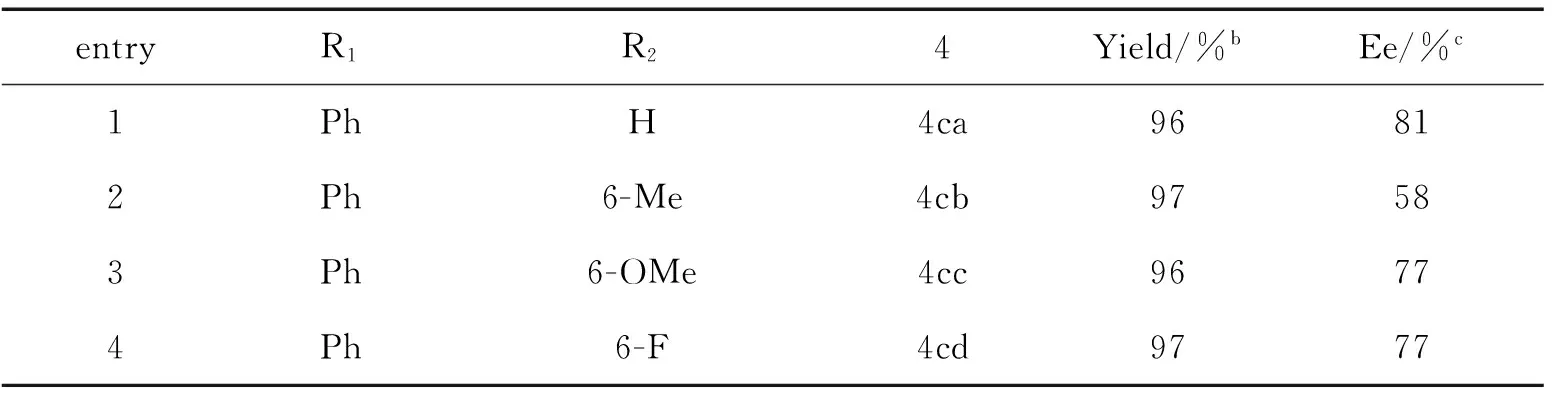
entryR1R24Yield/%bEe/%c1PhH4ca96812Ph6-Me4cb97583Ph6-OMe4cc96774Ph6-F4cd9777

续表3
[a] Unless otherwise indicated, the reaction was performed with 3 (0.1 mmol),4 (0.1 mmol), 1j (0.01 mmol),in CH2Cl2(1 mL) at room temperature for 8-24h;[b] Isolated yield; [c] Determined by HPLC analysis.
综上所述,我们发展了一种手性磷酸催化的2-苯基吲哚与环状N-磺酰亚胺的傅克反应烷基化反应,以高收率和中等的对映选择性获得了3-吲哚甲胺类衍生物,该化合物同时含有具生物活性的吲哚结构和磺酰胺结构。
参考文献:
[1]FAULKNER D.Marine natural products[J].J. Nat.Prod.Rep.2002,19(1):1-48.
[2]SOMEI M,YAMADA F.Simple indole alkaloids and those with a nonrearranged monoterpenoid unit[J].Nat. Prod.Rep.2004,21(2):278-311.
[3]WANG Y Q,SONG J,HONG R,et al.Asymmetric friedel-crafts reaction of indoles with imines by an organic catalyst[J].J.Am.Chem.Soc.2006,128(25):8156-8157.
[4]SPENCER J,WILLIAMS S J.Sulfat ase inhibitors:a patent review[J].Expert Opin.Ther.Patents 2013,23(1):79-98.
[5]JOHANNSEN M.An enantioselective synthesis of heteroaromatic N-tosyl-amino acids[J].Chem.Commun.1999,31(21):2233-2234.
[6]KANG Q,ZHAO Z A,YOU S L.Highly enantioselective friedel-crafts reaction of indoles with imines by a chiral phosphoric acid.[J].J.Am.Chem.Soc.2007,129(6),1484-1485.
[7]WANG Y Q,SONG J,HONG R,et al.Asymmetric friedel-crafts reaction of indoles with imines by an organic catalyst.[J].J.Am.Chem.Soc.2006,128(25),8156-8157.
[8]QIAN Y,MA G Y,LV,A F,et al.Squaramide-catalyzed enantioselective friedel-crafts reaction of indoles with imines.[J].Chem.Commun.2010,46(17),3004-3006.
[9]CHEN L Y,HE H,CHAN W H,et al.Chiral sulfonimide as a brnsted acid organocatalyst for asymmetric friedel-crafts alkylation of indoles with imines.[J].J.Org.Chem.2011,76(17),7141-7147.
Chiral Phosphoric Acid Catalyzed Asymmetric Friedel-Crafts Alkylation of Cyclic N-Sulfimines with 2-phenyl-1H-indoles
LI Tiantian,LIN Yongjun,DU Lina,KANG Tairan,LIU Quanzhong
(College of Chemistry and Chemical Engineering,China West Normal University,Nanchong Sichuan 637009,China)
Abstract:An asymmetric Friedel-Crafts Alkylation reaction of cyclic N-Sulfimines with 2-phenyl-1H-indoles has been researched under the catalysis of chiral phosphoric acids as an organocatalyst,affording Friedel-Crafts reaction products in high yields ( up to 98% yield) and with moderated to high enantioselectivities of up to 81% ee.
Keywords:friedel-crafts alkylation;cyclic N-sulfimines;2-phenyl-1H-indoles;chiral phosphoric acids;enantioselectivities
文章编号:1673-5072(2016)02-0180-04
收稿日期:2015-05-30
基金项目:国家自然科学基金项目(21572183);四川省省属高校科研创新团队(14TD0016)
作者简介:李天田(1988—),女,甘肃平凉人,硕士研究生,主要从事有机合成研究。 通讯作者:刘全忠(1967—),男,四川雅安人,教授,主要从事有机合成研究。E-mail:quanzhongliu@sohu.com
中图分类号:O629.3
文献标识码:A
DOI:10.16246/j.issn.1673-5072.2016.02.010

