芥蓝花薹中莱菔硫烷含量的HPLC分析
李占省刘玉梅*方智远杨丽梅庄 木张扬勇李凌云孙培田
(1中国农业科学院蔬菜花卉研究所,北京 100081;2农业部蔬菜品质监测检验中心,北京 100081)
芥蓝花薹中莱菔硫烷含量的HPLC分析
李占省1刘玉梅1*方智远1杨丽梅1庄木1张扬勇1李凌云2孙培田1
(1中国农业科学院蔬菜花卉研究所,北京 100081;2农业部蔬菜品质监测检验中心,北京 100081)
摘 要:以23份芥蓝纯合自交系和21份杂交F1为试材,采用反相高效液相色谱法(RP-HPLC)测定花薹中莱菔硫烷含量,分析芥蓝花薹中莱菔硫烷含量的变化规律。结果表明:44份芥蓝材料花薹中莱菔硫烷含量变异范围为46.89~419.45 mg·kg-1(DW),供试材料间莱菔硫烷含量差异达显著水平。获得了1份莱菔硫烷含量较高的F1材料A86,含量为419.45 mg·kg-1(DW);3份莱菔硫烷含量较高的高代纯合自交系材料A1、A17和A53,含量分别为298.50、354.19、361.06 mg·kg-1(DW),可用于芥蓝抗癌新品种的选育和利用。
关键词:芥蓝;花薹;莱菔硫烷;高效液相色谱法
李占省,男,博士,助理研究员,专业方向:蔬菜遗传育种与生物技术,E-mail:lizhansheng@caas.cn
芥蓝(Brassica albograbra L.H.Bailey)是十字花科芸薹属甘蓝类的一个变种,目前在广东、广西、台湾等地广泛栽培,可食用部位为花薹、嫩叶和幼苗,富含VC、K、Ca等营养成分和矿物质(张慎好 等,2004)。据报道,芥蓝还含有4-甲基亚磺酰基丁基硫苷(glucoraphanin,GRA或RAA),该成分能被黑芥子酶水解生成生物活性物质莱菔硫烷(Fahey et al.,2001)。
莱菔硫烷(sulforaphane,SF)又称萝卜硫素,是硫苷中的GRA与黑芥子酶发生水解反应的次生代谢产物,是一种异硫氰酸盐类物质。研究发现,GRA普遍存在于十字花科芸薹属蔬菜中,如青花菜、甘蓝、芥蓝、羽衣甘蓝等,其水解产物莱菔硫烷是迄今为止在蔬菜中发现的抗癌活性较强的有效成分之一(Fahey et al.,2001)。流行病学和小鼠试验表明,莱菔硫烷能够显著降低肝癌(Keck et al.,2003)、乳腺癌(Pawlik et al.,2013)、胃癌(Fahey et al.,2002)、前列腺癌(Cho et al.,2005)、结肠癌(Rong et al.,2003)、皮肤癌(Xu et al.,2006)等的发生几率。其抗癌机理是通过抑制体内Ⅰ相解毒酶的形成和诱导Ⅱ相解毒酶中的谷胱甘肽硫转移酶-GST、还原型辅酶Ⅱ-NADPH、苯醌还原酶-QR、苯醌氧化还原酶-1NQO1等(Singletary & MacDonald,2000;Misiewic et al.,2004)激活并发挥自身免疫功能;同时,莱菔硫烷在DNA损伤修复、抑制细菌和病毒(Galan et al.,2004),诱导肿瘤细胞凋亡(Dinkova-Kostova et al.,2002;Yanaka et al.,2005)等方面亦有一定的生理功效,在抗癌新药开发与流行病学研究方面具有重大的社会价值与科研价值。所以,挖掘富含莱菔硫烷的芥蓝种质资源并明确其含量变化,将为选育芥蓝抗癌新品种及研究莱菔硫烷活性提供材料和依据。
陈新娟等(2006)对芥蓝叶和薹中的硫苷成分进行了检测,结果表明芥蓝这两个器官中的硫苷组分相同,均包含6种脂肪族硫苷和4种吲哚族硫苷,其中脂肪族硫苷包含莱菔硫烷前体GRA;同时指出花薹中脂肪族硫苷含量较高,而叶中吲哚族硫苷含量较高。孙勃等(2011)在对芥蓝不同器官主要营养成分的报道中指出,芥蓝的一些品种富含GRA成分,且该成分在总硫苷含量中所占比例较大,这为从芥蓝中筛选富含GRA的材料提供了依据。当前对莱菔硫烷的报道多集中在青花菜上,何洪巨等(2003)、夏薇等(2005)、Liang等(2006)、张婵娟等(2007)都证实了青花菜富含莱菔硫烷成分,并且分布在不同的营养器官中,如花球、茎和种子等,采用的检测方法主要为高效液相色谱法(high performance liquid chromatography,HPLC)。而对芥蓝花薹中莱菔硫烷含量的研究鲜有报道,本试验以23份芥蓝高代纯合自交系和21份杂交F1为试材,采用HPLC法测定其莱菔硫烷含量,分析其含量变化规律,旨在筛选出莱菔硫烷含量较高的芥蓝材料,为选育高莱菔硫烷含量的芥蓝抗癌新品种和满足人们的多样化需求奠定理论基础。
1 材料与方法
1.1试验材料
以2014年种植于中国农业科学院蔬菜花卉研究所试验基地的23份芥蓝高代纯合自交系和21份杂交F1为试验材料,采用随机区组设计,3次重复,每重复20株。
芥蓝成熟期选取成熟度一致的芥蓝主花薹(商品芥蓝),每重复取5株,去除下端的大叶,保留靠近上端的嫩叶,切段后用液氮处理,然后进行真空冷冻干燥,经机械粉碎后于4 ℃干燥器中密封保存。
1.2莱菔硫烷提取
准确称取粉碎后的芥蓝样品0.50 g,加入pH值为7.0的磷酸钾缓冲液(0.1 mol·L-1,用磷酸二氢钾和磷酸氢二钾配制)15.0~20.0 mL,酶解2.0 h后加入乙酸乙酯30 mL萃取(室温),然后5 500 rpm离心10.0 min,取上清液;重复萃取2次后合并3次萃取液,在旋转蒸发仪上旋转蒸干(35 ℃),最后用10.0 mL色谱级甲醇定容,经0.22 μm过滤膜后-20 ℃低温保存待测。
1.3HPLC检测
1.3.1色谱条件 采用SHIMADZU LC-20A系列高效液相色谱仪,配备Waters PAH反相C18(250 mm×4.6 mm,5.0 μm);流速0.8 mL·min-1,柱温32 ℃,检测波长254 nm,自动进样量为10 μL,梯度洗脱见表1;流动相A泵为5%四氢呋喃溶液,流动相B泵为100%甲醇,25.0 min时结束进样。
1.3.2线性方程、精密度、回收率 将10.0 mg莱菔硫烷标准品(美国LKT公司,纯度≥98%)用色谱级甲醇定容于10.0 mL棕色容量瓶中,配制成1.0 mg·mL-1的标准溶液,然后再分别稀释成浓度为5.0、10.0、25.0、50.0、200.0 μg·mL-1的标准溶液,以峰面积(横坐标)和浓度(纵坐标)计算标准曲线。
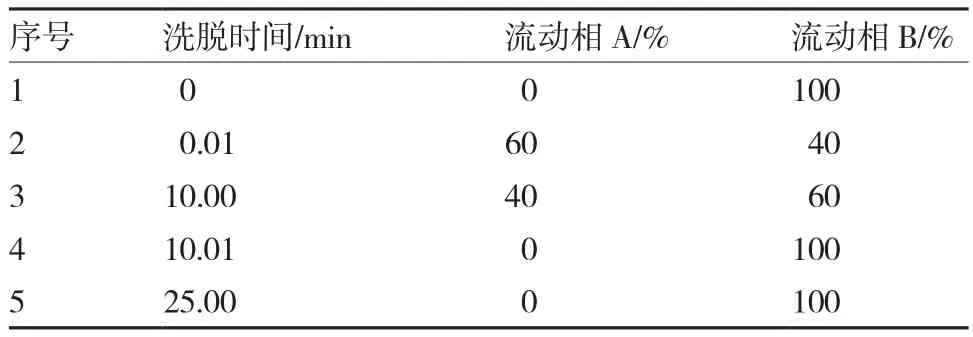
表1 梯度洗脱程序
精密度测定:吸取浓度为50 μg·mL-1的莱菔硫烷标准品溶液,反复进样测定6次(n=6),根据测得的峰面积计算精密度。
回收率测定:先准确称取浓度为100 μg· mL-1的莱菔硫烷样品100 μL,再分别加入5.51、12.55、20.43、45.51、60.27、80.69 μg·mL-1的标准品溶液,按照1.2莱菔硫烷提取方法测定回收率。
1.4数据处理
试验数据采用Excel软件和SPSS 10.0统计学软件进行处理和分析,数据用平均值±标准差表示,差异显著性检验采用One-way ANOVA。
2 结果与分析
2.1精密度与回收率
采用HPLC法,分别对浓度为5.0、10.0、25.0、50.0、200.0 μg·mL-1的莱菔硫烷标准品溶液进行测定,根据峰面积(横坐标)和浓度(纵坐标)计算线性方程。结果表明,莱菔硫烷在5.0~200.0 μg·mL-1范围内的线性方程为y=3.691× 10-4x-1.264,R2=0.999 5(RSD=1.27%)。
精密度良好,测得的6次峰面积的相对标准偏差RSD=0.24%。
回收率较高,6次样品中莱菔硫烷的平均加样回收率为96.3%(RSD=1.30%)。
2.2芥蓝花薹中莱菔硫烷含量
HPLC图谱显示(图1),芥蓝提取样品和莱菔硫烷标准样品保留时间一致,定性出峰时间为7.23 min,峰形较好,不受杂质干扰,表明采用该方法能够准确检测到莱菔硫烷成分。
从表2可以看出,44份芥蓝材料花薹中均检测到莱菔硫烷成分,其含量变异范围为46.89~419.45 mg·kg-1(DW),平均含量为188.31 mg·kg-1(DW);供试材料间莱菔硫烷含量差异显著,具有统计学意义。44份芥蓝材料中,23份自交系花薹中莱菔硫烷含量变异范围为79.46~361.06 mg·kg-1(DW),平均含量为195.56 mg·kg-1(DW),最高含量(A53)约是最低含量(A45)的4.5倍;21份F1花薹中莱菔硫烷含量变异范围为46.89~419.45 mg·kg-1(DW),平均含量为180.16 mg·kg-1(DW),最高含量(A86)约是最低含量(A147)的9倍。杂交F1花薹中的莱菔硫烷含量变幅大于自交系材料,且供试材料中的最低含量和最高含量均为F1材料,这可能与十字花科作物具有明显的杂交优势有关。
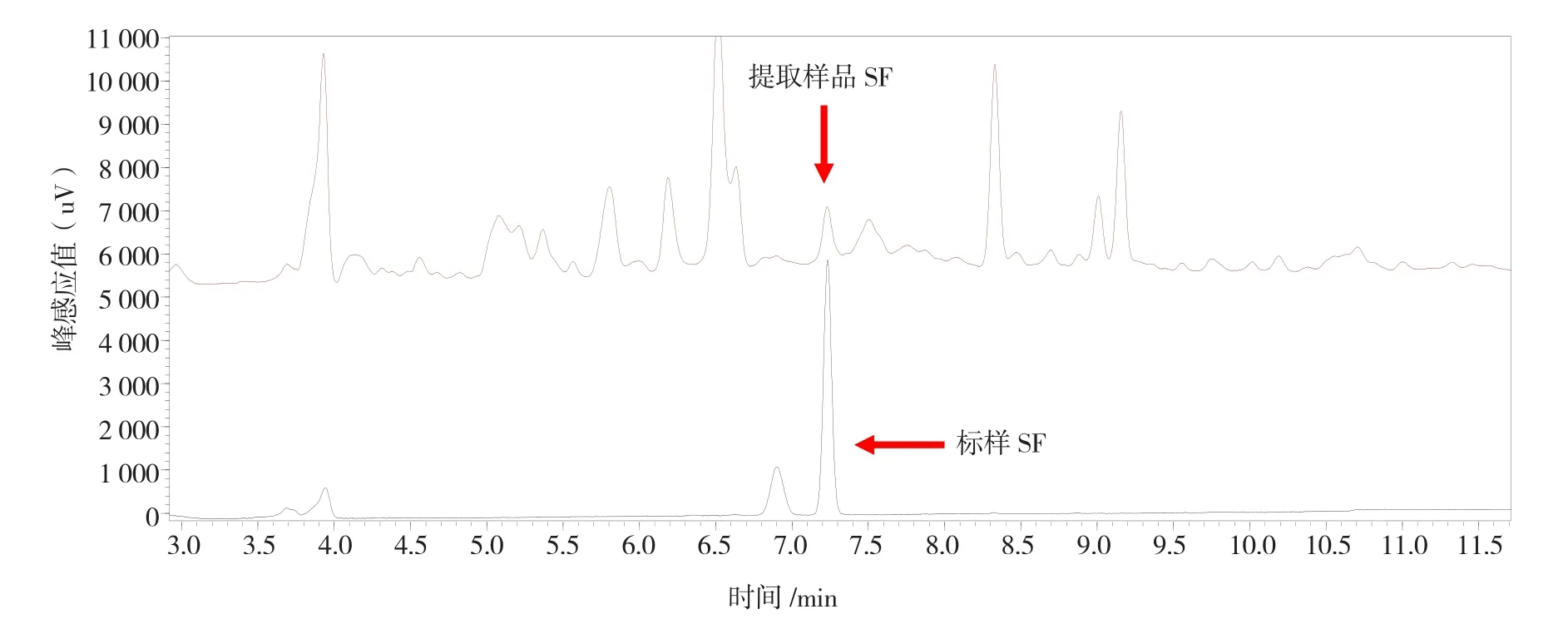
图1 莱菔硫烷标准样品和芥蓝提取样品(A45)的HPLC图谱
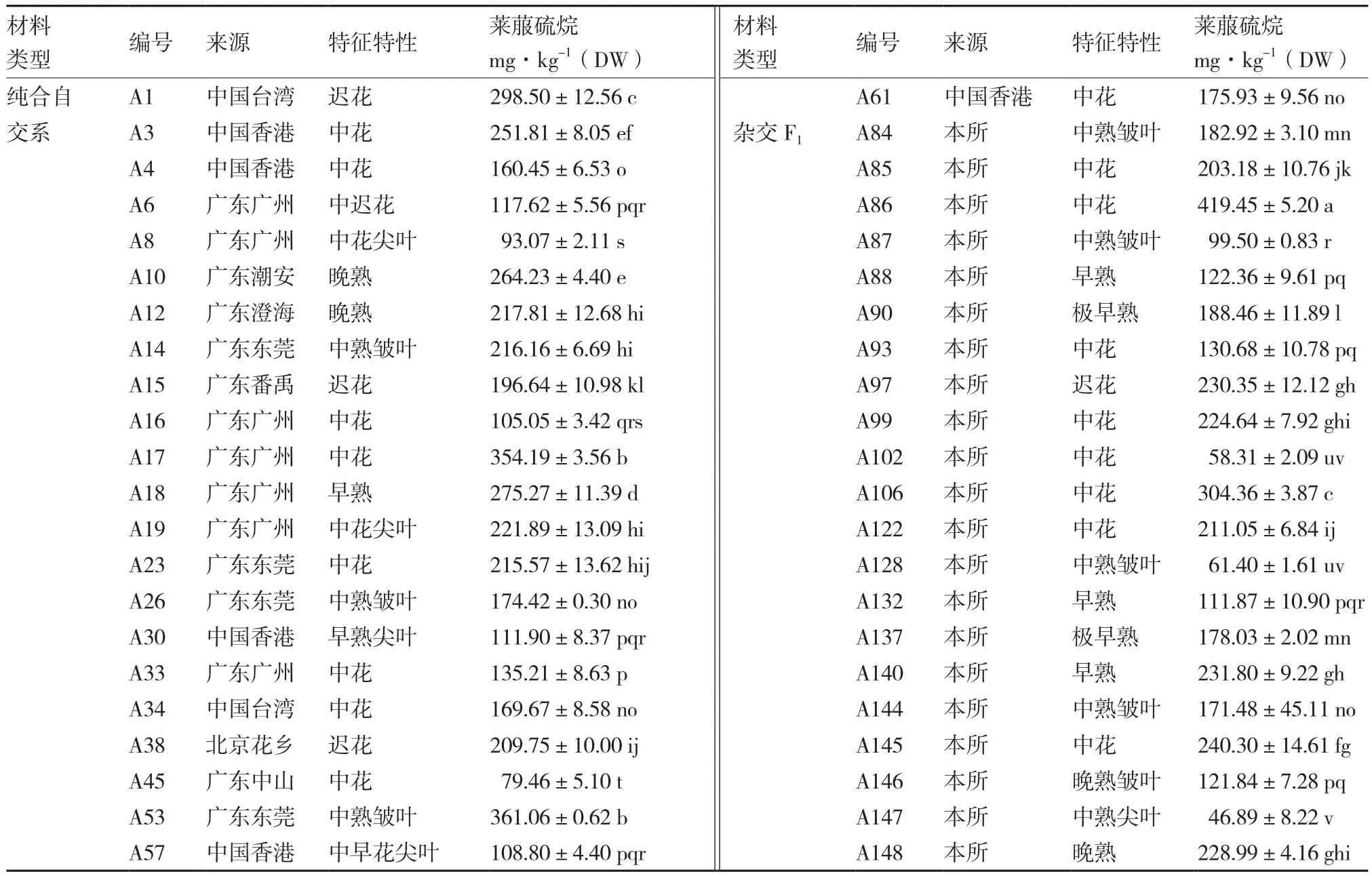
表2 44份芥蓝材料花薹中莱菔硫烷含量
芥蓝自交系材料A1〔298.50 mg·kg-1(DW)〕、A17〔354.19 mg·kg-1(DW)〕和A53〔361.06 mg· kg-1(DW)〕花薹中莱菔硫烷含量较高,可用作育种材料进行新品种配制;杂交F1材料A86〔419.45mg·kg-1(DW)〕花薹中莱菔硫烷含量在所有参试材料中最高,可作为抗癌芥蓝新品种进行推广和开发;另外,杂交F1材料A97〔230.35 mg·kg-1(DW)〕、A106〔304.36 mg·kg-1(DW)〕、A140 〔231.80 mg·kg-1(DW)〕和A145〔240.30 mg· kg-1(DW)〕花薹中莱菔硫烷含量也处于较高水平,可考虑作为富含莱菔硫烷芥蓝品种加以利用,丰富市场品种。
3 结论与讨论
芥蓝是我国特色蔬菜之一,在南方地区广泛栽培,其花薹脆嫩、清甜,越来越多的消费者开始食用芥蓝。本试验对44份芥蓝材料花薹中莱菔硫烷含量进行了测定,丰富了有关芥蓝营养方面的报道,其含有的生物活性成分莱菔硫烷已经被证实具有降低癌症患病率的功能(Keck et al.,2003;Rong et al.,2003;Cho et al.,2005;Xu et al.,2006;Pawlik et al.,2013),这将使得人们对芥蓝的营养价值和医学价值的认识更加全面,从而有可能引导人们通过多样化的摄取食物来提高自身免疫力,最终实现降低癌症发病几率、提高我国人民的健康水平。
本试验结果表明,不同芥蓝材料花薹中莱菔硫烷含量差异较大,这可能是由基因型决定的,该结论在青花菜上报道较多,但在芥蓝中鲜有报道。Kushad等(1999)、Fahey等(2001)、Farnham等(2004)、Abercrombie等(2005)、谢祝捷等(2010)的研究结果都表明,青花菜中的GRA主要受基因型调控。李占省等(2012)对青花菜DH群体花球中莱菔硫烷含量进行了测定,结果表明莱菔硫烷这一性状受3对主基因并存在加性-上位性+多基因控制,主基因遗传率较高,为89.28%。陈新娟等(2006)采用HPLC法测定芥蓝薹和叶中的硫苷组分,结果表明花薹中GRA含量为455.2 μg·g-1(DM),叶中为55.5 μg·g-1(DM),由此可见芥蓝花薹中GRA含量远高于叶中,该结果鼓励人们多食用芥蓝花薹。但是,GRA自身并没有生物活性,其水解产物莱菔硫烷才具有抗癌活性,只有通过体外生物提取或体内咀嚼消化的方式让芥蓝中的GRA转化成莱菔硫烷才具有医学功效,因此在食用芥蓝时尽可能养成细嚼慢咽的习惯,这样才能最大程度地生成生物活性成分莱菔硫烷。
本试验参试的44份芥蓝材料中,3份自交系材料A1、A17和A53花薹中的莱菔硫烷含量较高,可作为抗癌芥蓝亲本材料配制不育系和新品种,同时也可根据市场和人们的需要,通过与青花菜杂交配制西兰薹新品种用于内销和出口。A86花薹中的莱菔硫烷含量在所有参试材料中最高,且为杂交F1,可直接作为抗癌芥蓝新品种进行推广和利用;莱菔硫烷含量处于中等或中上等水平的A97、A106、A140和A145可作为备选抗癌芥蓝品种进行推广和利用,以满足人们对芥蓝不同风味的需要,丰富市场品种。对芥蓝中莱菔硫烷的遗传代谢机理进行研究,将有助于筛选出富含莱菔硫烷的芥蓝新材料和抗癌新品种,但这方面尚待深入研究。
参考文献
陈新娟,朱祝军,杨静,刘永华.2006.芥蓝叶和薹的硫代葡萄糖苷组分及含量.园艺学报,33(4):741-744.
何洪巨,唐晓伟,刘玲,宋曙辉.2003.HPLC-ESI/MS鉴定十字花科植物中完形硫代葡萄糖甙.质谱学报,24(3):385-388.
李占省,刘玉梅,方智远,杨丽梅,庄木,张扬勇,袁素霞,赵文,刘二艳,孙培田.2012.青花菜DH群体花球中莱菔硫烷含量的遗传效应分析.园艺学报,39(1):101-108.
孙勃,方莉,刘娜,闫会转,张雅君,施倩倩,汪俏梅.2011.芥蓝不同器官主要营养成分分析.园艺学报,38(3):541-548.
夏薇,赵秀娟,吴坤,苑林宏.2005.北方12种蔬菜中莱菔硫烷含量的测定.疾病控制杂志,9(3):209-211.
谢祝捷,李媛,姚雪琴,邱海荣.2010.青花菜基因型和环境互作对花球4-甲基亚磺酰丁基硫苷含量的影响.园艺学报,37 (4):625-630.
张婵娟,郭晓玲,孟青,冯毅凡.2007.不同品种西兰花种子中莱菔硫烷的HPLC分析.广东药学院学报,23(5):505-508.
张慎好,王学东,轩兴栓,尚玉峰,何洪巨.2004.芥蓝不同品种营养成分含量评价.河北科技师范学院学报,18(2):58-61.
Abercrombie J M,Farnham M W,Rushing J W.2005.Genetic combining ability of glucoraphanin level and other horticultural traits of broccoli.Euphytica,143(1):145-151.
Cho S D,Li S G,Hu H.2005.Involvement of c-Jun N-terminal kinase in G2/M arrest and caspase-mediated apoptesis induced by sulforaphane in DUI45 prostate cancer cells.Nutrition Cancer,52 (2):213-224.
Dinkova-Kostova A T,Holtzclaw W D,Cole R N,Itoh K,Wakabayashi N,Katoh Y,Yamamoto M,Talalay P.2002.Direct evidence that sulfhydryl groups of Keap1 are the sensors regulating induction of phase 2 enzymes that protect against carcinogens and oxidants.Proceedings of the National Academy of Sciences U S A,99(18):11908-11913.
Fahey J W,Zalcmann A T,Talalay P.2001.The chemical diversity and distribution of glucosinolates and isothiocyanates among plants.Phytochemistry,56(1):5-51.
Fahey J W,Haristoy X,Dolan P M,Kensler T W,Scholtus I,Stephenson K K,Talalay P,Lozniewski A.2002.Sulforaphane inhibits extracellular,intracellular,and antibiotic-resistane strains of Helicobacter pylori and prevents benin〔a〕pyrene-induced stomach tumor.Proceedings of the National Academy of Sciences U S A,99(11):7610-7615.
Farnham M W,Wilson P E,Stephenson K K,Fahey J W.2004.Genetic and environmental effects on glucosinolate content and chemoprotective potency of broccoli.Plant Breeding,123(1):60-65.
Galan M V,Kishan A A,Silverman A L.2004.Oral broccoli sprouts for the treatment of Helicobacter pylori infection:a preliminary report.Digestive Diseases and Sciences,49(7-8):1088-1090.
Keck A S,Qiao Q,Jeffery E H.2003.Food matrix effects on bioactivity of broccoli-derived sulforaphane in liver and colon of F344 rats.Journal of Agriculture and Food Chemistry,51(11):3320-3327.
Kushad M M,Brown A F,Kurilich A C,Juvik J A,Klein B P,Wallig M A,Jeffery E H.1999.Variation of glucosinolates in vegetable crops of Brassica oleracea.Journal of Agricultural and Food Chemistry,47(4):1541-1548.
Liang H,Yuan Q P,Dong H R,Liu Y M.2006.Determination of sulforaphane in broccoli and cabbage by high-performance liquid chromatography.Journal of Food Composition and Analysis,19 (5):473-476.
Misiewicz I,Skupińska K,Kowalska E,Lubińsk J,Kasprzycka-Guttman T.2004.Sulforaphane-mediated induction of a phase 2 detoxifying enzyme NAD(P)H:quinone reductase and apoptosis in human lymphoblastoid cells.Acta Biochimica Polonica,51 (3):711-721.
Pawlik A,Wiczk A,Kaczynska A,Antosiewicz J,Herman-Antosiewicz A.2013.Sulforaphane inhibits growth of phenotypically different breast cancer cells.European Journal of Nutrition,52(8):1949-1958.
Rong H,Bok R K,Chi C.2003.The roles of JNK and apoptotic signaling pathways in PEITC-mediated responses in human HT-29 colon adenocarcinoma cells.Carcinogenesis,24(8):1361-1367.
Singletary K,MacDonald C.2000.Inhibition of benzo〔a〕pyreneand 1,6-dinitropyrene-DNA adduct formation in hunlan mammary epithelial cells bydibenzoylmethane and sulforaphane.Cancer Letters,155(1):47-54.
Xu C,Huang M T,Shen G,Yuan X,Lin W.2006.Inhibition of 7,12-dimethylbenz〔a〕anthracene-induced skin tumorigenesis in C57BL/6 mice by sulforaphane is mediated by nuclear factor E2-related factor 2.Cancer Research,66(16):8293-8296.
Yanaka A,Zhang S,Tauchi M.2005.Role of the Nrf 2 gene in protection and repair of gastric mucosa against oxidative stress.Inflammopharmacology,13(1-3):83-86.
Analysis of Sulforaphane in Chinese kale(Brassica albograbra L. H. Bailey)by HPLC
LI Zhan-sheng1,LIU Yu-mei1*,FANG Zhi-yuan1,YANG Li-mei1,ZHUANG Mu1,ZHANG Yangyong1,LI Ling-yun2,SUN Pei-tian1
(1Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China;2Supervision and Testing Center for Vegetable Quality,Ministry of Agriculture,Beijing 100081,China)
Abstract:Forty four lines of Chinese kale(Brassica albograbra L.H.Bailey)including 23 high inbred lines and 21 F1generations were used to detect the sulforaphane contents in flower stalk of Chinese kale by RPHPLC,and to analyze the changing rule in sulforaphane contents.The results showed that the changing range of sulforaphane contents in 44 Chinese kale was 46.89-419.45 mg·kg-1(DW),and there were significant differences between sulforaphane contents of the testing lines.Four lines were detected with higher sulforaphane contents,among them one line was F1generation A86 with 419.45 mg·kg-1(DW)sulforaphane content,the other 3 were inbred lines A1,A17 and A53.Their sulforaphane contents were 298.50 mg·kg-1(DW),354.19 mg·kg-1(DW),361.06 mg·kg-1(DW),respectively.They could be used for breeding of Chinese kale in anti-cancer and marketing promotion.
Key words:Brassica albograbra L.H.Bailey;Flower stalk;Sulfoaphane;High performance liquid chromatography(HPLC)
*通讯作者(
Corresponding author):刘玉梅,女,研究员,专业方向:蔬菜遗传育种与生物技术,E-mail:liuyumei@caas.cn
收稿日期:2015-11-27;接受日期:2016-02-04
基金项目:国家自然科学基金项目(31372067,31501761),现代农业产业技术体系建设专项(CARS-25-A),国家科技支撑计划项目(2013BAD01B04),农业部园艺作物生物学与种质创制重点实验室项目,中国农业科学院科技创新工程项目(CAAS-ASTIPIVFCAAS)

