南瓜属作物育种研究回顾和展望
葛 宇韩文昊刘大伟,3*
(1中国热带农业科学院海口实验站,海南海口 570102;2东北农业大学农学院,黑龙江哈尔滨 150030;3黑龙江省高校寒地蔬菜生物学重点实验室,黑龙江哈尔滨 150030)
南瓜属作物育种研究回顾和展望
葛 宇1韩文昊2刘大伟2,3*
(1中国热带农业科学院海口实验站,海南海口 570102;2东北农业大学农学院,黑龙江哈尔滨 150030;3黑龙江省高校寒地蔬菜生物学重点实验室,黑龙江哈尔滨 150030)
摘 要:针对南瓜属作物育种研究现状,对国内外南瓜属作物传统育种中的新品种选育、品质育种、抗性育种、农艺性状育种及分子育种中的种质亲缘关系、遗传图谱构建、质量与数量性状基因定位、基因克隆等进行了系统阐述。同时,提出了南瓜属作物育种中存在的问题,并对育种前景进行了展望。
关键词:南瓜属作物;传统育种;分子育种
葛宇,男,博士,助理研究员,专业方向:园艺作物研究,E-mail:geyu1@qq.com
南瓜属(Cucurbita)蔬菜是人类最早栽培的蔬菜之一,长期以来世界各地均有栽培。南瓜属作物起源于美洲大陆的两个中心地带:一是墨西哥和中南美洲,是中国南瓜、美洲南瓜、墨西哥南瓜,还有可能是黑籽南瓜等栽培种的初生起源中心。二是南美洲的玻利维亚、秘鲁南部和阿根廷北部,是印度南瓜栽培种的初生起源中心(Whitaker & Davis,1962;Esquinas-Alcazar & Gulick,1983;Sanjur et al.,2002)。现在南瓜属作物在美洲大陆大概分布有12~14个种(Andres,1990;Nee,1990;Merrick,1995)。
国内外许多育种专家对南瓜属作物育种做了大量研究工作,本文针对传统及分子育种技术在南瓜属作物育种工作中的进展进行综述,以期为今后南瓜属作物育种提供指导。
1 传统育种研究
传统育种经历了一个多世纪的发展,由于其他基础学科特别是遗传学的发展,促使育种学在理论和实践方面均取得了较大的发展和成就。前人通过传统育种方法在南瓜作物新品种选育、品质、抗性及重要农艺性状育种上作出了巨大贡献,并且这些方法的继续应用仍将能取得很大的收获。
1.1新品种选育
发达国家对南瓜的研究起步早,研究有深度和广度,尤其对品种资源的收集研究利用工作极为重视,早在20世纪20年代初就曾组织科学探险队在南瓜的起源地中南美洲地区进行南瓜品种的起源、分布、数量、种类及特征特性等方面的科学研究(Whitaker & Davis,1962;Esquinas-Alcazar & Gulick,1983;Sanjur et al.,2002)。但以前南瓜类蔬菜作物在我国蔬菜研究领域被作为一个小的种类而不受重视,对其所做的研究不论从深度还是广度都远远落后于其他主要蔬菜。从20世纪90年代后期开始,国内一些科研单位才陆续开展南瓜的引种和育种工作,在肉用南瓜、籽用南瓜、砧用南瓜方面推出了一些新品种(黄河勋 等,2006;温玲 等,2015)。
1.1.1肉用南瓜 肉用南瓜包括肉用中国南瓜、肉用印度南瓜、菜用西葫芦,具有良好的栽培特性,对环境条件适应性强,在世界范围内广泛栽培。南瓜是富含食用纤维、低脂肪、高类胡萝卜素及微量元素丰富的蔬菜,南瓜果肉中碳水化合物含量最高的超过10%;类胡萝卜素含量高者达322 mg·kg-1;VC含量最高为239 mg·kg-1。
自20世纪90年代以来,国外已经选育出一系列适应不同生产目的及生态条件的肉用南瓜属品种,如冬玉、牵手、碧玉、惠比寿、栗自蔓等。在国内,以蜜本南瓜(郑汉藩,1998)为代表的杂种一代,因其品质优良、产量高、耐贮运的特点,在我国南方大面积推广,并成为我国北方地区秋冬季节上市的主要南瓜品种之一。我国科研工作者后来从国内外收集了较为丰富的品种资源,在此基础上培育出了适合市场需求和适应我国气候和栽培条件的高品质、丰产、多类型、抗性强的肉用南瓜系列新品种,并在生产上大面积推广应用,如吉祥1号(刘宜生 等,2001)、锦栗(严钦平 等,2001)、红栗(罗伏青 等,2001)、京红栗(李海真 等,2006)、短蔓京绿栗(贾长才 等,2007)等。
1.1.2籽用南瓜 籽用南瓜是南瓜属3个栽培种中食用种子的南瓜栽培种的总称。籽用南瓜要求肉薄,果腔大,种子多且仁厚。其食用种子即南瓜籽(白瓜籽),营养丰富,为炒货中之佳品;由于不饱和脂肪酸含量高,又可生产高级植物油。
以前我国使用的籽用南瓜多为地方农家品种,瓜籽产量低且不稳定。籽用南瓜新品种选育经过广大科技工作者的不懈努力,目前已取得了一定进展,先后选育出了甘南1号(孙为民 等,2002)、宝库1号(张艳红,2007)、 绿农1号、梅亚雪城1号(吉新文 等,2002)、梅亚雪城2号、银辉1号、银辉2号(屈淑平和崔崇士,2010)等品种应用于生产,为籽用南瓜的发展提供了有利的技术保障。1.1.3 砧用南瓜 选择砧木是从事嫁接的基础工作,各国都很重视砧木材料的搜集、研究和开发利用,并投入大量人力、物力从事砧木的选育。日本、韩国等国家已经选择、选配出一系列适应不同生产目的及生态条件,具有高抗甚至免疫以及复合抗性的专用或多用途砧用南瓜品种。如适于嫁接西瓜、甜瓜、茄子和黄瓜的砧木土佐系;耐高温黄瓜砧木铁盔和马库斯;根浅、耐湿的黄瓜砧木白菊座;越夏栽培黄瓜砧木强力新和等(Kato & Lou,1989;田迎宇和李世平,2015)。上世纪80年代以来,国内一些育种单位开展砧用南瓜育种研究,育成西瓜砧木京欣砧3号 (贾长才 等,2011)、京欣砧4号(李海真 等,2009)等;黄瓜砧木冀砧 10号 (郄丽娟 等,2009)、绿洲天使 (曹岩坡 等,2009)、京欣砧5号(张帆 等,2011)、 京欣砧6号(李海真 等,2011)等在生产上应用。
1.2品质育种研究
南瓜的果肉中富含氨基酸、维生素、矿物质、果胶、多糖、类胡萝卜素等多种营养成分和生物活性物质;南瓜籽中含有大量的蛋白质和脂肪酸。南瓜药用保健功效成分的开发利用已成为南瓜品质育种研究的一个热点。对于营养品质性状的变异及相关性研究,杨鹏鸣等(2006)选用20个南瓜自交系,对多个营养品质性状的变异及相关性进行了研究。结果表明,在18个品质性状中,β-胡萝卜素变异系数最大,纤维的变异系数最小。在糖和干物质之间的相关分析中,蔗糖分别与总糖和干物质的相关性达到极显著,说明在影响总糖和干物质的各因素中,蔗糖起到决定性作用,而总糖与干物质之间的相关性也达到显著。另外,果糖和葡萄糖的相关性也达到极显著。在南瓜其他营养品质性状的相关分析中,β-胡萝卜素与VC及蛋白质的相关性均达到极显著,VC与蛋白质之间的相关性也达到极显著,β-胡萝卜素与纤维的相关性也达到极显著。褚盼盼和向长萍(2007)利用70份中国南瓜对相关营养品质变化规律和相关性进行了研究。所研究材料的品质性状平均变异系数是31.70%。其中VC含量的变异系数最大,达到60.07%;含水量的变异系数最小,为1.52%;VC、可溶性蛋白质、可溶性糖含量、可溶性固形物等性状之间的相关系数均达到显著或极显著水平,与含水量均呈负相关。李新峥等(2009)以96份南瓜品系为材料,通过南瓜多糖、可溶性固形物含量和口感3个性状间的遗传相关分析,探讨性状之间的相关程度。研究表明,南瓜多糖含量与口感面度、甜度间均存在极显著正相关;可溶性固形物含量与口感面度、甜度间也存在显著或极显著正相关。
在配合力研究方面,杨鹏鸣等(2011)利用16个中国南瓜自交系按Griffing双列杂交方法Ⅳ组配成120个杂交组合,对中国南瓜VC含量的配合力进行了比较系统的研究。其杂交组合的一般配合力从-4.83到2.56不等,特殊配合力从-9.88到14.90不等。不同自交系及不同组合间,配合力存在着一定的差异。周俊国等(2011)利用相同的材料对中国南瓜干物质含量的配合力进行了比较系统的研究,其杂交组合的一般配合力从-2.034到2.703不等,特殊配合力从-3.763到2.915不等。
1.3抗性育种研究
南瓜的抗性较强,但近年来随着生产面积的不断扩大,规模化种植和连作的加重,南瓜病害有逐年严重的趋势。许多病害如白粉病、病毒病等在有的年份和地区会大面积流行、危害严重,造成南瓜减产。对南瓜抗性遗传机制的研究将有助于我们选育出抗病品种。
南瓜白粉病是一种分布广泛、普遍发生的世界性病害,最早在1800年就有葫芦科属植物白粉病的记载。Cohen等(2003)利用从1个南瓜属野生种中获得的抗源,发现美洲南瓜白粉病抗性主要由1个不完全显性基因控制,并将该基因命名为Pm-0。
凡种植瓜类作物的地区都会不同程度地发生病毒病。Gilbert-Albertini等(1993)通过对抗西瓜花叶2型病毒(WMV2)和西葫芦黄化花叶病毒病(ZYMV)的中国南瓜Menina与易感病的中国南瓜Musquee de Provence杂交后代群体进行抗病分析,发现西瓜花叶2型病毒病抗性是由1个显性基因控制的,而且该基因对分布于不同地域的8个菌株均具有抗性。另外对2种病毒共同侵染后的试验群体进行分析,认为上述2种病毒的抗性可能是由同一个显性基因(Zym,抗西葫芦黄化花叶病毒病显性基因)或2个紧密连锁的基因控制。中国南瓜Nigerian Local同时抗西葫芦黄化花叶病毒、西瓜花叶病毒、木瓜环斑西瓜病毒和黄瓜花叶病毒。Maluf等(1997)利用抗木瓜环斑西瓜病毒病(PRSV-W)的印度南瓜ABL-010、Redlands Trailblazer与易感病印度南瓜Buttercup杂交后代的2个群体,对抗病性进行遗传分析。对ABL-010×Buttercup杂交后代群体进行抗病分析,认为抗病性状由3个不完全显性基因控制;对Redlands Trailblazer×Buttercup杂交后代群体进行抗病分析,认为抗病性状由至少2个以加性效应为主的基因控制。Brown等(2003)把抗4种病毒的中国南瓜Nigerian Local作为抗源与易感病的美洲南瓜杂交,利用F1、F2和BC1群体研究抗性遗传规律。他们首先肯定了西葫芦黄化花叶病毒病抗性是由前人发现的单显性基因Zym控制的;同时发现西瓜花叶病毒病和黄瓜花叶病毒病抗性也是由单显性基因控制的,被分别命名为Wmv 和Cmv,而1个单隐性基因prv控制木瓜环斑西瓜病毒病抗性。
1.4农艺性状育种研究
南瓜属作物品种间的许多农艺性状差异显著,不仅在葫芦科内,即使在其他科的蔬菜中也属罕见。国内外研究人员对南瓜作物果皮条纹、果皮颜色、生长习性等农艺性状进行了较为深入的研究。
果皮上深浅交互的条纹是美洲南瓜一种常见的农艺性状。Globerson(1969)通过研究美洲南瓜果皮及茎颜色的遗传规律,发现青条纹的果皮较之纯白色果皮为显性,受1对显性基因控制;深绿色茎较之浅绿色茎为显性,也同样受1对显性基因控制。Paris(2000a)研究发现具有较窄的深色条纹的果皮由等位基因l-1St控制,对控制无条纹的浅色果皮等位基因l-1呈显性,对控制无条纹的深色果皮等位基因L-1呈隐性。同时他发现较宽的条纹较之较窄的及无条纹浅色果皮为显性,由1个基因l-1BSt控制,对无条纹深色果皮呈隐性。从基因座l-1多个等位基因的显隐关系分析应为L-1>l-1BSt>l-1St> l-1。 Paris(2002a)又继续对具有不规则条纹的果皮性状进行研究,发现控制不规则条纹的基因是基因座l-1中的等位基因之一l-1iSt。通过杂交、测交,Paris(2002a)总结了几年间对基因座l-1多个等位基因显隐关系的研究结果,其显隐关系应为L-1>(l-1BSt> l-1St) ≥l-1iSt> l-1。
对于美洲南瓜,研究人员已发现有13个基因位点控制果实发育期间果皮的着色(Paris ,2000b),其中起主效作用的有3个基因(D,l-1,l-2)。D基因对果实发育早期果皮的着色并不起作用或作用不明显,从授粉10 d后作用才逐渐显现。含有显性D基因位点(D/-)的果实颜色将逐渐发深,而含有隐性d基因位点(d/d)的果实颜色不变。隐性l-1和l-2两基因位点促使幼嫩果实的果皮着色较浅(Paris,2002b),而含有显性L-1和L-2基因位点(L-1/-,L-2/-)的果实颜色在果实发育期逐渐加深。
美洲南瓜按生长习性可分为3个类型,矮生类型、半蔓生类型和蔓生类型。Edelstein等 (1989)研究美洲南瓜生长习性,发现矮生类型较之蔓生类型为显性,受1对显性基因控制。周祥麟和李海真(1991)、Wu等 (2007)研究中国南瓜生长习性也得到相同的结果,而马海龙等(2011)通过无蔓中国南瓜与蔓生异种南瓜材料的种间杂交一代表现,则认为矮生类型较之蔓生类型为不完全显性。
2 分子育种研究
随着现代分子生物学技术的发展,分子育种技术也逐渐应用到南瓜属作物的育种研究上,如南瓜种质亲缘关系、质量及数量性状定位等方面。分子育种技术大大提高了遗传分析的准确性和选育种的有效性,因而在遗传育种领域愈来愈受到重视。
2.1种质亲缘关系
目前南瓜属作物的栽培种有5个:即中国南瓜(Cucurbita moschata Duch.,俗称倭瓜、番瓜)、印度南瓜(C.maxima Duch.,俗称笋瓜)、美洲南瓜(C. pepo L.,俗称西葫芦)、灰籽南瓜(C.mixta,又名墨西哥南瓜)、黑籽南瓜(C.ficifolia)。其中中国南瓜、印度南瓜与美洲南瓜是南瓜属作物的三大主要栽培种,在我国乃至世界各地都广泛栽培,具有丰富的营养成分和药用价值。对于南瓜属作物各种类特别是栽培种的进化、分类研究,不但有助于确定其亲缘关系,也有利于种质资源的收集、整理以及育种需要。
Sanjur等(2002)根据线粒体基因nad1的内含子序列开发分子标记,通过所开发的标记研究南瓜属6个栽培种与6个野生种的亲缘关系。结果表明,在南瓜栽培种的进化历程中最先出现的是黑籽南瓜,随后印度南瓜与美洲南瓜几乎同时出现,最后出现的是中国南瓜,其祖先来自于美洲南瓜,所以中国南瓜与美洲南瓜的亲源关系较印度南瓜和黑籽南瓜更近。国内研究人员通过分子标记研究南瓜属作物的亲缘关系,同样发现中国南瓜与美洲南瓜亲源关系最近,与印度南瓜次之(李海真 等,2000;李俊丽 等,2005;张天明 等,2006;赵福宽 等,2006)。另外也有学者通过分子标记研究了南瓜多个栽培种内种质资源的多样性,如中国南瓜(Youn & Chung,1998;Gwanama et al.,2000;Ferriol et al.,2004a;Chu et al.,2007;Du et al.,2011;Wu et al.,2011)、美洲南瓜(Katzir et al.,2000;Ferriol et al.,2003a;Paris et al.,2003)、印度南瓜(Ferriol et al.,2003b;Ferriol et al.,2004b),发现南瓜多个栽培种内遗传多样性非常丰富,为南瓜栽培种杂交育种中的亲本选配提供了依据,有利于南瓜优势育种。
2.2质量性状基因定位
Brown & Myers(2002)率先开展了南瓜属作物杂色叶片和早熟黄色外皮基因的定位分析,之后其他南瓜属作物的基因定位研究相继开展。在南瓜属作物质量性状方面,已对南瓜矮生、南瓜裸仁、杂色叶片等进行了研究,并找到了一些相应的分子标记(表1)。
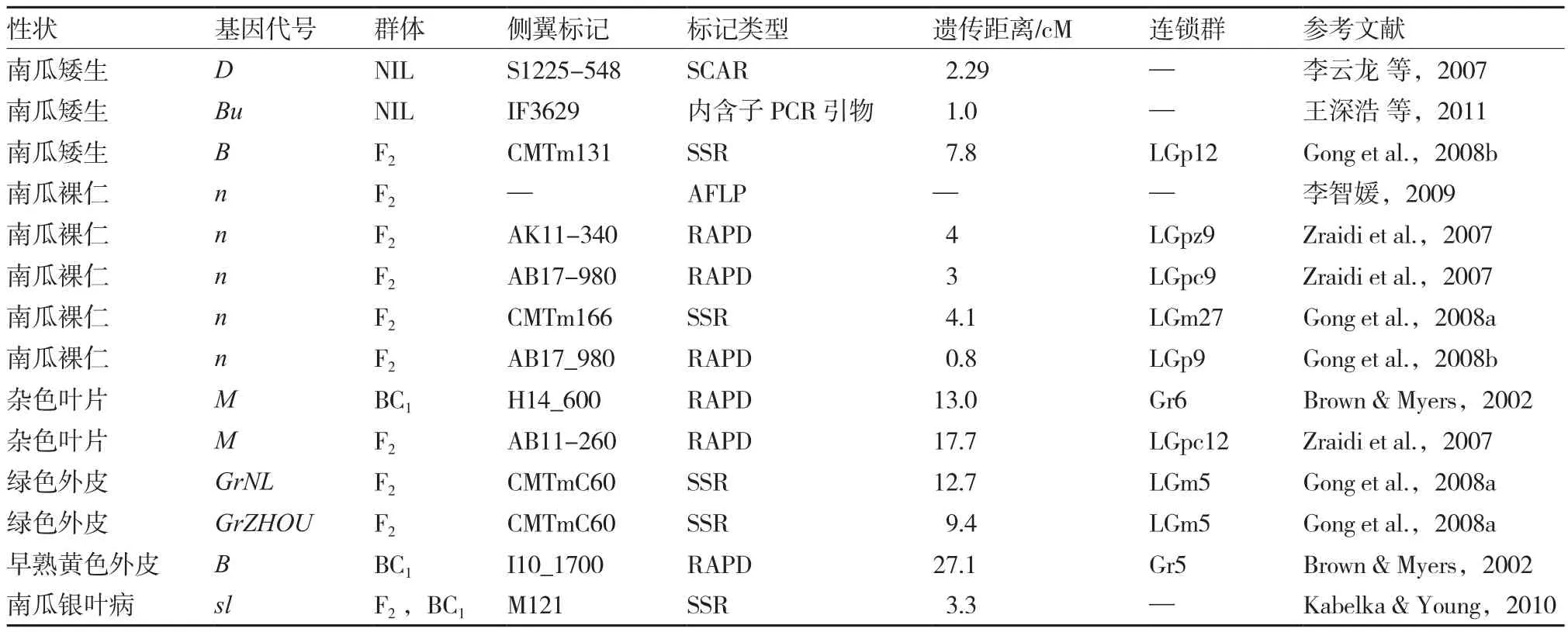
表1 南瓜属作物质量性状定位研究
近等基因系通常是经过饱和回交形成的除目标性状有差异,其他遗传背景完全相同的两个遗传材料(品系),是定位质量性状基因的最佳材料。以中国南瓜矮生突变体为供体亲本,以印度南瓜为轮回亲本,经过6代回交和2代自交选育出南瓜矮生近等基因纯合株系,将其再与轮回亲本杂交获得的F2分离群体作为试验材料,李云龙等(2007)利用近等基因系和RAPD技术,发现RAPD标记S1225-548与矮生基因D紧密连锁,遗传距离为2.29 cM。最后将该标记成功转化为SCAR标记SCAR3-398。为了对矮生基因进行精确定位,王深浩等(2011)利用相同材料将获得的SCAR标记SCAR3-398的特异片段序列与黄瓜基因组进行比对,确定该标记在黄瓜基因组中的位置。在附近1 Mbp范围内,设计跨内含子PCR引物,最终发现新的PCR标记IF3629与矮生基因Bu(同矮生基因D)紧密连锁,遗传距离为1.0 cM。该试验不但将遗传距离大大减少而且将南瓜矮生基因Bu比较定位至黄瓜5号染色体上,为该基因的克隆奠定了基础。
Zraidi等(2007)构建了2个美洲南瓜遗传图谱,分别将南瓜裸仁基因n定位到连锁群LGpz9和LGpc9上。根据相同标记对2个图谱进行比较分析,发现连锁群LGpz9与LGpc9具有同源性,定位于上述2个图谱上的南瓜裸仁基因n可能为同一基因。Gong等(2008b)更新了Zraidi 等(2007)所构建的1个美洲南瓜遗传图谱,增加其标记密度,发现与南瓜裸仁基因n更紧密连锁的RAPD标记AB17_980,其遗传距离为0.8 cM,比原图谱的RAPD标记AB17-980近2.2 cM。同时Gong等(2008a)构建了1个中国南瓜遗传图谱,将南瓜裸仁基因n定位到连锁群LGm27上。虽然Gong等(2008a)利用相同的SSR标记,将其前期所构建的美洲南瓜遗传图谱与中国南瓜遗传图谱进行连锁群比对,但由于连锁群LGm27标记太少,因此无法确定位于连锁群LGm27上的控制中国南瓜的裸仁基因n是否与连锁群LGpc9上的控制美洲南瓜的裸仁基因n位于同一连锁群。在国内,李智媛(2009)以美洲南瓜为试材构建F2群体,利用AFLP技术和BSA法获得了4个与裸仁基因n相连锁的AFLP标记,最近的遗传距离为8.9 cM。
2.3遗传图谱的构建
遗传连锁图谱是进行基因定位、基因克隆和标记辅助选择育种的重要工具,在分子遗传育种等领域起着重要作用。
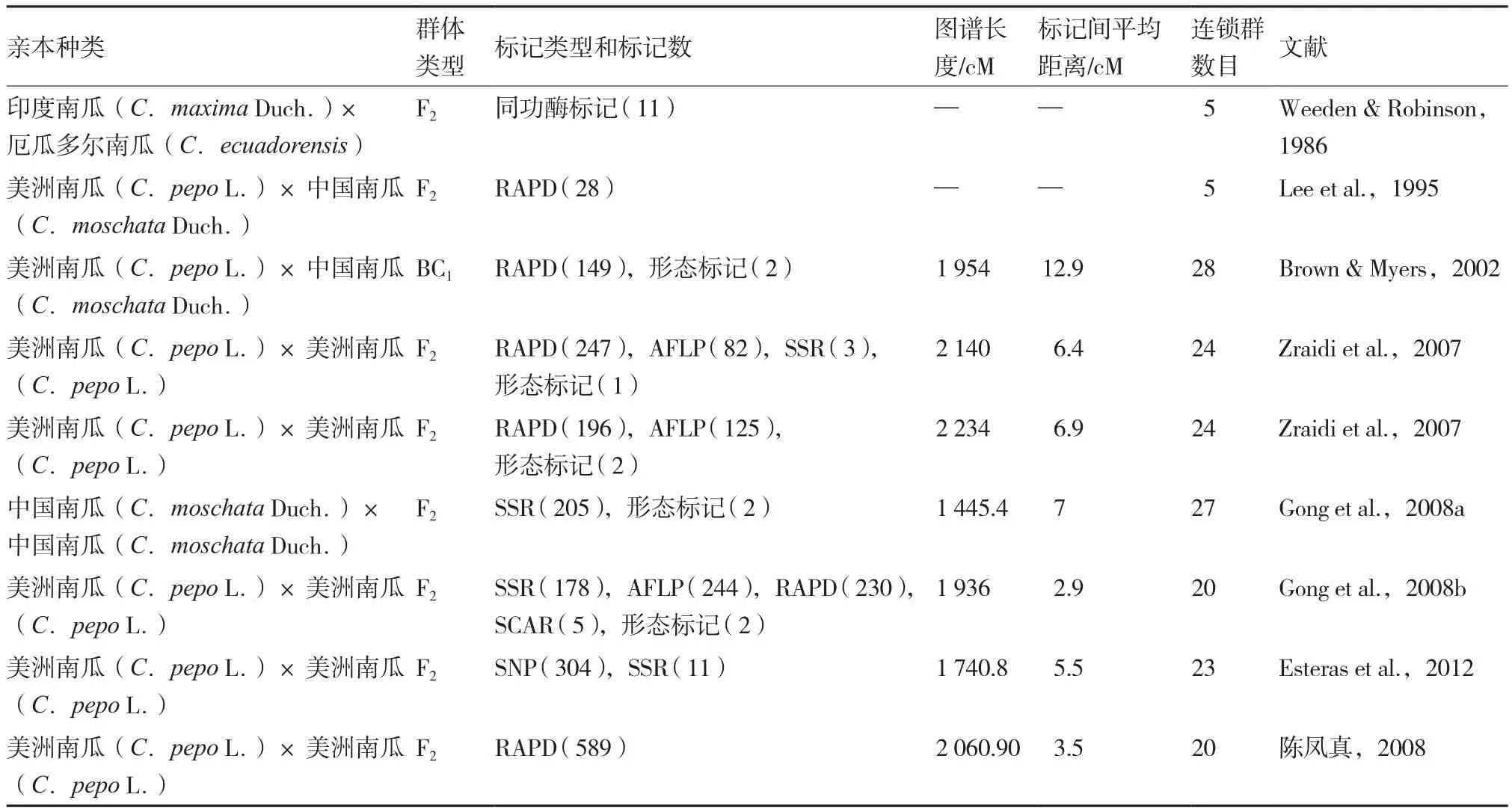
表2 南瓜属作物分子遗传图谱汇总
南瓜属作物近些年在构建遗传图谱方面的研究还处于发展阶段,从表2可以看到国内外已发表的9个南瓜属作物遗传图谱主要特征的统计,这些特征包括亲本种类、群体类型、标记类型和标记数、图谱长度、标记间平均距离及连锁群数目等。国内外已构建的南瓜属作物遗传图谱的群体类型全部为F2和BC1暂时性群体。南瓜属作物遗传图谱的长度在1 445.4~2 234 cM之间。南瓜属作物的单倍体染色体数为20,前人构建的南瓜属作物遗传图谱的连锁群数目在5~28之间。Gong等(2008b)构建了富含SSR标记的染色体基因组信息库,对2 400个靶克隆进行测序,设计了532条SSR引物。利用所开发的SSR标记,Gong等(2008a,2008b)构建了中国南瓜和美洲南瓜2个南瓜种作物图谱,其中美洲南瓜连锁群数目为20,与单倍体染色体数目一致。Esteras等(2012)率先利用SNP分子标记构建了美洲南瓜分子遗传图谱,并对美洲南瓜花、果实等多个性状的QTL位点进行定位,同时还把该图谱与黄瓜图谱进行同源性分析。从构建各图谱的亲本种属关系上分析,在3个图谱中两亲本分别来自于不同的种类 (Weeden & Robinson,1986;Lee et al.,1995;Brown & Myers ,2002),而在另外6个图谱中两亲本均来自于相同的种类(Zraidi et al.,2007;陈凤真,2008;Gong et al.,2008a,2008b;Esteras et al.,2012)。对于中国南瓜、印度南瓜与美洲南瓜这三大主要栽培种,至今还没有以两亲本均为印度南瓜的遗传图谱出现。
2.4性状QTL定位
植物的许多重要性状表现为数量性状遗传的特点,即受多个数量基因座位(QTL)和环境因子的共同作用。由于分子育种技术的发展,目前人们已经有能力将数量性状进行分解,像研究质量性状一样对控制数量性状的多个基因分别进行研究,从而使数量性状研究取得了突破性进展。
南瓜属作物分子遗传图谱的相继出现,为定位数量性状QTL提供了首要条件,大大提高了QTL定位的精确度。Brown & Myers (2002)利用所构建的遗传图谱对控制果实形状、叶脉凹陷深度和果皮颜色等3个数量性状基因进行定位。他们用美洲南瓜自交系A0449与中国南瓜自交系Nigerian Local杂交得到F1,将A0449作为轮回亲本构建了回交群体BC1,利用RAPD标记构建了遗传图谱,通过遗传图谱各检测到1个控制上述3个数量性状的QTL位点。其中控制果实形状的QTL位点位于第10连锁群,距离标记B8_900最近;控制叶脉凹陷深度的QTL位点位于第5连锁群,距离标记K11_950最近;控制果皮颜色的QTL位点位于第8连锁群,距最近的标记G17_700 9.7 cM。Esteras等(2012)利用所构建的美洲南瓜遗传图谱分别对控制茎、花、果实部位的12个质量性状和50个数量性状的QTL位点进行定位。通过遗传图谱分别检测到6个控制花的和11个控制果实的数量性状QTL位点,同时还分别检测到3个与控制茎(茎的颜色、叶腋颜色、卷须有无)相关的及1个与控制果实颜色相关的质量性状QTL位点。
2.5基因的克隆
Wu和Cao(2010)以南瓜无蔓1号自交后代分离得到的矮化突变体cga及其野生型(长蔓株)为材料,通过cDNA-AFLP结合RACE技术,克隆得到1个与南瓜蔓伸长相关的基因CmV1。此外,国外研究人员还克隆出西葫芦的CAT酶基因(Ellard-Ivey et al.,1999)和CpCPK1基因(Esaka et al.,1997)。
3 存在的育种问题
我国地域广阔,南瓜属作物资源相当丰富,类型多样,但南瓜属作物的育种研究工作长期以来一直未能得到相应的重视,缺乏系统深入的研究。
在南瓜品种选育方面,由于长期的不重视,现在许多地方都沿用地方品种,品种退化问题严重,产量低、品质差现象突出,生产中品种单一问题也相当突出。我国推广面积最大的品种蜜本南瓜由于品质好、产量高,在我国已种植多年,品种现已出现抗病性差、产量下降等现象,而且由于受日照、温度等影响,该品种只能在长江以南地区种植,生产上亟需推出适合北方地区种植的南瓜类型品种,以扩大品种的适应性,丰富品种的多样性。另外,国内尚未育成生态型丰富的南瓜品种。由于印度南瓜的抗病性比中国南瓜和美洲南瓜相对要差,国内育成的印度南瓜品种中,尚未发现有抗病毒病和白粉病的品种,尤其是红皮类型的西洋南瓜,如东升、红栗、锦绣、京红栗等均不能在高温炎热的秋季露地栽培。对于籽用南瓜,品种多为常规品种,现有品种抗性差,缺少加工专用新品种,特别是种籽和果肉中营养成分高、生物活性物质多的品种。
南瓜的营养保健价值已被世界所公认,但目前国内外有关南瓜品质育种改良方面的研究却极少,大多数研究仍集中于如碳水化合物、蛋白质、果胶、维生素等普通营养成分的分析方面。病毒病、疫病和白粉病是南瓜属作物生产中的重要病害,但国内外抗病研究大多集中在抗性品种资源筛选及抗性鉴定方法等研究上,其抗性遗传规律等基础研究远滞后于生产。另外,南瓜属作物品种间的许多农艺性状差异显著,如茎、叶、花、果实等的颜色与形状,即使在其他科的蔬菜内也属罕见,为南瓜属作物育种研究提供了充足的研究材料,但目前南瓜属作物农艺性状遗传规律等基础研究报道较少。
前人通过形态学、细胞遗传学及分子遗传学等的研究结果(Sanjur et al.,2002;区柄庆 等,2003;孙正海 等,2004),认为中国南瓜与美洲南瓜亲源关系最近,与印度南瓜次之,但上述结果与生产实践中所得出的亲源关系并不一致。生产实践中中国南瓜与印度南瓜亲和力最强,而与美洲南瓜杂交却很难结籽(林德佩,2000)。
同为葫芦科作物,从国内外葫芦科作物分子育种研究进展看,南瓜属作物研究水平要远低于黄瓜、甜瓜等作物,这与其在国内外的经济价值并不匹配。南瓜属作物分子育种研究水平较低的原因,第一,南瓜属作物单倍体染色体数为20,而黄瓜、甜瓜单倍体染色体数分别为7和12,远少于南瓜单倍体染色体数,所以如果以相同类型的标记构建标记密度相近的遗传图谱,构建南瓜属作物遗传图谱所花费的人力、物力均远多于构建黄瓜、甜瓜遗传图谱的花费。第二,前期所构建的遗传图谱所含标记大多为随机性标记,对于已定位于图谱上的一些重要性状的QTL或基因,不便于实验室间的交流,阻碍了分子育种研究进程。第三,研究人员对南瓜基因组公布的数据较少,截止到2016年3月2日,在NCBI上发表的南瓜属EST序列仅1 542条,远少于同为葫芦科的黄瓜属的140 590条及西瓜属的12 617条,因此根据南瓜基因组序列所开发的引物较少。
4 未来研究展望
在今后的研究中,对于传统育种基础研究,首先,应该进一步开展国内外种质资源的引进与创新,拓宽育种材料的遗传背景;开展杂交新品种选育研究,尤其是籽肉两用或籽用专用新品种,保持我国南瓜育种的可持续发展。其次,南瓜属作物营养丰富,在南瓜属作物品质育种研究中,应重视营养成分,尤其是功能成分生理代谢途径的研究。第三,在南瓜属作物抗病育种研究中,应系统地对抗不同生理小种病菌的遗传规律进行研究。最后,应根据不同的地域、生产季节和消费要求,制定不同的育种目标,应对与生产紧密联系的南瓜属作物主要经济农艺性状遗传规律进行全面深入研究,选育出具有较高价值的品种,使基础研究成果较快地转化为生产力。
对于分子育种研究,应根据科研情况,适时地开发特异性的锚定标记及高密度南瓜属作物遗传图谱,它们是重要农艺性状定位(QTL)、分子标记辅助选择育种(marker-assisted selection,MAS)、功能基因克隆及比较基因组学等研究的基础。至今国内外所开发的图谱中还没有1个遗传图谱可作为公共参考遗传图谱。未来,其他学者可通过开发南瓜锚定标记将各连锁群与公共参考图谱对应起来,从而根据连锁群与染色体对应的结果,将已定位的一些重要性状的QTL或基因定位于参考图谱,便于实验室间的交流。
黄瓜全基因组测序计划已于2009年底完成,序列信息已经公布(Huang et al.,2009)。该信息同样为南瓜属作物某些重要基因的克隆和功能研究提供了有利的资源平台,也能弥补南瓜基因组公布的数据较少的事实。王深浩等(2011)利用比较基因组学,将与南瓜矮生基因连锁的标记比较定位至黄瓜染色体,并利用黄瓜基因组序列开发了与矮生基因紧密连锁的标记,为该基因的图位克隆奠定了基础。
传统育种技术包括杂交育种、诱变育种、单倍体育种等;分子育种技术主要包括基因工程育种和分子标记辅助选择,但其核心仍然是传统育种手段和方法。笔者认为传统育种一般是直接改变植株的遗传性,宏观上进行优良品种筛选;而分子育种是从基因这个微观层面上予以改造和标记,再在植株上进行表达。当今分子育种技术作为传统育种技术的补充,给育种者提供新工具、新基因型和新概念,以便解决育种者面临的紧迫问题。Ferriol等(2004b)和Chu等(2007)便通过综合传统形态和现代分子标记分别研究了中国和印度南瓜种内种质资源的多样性,为育种者对中国和印度南瓜杂交育种中的亲本选配提供了更加准确的依据。
参考文献
曹岩坡,冯贺敬,代鹏,全秀伟,戴素英.2009.黄瓜嫁接砧木用南瓜新品种‘绿洲天使’.园艺学报,36(10):1553-1554.
陈凤真.2008.西葫芦农艺性状的遗传、遗传图谱的构建及遗传多样性的研究〔博士论文〕.泰安:山东农业大学.
褚盼盼,向长萍.2007.中国南瓜营养品质的变化规律和相关性.中国蔬菜,(12):15-19.
黄河勋,林毓娥,梁肇均.2006.我国南瓜育种研究现状及展望.广东农业科学,(1):18-20.
吉新文,吉小平,丁春利.2002.梅亚雪城1号大片籽用南瓜新品种的选育研究.中国西瓜甜瓜,(2):17-19.
贾长才,李海真,屈广琪,张帆.2007.优质南瓜(笋瓜)新品种短蔓京绿栗的选育.中国蔬菜,(5):31-33.
贾长才,李海真,张帆,姜立纲.2011.甜瓜、西瓜专用砧木品种——京欣砧 3号的选育和推广.中国瓜菜,24(5):28-31.
李海真,许勇,武峻新,王永健,郭军,寿森炎.2000.南瓜属三个种的亲缘关系与品种的分子鉴定研究.农业生物技术学报,8(2):161-164.
李海真,贾长才,张帆.2006.优质丰产早熟南瓜新品种京红栗的选育.中国蔬菜,(1):27-29.
李海真,宫国义,张帆,贾长才,姜立纲.2009.西瓜专用砧木——京欣砧 4号的选育.长江蔬菜,(2):61-63.
李海真,张帆,贾长才,姜立纲,张国裕.2011.黄瓜专用砧木品种京欣砧6 号的选育.中国瓜菜,24(2):18-20.
李俊丽,向长萍,张宏荣,杨静.2005.南瓜种质资源遗传多样性的RAPD分析.园艺学报,32(5):834-839.
李新峥,杨鹏鸣,范文秀,刘振威,杜晓华.2009.南瓜多糖及可溶性固形物含量与口感性状相关性分析.中国蔬菜,(4):26-29.
李云龙,李海真,崔崇士,张海英,宫国义.2007.与南瓜矮生基因连锁的分子标记.农业生物技术学报,15(2):279-282.
李智媛.2009.美洲南瓜裸仁基因的AFLP分子标记〔硕士论文〕.哈尔滨:东北农业大学.
林德佩.2000.南瓜植物的遗传基因及种间杂交.中国西瓜甜瓜,(3):41-44.
刘宜生,王长林,崔力琴,张秀德,王迎杰,温凤英,张学杰.2001.早熟南瓜吉祥1号的选育.中国蔬菜,(1):24-25.
罗伏青,董亚静,孙小武.2001.南瓜新品种红栗的选育.湖南农业大学学报:自然科学版,27(4):286-288.
马海龙,智海英,岳青,梁燕平,苗如意.2011.中国南瓜无蔓性状种间遗传研究.中国农学通报,27(13):219-222.
郄丽娟,齐铁权,苏俊坡,韩建会.2009.黄瓜砧木用南瓜新品种‘冀砧10号’.园艺学报,36(2):308.
区炳庆,任吉君,何丽烂.2003.不同品种南瓜POD及PPO同工酶的比较研究.武汉植物学研究,21(1):77-80.
屈淑平,崔崇士.2010.籽用南瓜新品种银辉2号的选育.中国蔬菜,(12):83-84.
孙为民,邓少华,刘玉纯,张瑞岭,徐铁生,林令堂.2002.籽用南瓜甘南1号的选育.中国蔬菜,(4):32-33.
孙正海,李跃建,宋明,杨武云,房超,刘小俊.2004.南瓜属三个种种质的遗传多样性.西南农业学报,17(1):71-73.
田迎宇,李世平.2015.茄科葫芦科蔬菜砧木遗传选育综述.山西农业科学,43(2):244-248.
王深浩,李海真,张忠华,贺俊,贾长才,张帆,黄三文.2011.南瓜矮生基因Bu的比较定位.园艺学报,38(1):95-100.
温玲,赵丹,朱子成,赵松,杨帆.2015.俄罗斯南瓜种质资源引进及综合性状评价.北方园艺,(19):11-13.
严钦平,罗伏青,孙小武,匡华夫.2001.优质南瓜新品种锦栗.中国蔬菜,(1):47-48.
杨鹏鸣,李桂荣,李孝伟,李新峥.2006.南瓜主要营养品质性状的变异及相关性研究.中国农学通报,22(2):285-288.
杨鹏鸣,周俊国,李新铮.2011.中国南瓜Vc含量配合力的研究.湖南农业科学,(3):12-14.
张帆,贾长才,姜立纲,张国裕,李海真.2011.黄瓜专用砧木品种京欣砧5号的选育.中国蔬菜,(4):73-75.
张天明,屈冬玉,王长林,王迎杰,刘宜生.2006.南瓜属4个栽培种亲源关系的AFLP分析.中国蔬菜,(1):11-14.
张艳红.2007.裸仁南瓜绿农1号的选育及高产栽培技术.作物杂志,(1):73-74.
赵福宽,李海英,赵晓萌.2006.南瓜种质资源亲缘关系的RAPD分析.分子植物育种,4(3S):45-50.
郑汉藩.1998.白沙蜜本南瓜.长江蔬菜,(1):21.
周俊国,杨鹏鸣,李新峥.2011.中国南瓜干物质含量配合力的研究.广东农业科学,(4):53-55.
周祥麟,李海真.1991.中国南瓜无蔓性状的遗传性及其生产利用的研究.山西农业科学,(1):1-7.
Andres T C.1990.Evidence for multiple domestications of Cucurbita pepo//Bates D M,Robinson R W,Jeffrey C.Biology and Utilization of the Cucurbitaceae.Ithaca:Cornell University Press:102-119.
Brown R N,Myers J R.2002.A genetic map of squash(Cucurbita sp.)with randomly amplified polymorphic DNA markers and morphological markers.Journal of the American Society for Horticultural Science,127(4):568-575.
Brown R N,Herrera B A,Myers J R,Jahn M M.2003.Inheritance of resistance to four cucurbit viruses in Cucurbita moschata.Euphytica,129:253-258.
Chu P P,Xiang C P,Zhang C X,Liu C P.2007.Genetic diversity of Cucurbita moschata genotypes revealed by RAPD markers and agronomic traits.Journal of Nuclear Agricultural Sciences,21(5):441-444.
Cohen R,Hanan A,Paris H S.2003.Single-gene resistance to powdery mildew in zucchini squashes (Cucurbita pepo).Euphytica,130:433-441.
Du X H,Sun Y D,Li X Z,Zhou J G,Li X M.2011.Genetic divergence among inbred lines in Cucurbita moschata from China.Scientia Horticulturae,127:207-213.
Edelstein M,Paris H S,Nerson H.1989.Dominance of bush growth habitin spaghetti squash (Cucurbita pepo).Euphytica,43:253-257.
Ellard-Ivey M,Hopkins R B,White T J,Lomax T W.1999.Cloning,expression and N-terminal myristoylation of CpCPK1,a calcium-dependent protein kinase from zucchini.Plant Molecular Biology,39(3):199-208.
Esaka M,Yamada N,Kitabayashi M,Setoguchi Y,Tsugeki R,Kondo M,Nishimura M.1997.cDNA cloning and differential gene expression of three catalases in pumpkin.Plant Molecular Biology,(35):141-155.
Esquinas-Alcazar J T,Gulick P J.1983.Genetic resources of Cucurbitaceae.Rome:IBPGR:55-58.
Esteras C,Gómez P,Monforte A J,Blanca J,Vicente-Dólera N,Roig C,Nuez F,Picó B.2012.High-throughput SNP genotyping in Cucurbita pepo for map construction and quantitative trait loci mapping.BMC Genomics,13:80.
Ferriol M,Picó B,Nuez F.2003a.Genetic diversity of a germplasm collection of Cucurbita pepo using SRAP and AFLP markers.Theoretical and Applied Genetics,107:271-282.
Ferriol M,Picó B,Nuez F.2003b.Genetic diversity of some accessions of Cucurbita maxima from Spain using RAPD and SBAP markers.Genetic Resources and Crop Evolution,50:227-238.
Ferriol M,Picó B,Córdova P F,Nuez F.2004a.Molecular diversity of a germplasm collection of squash (Cucurbita moschata) determined by SRAP and AFLP markers.Crop Science,44:653-664.
Ferriol M,Picó B,Nuez F.2004b.Morphological and molecular diversity of a collection of Cucurbita maxima landraces.Journal of the American Society for Horticultural Science,129:60-69.
Gilbert-Albertini F,Lecoq H,Pitrat M,Nicolet J L.1993.Resistance of Cucurbita moschata to Watermelon mosaic virus type 2 and its genetic relation to resistance to Zucchini yellow mosaic virus.Euphytica,69:231-237.
Globerson D.1969.The inheritance of white fruit and stem color in summer squash Cucurbita pepo L..Euphytica,18:249-255.
Gong L,Pachner M,Kalai K,Lelley T.2008a.SSR-based genetic linkage map of Cucurbita moschata and its synteny with Cucurbita pepo.Genome,51:878-887.
Gong L,Stift G,Kofler R,Pachner M,Lelley T.2008b.Microsatellites for the genus Cucurbita and an SSR-based genetic linkage map of Cucurbita pepo L..Theoretical and Applied Genetics,117(1):37-48.
Gwanama C,Labuschange M T,Botha A M.2000.Analysis of genetic variation in Cucurbita moschata by random amplified polymorphic DNA(RAPD).Euphytica,113(1):19-24.
Huang S W,Li R Q,Zhang Z H,Li L,Gu X F,Fan W,Lucas W J,Wang X W,Xie B Y,Ni P X,Ren Y Y,Zhu H M,Li J,Lin K,Jin W W,Fei Z J,Li G C,Staub J,Kilian A,Van der Vossen E A G,Wu Y,Guo J,He J,Jia Z Q,Ren Y,Tian G,Lu Y,Ruan J,Qian W B,Wang M W,Haung Q F,Li B,Xuan Z L,Cao J J,Asan,Wu Z G,Zhang J B,Cai Q L,Bai Y Q,Zhao B W,Han Y H,Li Y,Li X F,Wang S H,Shi Q X,Liu S Q,Cho W K,Kim J Y,Xu Y,Heller-Uszynska K,Miao H,Cheng Z C,Zhang S P,Wu J,Yang Y H,Kang H X,Li M,Liang H Q,Ren X L,Shi Z B,Wen M,Jian M,Yang H L,Zhang G J,Yang Z T,Chen R,Liu S F,Li J W,Ma L J,Liu H,Zhou Y,Zhao J,Fang X D,Li G Q,Fang L,Li Y R,Liu D Y,Zheng H K,Zhang Y,Qin N,Li Z,Yang G H,Yang S,Bolund L,Kristiansen K,Zheng H C,Li S C ,Zhang X Q,Yang H M,Wang J,Sun R F,Zhang B X,Jiang S Z,Wang J,Du Y C,Li S G.2009.The genome of the cucumber,Cucumis sativus L..Nature Genetics,41:1275-1281.
Kabelka E A,Young K.2010.Identification of molecular markers associated with resistance to squash silverleaf disorder in summer squash (Cucurbita pepo).Euphytica,173(1):49-54.
Kato T,Lou H.1989.Effect of rootstock on the yield,mineral nutrition and hormone level in xylem sap in eggplant.Journal of Japanese Society Science,58(2):345-352.
Katzir N,Tadmor Y,Tzuri G,Leshzeshen E,Mozes-Daube N,Damin-Poleg Y,Paris H S.2000.Further ISSR and preliminary SSR analysis of relationships among accessions of Cucurbita pepo.Proc VII EUCARPIA Mtg Cucurbit Genet Breed,510:433-439.
Lee Y H,Jeon H J,Hong K H,Kim B D.1995.Use of random amplified polymorphic DNA for linkage group analysis in an interspecific cross hybrid F2generation of Cucurbita.Journal of the Korean Society for Horticultural Science,36:323-330.
Maluf W R,Pereira J J,Figueira A R.1997.Inheritance of resistance to the papaya ringspot virus-watermelon strain from two different accessions of winter squash Cucurbita maxima Duch..Euphytica,94:163-168.
Merrick L C.1995.Squashpumpkins,and gourds:Cucurbita (Cucurbitaceae)//Smartt J,Simmonds N W.Evolution of Crop Plants.Essex:Longman:97-105.
Nee M.1990.The domestication of Cucurbita (Cucurbitaceae).Economic Botany,44:56-68.
Paris H S.2000a.Gene for broad,contiguous dark stripes in cocozelle squash (Cucurbita pepo).Euphytica,115:191-196.
Paris H S.2000b.Quiescent intense (qi),a gene that affects young but not mature fruit color intensity in Cucurbita pepo.Journal of Heredity,91:333-339.
Paris H S.2002a.Genetic control of irregular striping,a new phenotype in Cucurbita pepo.Euphytica,129:119-126.
Paris H S.2002b.Multiple allelism at a major locus affecting fruit coloration in Cucurbita pepo.Euphytica,125:149-153.
Paris H S,Yonash N,Portnoy V,Mozes-Daube N,Tzuri G,Katzir N.2003.Assessment of genetic relationships in Cucurbita pepo (Cucurbitaceae)using DNA markers.Theoretical and Applied Genetics,106(6):971-978.
Sanjur O I,Piperno D R,Andres T C,Wessel-Beaver L.2002.Phylogenetic relationships among domesticated and wild speciesof Cucurbita (Cucurbitaceae) inferred from a mitochondrial gene:implications for crop plant evolution and areas of origin.Proceedings of the National Academy of Sciences of the United States of America,99(1):535-540.
Weeden N F,Robinson R W.1986.Allozyme segregation ratios in the interspecific cross Cucurbita maxima × C.equadorensis suggest that hybrid breakdown is not caused by minor alterations in chromosome structure.Genetics,114:593-609.
Whitaker T W,Davis G N.1962.Cucurbits,botany,cultivation and utilization.London and New York:Leonard Hill:22-25.
Wu J X,Chang Z J,Wu Q S,Zhan H X,Xie S L.2011.Molecular diversity of Chinese Cucurbita moschata germplasm collections detected by AFLP markers.Scientia Horticulturae,128:7-13.
Wu T,Zhou J H,Zhang Y F,Cao J S.2007.Characterization and inheritance of a bush-type in tropical pumpkin (Cucurbita moschata Duchesne).Scientia Horticulturae,114:1-4.
Wu T,Cao J S.2010.Molecular cloning and expression of a bush related CmV1 gene in tropical pumpkin.Molecular Biology Reports,37:649-652.
Youn S J,Chung H D.1998.Genetic relationship among the local varieties of the Korean native squashes (Cucurbita moschata) using RAPD technique.Journal of the Korean Society for Horticultural Science,39:517-521.
Zraidi A,Stift G,Pachner M,Shojaeiyan A,Gong L,Lelley T.2007.A consensus map for Cucurbita pepo.Molecular Breeding,20(4):375-388.
Review and Outlook on Cucurbita Breeding Research
GE Yu1,HAN Wen-hao2,LIU Da-wei2,3*
(1Haikou Experimental Station,Chinese Academy of Tropical Agricultural Sciences,Haikou 570102,Hainan,China;2College of Agriculture,Northeast Agricultural University,Harbin 150030,Heilongjiang,China;3Key Laboratory of Cold Area Vegetable Biology,Heilongjiang Provincial University,Harbin 150030,Heilongjiang,China)
Abstract:This paper systematically expounds the research status on Cucurbita breeding,including breeding of new variety,quality breeding,resistance breeding,agronomic characters breeding,and molecular breeding of Cucurbita,about germplasm genetic relationship,genetic map construction,gene mapping of quality and quantity traits,and gene clone all over the world.Meanwhile,the paper also puts up problems existing in Cucurbita breeding,and then prospected the future development of Cucurbita breeding.
Key words:Cucurbita;Conventional breeding;Molecular breeding
*通讯作者(
Corresponding author):刘大伟,男,博士,副教授,专业方向:植物病理学研究,E-mail:liudawei353@163.com
收稿日期:2015-12-10;接受日期:2016-03-08
基金项目:黑龙江省自然科学基金项目(C201428),黑龙江省高校寒地蔬菜生物学重点实验室开放课题基金项目,海南省自然科学基金项目(20163069)

