米诺地尔固体脂质纳米粒的制备和评价
王文喜,陈丽娜,黄新炎
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江大学 医学院附属第二医院,浙江 杭州 310009)
米诺地尔固体脂质纳米粒的制备和评价
王文喜1,陈丽娜1,黄新炎2
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江大学 医学院附属第二医院,浙江 杭州 310009)
摘要:制备米诺地尔固体脂质纳米粒,评价其质量并考察其体外透皮情况.采用高压均质法制备米诺地尔固体脂质纳米粒,硬脂酸作为固体脂质,吐温80和司盘80作为乳化剂,用激光粒度仪测定纳米粒的粒径和电位,用离心法测定纳米粒的包封率和载药量,用透皮扩散试验仪考察药物的体外释放及透皮情况.结果表明:所得米诺地尔固体脂质纳米粒的平均粒径为(422.2±10.2) nm,PDI为(0.210±0.024),平均Zeta电位为(-31.29±3.20) mV,包封率为(66.34±1.42)%,载药量为(8.12±0.23)%.此外,MXD-SLN具有良好的缓释性能,并适合经皮给药.因此,所得MXD-SLN制剂性能良好,在局部用药上具有良好的发展前景.
关键词:米诺地尔;高压均质法;固体脂质纳米粒;透皮实验
米诺地尔(Minoxidil, MXD)是近年来使用较多的生发药物,广泛用于治疗雄性激素性脱发[1-2].但米诺地尔在水中的溶解度很小,市售制剂常包含较高浓度的乙醇或丙二醇,频繁使用易导致头屑增加、头皮瘙痒、头发容易油腻、皮肤红肿、皮肤干燥、过敏性接触性皮炎以及系统毒性等不良反应.为降低市售制剂不良反应,考虑制备不含有机溶剂的MXD固体脂质纳米粒[3].固体脂质纳米粒(Solid lipid nanoparticles, SLN)是20世纪90年代初迅速发展起来的第一代脂质纳米粒给药系统[4],是将固态的脂质或类脂质加入到含有乳化剂的水相中,通过合适的工艺条件,包裹药物进入脂质,形成粒径范围为10~1 000 nm的固体脂质纳米粒给药体系[5].固体脂质纳米粒在局部用药方面展现了突出的优势,它能保护敏感性药物,有较好的靶向作用,无有机溶剂制备工艺,系统毒性低,生物相容性好,SLN是一种极具发展前景的给药系统[6].
1仪器与材料
1.1仪器
Beckman Delsa Nano激光粒度仪(美国Beckman公司);FJ200数显高速分散均质机(美国Newton公司);JEM-1400透射电镜(日本JEOL公司);Micro Ultracentrifuge高速离心机(日本Hitachi Koki有限公司);TPY-2型药物透皮扩散试验仪(上海黄海药检仪器有限公司);岛津高效液相色谱(日本Shimadzu公司);AR-1140型电子分析天平(美国奥毫斯公司).
1.2材料
油酸(杭州双林化工试剂厂);硬脂酸(浙江温州化学用料厂);吐温80和司盘80(温州清明化工有限公司);米诺地尔(台州晟欣医药化工有限公司);甲醇(西格玛奥德里奇贸易有限公司);磺基丁二酸钠二辛酯(阿拉丁股份有限公司),其他试剂皆为分析纯.
2实验方法
2.1米诺地尔含量测定方法
2.1.1色谱条件
色谱柱:ODS-C18柱;流动相:V(甲醇)∶V(水)∶V(冰醋酸)=700∶300∶10),1 000 mL流动相中含有3.0 g磺基丁二酸钠二辛酯,并用高氯酸调节pH=3.0;检测波长286 nm;流速1 mL /min;进样体积10 μL.
2.1.2方法专属性
精密移取MXD-SLN悬液,加甲醇溶液,超声条件下破乳溶解,用甲醇稀释定容至刻度,即得MXD-SLN供试品溶液.同法制得空白SLN供试品溶液.按“2.1.1”项下色谱条件测定,记录色谱图,考察方法的专属性.
2.1.3线性关系考察
精密称取米诺地尔适量,纯化水溶解后,置于容量瓶中,定容至刻度,即得质量浓度为498 μg/mL的标准储备液.将标准储备液用甲醇逐级稀释,得质量浓度分别1.99,4.98,9.96,19.92,39.84,59.76,79.68 μg/mL的标准溶液,按“2.1.1”项下色谱条件测定各溶液的峰面积.
2.2米诺地尔固体脂质纳米粒的制备
采用高压均质法制备米诺地尔SLN.精密称取6 g硬脂酸,0.25 g司盘80和0.75 g吐温80,80 ℃下加热熔融形成油相,精密称取1 g米诺地尔溶解于油相中.另取纯化水加热至85 ℃作为水相.在2 000 r/min搅拌下,将水相快速加入油相中,继续搅拌5 min,即可形成初乳.制备所得初乳在10 000 r/min下高速分散1 min,再用高压均质机在20 000 psi压力下作用2个循环,冰水浴冷却过夜即得2%米诺地尔固体脂质纳米粒(MXD-SLN).
2.3粒径和Zeta电位
室温条件下,取新制备的MXD-SLN适量,纯化水适当稀释后,采用Beckman激光粒度测定仪测定其平均粒径、粒径分布和Zeta电位[7].
2.4包封率和载药量的测定
采用高速离心法和低速离心法相结合的方法测定[8].精密移取MXD-SLN悬液1mL置于离心管中,在100 000r/min,4 ℃条件下高速离心5h.移取上清液,用甲醇适当稀释,进样测定,计算游离药量W1;精密移取MXD-SLN悬液1mL置于离心管中3 000r/min离心15min,取沉淀并用甲醇适当稀释,进样测定,计算游离药量W2.另精密移取MXD-SLN悬液按“2.1.2”项下方法测定药物浓度,计算总药量W3.包封率(EE)和载药量(DL)计算公式分别为
式中:W1,W2分别为游离药量;W3为总药量;W4为脂质质量.
2.5体外释药
将处理好的半透膜固定于Franz扩散池中间,于供给室加入1mL的MXD-SLN悬液,接收室加入磷酸缓冲液(pH=7.4),半透膜与接收液完全接触.药物扩散透皮仪转速为200r/min,扩散面积2.8cm2,接收池总体积为6.5mL,37 ℃下循环水浴.在固定时间间隔取出全部接收液并立即补加等量同温磷酸缓冲液,经0.45μm微孔滤膜过滤后,取续滤液按“2.1.1”项下色谱条件测定,计算药物累积释放百分率(Q)[9].
2.6透皮实验
将健康大鼠处死,剪取适当大小的腹部皮肤,剥离皮下组织,用生理盐水冲洗干净,检查鼠皮完整性后保存在4 ℃冰箱.药物扩散透皮仪其接收液为磷酸缓冲液,32 ℃下循环水浴.实验时,取出处理好的完整鼠皮,固定于Franz扩散池中间,将磁力搅拌子装入接收室中,注满磷酸缓冲液,小心排出气泡使接收液和鼠皮充分接触.移取MXD-SLN悬液缓慢加入到供给室中的皮肤表面,供给室上用保鲜膜封口.开动磁力搅拌器和恒温水浴,在固定时间间隔取出全部接收液,立即重新注满新鲜接收液,样品10 000 r/min离心15 min后取上清液,经0.45 μm微孔滤膜过滤后,取续滤液按“2.1.1”项色谱条件下进样测定.
3结果与讨论
3.1米诺地尔含量测定方法
3.1.1线性关系
以峰面积(A)对米诺地尔的质量浓度(C,μg/mL)进行线性回归,得回归方程为A=56 176C-17 111(r=0.999 7),表明在1.99~79.68 μg/mL质量浓度范围内,峰面积与米诺地尔质量浓度的线性关系良好.
3.1.2专属性
米诺地尔对照品、空白SLN和MXD-SLN供试液的HPLC色谱图见图1,从图1中可看出:辅料对药物的测定无干扰.
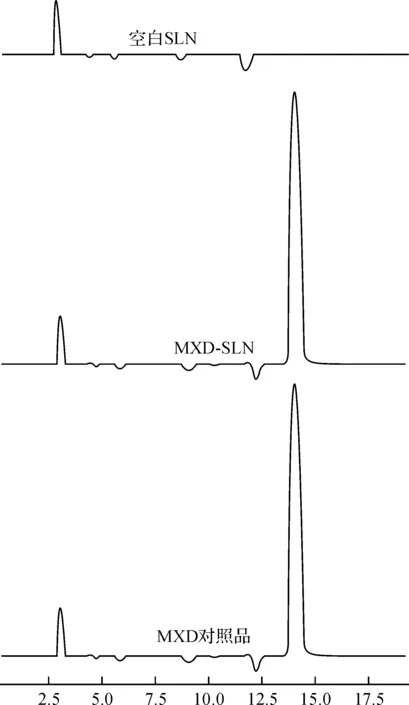
图1 HPLC色谱图Fig.1 The chromatogram of HPLC
3.2MXD-SLN粒径,Zeta电位测定
目前,制备SLN的方法主要有高压均质法、超声法、乳化溶剂法、熔融法以及微乳化法等[10-11].溶剂扩散法制备SLN,其制备工艺难控制,且粒径分布过宽[12].高压均质法是制备SLN最常用的方法,通过高压乳匀法能实现大规模生产,极具发展前景,故本研究采用高压乳匀法来制备MXD-SLN.采用Beckman激光粒度测定仪测得按2.2所示最佳工艺制得MXD-SLN悬液的平均粒径为(422.2±10.2) nm(图2),PDI为(0.210±0.024),平均Zeta电位为(-31.29±3.20) mV,从图2中可以看出:本法所得的MXD-SLN粒径较均一,基本呈正态分布,且制备所得纳米悬液的电位较大,表明具有较高的稳定性.
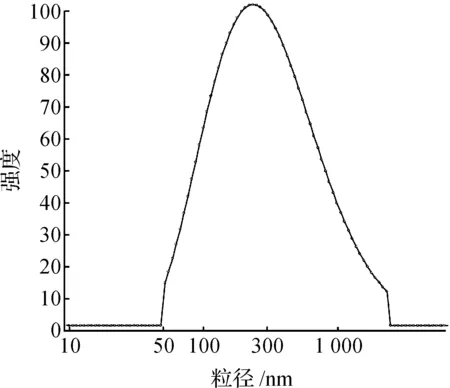
图2 MXD-SLN粒径分布图Fig.2 The particle distribution of MXD-SLN
3.3MXD-SLN包封率和载药量
通过分离包裹在SLN中的药物和游离的药物测定包封率和载药量.分离方法通常有超速离心法、低速离心法、葡聚糖凝胶过滤法以及透析法[13].超速离心法操作简单快速而被广泛应用,在超速离心管中加入悬液,利用高速旋转下产生的离心力将纳米粒和游离药物分离[14].由于米诺地尔在介质中的溶解度较小,当药物的包封率小于83%时,有部分游离的药物将会析出,可通过低速离心将其沉淀下来.因此,本实验通过将低温超速离心法和低速离心法相结合的方法来测定包封率.该法测得按2.2所示最佳工艺制得MXD-SLN包封率为(66.34±1.42)%,载药量为(8.12±0.23)%,表明所得产品的包封率和载药量均较高.
3.4体外释药
MXD-SLN在Franz扩散池中的药物释放如图3所示.从图3中可以看出:MXD-SLN具有良好的缓释效果,在24 h内仅释放19.0%的药物.前5 h的药物释放较快,主要是由于SLN中的游离药物及吸附在SLN表面的药物首先释放[14].分别采用不同的方程对MXD-SLN的体外释放曲线进行拟合,结果见表1.从表1中可以看出:Higuchi模型拟合R值最优,MXD在SLN中的体外释药行为符合Higuchi模型[15].
表1药物释放模型拟合
Table 1Mathematical models used to describe the in vitro release of drug

模型拟合方程R零级动力学Q=0.0073t+0.03170.9642一级动力学ln(1-Q)=-0.0081t-0.03110.9718HiguchiQ=0.0411t1/2-0.01190.9982Ritger-peppaslnQ=0.6705lnt-3.65710.9923
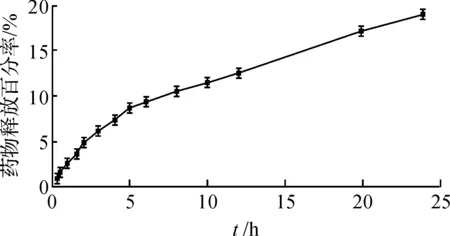
图3 药物在磷酸缓冲液中从MXD-SLN中的释放曲线Fig.3 In vitro release profiles of MXD from MXD-SLN in PBS
3.5大鼠透皮实验
米诺地尔治疗脱发的传统剂型常含有较高的有机溶剂,频繁使用易导致不良反应.SLN是用于经皮给药的良好载体,其采用生物相容性好、易降解、载药能力强的类脂材料为载体,无有机溶剂制备工艺,相较于传统剂型能显著降低皮肤刺激性.并且通过脂类的包裹可以保护化学性质不稳定的药物,其特殊的性能结构能使药物较多地滞留在皮肤内,从而避免药物的系统毒副作用.MXD-SLN悬液大鼠透皮累积释放曲线见图4.MXD-SLN主要通过融合和穿透机制进入皮肤,需要一定的分配和透过时间.在渗透前期药物的渗透速率较快,12 h后药物的渗透速率减慢,与体外释放结果一致,可能由于SLN中游离药物及吸附在SLN表面的药物首先透过导致.
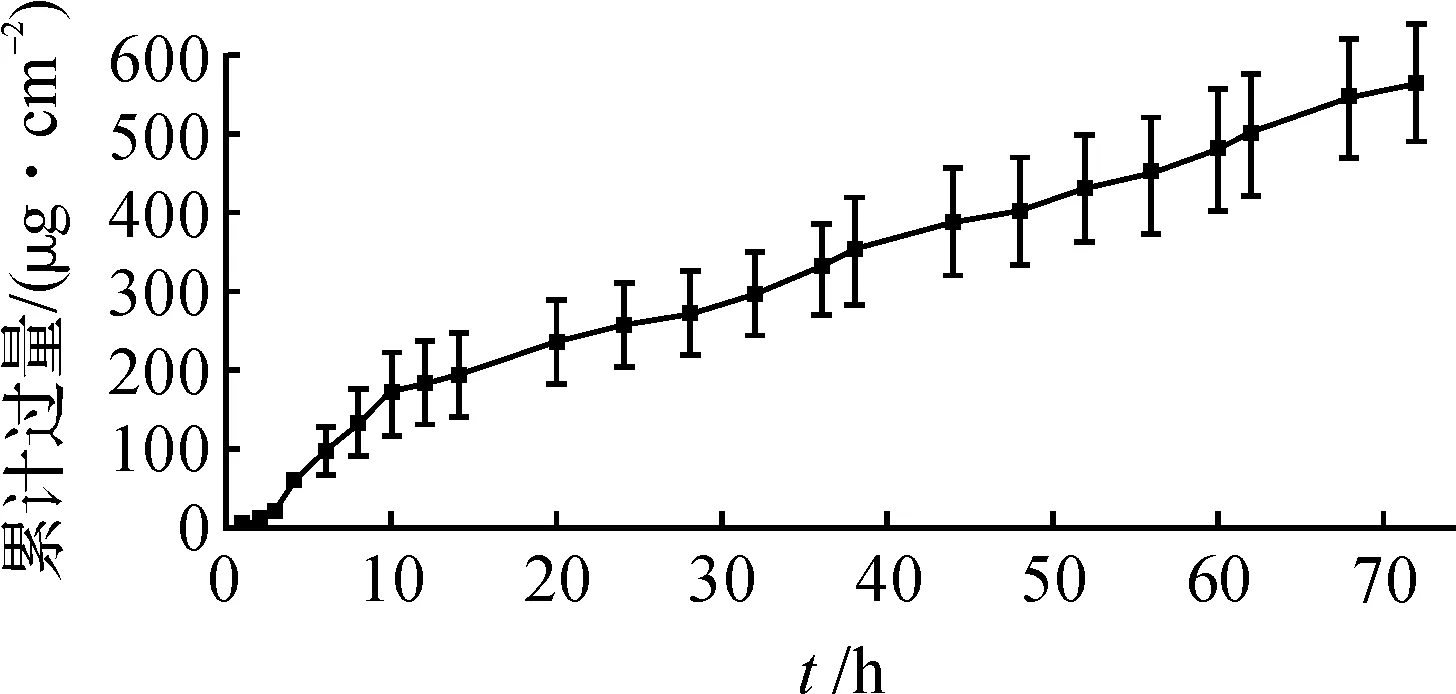
图4 药物从MXD-SLN中透过大鼠皮肤的累积透过量Fig.4Percutaneous permeation profiles of MXD-SLN through the excised rat skins
4结论
本实验采用高压均质法成功制备了米诺地尔固体脂质纳米粒,实验确定的处方为6 g硬脂酸,0.25 g司盘80,0.75 g吐温80和2%米诺地尔.所制得的MXD-SLN平均粒径为(422.2±10.2) nm,PDI为(0.210±0.024),平均Zeta电位为(-31.29±3.20) mV,包封率为(66.34±1.42)%,载药量为(8.12±0.23)%.MXD-SLN具有良好的缓释性能,其体外释药行为符合Higuchi模型.大鼠透皮实验结果表明MXD-SLN能透过大鼠皮肤,适合经皮给药.本实验的研究为该类新剂型的进一步研究和改进提供了一些有价值的实验基础.
参考文献:
[1]SINCLAIR R D, DAWBER R P R. Androgenetic alopecia in men and women[J]. Clinics in dermatology,2001,19:167-178.
[2]REDLER S, DOBSON K, DRICHEL D, et al. Investigation of six novel susceptibility loci for male androgenetic alopecia in women with female pattern hair loss[J]. Journal of dermatological science,2013,72:186-188.
[3]PADOIS K, CANTIéNI C, BERTHOLLE V V, et al. Solid lipid nanoparticles suspension versus commercial solutions for dermal delivery of minoxidi[J]. International journal of pharmaceutics,2011,416(1):300-304.
[4]WISSING S A, KAYSER O, MULLER R H. Solid lipid nanoparticles for parenteral drug delivery[J]. Advanced drug delivery review,2004,56(9):1257-1272.
[5]殷润婷,杨阳,张婕,等.固体脂质纳米粒的制备及在治疗中的应用研究[J].现代生物医学进展,2014,14(36):7182-7185.
[6]王卫国,郭彦亮.固体脂质纳米粒给药系统的研究进展[J].山西医药杂志,2008,32(3):127-131.
[7]王文喜,代凯,唐岚.八聚精氨酸修饰的载ASODN脂质体的构建及体外评价[J].浙江工业大学学报,2014, 43(3):334-337.
[8]LEE S G, JEONG J H, KIM S R, et al. Topical formulation of retinyl retinoate employing nanostructured lipid carriers[J]. Journal of pharmaceutical investigation,2012,42:243-250.
[9]洪伟勇,严琴英,杨根生.抗癌药物羟基喜树碱纳米囊泡的研究[J].浙江工业大学学报,2012,40(3):253-256.
[10]李欣玮,孙立新,林晓宏,等.固体脂质纳米粒作为药物载体[J].化学进展,2007,19(1):87-92.
[11]侯君,周世文.固体脂质纳米粒研究新进展[J].解放军药学学报,2008,24(3):239-242.
[12]晏子俊,李万玉,胡雪原,等.姜黄素固体脂质纳米粒在大鼠体内的药动学[J].中国医院药学杂志,2015,35(4):300-303.
[13]何红永,王文喜.醋酸泼尼松固体脂质纳米粒的制备[J].海峡药学,2009,21(12):35-37.
[14]王敏,谢鹏,杨益民,等.塞来昔布固体脂质纳米粒的制备及其在大鼠体内药动学[J].中国医院药学杂志,2015,35(1):31-35.
[15]王文喜,章哲文,李佳萍,等.庆大霉素普鲁卡因胃漂浮缓释微丸的制备及质量评价[J].浙江工业大学学报,2013,41(3):265-269.
(责任编辑:陈石平)
The preparation and evaluation of minoxidil loaded solid lipid nanoparticles
WANG Wenxi1, CHEN Lina1, HUANG Xinyan2
(1.College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China;2.Dermatology Department, The Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310014, China)
Abstract:In order to prepare minoxidil loaded solid lipid nanoparticles(MXD-SLN) and evaluate its quality and skin permeation, the MXD-SLN was prepared by a hot high pressure homogenization method, in which stearic acid was used as solid lipid while tween 80 and span 80 were used as surfactant. The particle size and zeta potential of SLN was measured with a DelsaTM Nano C Particle Analyzer. The entrapment efficiency (EE) and drug loading capacity (DL) of MXD in SLN dispersions were determined by a centrifugation method. In vitro drug release and skin permeation were conducted using transdermal diffusion test apparatus. The average particle size was (422.2±10.2) nm with PDI of (0.210±0.024) and the zeta potential was (-31.29±3.20) mV. The average EE and DL of MXD-SLN dispersions were (66.34±1.42)% and (8.12±0.23)%, respectively. The in vitro drug release test indicated that the MXD-SLN has a sustained-release performance. Moreover, the skin permeation study showed that SLN is suitable for the transdermal administration. All these results demonstrate the developed MXD-SLN possesses satisfactory qualities and a better application prospect.
Keywords:minoxidil; high pressure homogenization method; solid lipid nanoparticles; skin permeation test
收稿日期:2015-11-20
作者简介:王文喜(1977—),男,浙江苍南人,副教授,硕士生导师,主要从事药物新剂型与新技术研究,E-mail:yjw@zjut.edu.cn.
中图分类号:R944
文献标志码:A
文章编号:1006-4303(2016)04-0427-04

