紫花苜蓿不同品种对拟枝孢镰刀菌的抗性评价
潘龙其,张丽,田进山,袁庆华*,王瑜,苗丽宏(.中国农业科学院北京畜牧兽医研究所,北京 0093;.宜昌市农业科学研究院,湖北 宜昌 443004)
紫花苜蓿不同品种对拟枝孢镰刀菌的抗性评价
潘龙其1,2,张丽1,田进山2,袁庆华1*,王瑜1,苗丽宏1
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.宜昌市农业科学研究院,湖北 宜昌 443004)
在温室盆栽30个紫花苜蓿品种45 d后,将拟枝孢镰刀菌接种于幼苗根部土壤中,10 d根据根部病情指数评定抗病性,筛选抗性后选择抗病和感病品种再次接种,于4,8和12 h时测定与抗性相关酶的活性。结果表明,不同品种间抗性差异显著,其中耐病品种为晋南苜蓿、驯鹿、P G塞特、苏联二号4个,占测定品种总数的13.3%;高感品种为新疆大叶、中苜一号、陇中苜蓿、北疆苜蓿、皇冠、甘肃苜蓿和萨兰斯7个,占23.3%;其余的均为感病品种,占63.4%;未发现抗病和免疫品种。酶活性变化测定表明,对于接菌与未接菌的供试耐病和高感苜蓿品种,不同品种间C A T、S O D、P A L的活性存在一定差异;总体接菌植株的酶活性高于对照,且耐病品种的酶活性高于感病品种,酶活性在接菌后4~8 d呈上升趋势,8~12 d呈下降趋势;接菌植株C A T活性较对照增幅明显,S O D、P A L活性较其对照增幅不明显。
拟枝孢镰刀菌;抗性评价;酶活测定
http://cyxb.lzu.edu.cn
潘龙其,张丽,田进山,袁庆华,王瑜,苗丽宏.紫花苜蓿不同品种对拟枝孢镰刀菌的抗性评价.草业学报,2016,25(5):95-101.
P A N Long-Qi,Z H A N G Li,TIA N Jin-Shan,Y U A N Qing-H ua,W A N G Y u,M IA O Li-H ong.Resistance evaluation of different alfalfa varieties to Fusarium sporotrichioides.Acta Prataculturae Sinica,2016,25(5):95-101.
紫花苜蓿(Medicagosativa)是一次种植多年利用的豆科牧草,也是家畜的主要蛋白饲料[1],素有“牧草之王”之称[2],同时对维持生态系统营养的平衡和功能恢复发挥重要的作用[3]。随着气候的变化和紫花苜蓿种植面积的扩大,苜蓿病害的分布更广泛,为害有加重的趋势[4],其中紫花苜蓿根腐病是主要的根部病害,在苜蓿种植区普遍发生,属世界性病害[5]。不仅降低了苜蓿的产量和品质使其丧失利用的价值,而且制约着苜蓿的栽培和生产[6]。因此,该病害的研究对于其产业化发展有重大意义。关于该病国内外学者Corm ack[7]、H aw n[8]、T urner 和Alfew[9]与李敏权等[10]进行了大量研究,一致认为苜蓿根腐病病原较为复杂,但大多与镰刀菌有关。
目前防治苜蓿根腐病的主要措施是筛选抗病品种。Michand和Bai[11]利用人工接种来筛选抗病苜蓿品种,利用杂交来提高苜蓿品种的抗病性。李敏权[12]利用试管苗人工接种尖孢镰刀菌(Fusarium oxysporum)、锐顶镰刀菌(Fusarium acuminaturn)和半裸镰刀菌(Fusarium semitectum)对20个苜蓿品种进行抗性测定,得知不同苜蓿品种对根腐病的抗性存在一定差异。邓蓉等[13]利用活体接种成熟孢囊的苜蓿根腐病叶片对19个苜蓿品种进行了抗病性测定,筛选出4个免疫品种和7个高抗品种。刘海波[14]利用病原菌毒素筛选出抗根腐病苜蓿品种。另外,邓蓉等[15]对紫花苜蓿根腐病植株体内的过氧化物酶(P O D)活性进行测定,发现接种后植株体内P O D活性有所提高,并且抗病性差的品种P O D活性增幅最大。国内外学者对于紫花苜蓿根腐病的研究重点在于病原,虽说在抗病苜蓿品种筛选、育种和对其的防治方面进行了不少研究,但至今还未培育出抗病品种。另外,在田间苜蓿根腐病的防治上,采用化学防治无法达到预期效果,所以选育抗病品种来防治苜蓿根腐病是比较有效的方法。本研究采用温室盆栽法对30个品种进行根腐病的抗病性测定,耐病和高感苜蓿品种中C A T、S O D和P A L活性进行测定,以期为栽培区的合理种植和种质资源抗病性评价提供理论依据。
1 材料与方法
1.1 供试苜蓿品种
30个紫花苜蓿品种种子及来源由中国农业科学院北京畜牧兽医研究所牧草资源室提供(表1)。
1.2 供试病原菌
供试菌株为拟枝孢镰刀菌[16](Fusarium sporotrichioides)B Y E27-2-5,该菌株2013年从内蒙古阿鲁科尔沁旗巴雅尔草业基地苜蓿上分离得到,菌株纯化于PS A平板,4℃保存备用。
1.3 抗病性测定方法
1.3.1 育苗 种子用0.1%升汞消毒后置于无菌的培养皿中2 d,萌发后移栽至装有无菌的沙壤土和草炭(比例2∶1)的塑料花盆(直径为15 c m)中,每处理3盆,每盆10株。温室育苗45 d后进行接菌。
1.3.2 接种 将拟枝孢镰刀菌的孢子悬浮液(无菌水配制浓度为1×106个/m L)制成米粒接种体[16],25℃黑暗培养4 d,室温条件下,用无菌解剖刀垂直插入花盆中苜蓿幼苗周围1 c m处的灭菌土壤,制造出宽0.5 c m左右的空隙,将米粒接种体均匀的分散于其中(10粒/株),覆灭菌土壤5 m m,每品种3次重复。10 d后,对根部进行病情分级调查并划分反应型。
1.3.3 根部病情分级及反应型划分标准 根部病情共分5级(图1),分级标准为,0级:健康无病;1级:1/3初生根尖出现坏死斑点,不腐软;2级:1/3~1/2初生根尖出现变色腐烂,不腐软;3级:1/2~3/4根尖出现腐烂和变软;4级:3/4以上根部腐烂和变软。

图1 苜蓿根腐病病情分级标准Fig.1 Classification standard of alfalfa root rot

根部病情反应型划分标准为,免疫(I):病情指数=0;抗病(R):病情指数=0.1~20.0;耐病(T):病情指数=20.1~40.0;感病(S):病情指数=40.1~60.0;高感(S H):病情指数>60.0。
1.4 酶活性测定方法
1.4.1 育苗与接种 在1.3抗病测定的基础上筛选出3个高感品种和3个耐病品种按1.3.1温室育苗15 d后按1.3.2进行病原菌的接种,每处理3次重复。
1.4.2 采样 分别于接种后的4,8,12 d,拔出苜蓿幼苗,用无菌水将根茎部冲洗干净,滤纸吸干,每处理称取根茎部0.5 g,3次重复,装入塑料袋,-80℃保存备用。
1.4.3 过氧化氢酶(catalase form micrococous lysodeikticus,C A T)活性测定 C A T活性测定参照王学奎[17]的方法。
1.4.4 超氧化物歧化酶(superoxide dis m utase,S O D)活性测定 酶液提取参考王学奎[17]的方法。
反应体系(3 m L):粗酶液0.05 m L;130 m m ol/L甲硫氨酸(M et)溶液0.3 m L;0.05 m ol/L磷酸缓冲液1.5 m L;750μm ol/L氮蓝四唑(N B T)溶液0.3 m L;100μm ol/L E D T A-Na2溶液0.3 m L,20μm ol/L核黄素0.3 m L;蒸馏水0.25 m L。处理置于4000 lx日光条件下反应20 min,以缓冲液代替酶液置于暗处为对照。分别测定其在560 n m处的吸光度。以抑制N B T光化还原的50%为一个酶活性单位(U/g),按如下公式计算酶活性。
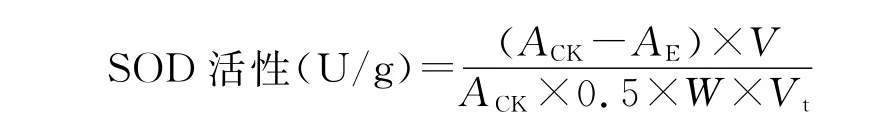
式中,AC K为对照的吸光值,AE为待测样品的吸光值,V为样液总体积(m L),Vt为测定样品的体积(m L),W为样品鲜重(g)。
1.4.5 苯丙氨酸解氨酶(phenylalanin a m m o-nialyase,P A L)活性测定 P A L活性测定参照陈建陨和王晓峰[18]的方法。
1.5 数据处理及统计分析
使用Excel 2010、D PS 7.05软件进行数据处理及统计分析。
2 结果与分析
2.1 不同苜蓿品种对拟枝孢镰刀菌的抗性比较
从表1中可以看出,不同紫花苜蓿品种对拟枝孢镰刀菌的抗性存在较大差异(P<0.05)。供试的30个品种的病情指数在30.67~64.67范围内。4个品种的病情指数<40.0,占试验总数的13.3%;26个品种病情指数>40.0,占试验总数的86.7%。30个紫花苜蓿品种根据病情反应型可以划分为5个抗病类型,其中耐病品种(T)4个:晋南苜蓿、驯鹿、P G塞特和苏联二号;感病品种(S)19个,主要有敖汉苜蓿、游客、普罗旺斯、维多利亚、青海苜蓿和察南苜蓿等;高感品种(S H)7个,新疆大叶、中苜一号、陇中苜蓿、北疆苜蓿、皇冠、甘肃苜蓿和萨兰斯,未发现抗病和免疫品种。其中苏联二号和P G塞特的病情指数相对较低,分别为30.67和32.67,这两个品种可作为紫花苜蓿抗根腐病的主要育种材料,而新疆大叶病情指数最高,为典型的感病材料,不建议该品种在紫花苜蓿根腐病的高发地区种植(表1)。
2.2 过氧化氢酶活性的变化
由表2可知,6个品种间C A T的活性在接菌后4~8 d呈上升趋势,8~12 d呈下降趋势。在整个采样时间内接种植株的酶活性较对照增幅较为明显,4 d后不同品种苜蓿C A T活性较对照的增幅在45.67%~111.08%之间;8 d后较对照的增幅在34.54%~120.33%之间;12 d后较对照的增幅在52.29%~99.87%之间,其中耐病品种苏联二号苜蓿接菌后8 d增幅最大,为120.33%。该结果表明,接种与未接种拟枝孢镰刀菌的供试苜蓿品种,不同品种之间的C A T活性存在一定的差异。总体来看,抗病品种的C A T活性高于感病品种,处理组苜蓿植株体内的C A T活性高于对照组。
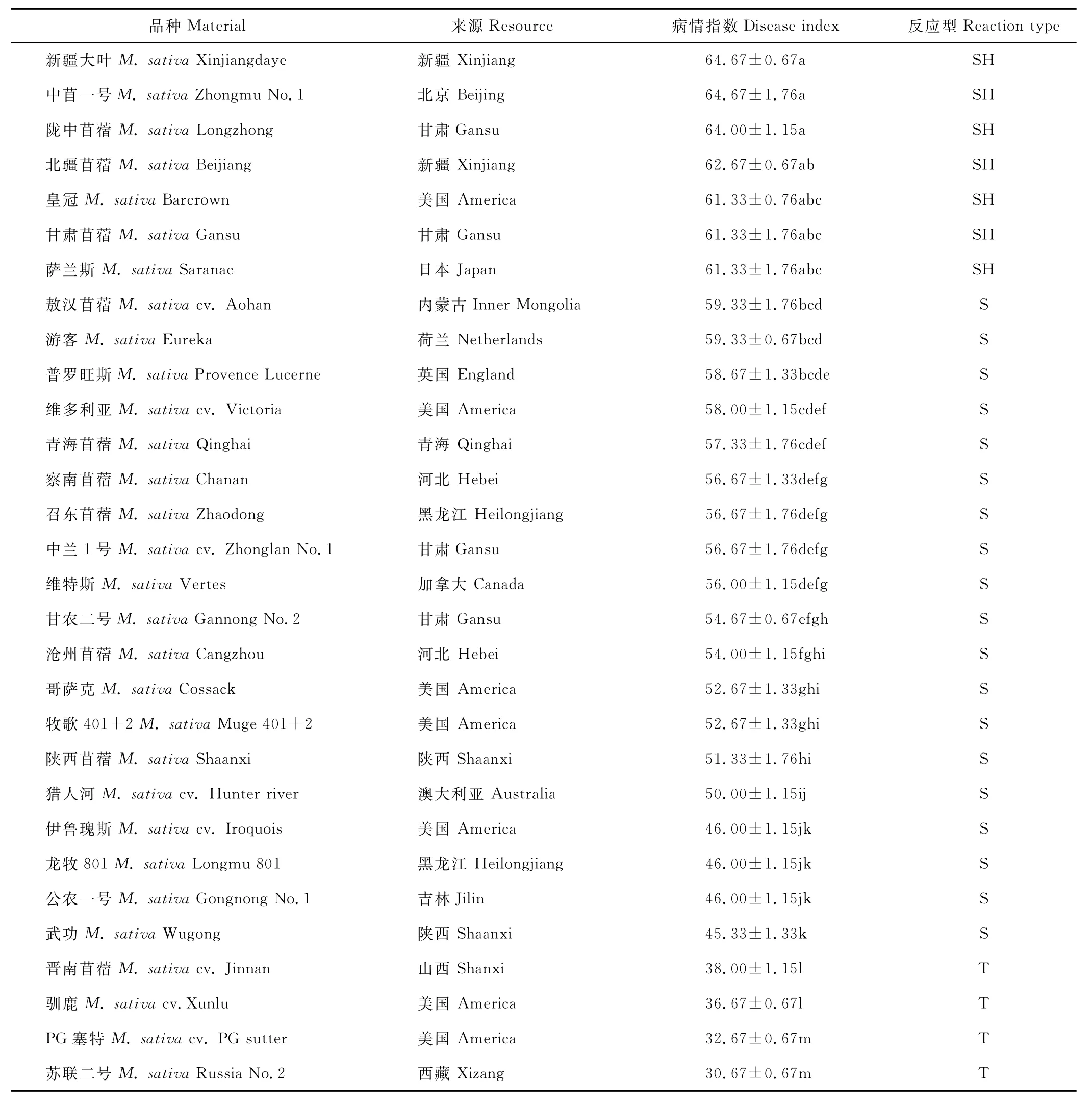
表1 30个苜蓿品种对拟枝孢镰刀菌根腐病的抗性评价Table 1 Evaluation of thirty alfalfa cultivars resistance to alfalfa root rot of F.sporotrichioides
2.3 超氧化物歧化酶活性的变化
由表3可以看出,各品种S O D活性在接菌后4~8 d呈缓慢上升趋势,8~12 d呈缓慢下降趋势。在整个采样时间内各接菌组较对照增幅不明显,4 d后不同品种苜蓿S O D活性较对照的增幅在6.06%~48.38%之间;8 d后较对照增幅在-2.17%~40.48%之间;12 d后较对照增幅在6.45%~33.34%之间,其中感病品种陇中苜蓿接菌处理4 d后增幅最大,为48.38%。该结果说明,接菌与未接菌的苜蓿品种之间S O D活性存在显著的差异,且抗病苜蓿品种的S O D活性高于感病品种,接菌苜蓿植株体内的S O D活性高于对照组。
2.4 苯丙氨酸解氨酶活性的变化
从表4中可知,在整个采样时间内接菌苜蓿植株体内P A L活性高于对照组,但接菌处理较对照增幅不明显,4 d后不同品种苜蓿P A L活性较对照增幅在13.61%~31.20%之间;8 d后较对照增幅在7.90%~28.77%之间;12 d后较对照增幅在1.46%~37.45%之间,其中耐病品种P G塞特接种拟枝孢镰刀菌12 d后增幅最大,为31.20%。供试品种接菌与未接菌的P A L活性存在一定差异,但不同品种之间P A L活性的差异不明显。综合来看,抗病苜蓿品种体内的P A L活性高于感病品种,各品种间P A L的活性在接菌后4~8 d呈缓慢上升趋势,8~12 d呈缓慢下降趋势。
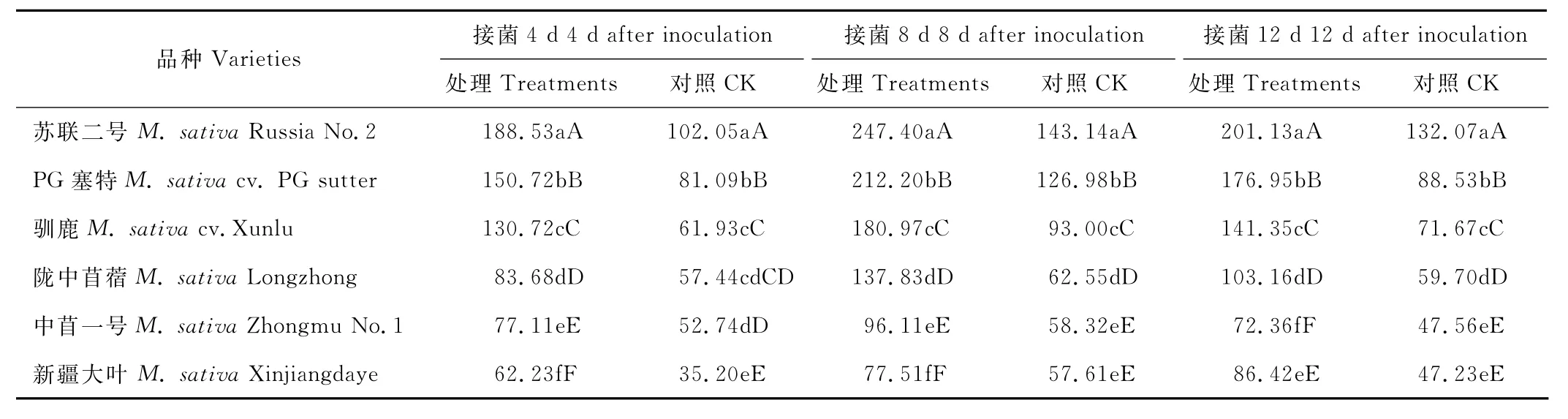
表2 接种拟枝孢镰刀菌后不同时间C A T活性变化Table 2 Change of C A T activity in different times after inoculated with F.sporotrichioides U/(g·min)
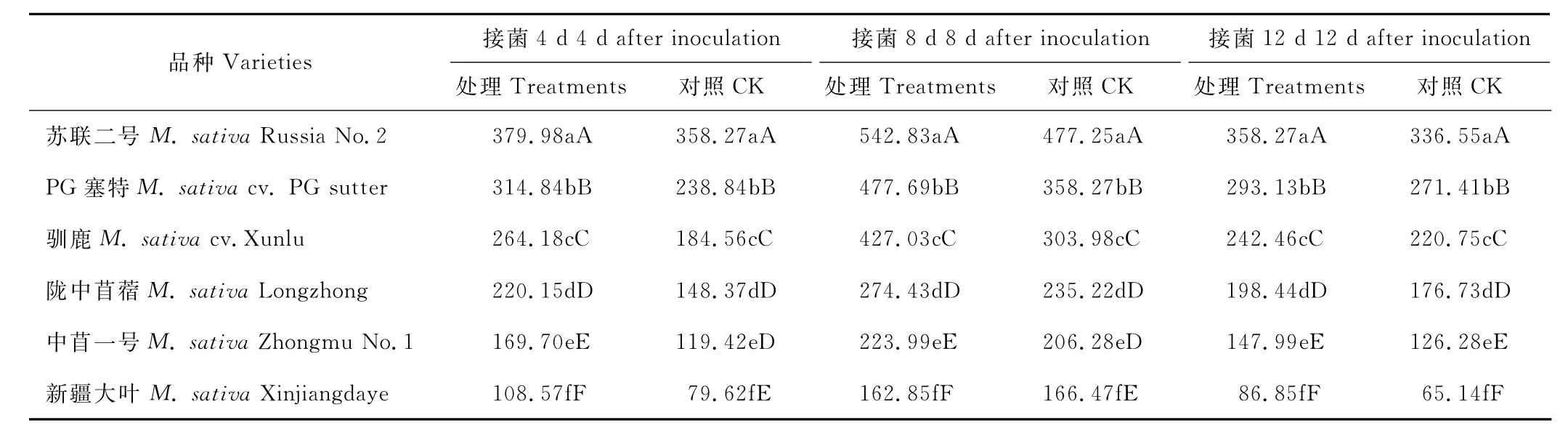
表3 接种拟枝孢镰刀菌后不同时间SO D活性变化Table 3 Change of SO D activity in different times after inoculated with F.sporotrichioides U/g
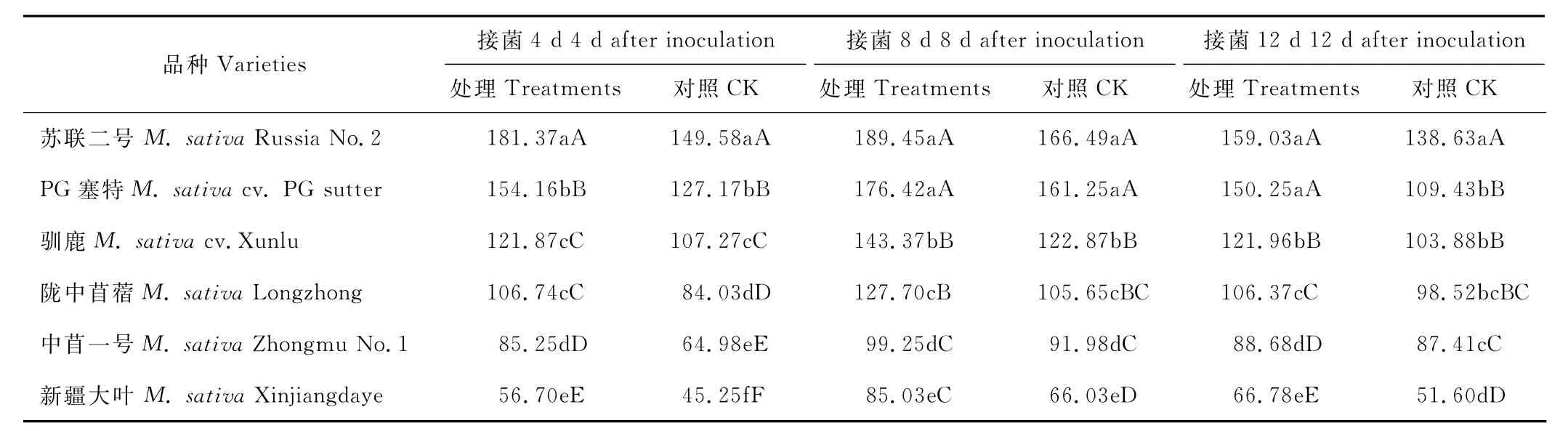
表4 接种拟枝孢镰刀菌后不同时间P A L活性变化Table 4 Change of P A L activity in different times after inoculated with F.sporotrichioides U/g
3 结论与讨论
本试验对30个不同苜蓿品种在温室条件下通过人工接种拟枝孢镰刀菌进行了苗期抗病性测定,结果表明不同苜蓿品种间抗病性差异显著。苏联二号和P G塞特具有较低的病情指数,可作为抗根腐病的主要育种材料,而新疆大叶为典型的感病材料,不建议在该病的高发地区种植。到目前为止,我国还没有培育出抗苜蓿根腐病的品种,通常都是从已有的苜蓿品种中筛选出抗病性较强的品种[19]。本试验是在温室条件下对不同品种苜蓿幼苗人工接种拟枝孢镰刀菌进行抗病性研究。虽然笔者尽可能提供了与自然发病相一致的环境条件,但温室条件、人工接种更宜于发病,且米粒接种体的带菌量较大,使得各品种的病情指数均偏高,因而使得在大田生产上抗病较好的苜蓿品种在试验中抗病效果并不理想。试验条件下感病的品种,在自然条件下可能为抗病品种,该结论与丁守彦[20]研究所得出的结论相一致。
酶活性测定试验表明,供试的3个耐病和3个高感苜蓿品种在人工接种拟枝孢镰刀菌后,植株体内的C A T、S O D、P A L活性存在一定的差异。C A T活性接菌处理较其对照增幅较为明显,S O D、P A L的酶活性接菌处理较其对照增幅变化不大。C A T在植物代谢过程中能清除活性自由基(A O S),试验表明,接种拟枝孢镰刀菌的苜蓿体内C A T活性上升,清除其体细胞内的活性氧,使植株保持正常水平,植物免受侵害。另外,植株体内S O D活性增强利于其形成抗体,试验表明,接种拟枝孢镰刀菌的植株体内S O D活性大幅提升,增加植株的抗逆性。目前通过测定苜蓿体内的P A L活性来确定其抗病性的研究甚少,尤其由镰刀菌引起的根腐病,本试验得知苜蓿根部的P A L活性在接种后与未接种之间存在差异,品种间也存在一定的差异,这一结论与李敏权[21]的研究结果相同。
近年来,国内许多学者尝试通过苜蓿体内P A L[22]、S O D、P O D、几丁质酶、β-1,3-葡聚糖酶和多酚氧化酶(PP O)的活性来测定其抗根腐病的能力[16,23],但其实用性和可靠性有待进一步研究。王敬文和薛应龙[24]分别研究发现马铃薯(Solanum tuberosum)、玉米(Zea mays)、小麦(Triticum aestivum)、黄瓜(Cucumissativus)和水稻(Oryzasativa)等作物感染病原菌后几种酶活力升高都表现出有规律的动态变化,且致病菌对酶活性升高的刺激作用大于非致病菌。但也有完全相反的结论[25]。关于以上3种酶活性在苜蓿接种拟枝孢镰刀菌菌株后的变化情况有待进一步试验校正。
References:
[1]Li Y,Y uan Q H.Factors influencing pathogenicity of Uromycesstriatus.Acta Prataculturae Sinica,2015,24(4):127-131.
[2]Guo Y X,Nan Z B,W ang C Z,etal.Progress in research on rootinvading fungi of Medicagosativa.Acta Prataculturae Sinica,2009,18(5):243-249.
[3]Ren A T,Lu W H,Yang J J,etal.Seasonal change patterns in the production and m ortality of fine roots in cotton and alfalfa.Acta Prataculturae Sinica,2015,24(6):213-219.
[4]Y uan Q H.A dvances in alfalfa diseases in China.Plant Protection,2007,33(1):6-11.
[5]H uang N,Lu X S.Research and resistance evaluation progress on alfalfa leaf and root diseases.Chinese A gricultural Science Bulletin,2012,28(5):1-7.
[6]Zhao Z F.Preliminary Study on M ajor Fungal Diseases and Pathogens of Alfalfa in H utubi Country of Xinjiang[D].Uru m qi:Xinjiang A gricultural U niversity,2011.
[7]Corm ack M W.Fusarium spp.root parasites of alfalfa and swect clover in Alberta.Canadian Journal of Research,1937,15:493-510.
[8]H aw n E J.Studies on the epide miology of crow n bud rot of alfalfa in Southern Alberta.Canadian Journal of Botany,1958,36:239-250.
[9]Turner V van,Alfew N K.Crow n rot of alfalfa in Utah.Phytopathology,1983,73:1333-1337.
[10]Li M Q,Chai Z X,Li J H,etal.Identification pathogens of crow n and root rot of alfalfa in Dingxi China.Acta A grestia Sinica,2003,11(1):83-86.
[11]Michand R,Bai Y H.Alfalfa varieties of root collar and root rot disease resistance evaluation.Canadian Journal of Plant Science,1985,(1):20-23.
[12]Li M Q.Studies on pathogens and resistance to crow n and root rot in alfalfa.Grassland of China,2003,25(1):39-43.
[13]Deng R,Xiang Q H,Zhang D H,etal.The inoculation test ofliving alfalfa root rot.Guizhou A nim al Science and Veterina-ry M edicine,2007,(4):3-41.
[14]Liu H B.Selection of A nti-root Rot Plants of Medicago sativa L.Using Toxin Generated by Fusarium oxysporum[D].Chongqing:South west U niversity,2006.
[15]Deng R,Xiang Q H,Zhang D H,et al.Studies on peroxidase activity in the application of alfalfa root rot resistance.Guizhou A nim al Science and Veterinary M edicine,2008,32(5):5-6.
[16]Pan L Q,Zhang L,Yang C D,etal.Identification and biological characteristics of Fusarium sporotrichioides fro m Medicago sativa root rot.Acta Prataculturae Sinica,2015,24(10):88-89.
[17]W ang X K.Principle and Technology of Plant Physiological and Bioche mical Experim ents[M].Beijing:Higher Education Press,2006:169-173.
[18]Chen J Y,W ang X F.Plant Physiology Experim ent Instruction[M].Guangzhou:South China U niversity of Technology Press,2006:68-72.
[19]H uang N,Sun X B,W ang T M,etal.Evaluation of resistance to Fusarium wilt(Fusarium oxysporum)and preliminary screening of check varieties of resistant evaluation fro m 62 alfalfa(Medicagosativa)cultivars.Chinese Journal of Grassland,2013,35(1):12-16.
[20]Ding S Y.Studied on Alfalfa Varieties Resistance and Induced Resistance to Fusarium[D].Lanzhou:Gansu A griculture U niversity,2010.
[21]Li M Q.Studies on Pathogens and Resistance to Crow n and Root Rot in Alfalfa[D].Lanzhou:Gansu A griculture U niversity,2002.
[22]M a J F,Li M Q,Zhang Z H,etal.Study on relationship between phenylalanine a m m onia-lyase(P A L)and resistance to crow n and root rot in alfalfa cultivars.Acta Prataculturae Sinica,2003,12(4):35-38.
[23]Du L C,W ang J.Activities and distribution of chitinase andβ-1,3-Glucanase in rices induced by Pyriculariaoryzae C.Plant Physiology Journal,1992,18(1):29-36.
[24]W ang J W,Xue Y L.Studies on plant phenylalanine a m m onia-lyase(P A L)Ⅱ.Plant Physiology Journal,1982,8(1):34-41.
[25]Yang J S.Relation of m etabolis m of plant phenylalanine and resistance of w heat to powdery mildew.Acta Phytopathologica Sinica,1986,16(3):169-173.
[1]李跃,袁庆华.苜蓿锈病病菌侵染条件的研究.草业学报,2015,24(4):127-131.
[2]郭玉霞,南志标,王成章,等.苜蓿根部入侵真菌研究进展.草业学报,2009,18(5):243-249.
[3]任爱天,鲁为华,杨洁晶,等.棉花、苜蓿细根生长和死亡的季节变化.草业学报,2015,24(6):213-219.
[4]袁庆华.我国苜蓿病害研究进展.植物保护,2007,33(1):6-11.
[5]黄宁,卢欣石.苜蓿叶部与根部病害研究的评价进展.中国农学通报,2012,28(5):1-7.
[6]赵宗峰.新疆呼图壁县种用苜蓿主要真菌病害及其病原初步研究[D].乌鲁木齐:新疆农业大学,2011.
[10]李敏权,柴兆祥,李金花,等.定西地区苜蓿根和根颈腐烂病病原研究.草地学报,2003,11(1):83-86.
[12]李敏权.苜蓿根和根颈腐烂病病原致病性及品种抗病性研究.中国草地,2003,25(1):39-43.
[13]邓蓉,向清华,张定红,等.紫花苜蓿根腐病活体整株接种试验.贵州畜牧兽医,2007,(4):3-41.
[14]刘海波.利用病原菌毒素筛选抗苜蓿根腐病的研究[D].重庆:西南大学,2006.
[15]邓蓉,向清华,张定红,等.过氧化物酶活性在紫花苜蓿抗根腐病中的应用研究.贵州畜牧兽医,2008,32(5):5-6.
[16]潘龙其,张丽,杨成德,等.紫花苜蓿根腐病原菌——拟枝孢镰刀菌的鉴定及其生物学特性研究.草业学报,2015,24 (10):88-89.
[17]王学奎.植物生理生化实验原理和技术(第2版)[M].北京:高等教育出版社,2006:169-173.
[18]陈建陨,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006:68-72.
[19]黄宁,孙鑫博,王铁梅,等.62个苜蓿品种抗根腐病评价及抗病评价标准品种的筛选.中国草地学报,2013,35(1):12-16.
[20]丁守彦.不同苜蓿品种对镰刀菌的抗性鉴定及诱导抗性研究[D].兰州:甘肃农业大学,2010.
[21]李敏权.苜蓿根和根颈腐烂病的病原及种质抗病性研究[D].兰州:甘肃农业大学,2002.
[22]马静芳,李敏权,张自和,等.苯丙氨酸解氨酶与苜蓿根和根颈腐烂病抗病性的研究.草业学报,2003,12(4):35-38.
[23]杜良成,王钧.稻瘟菌诱导的水稻几丁酶,β-1,3-葡聚糖酶活性及分布.植物生理学报,1992,18(1):29-36.
[24]王敬文,薛应龙.植物苯丙氨酸解氨酶的研究Ⅱ.植物生理学报,1982,8(1):34-41.
[25]杨家书.植物苯丙酸类代谢与小麦白粉病抗性的关系.植物病理学报,1986,16(3):169-173.
Resistance evaluation of different alfalfa varieties to Fusarium sporotrichioides
P A N Long-Qi1,2,Z H A N G Li1,TIA N Jin-Shan2,Y U A N Qing-H ua1*,W A N G Y u1,M IA O Li-H ong1
1.Institute of Animal Science of CA AS,Beijing 100193,China;2.Yichang Academy of Agricultural Sciences,Yichang 443004,China
T he present study evaluated the resistance of 30 alfalfa varieties to Fusarium sporotrichioides by inoculation of 45 d old seedlings in a greenhouse.Resistant and susceptible varieties were selected based on the root disease index after 10 days of inoculation and were further evaluated by inoculation pathogen and m easuring enzy m es activities after 4,8 and 12 hours inoculation.T he results showed that there were four resistant varieties:Jinnan,Xunlu,P G Saite and Sulian N o.2,w hich together accounted for 13.3%.T here were seven highly sensitive varieties:Xinjiangdaye,Zhong m u N o.1,Longzhong,Beijiang,H uangguan,Gansu and Salansi,w hich together accounted for 23.3%.T he re m aining varieties were all sensitive and together accounted for 63.4%.T here were no resistant or im m une varieties.M easure m ent of enzy m e activities showed highly significant variations in C A T,S O D and P A L activities a m ong the different varieties,for both the inoculated sa m ples and for the controls without inoculation.Enzy m e activities in inoculated plants were higher than those of control plants and enzy m e activities in the resistant varieties were higher than those of susceptible varieties.Enzy m e activity increased after 4-8 d inoculation and decreased after 8-12 d inoculation.C A T activity of the inoculated plants significantly increased co m pared to the control,w hile S O D and P A L activities did not signifi-cantly increase.
Fusarium sporotrichioides;resistance evaluation;chitinase activity
.E-m ail:yuanqinghua@iascaas.net.cn
10.11686/cyxb2015331
2015-06-30;改回日期:2015-09-30
公益性行业(农业)科研专项项目(201303057)资助。
潘龙其(1988-),男,甘肃天水人,在读硕士。E-m ail:gsaupanlongqi@126.com

