PPARα及Acox1在酒精性脂肪肝中的表达*
仝巧云, 葛存锦, 郑世华
三峡大学消化疾病研究所,宜昌市中心人民医院消化内科,宜昌 443003
PPARα及Acox1在酒精性脂肪肝中的表达*
仝巧云,葛存锦,郑世华
三峡大学消化疾病研究所,宜昌市中心人民医院消化内科,宜昌443003
摘要:目的通过测定酒精性脂肪肝大鼠血清TNF-α、肝内甘油三酯、PPARα mRNA及Acox1 mRNA含量、肝内PPARα蛋白含量,并通过PPARα激动剂苯扎贝特(Bezafibrate)的干预研究,探讨酒精性脂肪肝大鼠肝内甘油三酯沉积的分子生物学机制及酒精性脂肪肝的发病机制。方法将60只Wistar大鼠随机分为正常对照组(n=20)、酒精性脂肪肝组(n=20)及苯扎贝特组(n=20)。正常对照组予蒸馏水灌胃8周;酒精性脂肪肝组给予鱼油2.5 mL/kg+乙醇灌胃8周;苯扎贝特组采用鱼油+乙醇灌胃,4周后加用苯扎贝特100 mg/kg灌胃治疗4周。第8周取腹腔静脉血及肝组织,采用ELISA法测定血清TNF-α含量;比色法测定肝脏甘油三酯沉积;RT-PCR法测定肝内PPARα mRNA及Acox1 mRNA含量;Western blot法测定肝内PPARα蛋白含量。结果与正常对照组相比,酒精性脂肪肝组大鼠血清内TNF-α含量升高[(3.01±0.31)ng/mL vs.(1.07±0.28)ng/mL,P<0.01],肝内甘油三酯沉积增多[(0.72±0.09)mmol/L vs.(0.28±0.07)mmol/L,P<0.01],肝内PPARα mRNA[(0.22±0.08) vs.(0.68±0.13),P<0.01]及Acox1 mRNA[(0.43±0.12) vs.(1.14±0.21),P<0.01]表达减少,PPARα蛋白含量减少[(0.19±0.07) vs.(0.48±0.11),P<0.01]。经苯扎贝特治疗后,苯扎贝特组大鼠血清内TNF-α含量降低,肝内甘油三酯沉积减少,肝内PPARα mRNA及Acox1 mRNA表达增多,PPARα蛋白含量增多。结论酒精性脂肪肝大鼠肝内PPARα及Acox1表达减少,从而影响脂肪酸的代谢,导致肝内甘油三酯沉积增多,血清内TNF-α含量升高,引起酒精性脂肪肝。苯扎贝特可通过激活PPARα,使肝内PPARα及Acox1表达增加,促进脂肪酸的代谢,减少肝内甘油三酯沉积,降低血清内TNF-α含量,起到预防和治疗酒精性脂肪肝的作用。
关键词:酒精性脂肪肝;甘油三酯;PPARα;Acox1;苯扎贝特
酒精性脂肪肝(alcoholic fatty liver disease,AFLD)是由于长期大量饮酒导致体内生物酶活性改变,使肝细胞脂肪变性,进而发展为酒精性肝炎、肝纤维化,最终可导致酒精性肝硬化,以及一系列严重并发症[1-2]。过氧化物酶体增殖物激活受体(PPARs)是一类由配体激活的转录因子,属核激素受体超家族的一员。PPARs按其结构和功能可分为PPARα、PPARβ、PPARγ等3种亚型,其中PPARα主要表达在脂质代谢能力强的组织中,主要参与调节脂肪代谢、炎症和免疫反应等[3]。脂肪酸β氧化是肝脏内脂质分解代谢实现降脂效应的重要途径[4-5],Acox1是脂肪酸β氧化过程中的关键限速酶,其表达水平受PPARα的调控[1,6-7]。有学者研究发现非酒精性脂肪肝大鼠模型中肝脏PPARα表达受抑制,但关于PPARα在酒精性脂肪肝发病中的作用尚不十分明确[8-9]。本实验通过观察酒精性脂肪肝大鼠肝内PPARα及Acox1的表达,探讨其与脂代谢紊乱的关系,并进一步阐述酒精性脂肪肝的发病机制;通过观察PPARα激动剂苯扎贝特(Bezafibrate)对酒精性脂肪肝大鼠PPARα及Acox1表达的影响,为临床酒精性脂肪肝的防治提供新的思路。
1材料与方法
1.1实验动物
选用健康雄性Wistar大鼠60只,体重(200±25)g,随机分为3组:正常对照组20只;酒精性脂肪肝组20只;苯扎贝特组20只。给予普通维持级饲料,自由进食水,维持饲养环境温度在20~25℃。
1.2动物分组及处理
正常对照组予蒸馏水灌胃;酒精性脂肪肝组给予鱼油2.5 mL/kg+乙醇灌胃,乙醇初始剂量为6 g/(kg·d),2周内逐渐递增至8 g/(kg·d),每天1次;苯扎贝特组采用鱼油+乙醇灌胃,4周后加用苯扎贝特100 mg/kg灌胃治疗4周。所有动物均于第8周麻醉取材,留取腹腔静脉血及肝脏组织,并行肝脏苏木精-伊红(HE)染色确认酒精性脂肪肝模型构建成功。
1.3主要检测指标及方法
ELISA法测定腹腔静脉血内TNF-α含量;比色法测定肝脏组织内甘油三酯含量;RT-PCR法测定肝内PPARα mRNA及Acox1 mRNA含量,Western blot法测定肝内PPARα蛋白含量。TNF-α ELISA试剂盒购于武汉博士德生物工程有限公司;TRIzol Reagent、Reverse Transcription System购自美国Trevigen公司;PPARα单克隆抗体购自美国Abcam公司。检测均严格按照试剂盒说明操作。
1.4RT-PCR检测PPARα mRNA及Acox1 mRNA
1.4.1总RNA提取取300 mg肝组织,加入TRIzol 1 mL,并转移到匀浆器中,将匀浆器置于冰上研磨,将匀浆样品在15~30℃条件下孵育5 min后转移至1.5 mL无RNA酶的EP管中。加0.2 mL氯仿,孵育2~3 min后,于高速低温离心机中离心15 min(4℃,13 500 r/min),取上层液至另一无RNA酶的EP管中,加入0.5 mL异丙醇,孵育10 min,低温离心10 min(4℃,13 500 r/min)。小心移去上清液,加入1 mL 75%乙醇,低温离心5 min(4℃,7 500 r/min),小心移去上层液,于无菌操作台上自然干燥5~10 min后加入60~100 μL DEPC水,溶解后的RNA即刻用于浓度测定,取A260/A280比值位于1.8~2.1和A260/A230大于2.0的RNA样品用于逆转录反应。
1.4.2引物合成根据参考文献提供引物序列[10],由Invitrogen公司合成,引物序列为:PPARα上游引物5′-AGGGCCTCCCTCCTACGCTTG-3′,下游引物5′-GGGTGGCAGGAAGGGAACAGA-3′;Acox 1上游引物5′-CAATCACGCAATAGTT-CTGGCTC-3′,下游引物5′-AAGCTCAGGCAGTTCACTCAGG-3′;β-actin上游引物5′-GGCCGGG-ACCTGACAGACTACCT-3′,下游引物5′-GGG-CATCGGAACCGCTCATTG-3′。GAPDH上游引物5′-CCCATCACCATCTTCCAGGAGC-3′,下游引物5′-CCAGTGAGCTTCCCGTTCAGC-3′。
1.4.3逆转录反应取4 μg RNA,加入2 μL Oligo(dT)(10 μmol/L)、2 μL dNTP(2.5 mmol/L),加入ddH2O至14.5 μL,于70℃变性5 min后置于冰上。加入4 μL 5 × RT buffer、0.5 μL RNase inhibiter、1 μL M-MLV,于42℃孵60 min,95℃加热5 min终止逆转录反应。
1.4.4PCR反应建立25 μL反应体系:上游引物0.5 μL、下游引物0.5 μL、dNTP(2.5 mmol/L)2 μL、Taq聚合酶0.25 μL、10×Taq buffer 2.5 μL、cDNA 1 μL、ddH2O 18.25 μL。反应条件如下:94℃ 4 min;94℃ 30 s,56℃ 30 s,72℃ 25 s,30个循环;72℃ 4 min,4℃ 4 min。
1.4.5定量分析采用Gel-Pro analyzer凝胶电泳分析软件对DNA电泳条带进行半定量分析,分析各条带的积分吸光度值(IOD),以目的基因与内参基因(β-actin或GAPDH)的比值反映目的基因PPARα及Acox1的mRNA相对表达水平。
1.5Western blot检测肝PPARα蛋白
取适量RIPA裂解液匀浆组织,测蛋白浓度后,取50 μg总蛋白上样电泳;后行PPARα转膜(200 mA、110 min);TBST封闭PVDF膜;1:600稀释PPARα一抗,4℃孵育过夜;1:50 000稀释的HRP标记的二抗温室摇床孵育2 h;滴加ECL底物液显影定影。采用Bandscan分析PPARα及β-actin蛋白条带灰度值。
1.6统计学处理

2结果
2.1肝组织内甘油三酯与血清中TNF-α含量
与正常对照组相比,酒精性脂肪肝大鼠肝组织内甘油三酯沉积明显增多[(0.72±0.09)mmol/Lvs.(0.28±0.07)mmol/L,P<0.01],血清中TNF-α含量明显升高[(3.01±0.31)ng/mLvs.(1.07±0.28)ng/mL,P<0.01];苯扎贝特组大鼠肝内甘油三酯[(0.43±0.11)mmol/L]较酒精性脂肪肝组沉积减少(P<0.01),但仍高于正常对照组(P<0.01),血清内TNF-α含量[(1.89±0.35)ng/mL]较酒精性脂肪肝组减少(P<0.01),但仍高于空白对照组(P<0.01),见表1。
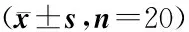
Table 1Comparison of TG in the liver and serum TNF-α in


组别TG(mmol/L)TNF-α(ng/mL)正常对照组0.28±0.071.07±0.28酒精性脂肪肝组0.72±0.09△3.01±0.31△苯扎贝特组0.43±0.11△*1.89±0.35△*
与正常对照组比较,△P<0.01;与酒精性脂肪肝组比较,*P<0.01
2.2肝组织PPARα mRNA及Acox1 mRNA的表达
正常对照组大鼠肝组织PPARα mRNA及Acox1 mRNA表达相对较高,酒精性脂肪肝组大鼠肝内PPARα mRNA[(0.22±0.08)vs.(0.68±0.13),P<0.01]及Acox1 mRNA[(0.43±0.12)vs.(1.14±0.21),P<0.01]的表达减少;经苯扎贝特干预后,PPARα mRNA(0.59±0.13)较酒精性脂肪肝组增加(P<0.01),但与正常对照组相比差异无统计学意义(P>0.05),Acox1 mRNA(0.83±0.17)表达量较酒精性脂肪肝组增多(P<0.01),但仍低于正常对照组(P<0.01)。见图1、图2。

M:DNA marker;C:正常对照组;A:酒精性脂肪肝组;B:苯扎贝特组图1 各组大鼠肝组织PPARα mRNA扩增条带图Fig.1 Amplified bands of PPARα mRNA in the liver tissues in rats of each group
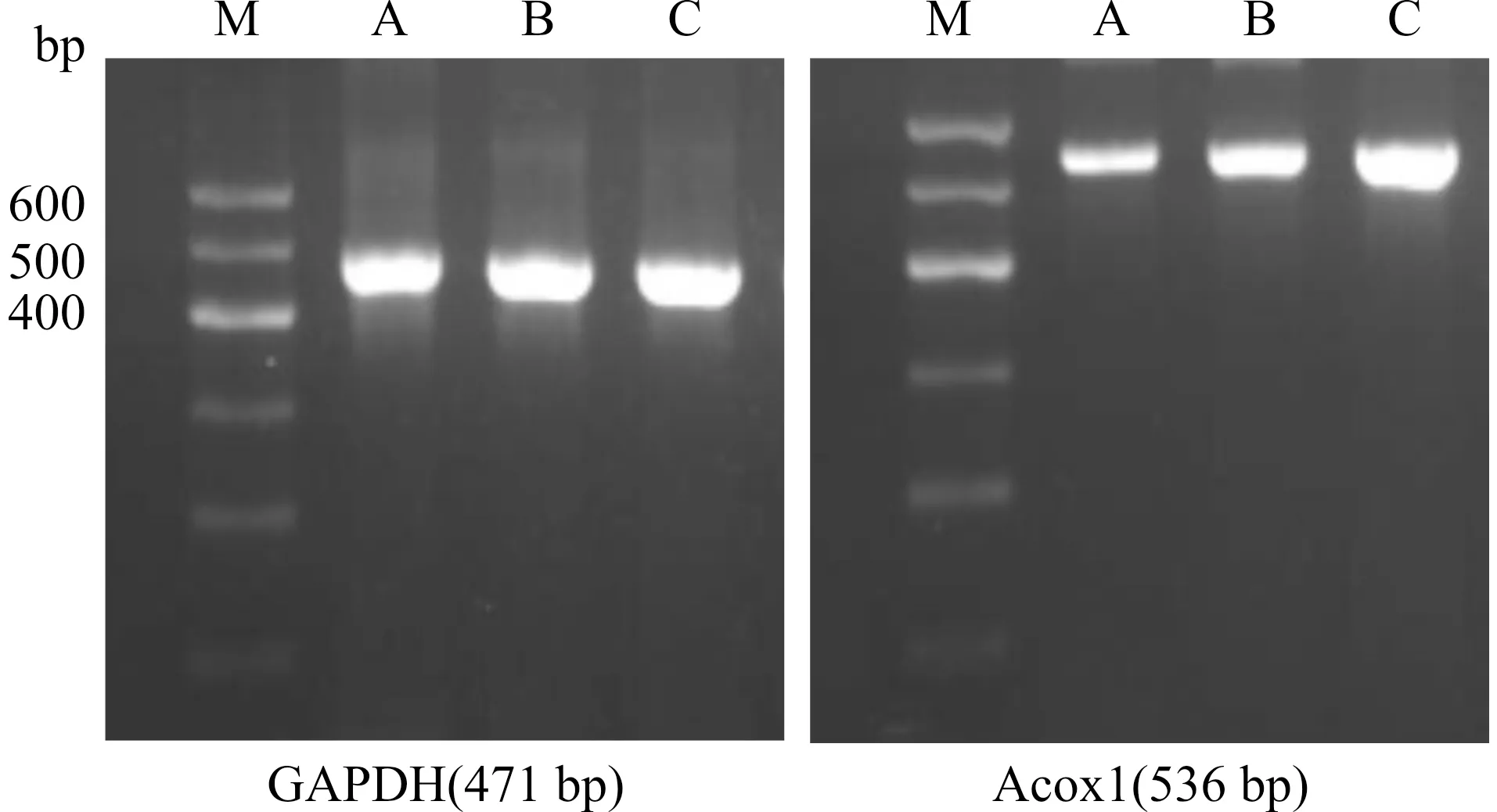
M:DNA marker;A:酒精性脂肪肝组;B:苯扎贝特组;C:正常对照组图2 各组大鼠肝组织Acox1 mRNA扩增条带图Fig.2 Amplified bands of Acox1 mRNA in the liver tissues in rats of each group
2.3肝组织内PPARα蛋白表达
与正常对照组相比,酒精性脂肪肝组大鼠肝PPARα蛋白表达明显减少[(0.19±0.07)vs.(0.48±0.11),P<0.01],经过苯扎贝特干预治疗后,苯扎贝特组大鼠肝内PPARα蛋白表达较酒精性脂肪肝组增加[(0.33±0.08),P<0.01],但仍低于正常对照组(P<0.01),见图3。

C:正常对照组;A:酒精性脂肪肝组;B:苯扎贝特组图3 Western blot法检测各组大鼠肝内PPARα水平Fig.3 Western blot analysis of the expression of PPARα in the liver tissues in different groups
3讨论
肝脏是脂质和脂肪酸代谢的重要部位,且脂质和脂肪酸的合成、分解、酮体生成和脂蛋白代谢都在多因子调控下保持相对平衡。PPARα主要存在于肝脏中,调控多种靶基因的表达,包括参与脂代谢过程的多个基因,如脂肪酸摄取、结合与氧化、脂蛋白组合、运输与代谢的基因,是脂质代谢过程的关键因子[7]。Acox1是PPARα的下游靶基因,其主要调节脂肪酸在线粒体和过氧化物酶体中的β氧化过程,促进脂肪酸的代谢[11]。PPARα与脂肪酸及其衍生物、贝特类降脂药等结合后活化,活化后的PPARα可与视黄酸类受体结合形成二聚体,并作为一个特殊的转录因子,再与靶基因中的PPARs反应原件相互作用,从而启动一系列与脂质代谢有关的酶和蛋白基因如Acox1等的转录,因此PPARα在脂质代谢中占有非常重要的地位。
Acox1位于PPARα途径的下游,是脂肪酸β氧化的关键限速酶,本实验结果表明,在酒精性脂肪肝大鼠肝脏中,PPARα mRNA及其下游基因Acox1 mRNA的表达均明显减少,肝内PPARα的蛋白含量明显降低,导致脂肪酸代谢过程减慢,肝内脂肪沉积。而经过苯扎贝特干预治疗后,肝内PPARα mRNA及Acox1 mRNA的表达增加,肝内PPARα蛋白含量升高,符合PPARα及Acox1在酒精性脂肪肝代谢过程中的调节作用,进一步证明脂质代谢紊乱在酒精性脂肪肝发病机制中的作用。
肿瘤坏死因子-α(TNF-α)是重要的炎症因子,在正常情况下主要是由脂肪组织产生,参与机体炎性反应、组织损伤等过程[12]。本课题组先前研究发现氧化应激及脂质过氧化反应在酒精性脂肪肝的发病过程中具有重要作用,酒精性脂肪肝形成时,肝内甘油三酯沉积增加,TNF-α合成增加,通过直接或者激活其他细胞因子,如白细胞介素6(IL-6)、IL-8等细胞因子,参与氧化应激及脂质过氧化损伤,诱发炎症瀑布反应,导致肝细胞损伤,出现酒精性肝炎的一系列表现。PPARα激活剂苯扎贝特可通过激活PPARα受体,促进脂肪酸代谢过程[13],降低肝脏组织内脂肪含量,使TNF-α合成减少,从而改善酒精性脂肪肝。本实验结果进一步证明PPARα激动剂苯扎贝特在酒精性脂肪肝中的治疗和预防作用。
本实验从分子生物学机制研究发现,酒精抑制肝内脂肪代谢的关键基因PPARα及Acox1的表达,导致肝内甘油三酯沉积,促进炎症因子如TNF-α等的合成和释放,引发酒精性脂肪肝。而PPARα激动剂苯扎贝特可以提高PPARα及Acox1的表达水平,调节肝内脂质代谢过程,减少肝内脂质沉积,起到预防和治疗酒精性脂肪肝的作用。为临床上应用PPARα激动剂贝特类药物提供了理论依据,也为进一步开发其他PPARα激动剂在临床的应用提供了新的思路。
参考文献
[1]邬升,郑世华,仝巧云.酒精性肝病发病机制的研究进展[J].实用医学杂志,2013,29(12):2049-2050.
[2]Mann R E,Smart R G,Govoni R.The epidemiology of alcoholic liver disease[J].Alcohol Res Health,2003,27(3):209-219.
[3]陶妍,吴高峰,杨建成,等.PPAR-α在酒精性脂肪肝发生中的作用研究进展[J].动物医学进展,2012,33(2):71-74.
[4]Ajmo J M,Liang X,Rogers C Q,et al.Resveratrol alleviates alcoholic fatty liver in mice[J].Am J Physiol Gastrointest Liver Physiol,2008,295(4):G833-G842.
[5]You M,Fischer M,Deeg M A,et al.Ethanol induces fatty acid synthesis pathways by activation of sterol regulatory element-binding protein(SREBP)[J].J Biol Chem,2002,277(32):29342-29347.
[6]贾蓉蓉,赵严,邱磊,等.PPARα与非酒精性脂肪肝的最新进展[J].胃肠病学和肝病学杂志,2013,22(3):210-213.
[7]Martin G,Schoonjans K,Lefebvre A M,et al.Coordinate regulation of the expression of the fatty acid transport protein and acyl-CoA synthetase genes by PPARalpha and PPARgamma activators[J].J Biol Chem,1997,272(45):28210-28217.
[8]石巧娟,刘月环,楼琦,等.非酒精性脂肪肝大鼠PPARα基因表达及脂代谢和胰岛素水平的变化[J].中国比较医学杂志,2009,19(8):26-30.
[9]施军平,陈芝芸,包剑锋,等.高脂饮食诱导的非酒精性脂肪性肝病大鼠肝组织PPARα和CPT-I mRN A的表达[J].浙江中医药大学学报,2007,31(1):52-55.
[10]Finck B N,Bernal-Mizrachi C,Han D H,et al.A potential link between muscle peroxisome proliferator-activated receptor-alpha signaling and obesity-related diabetes[J].Cell Metab,2005,1(2):133-144.
[11]Marcus S L,Miyata K S,Zhang B,et al.Diverse peroxisome proliferator-activated receptors bind to the peroxisome proliferator-responsive elements of the rat hydratase/dehydrogenase and fatty acyl-CoA oxidase genes but differentially induce expression[J].Proc Natl Acad Sci U S A,1993,90(12):5723-5727.
[12]李徽徽,汪华学,柴继侠,等.脓毒症致大鼠急性肾损伤中炎症介质的变化及机制探讨[J].中国组织化学与细胞化学杂志,2014,23(2):160-164.
[13]Tenenbaum A,Motro M,Fisman E Z,et al.Bezafibrate for the secondary prevention of myocardial infarction in patients with metabolic syndrome[J].Arch Intern Med,2005,165(10):1154-1160.
(2016-01-08收稿)
Expression of PPARα and Acox1 in Rats with Alcoholic Fatty Liver Disease
Tong Qiaoyun,Ge Cunjin,Zheng Shihua
InstituteofDigestiveDiseases,ChinaThreeGorgesUniversity;DepartmentofGastroenterologyofYichangCentralPeople’sHospital,Yichang443003,China
AbstractObjectiveTo investigate the molecular biological mechanism of deposition of triglyceride(TG)in hepatocytes in alcoholic fatty liver disease(AFLD)and the pathogenesis of this condition by detecting the contents of serum tumor necrosis factor-α(TNF-α),liver triglyceride(TG),peroxisome proliferator-activated receptor α(PPARα)and acyl-CoA oxidase(Acox1)mRNAs,and liver PPARα protein after intervention with bezafibrate,a PPARα agonist.MethodsSixty Wistar rats were randomly divided into three groups:control group(n=20),AFLD group(n=20),and bezafibrate group(n=20).Animals in control group were given distilled water by gavage once a day for 8 weeks.Those in AFLD group were given ethanol and fish oil(2.5 mL/kg)by gavage daily for the same period of time.In bezafibrate group,rats were treated by gavage with ethanol and fish oil(2.5 mL/kg)for the first 4 weeks and then with bezafibrate(100 mg/kg)for another 4 weeks.TG in the liver was measured by colorimetric method,serum TNF-α levels by enzyme linked immunoabsorbent assay(ELISA),the mRNA expression of PPARα and Acox1 in hepatocytes by reverse transcription polymerase chain reaction(RT-PCR)and the expression of PPARα protein in hepatocytes by Western blot.ResultsA significant increase in TG[AFLD group(0.72±0.09)mmol/L vs.control group(0.28±0.07)mmol/L,P<0.01] and TNF-α[AFLD group(3.01±0.31)ng/mL vs.control group(1.07±0.28)ng/mL,P<0.01]was found in AFLD group when compared with control group.After bezafibrate intervention,the contents of liver TG and serum TNF-α were significantly decreased.The mRNA expression of PPARα[AFLD group(0.22±0.08) vs.control group(0.68±0.13),P<0.01] and Acox1[AFLD group(0.43±0.12) vs.control group(1.14±0.21),P<0.01]was suppressed in AFLD group,which was significantly reversed by bezafibrate treatment[bezafibrate group(0.59±0.13)for PPARα mRNA vs.AFLD group,P<0.01;bezafibrate group(0.83±0.17)for Acox1 mRNA vs.AFLD group,P<0.01].The expression of PPARα protein in hepatocyts was also found to decrease in AFLD group[AFLD group(0.19±0.07) vs.control group(0.48±0.11),P<0.01].After bezafibrate intervention,it was profoundly increased.ConclusionThe down-expression of PPARα and Acox1 in the liver of rats with AFLD may suppress the fatty acid metabolism and lead to the TG deposition in the liver.The increase in serum TNF-α contents also contributes to the development of AFL.Bezafibrate can prevent and treat AFL by activating PPARα,increasing the expression of PPARα and Acox1,promoting the metabolism of fatty acids,decreasing the TG deposition and the serum TNF-α contents.
Key wordsalcoholic fatty liver;triglyceride;PPARα;Acox1;bezafibrate
中图分类号:R575.5
DOI:10.3870/j.issn.1672-0741.2016.03.010
*湖北省宜昌市科技计划资助项目(No.A09301-07)
仝巧云,女,1968年生,主任医师,E-mail:ycxhnk@163.com

