金刚烷胺对缺血缺氧脑损伤新生鼠的脑保护作用及其机制*
孙 怡, 李海风, 张登文
广东省人民医院麻醉科,广东省医学科学院,广州 510080
金刚烷胺对缺血缺氧脑损伤新生鼠的脑保护作用及其机制*
孙怡,李海风,张登文
广东省人民医院麻醉科,广东省医学科学院,广州510080
摘要:目的探讨非竞争性N-甲基-M-天冬氨酸(NMDA)受体阻断剂金刚烷胺(amantadine,AMA)对缺血缺氧脑损伤新生鼠的治疗作用及可能的作用机制。方法7 d龄的新生SD大鼠结扎右侧颈总动脉,随后吸入8%O2 2 h,建立新生鼠缺血缺氧性脑病(HIE)模型。实验动物分为3组:空白对照组(n=15)、模型(HIE)组(n=15)和治疗(AMA)组(n=45),治疗组分为3个亚组,每组15只,分别于术前30 min,术后15 min和低氧吸入前30 min给予鼻腔注入AMA 50 mg/kg体重。术后7 d取双侧大脑称重,通过右/左侧大脑半球重量比测定筛选出1个亚组的给药时点作为后续实验的给药时点。另取大鼠45只,模型制作和分组同前(每组15只),术后24 h取结扎侧海马,采用ELISA方法测定IL-1β和IL-6的浓度。另取大鼠45只,模型制作和分组同前(每组15只),术后30 d进行行为学测试,包括大鼠钻洞实验、转动杆测试和恐惧实验,比较各组差异。结果术后15 min给予AMA可提高大鼠右/左侧大脑半球重量比,与HIE组相比,差异有统计学意义(P<0.05)。与HIE组比较,术后15 min给予AMA不仅可降低结扎侧海马的IL-1β、IL-6浓度,而且可减少钻洞时间,延长转动杆站立时间和恐惧记忆时间,差异均有统计学意义(均P<0.05)。结论AMA可减轻缺血缺氧后新生鼠的海马炎症反应,降低脑损伤,提供脑保护作用。
关键词:金刚烷胺;缺血缺氧性脑病;炎症;脑保护;新生鼠
由缺血或缺氧这两个直接因素引起的新生儿脑病可导致患儿残废或死亡。据文献报道,在每年的900万患儿中,死亡和残废的人数达到1/3[1]。给家庭和社会造成了沉重的负担。如何在早期进行药物干预,减轻脑损伤,促进预后,是目前临床亟待解决的问题。
金刚烷胺(amantadine,AMA)是常见的抗病毒药物,因具有显著的脑保护作用,AMA的治疗领域目前已扩展至外伤性脑损伤,且临床疗效已得到证实[2]。本研究拟探讨其对新生儿的缺血缺氧性脑病的治疗功效及机制,以期为未来的临床治疗提供依据。
1材料与方法
1.1试剂和仪器
IL-1β、IL-6 ELISA试剂盒(R&D system公司,美国),异氟醚(江苏恒瑞公司),金刚烷胺(Sigma公司,美国),行为学测试装备(San Diego Instruments,美国)。
1.2实验动物及分组
清洁级SD大鼠,雌雄不限,7 d龄,体重10~15 g,由中山大学实验动物中心提供。新生鼠随机分为空白对照组(n=15)、HIE组(n=15)和AMA组(n=45)。AMA组按给药时间分为3个亚组,每个亚组15只动物,分别于结扎前30 min、结扎后15 min和低氧吸入前30 min给予鼻腔注射AMA 50 mg/kg,容量10~15 μL。HIE组给予等量的生理盐水。7 d后75只新生鼠在深麻醉下处死,取双侧大脑进行称重,计算右/左侧大脑重量比,据此确定效果最好的亚组的给药时点作为后续实验治疗组的给药时点。对给药方式进行了预实验,分别采用1次/d ×1 d、1次/d ×2 d、1次/d ×3 d给药,最后确定以1次/d ×1 d作为本次实验的给药方式。后续ELISA检测及行为学检测的动物制模方法同前,亦分为空白对照组(n=15)、HIE组(n=15)和AMA组(n=15)。进入实验的动物共165只。
1.3新生鼠缺血缺氧性脑病(HIE)模型制作
7 d龄的新生SD大鼠在异氟醚和30%O2-70%N2混合气体麻醉下,右侧颈总动脉用7#丝线进行结扎。回笼3 h后置于37℃的温箱中,维持8%O2-92%N2浓度下2 h。
1.4ELISA测定
造模术后24 h,45只新生鼠在异氟醚深麻醉下使用生理盐水进行心脏灌洗,取右侧海马于0.05 mol/L的Tri-HCl中溶解,4℃下离心,13 000 g×20 min,取上清液采用BSA法进行蛋白浓度测定。随后使用R&D system公司的IL-1β和IL-6系列ELISA试剂盒(R&D systems,MN,USA),按照说明书要求进行浓度测定。
1.5行为学检测
1.5.1钻洞实验造模术后30 d,45只大鼠进行钻洞实验训练,详细过程参考Zuo等[3]的实验。实验装置为一个旋转的平台,共20个同样大小的洞。其中一个洞连着黑色的盒子,称为目标盒。实验开始时,大鼠放置于平台中央,在85 dB的噪音和200 W的强光照射干扰下,大鼠被训练在3 min内进入目标盒中。这个过程2次/d,间隔15 min以上,共4 d,第5天测试(近期记忆力指标),7 d后再次测试(远期记忆力指标)。实验中测定指标为训练期(4 d)的钻洞时间和记忆时间[(近期记忆力指标+远期记忆力指标)/2]。
1.5.2运动协调功能评估钻洞实验后进行大鼠运动协调功能评估,详细过程参考Zuo等[4]的实验。大鼠被放置在旋转棒上,5 min内,频率从4次/min增加到40次/min,记录大鼠跌落时的频率和速度,计算速度-频率指数(速度与频率的乘积)。训练期3次/d,连续2 d,第3天进行测试,每只大鼠测试5次,取平均值作为测试值。
1.5.3恐惧实验本实验用于明确与海马有关的学习和记忆功能。详细过程参考Zuo等[5]的实验。每只大鼠均被放入树脂材料的训练盒(30 cm×30 cm×15 cm)中,放入前使用70%的乙醇消毒。经过3 min的适应阶段后,在黑暗的环境中,大鼠被给予高分贝噪音(2 000 Hz,90 dB)及随后的电刺激(1 mA,2 s),共3次,间隔1 min。训练之后24 h,大鼠被再次放入训练盒中,于无噪音和电刺激的状态下8 min,记录大鼠的静止、发抖等恐惧行为持续时间。2 h后,大鼠被放入测试盒中,这个测试盒有不同的环境和气味(使用1%的醋酸代替乙醇),经过3 min的适应阶段后,释放同前的噪音,每次30 s,记录8 min内大鼠恐惧行为的持续时间,计算恐惧时间比(%)=恐惧行为持续时间/实验总时间×100%。
1.6统计学方法

2结果
2.1右/左侧大脑半球重量比(RR/L)
术后7 d,空白对照组大鼠两侧大脑半球基本等大,而结扎后15 min给药AMA组和HIE组大鼠右侧大脑半球体积减小,明显小于左侧,HIE组更明显,如图1所示。
术后7 d各组大鼠的RR/L如图2所示。空白对照组的大鼠RR/L约为1.0,HIE组约为0.6,在AMA组中,结扎后15 min给药组的大鼠RR/L最高,约为0.8,与HIE组相比,差异有统计学意义(P<0.05),表明该时间点给予AMA能最大程度发挥其效能,同时也说明鼻腔注射AMA能减轻缺血缺氧造成的脑损伤,具有一定脑保护作用。在后续实验中,采用结扎后15 min作为AMA组给药时点。
2.2各组大鼠右侧海马IL-1β、IL-6水平
如图3所示,大鼠右侧海马的IL-1β浓度,HIE组高于空白对照组(P<0.05),AMA组低于HIE组(P<0.05),AMA组与空白对照组相比差异无统计学意义(P>0.05)。大鼠右侧海马的IL-6浓度,HIE组和AMA组均明显高于空白对照组(均P<0.05),而AMA组低于HIE组(P<0.05)。
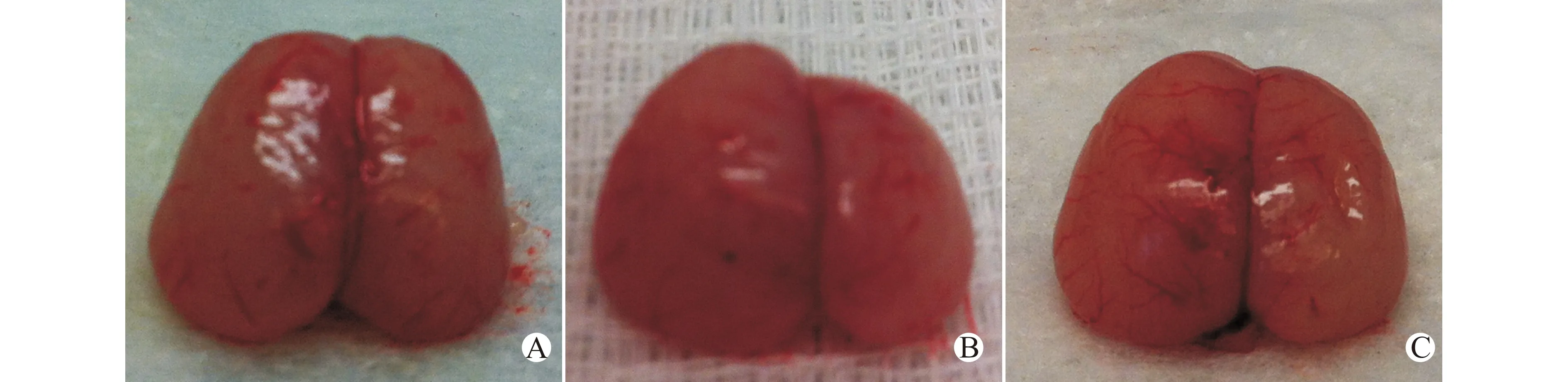
A:空白对照组;B:HIE组;C:结扎后15 min给药AMA组图1 术后7 d各组动物双侧大脑半球形态学观察Fig.1 Morphological results of bilateral hemispheres of rats in different groups 7 days after the HI brain injury
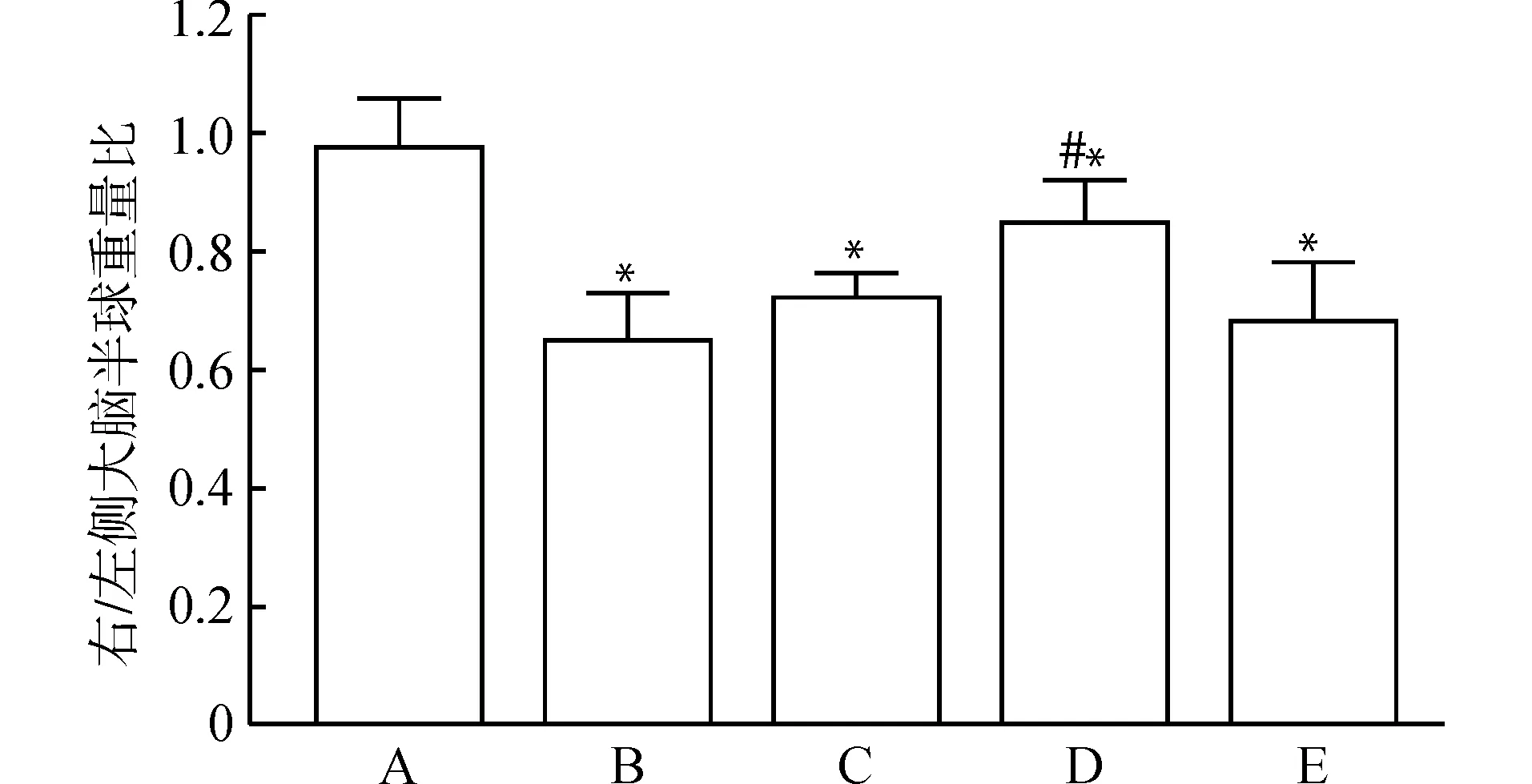
A:空白对照组;B:HIE组;C:结扎前30 min给药AMA组;D:结扎后15 min给药AMA组;E:低氧前15 min给药AMA组;与空白对照组比较,*P<0.05;与HIE组比较,#P<0.05图2 术后7 d各组动物右/左侧大脑半球重量比(RR/L)Fig.2 Right-to-left hemispheric weight ratio in each group 7 days after the HI brain injury
2.3行为学测试
在钻洞训练期间(图4A),4 d中HIE组大鼠的钻洞时间没有较大差别,而AMA组和空白对照组大鼠的钻洞时间逐渐缩短,两组在第4天所用的时间与第1天相比,差异均有统计学意义(均P<0.05)。在记忆能力测试(图4B)中,HIE组、AMA组大鼠的钻洞时间均长于空白对照组,而AMA组大鼠的钻洞时间短于HIE组,差异均有统计学意义(均P<0.05)。在运动协调功能实验(图4C)中,HIE组、AMA组大鼠的速度-频率指数均低于空白对照组,HIE组又低于AMA组,差异均有统计学意义(均P<0.05)。在恐惧实验(图4D)中,背景条件下,HIE组、AMA组的恐惧时间比均低于空白对照组,AMA组的恐惧时间比高于HIE组,差异均有统计学意义(均P<0.05);噪音条件下,HIE组的恐惧时间比低于空白对照组,差异有统计学意义(P<0.05),而AMA组与空白对照组比较,差异无统计学意义。
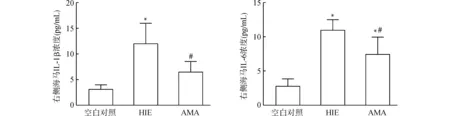
与空白对照组比较,*P<0.05;与HIE组比较,#P<0.05图3 术后24 h各组动物右侧海马中IL-1β和IL-6的浓度Fig.3 Concentrations of IL-1β and IL-6 in the right hippocampus of rats in each group 24 h after the HI brain injury
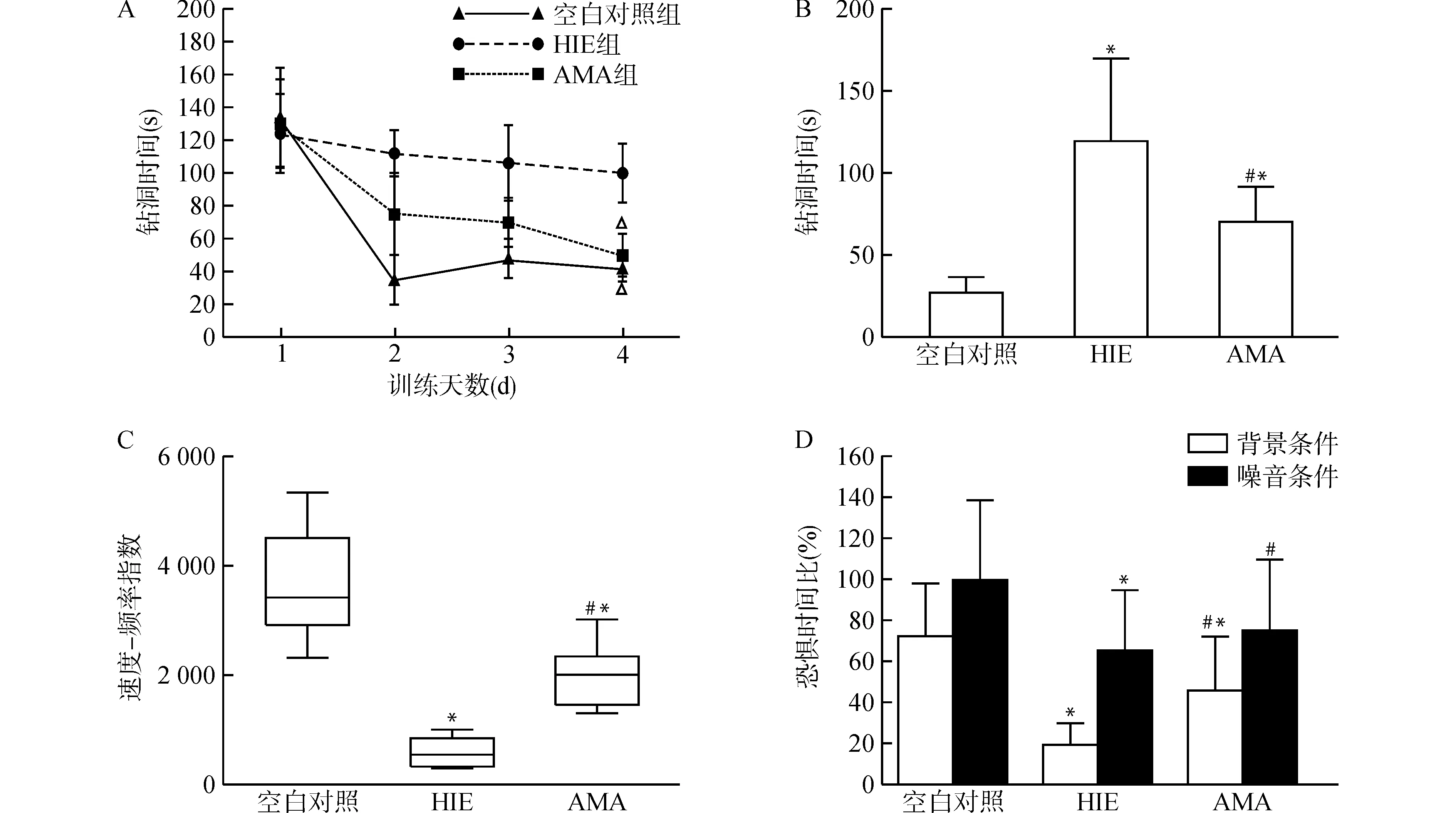
A、B:钻洞实验;C:运动协调功能实验;D:恐惧实验,包括背景和噪音刺激两部分。与训练第1天比较,△P<0.05;与空白对照组比较,*P<0.05;与HIE组比较,#P<0.05图4 建模后30 d各组大鼠的行为学测试Fig.4 Behavior tests of rats in each group 30 days after the HI brain injury
3讨论
HIE是严重危害新生儿健康的脑病,迄今为止,临床上尚无有效的治疗方法。AMA为中低等亲和力的非竞争性NMDA受体拮抗剂,近年来,因在临床创伤性脑损伤的各阶段治疗中均取得较好效果而备受关注[6],并成为HIE治疗的新研究方向。本实验以新生鼠为研究对象,就AMA的疗效和可能机制进行初步探讨。
HIE的损伤机制,既有缺氧造成的脑细胞代谢障碍,更有兴奋性氨基酸(EAAS)大量释放和对受体过度刺激导致的神经元兴奋、溃变、死亡,并产生兴奋性毒性,使血脑屏障的结构和功能发生改变,屏障作用受损,通透性增加,大量炎性因子和细胞穿越血脑屏障,引发局部炎症反应,加重损伤[7-9]。本次实验中HIE组新生鼠在病变发生后24 h其右侧海马IL-1β和IL-6的浓度明显增高,表明了血脑屏障的损伤。而AMA组新生鼠的炎症因子浓度低于HIE组,推测其原因为AMA作为非竞争性NMDA受体拮抗剂,可阻止EAAS激活NMDA受体,阻断神经损伤通路,减少神经细胞的损伤,还阻止钙内流引起的神经细胞损伤和破坏,因而具有降低缺血再灌注损伤、神经保护和抗炎等作用[10]。这一实验结果和Ossola等[11]的结论相吻合,是AMA具有脑保护作用的机制之一。
行为学测试是大脑不同机能的反映。一般而言,钻洞实验和恐惧实验用于测试大鼠海马相关的学习和记忆功能,运动协调实验则用于测试大脑运动功能。3组测试结果均表明AMA组新生鼠的大脑功能强于HIE组,显示了AMA阻止大脑病变发展、减弱缺血缺氧损害的组织修复功能,与前面的病理结果相呼应,共同验证了AMA的近期组织修复以及远期功能恢复的作用,从而揭示了AMA在HIE治疗上的疗效与潜力。有文献报道AMA可促进修复因子胶质细胞源性生长因子(GDNF)释放,但其在HIE治疗中的效果,还需后续实验予以证实。另有研究显示,AMA可以作用于多巴胺(DA)和去甲肾上腺素系统(NE),通过促进DA和NE的释放,抑制多巴胺能转运体(DAT)和肾上腺素转运体(NAT)活性而使脑内DA和NE浓度升高[12],因此可明显促进认知功能的改善。
实验中使用的结扎7 d龄新生大鼠一侧颈总动脉的方法,是目前国际通用的制作HIE动物模型的方法,而1周后测定双侧大脑半球的重量比,则是鉴定模型是否成功的标志[13]。本实验结果,空白对照组的大鼠RR/L约为1.0,HIE组约为0.6,与文献报道的基本相符,说明造模成功。AMA给药时间不同的3组RR/L代表了临床上3个不同给药阶段即发生前、发生中、发生后的效果,结果证实病变的不同阶段给药其效果不同,最佳给药时间为HIE发生后15 min,原因可能在于其作用时间与病变损伤期相重叠,因而抑制效应较为明显。单次剂量即可达到最大效应,表明早期治疗对新生儿的大脑组织损害是关键因素[14],可为将来的临床治疗提供一定的实验基础。鼻饲是临床常用的给药途径之一。与其它途径相比,具有方便、简单、快速,且不需要其它设施支持等优点[15],对于不适于口服和静脉通路不容易建立的新生儿,是一种有效的途径。另外,从实验结果我们可以看到HIE的最佳治疗时期是损害发生早期,故只有鼻饲才能提供及时的时间保障。AMA的血-脑通透性佳,药物通过上鼻甲入脑脊液,可绕过血脑屏障而靶向作用于脑组织[16-17],便于提高有效浓度,增强作用效果。对HIE患儿而言,AMA鼻饲给药是首选方式。
综上所述,AMA可有效降低新生儿缺血缺氧病的大脑损害,减少功能障碍。其具体作用机制尚需进一步探讨,本实验为其在临床的应用奠定了基础。
参考文献
[1]Bang A T,BangR A,Baitule S B,et al.Management of birth asphyxia in home deliveries in rural Gadchiroli:the effect of two types of birth attendants and of resuscitating with mouth-to-mouth,tube-mask or bagmask[J].J Perinatol,2005,25(Suppl.1):S82-S91.
[2]Giacino J T,Whyte J,Bagiella E,et al.Placebo-controlled trial of amantadine forsevere traumatic brain injury[J].N Engl J Med,2012,366(9):819-826.
[3]Zhang J,Jiang W,Zuo Z.Pyrrolidinedithiocarbamate attenuates surgery-induced neuroinflammation and cognitive dysfunction possibly via inhibition of nuclear factor kappa B[J].Neuroscience,2014,261:1-10.
[4]Li L,Zuo Z.Isoflurane preconditioning improves short-termand long-termneurologicaloutcome after focal brain ischemia in adult rats[J].Neurosci,2009,164(2):497-506.
[5]Li L,Zuo Z.Glutamate transporter type 3 knockout reduces brain tolerance tofocal brain ischemia in mice[J].J Cereb Blood Flow Metab,2011,31(5):1283-1292.
[6]Spritzer S D,Kinney C L,Condie J,et al.Amantadine for patients with severe traumatic brain injury:a critically appraised topic[J].Neurologist,2015,19(2):61-64.
[7]梅和珊,王永利.脑缺血时谷氨酸释放机制[J].中国药理学通报,2005,21(4):393-396.
[8]赵柏雄,田衍平,蔡其燕,等.新生大鼠慢性脑缺血损伤中氯离子通道ClC2的表达及其与白质发育影响作用的研究[J].中国组织化学与细胞化学杂志,2015,24(1):1-8.
[9]陈兴泳,汪银洲,汪效松,等.大鼠局灶性脑缺血再灌注后免疫蛋白酶体的变化[J].中国组织化学与细胞化学杂志,2015,24(4):311-317.
[10]Parsons C G,Panchenko V A,Pinchenko V O,et al.Comparative patch-clamp studies withfreshly dissociated rat hippocampal and striatal neurons on the NMDA receptor antagonistic effects of amantadine and memantine[J].Eur J Neurosci,1996,8(3):446-454.
[11]Ossola B,Schendzielorz N,Chen S H,et al.Amantadine protectsdopamine neurons by a dual action:reducing activation of microgliaand inducing expression of GNDF in astroglia[J].Neuropharmacology,2011,61(4):574-582.
[12]Ford L M,Sanberg P R,Norman A B,et al.MK-801 prevents hippocampal neurodegeneration in neonatal hypoxic-ischemic rats[J].Arch Neurol,1989,46(10):1090-1096.
[13]Sawyer E,Mauro L S,Ohlinger M J.Amantadine enhancement of arousal and cognition aftertraumatic brain injury[J].Ann Pharmacother,2008,42(2):247-252.
[14]Kabakus N,Ozcan A,Aysun S,et al.Evaluation of neuronal damage following hypoxic-ischacmic brain injury in acute and early chronic periods in neonatal rats[J].Cell Biochem Funct,2006,24(3):257-269.
[15]Gavini E,Rassu G,Muzzarelli C,et al.Spray-dried microspheres based on methylpyrrolidinone chitosan as new carrier administration of metoclopramide[J].Eur J Pharm Biopharm,2008,68(2):245-252.
[16]Charlton S T,Davis S S,IIIum L.Evaluation of bioadhesive polymers as delivery systems for nose to brain delivery:in vitro characterization studies[J].J Control Release,2007,118(2):225-234.
[17]Khurshid F,Lee K S,McNamara P J,et al.Lessons learned during implementation of therapeutic hypothermia for neonatal hypoxic ischemic encephalopathy in a regional transport program in Ontario[J].Paediatr Child Health,2011,16(3):153-156.
(2016-01-11收稿)
Neuroprotective Effects of Amantadine on the Hypoxic-ischemic Brain Injury of Neonatal Rats
Sun Yi,Li Haifeng,Zhang Dengwen
DepartmentofAnesthesiology,GuangdongGeneralHospital,GuangdongAcademyofMedicalScience,Guangzhou510080,China
AbstractObjectiveTo examine the neuroprotective effects of amantadine(AMA),a non-competitive NMDA receptor antagonist,on the hypoxic-ischemic(HI)brain injury of neonatal rats and the possible mechanisms.MethodsHypoxic-ischemic encephalopathy(HIE)models were established in seven-day-old male and female Sprague-Dawley rats by ligating the right cephalic artery and then inhaling 8% oxygen for 2 h.All the rats were divided into 3 groups:control group(n=15),HIE group(n=15),and AMA group(n=45).Animals in AMA group were intranasally treated with AMA at 50 mg/kg 30 min before and 15 min after ligation and 30 min before inhalation(15 rats each used at the three time points).The right-to-left hemispheric weight ratio was calculated 7 days after the HI brain injury.The right hippocampus tissues of rats(n=45)were harvested 24 h after the HI brain injury and the concentrations of IL-1β and IL-6 were detected by ELISA.The outcomes of behavior tests(involving 45 rats)including Barnes maze test,motor coordination test and fear conditioning test,were evaluated 30 days after the HI brain injury.ResultsIntranasal AMA significantly increased the right-to-left hemispheric weight ratio,lowered the concentrations of IL-1β and IL-6 in the right hippocampus of rats and promoted the behavior functions 15 min after ligation(P<0.05).ConclusionIntranasal AMA can provide neuroprotection partially by reducing the hippocampal inflammation in the neonatal rats with HI brain injury.
Key wordsamantadine;hypoxic-ischemic encephalopathy;inflammation;neuroprotection;neonatal rat
中图分类号:R978.7
DOI:10.3870/j.issn.1672-0741.2016.03.006
*广东省卫生厅资助项目(No.20120070)孙怡,女,1973年生,医学博士,E-mail:sunnyuva2014@yahoo.com

