Toll样受体-3和 -4对干细胞成软骨分化的影响及机制*
徐小峰, 曹学书, 陈 奇△, 吴 巍, 张志坚, 陈平波, 吴康健, 江 潮
1江苏大学附属医院骨科,镇江 2120002华中科技大学同济医学院附属同济医院骨科,武汉 4300303江苏大学基础医学与医学技术学院,镇江 212001
Toll样受体-3和 -4对干细胞成软骨分化的影响及机制*
徐小峰1,曹学书1,陈奇1△,吴巍2,张志坚3,陈平波1,吴康健1,江潮1
1江苏大学附属医院骨科,镇江2120002华中科技大学同济医学院附属同济医院骨科,武汉4300303江苏大学基础医学与医学技术学院,镇江212001
摘要:目的探索Toll样受体(Toll like receptor,TLR)-3和-4在骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)成软骨分化过程中对蛋白多糖和Ⅱ型胶原蛋白形成的影响及机制。方法用Ficoll密度梯度离心法分离SD大鼠BMSCs,并进行传代扩增。流式细胞术检测细胞表面标志物CD34、CD44、CD54、CD90的表达进行细胞鉴定。以Western blot法检测第3代细胞的蛋白多糖和Ⅱ型胶原的表达。再随机分为空白组、TLR-3激活组、TLR-4激活组,分别以PBS、TLR-3激动剂、TLR-4激动剂处理后,进行成软骨诱导培养。培养第14天,以阿利新蓝染色检测蛋白多糖,以免疫荧光及Western blot法检测Ⅱ型胶原的表达,以实时荧光定量PCR检测Sox-9的表达。结果Ficoll密度梯度离心法分离所得细胞,其表面标志物表达为CD34(-)、CD44(+)、CD54(+)、CD90(+),符合BMSCs特点。分组处理前,BMSCs不表达蛋白多糖及Ⅱ型胶原。经过2周成软骨诱导培养,空白组、TLR-3激活组和TLR-4激活组阿利新蓝染色均为阳性,且3组间无明显差异。免疫荧光及Western blot结果显示,3组均表达Ⅱ型胶原,但空白组表达明显低于TLR-3激活组和TLR-4激活组,且TLR组间无明显差异。PCR结果显示,TLR-3和TLR-4激活组Sox-9相对表达量较空白组增高1倍,而TLR组之间无明显差异。结论经过成软骨诱导培养,BMSCs能够形成基质蛋白多糖及Ⅱ型胶原,初步具有软骨细胞特性。TLR-3和-4对基质蛋白多糖的形成无明显作用,却能够促进Ⅱ型胶原的形成,其机制可能与TLR-3和-4对Sox-9的上调有关。
关键词:Toll样受体;干细胞;成软骨分化;蛋白多糖;Ⅱ型胶原
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨髓内存在的一类非造血干细胞,不仅自我更新能力强,而且具有多向分化潜能,一定条件下,能够向成骨细胞、成纤维细胞、成脂细胞和内皮细胞等方向分化。由于具有来源丰富、取材方便、不涉及伦理学等优点,其作为组织工程与再生医学的重要种子细胞,在医学研究中广泛应用。Toll样受体(Toll like receptor,TLR)是细胞表面广泛表达的一类模式调节受体,属于Ⅰ型跨膜糖蛋白,在天然免疫的启动和调节中发挥重要作用[1]。近年来研究发现,TLR还能够调节干细胞功能,包括增殖、迁徙、成骨分化等[2-5]。考虑到TLR-3和-4在骨性关节炎(osteoarthritis,OA)模型中表达增高[6-7],且促进软骨细胞的凋亡及分解代谢,我们推测,TLR-3和-4对干细胞向软骨细胞分化过程也具有调节作用,从而促进或负反馈调节OA的发病。本研究旨在探索TLR-3和-4在BMSCs成软骨诱导分化过程中的作用及可能机制。
1材料与方法
1.1主要实验材料
1.1.1实验动物清洁的健康成年SD大鼠15只,雌雄不限,体质量100~125 g,均由江苏大学动物实验中心提供[SCXK(苏)2013-0011]。
1.1.2实验试剂和仪器DMEM/F12 培养液、胎牛血清(Sigma公司),胰蛋白酶(Amersco公司),双抗(1∶1的青霉素和链霉素)(华北制药公司),Ficol分层液、磷酸盐缓冲液(PBS)、TLR-3激动剂(聚肌胞苷酸)、TLR-4激动剂(脂多糖)(Sigma公司),羊抗大鼠抗体(FITC标记)(Santa Cruz公司),成软骨诱导分化培养液(CDM)(深圳百恩维公司),阿利新蓝(武汉博士德公司),Ⅱ型胶原抗体、蛋白多糖抗体、内参抗体(Abcam公司)。总RNA快速提取试剂盒(上海捷瑞公司),逆转录试剂盒(Thermo公司),qPCR试剂盒(TIANGEN公司)。倒置相差荧光显微镜(DMI4000B)(Leica公司),CO2恒温培养箱(Thermo公司),流式细胞仪(FACS Calibur)(BD公司),酶标仪(Biotek公司),高精度分光光度计SMA4000(Merinton公司),荧光定量PCR仪(StepOne Plus公司)。
1.2BMSCs的分离、培养及鉴定
颈椎脱位法处死SD大鼠,浸泡于75%乙醇中15 min。在无菌超净台中解剖SD大鼠并取出双侧股骨。用5 mL注射器吸取DMEM/F12培养液(10%胎牛血清),反复冲洗骨髓腔,直至骨髓腔透亮。将细胞悬液沿管壁缓缓加入含Ficoll分离液(1.077 g/mL)的离心管中,体积比为1∶1,1 500 r/min离心30 min。吸取中层白色细胞带的细胞至另一离心管中,再以1 000 r/min离心5 min,弃去上清液,加入培养液重悬,调整细胞密度至2×105/mL接种于培养瓶中,放置37℃,5% CO2恒温培养箱孵育。每2~3天换液,直至细胞长满瓶底80%时传代。
取第3代细胞消化后制成细胞悬液(1×107/mL)。PBS洗涤后(3次×1 min),转移至EP管。EP管中加入异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的羊抗大鼠CD34、CD44、CD54和CD90,同型对照管中加入等量羊抗大鼠FITC-IgG。冰上避光孵育30 min,PBS洗涤(2次×1 min)后于室温下离心5 min(1 000 r/min)。弃上清,加入500 μL PBS重悬(1×107/mL)。将细胞悬液放置到流式细胞仪中进行检测。
1.3成软骨诱导前蛋白多糖和Ⅱ型胶原的检测
取第3代细胞,弃培养液,PBS漂洗(3次×1 min)。加入上样缓冲液,匀浆1 min,4℃下离心5 min(13 000 r/min),取上清作为蛋白样本与SDS-PAGE匀浆缓冲液混匀(1∶1)。沸水中煮3 min,混匀,上样20 μL电泳。直流电(1 mA/cm2)转膜90 min,染色50 s,以50%的甲醛脱色,双蒸水漂洗并风干。PBS漂洗待测NC膜(3次×5 min)。加入封闭缓冲液,室温下振荡2 h。弃缓冲液,PBS漂洗(3次×5 min)。加入一抗(大鼠Ⅱ型胶原抗体或大鼠抗蛋白多糖抗体)4℃下反应12 h。弃一抗,PBS漂洗(4次×5 min)。加入辣根过氧化物酶偶联的二抗,室温下振荡2 h。弃二抗,PBS漂洗(4次×5 min)。避光加入DAB显色液直至出现条带,双蒸水中终止反应。
1.4实验分组处理及成软骨诱导
取第3代细胞接种于6孔板,随机分为3组(每组6孔),分别为:TLR-3激活组,以聚肌胞苷酸(Poly inosine-cytidine,Poly[I:C])激活(1 μmL);TLR-4激活组以脂多糖(Lipopolysaccharide,LPS)激活(1 μmL);空白组加入等量PBS作为对照。各组处理后加入成软骨诱导培养液,置于37℃,5% CO2恒温培养箱中培养。
1.5成软骨诱导后蛋白多糖和Ⅱ型胶原的检测
1.5.1阿利新蓝染色检测蛋白多糖培养14 d,弃培养液,PBS漂洗(3次×5 min),4%多聚甲醛室温下固定30 min,PBS漂洗(3次×5 min),0.1 mol/L HCl溶液浸洗5 min,pH值降至1.0,阿利新蓝染色过夜,0.1 mol/L HCl漂洗(3次×5 min),去除背景。
1.5.2免疫荧光检测Ⅱ型胶原培养14 d,弃培养液,PBS漂洗(3次×1 min),4%多聚甲醛固定10 min,PBS漂洗(3次×5 min),0.5%Triton X-100透膜处理1 h,PBS漂洗(3次×5min),0.5%牛血清白蛋白(BSA)室温湿盒封闭1 h,PBS漂洗(2次×1min),一抗(1∶100)4℃孵育过夜,PBS漂洗(3次×5 min),二抗(1∶64)室温避光孵育1h,PBS漂洗(3次×5 min),双蒸水漂洗(3次×5 min),荧光显微镜观察拍照。
1.5.3Western blot法检测Ⅱ型胶原培养14 d,以Western blot法检测各组Ⅱ型胶原的表达,方法同1.3 项。
1.6实时荧光定量PCR检测Sox-9基因
培养14 d,离心柱法提取总RNA,测定纯度满足后,顺序进行逆转录和扩增(具体操作步骤见相应试剂盒说明书)。Sox-9和内参的引物序列见表1。以2-ΔΔCt法进行相对定量。

表1 引物序列
1.7统计学方法
2结果
2.1BMSCs的分离、培养及鉴定
原代BMSCs生长缓慢,镜下呈圆球形,24~72 h后才逐渐出现贴壁细胞,细胞贴壁后逐渐显现出梭形、纺锤形,逐渐形成集落生长区。7~10 d后基本铺满瓶底。
传代后细胞贴壁较快,2 h即可见贴壁细胞,12~24 h后大部分细胞已贴壁、伸展,3~5 d细胞铺成单排,呈网状、漩涡状、辐射状(图1)。传代后细胞生长速度明显加快,一般2~4 d即可铺满瓶底。传代至第5、6代时细胞出现老化。
流式细胞技术检测显示(图2):表面标志物CD34(-)、CD44(+)、CD54(+)、CD90(+),符合BMSCs特点。

图1 BMSCs传代细胞(×20)Fig.1 Passaged BMSCs (×20)

图2 BMSCs表面标志物表达Fig.2 Expression of surface markers of BMSCs
2.2成软骨诱导前蛋白多糖及Ⅱ型胶原的表达
BMSCs在成软骨分化诱导前,以Western blot法检测蛋白多糖及Ⅱ型胶原表达,结果发现,未进行成软骨分化诱导处理的BMSCs不表达蛋白多糖及Ⅱ型胶原,见图3。

图3 成软骨分化诱导前蛋白多糖及Ⅱ型胶原表达Fig.3 Expression of proteoglycan and type Ⅱ collagen in BMSCs before chondrogenesis induction
2.3成软骨诱导后蛋白多糖及Ⅱ型胶原的变化
成软骨诱导14 d后,将细胞进行阿利新蓝染色,胞质蓝色为阳性,说明胞质中富含蛋白多糖成分。空白组、TLR-3激活组和TLR-4激活组均可发现阳性细胞(图4),且阳性细胞数无明显差异(F=0.628,P=0.547)。
以免疫荧光检测Ⅱ型胶原,阳性细胞的胞质呈红色荧光,胞核呈蓝色荧光。结果发现(图5),3组免疫荧光均呈阳性,但空白组荧光强度明显弱于TLR-3激活组和TLR-4激活组,但TLR-3激活组和TLR-4激活组之间差别不明显。
Western blot法检测Ⅱ型胶原的表达,结果显示(图6),Ⅱ 型胶原的表达在TLR-4激活组(1.058±0.152)和TLR-3激活组(0.945±0.256)差异无统计学意义(t=0.934,P=0.372),但均强于空白组(0.500±0.095),差异均具有统计学意义(均P<0.05)。
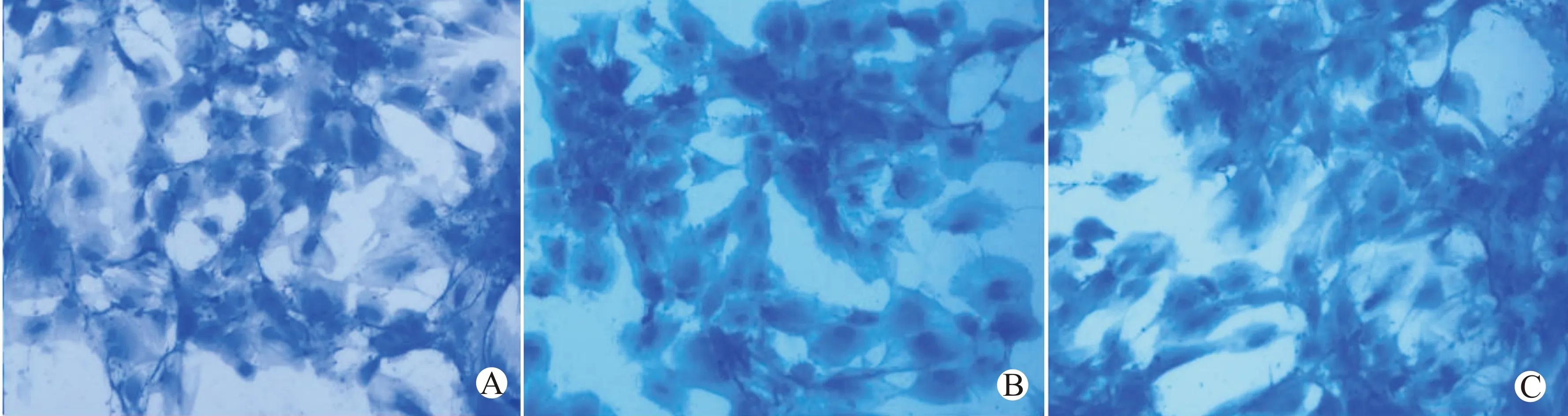
A:空白组;B:TLR-3激活组;C:TLR-4激活组图4 成软骨诱导后阿利新蓝染色(×100)Fig.4 Alician blut staining of BMSCs after chondrogenesis induction(×100)

A:空白组;B:TLR-3激活组;C:TLR-4激活组图5 免疫荧光检测成软骨细胞中Ⅱ型胶原(×100)Fig.5 Immunofluorescence of type Ⅱ collagen in chondroblasts(×100)

图6 Western blot检测Ⅱ型胶原的表达Fig.6 Western blot analysis of type Ⅱ collagen
2.4TLR对Sox-9基因表达的影响
TLR-3和TLR-4的激活上调了Sox-9的基因表达。实时荧光定量PCR检测结果显示,在TLR-3和TLR-4激活组,Sox-9的相对表达量较空白组明显增高,分别为对照组的2.20倍和2.14倍,差异具有统计学意义(均P<0.05)。而TLR-3激活组和TLR-4激活组之间,Sox-9的相对表达量差异无统计学意义(t=1.12,P=0.27)。见图7。

图7 各组Sox-9的相对表达量Fig.7 Relative expression of Sox-9 in each group
3讨论
软骨组织由软骨细胞、基质和纤维共同组成。基质的主要成分是大分子蛋白多糖,构成分子筛样立体结构,一方面,限制大分子的细菌通过,起到防御屏障的作用,另一方面,对营养物质具有很强的通透性,使缺乏血管结构的软骨组织能够通过渗透作用获得所需的营养物质,对软骨的代谢、自我修复及动态平衡的维持具有重要意义[8-9]。纤维构成了软骨组织的骨架结构,是软骨组织的重要组成成分,不同类型的软骨组织含有的纤维不同,构成关节面的透明软骨,含有丰富的胶原原纤维,其中90%属于Ⅱ型胶原。成熟软骨细胞分泌的Ⅱ型胶原,平行聚合,进一步形成具有周期性横纹的胶原原纤维,是软骨具有抗压性的重要因素。骨性关节炎及创伤的关节软骨中,Ⅱ型胶原的表达明显下降[10-11],以Ⅱ型胶原刺激,能够促进软骨细胞的再分化[12]。因此,蛋白多糖和Ⅱ型胶原是软骨组织形成和趋向成熟的重要标志[13]。
本研究中,在未进行成软骨诱导的第3代BMSCs中,蛋白多糖和Ⅱ型胶原并无明显表达,此时的BMSCs还保持干细胞的特性,不具备任一个定向成熟细胞系的生物学功能。细胞经过成软骨诱导培养2周后,胞质内检测出蛋白多糖成分,具备分泌蛋白多糖的能力。但空白组、TLR-3激活组和TLR-4激活组之间并无明显差异。这说明,TLR——无论是-3亚型还是-4亚型——在干细胞成软骨分化过程中,对软骨基质蛋白多糖的形成并无明显影响。
经过成软骨诱导培养,无论是免疫荧光染色还是Western blot均能检测出Ⅱ型胶原,但TLR-3和TLR-4激活组Ⅱ型胶原的表达高于空白组,而不同TLR亚型的激活对Ⅱ型胶原的表达影响无差异。这说明,在BMSCs成软骨分化的过程中,TLR能够促进Ⅱ型胶原的分泌,但与TLR的亚型无关。Sox-9是参与软骨组织发育的重要基因之一[14]。Sox-9在成熟软骨细胞中高表达,而在肥大软骨细胞中无明显表达,说明Sox-9与软骨细胞功能密切相关。研究表明,Ⅱ型胶原特异性增殖基因Col2a1依赖于Sox-9的磷酸化,其在软骨细胞中的表达与Sox-9的表达成正比[15]。在干细胞成软骨分化的过程中,Sox-9表达逐渐增多,对Ⅱ型胶原的产生具有重要意义[16]。本研究中,激活TLR-3和TLR-4,Sox-9的表达量较对照组增高1倍,这可能是TLR-3和TLR-4促进Ⅱ型胶原生成的机制。
综上所述,在BMSCs成软骨分化的过程中,TLR-3和-4对基质蛋白多糖的形成无明显影响,却能够促进Ⅱ型胶原的产生,不同亚型作用相同,其机制可能与TLR-3和-4对Sox-9的上调有关。
参考文献
[1]Jin M S,Lee J O.Structures of the toll-like receptor family and its ligand complexes[J].Immunity,2008,29(2):182-191.
[2]何晓霞,白海,杨国嵘,等.Toll样受体3和4在人骨髓间充质干细胞中的表达和活化对细胞增殖的影响[J].中国医科大学学报,2012,41(2):162-165.
[3]白庆霞,杨博,张艳,等.Toll样受体4与经典Wnt信号在破骨样细胞中作用机制的初步研究[J].牙髓牙周病杂志,2013,23(3):157-161.
[4]陈奇,魏长宝,徐晓峰,等.Toll样受体-3在干细胞成骨各阶段作用的贯续性[J].华中科技大学学报:医学版,2014,43(6):667-670.
[5]Takeda K,Akira S.Toll-like receptors in innate immunity[J].Int Immunol,2005,17(1):1-14.
[6]Chen Q,Xu X F,Wang X G.Effects of Toll like receptors (TLR)-3 and -4 in the osteogenesis of stem cells[J].Stem Cells Int,2014,22(16):1498-1503.
[7]Jiménez-Dalmaroni M J,Gerswhin M E,Adamopoulos I E.The critical role of toll-like receptors—From microbial recognition to autoimmunity:A comprehensive review[J].Autoimmun Rev,2016,15(1):1-8.
[8]毛艳,张西正.软骨组织工程中细胞外基质的研究[J].中国临床康复,2006,10(29):152-155.
[9]张晨,景士兵,杨琨,等.软骨脱细胞基质支架材料的软骨组织工程实验研究[J].中国修复重建外科杂志,2008,22(7):846-850.
[10]马春辉,阎作勤,郭常安,等.Ⅱ型胶原与Bcl-2在骨关节炎软骨细胞中的表达[J].中国矫形外科杂志,2012,20(19):1786-1789.
[11]杨军,娄德全,周振东,等.基质金属蛋白酶和胶原在创伤关节软骨组织中的表达[J].中国组织工程研究与临床康复,2011,15(20):3636-3640.
[12]孙明林,朱雷,吕丹,等.Ⅱ型胶原蛋白对兔去分化软骨细胞再分化的作用[J].中国修复重建外科杂志,2010,24(10):1244-1248.
[13]孙凯,游洪波,陈安民,等.TGF-β3诱导大鼠前软骨干细胞向软骨细胞特性方向分化及其在KLD-12自组装肽纳米凝胶中的培养[J].华中科技大学学报:医学版,2010,39(1):1-5.
[14]Ohba S,He X,Hojo H,et al.distinct transcriptional programs underlie Sox9 regulation of the mammalian chondrocyte[J].Cell Rep,2015,12(2):229-243.
[15]Ahmed N,Iu J,Brown C E,et al.Serum-and growth-factor-free three-dimensional culture system supports cartilage tissue formation by promoting collagen synthesis via Sox9-Col2a1 interaction[J].Tissue Eng Part A,2014,20(15/16):2224-2233.
[16]Chen C W,Tsai Y H,Deng W P,et al.Type I and Ⅱ collagen regulation of chondrogenic differentiation by mesenchymal progenitor cells[J].J Orthop Res,2005,23(2):446-453.
(2015-12-20收稿)
Effects of Toll Like Receptor-3 and -4 on Chondrogenic Differentiation of Stem Cells
Xu Xiaofeng,Cao Xueshu,Chen Qi△etal
DepartmentofOrthopedics,AffiliatedHospitalofJiangsuUniversity,Zhenjiang212000,China
AbstractObjectiveTo explore the effects of Toll like receptor (TLR)-3 and -4 on the expression of proteoglycan and type Ⅱ collagen in bone marrow mesenchymal stem cells (BMSCs) during chondrogenesis and the possible mechanisms.MethodsBMSCs in Sprague-Dawley (SD) rats were isolated by Ficoll density gradient centrifugation,cultured and passaged in vitro,and identified by detection of their surface markers (CD34,CD44,CD54 and CD90) by flow cytometry.Western blotting was used to detect the expression of proteoglycan and type Ⅱ collagen in BMSCs at 3rd passage.Cells were then divided randomly into blank group,TLR-3 activated group and TLR-4 activated group,in which PBS,TLR-3 agonist and TLR-4 agonist were added to treat cells,respectively.Fourteen days later,Alcian blue staining was used to detect the expression of proteoglycan,immunofluorescence and Western blotting to detect the expression of type Ⅱ collagen,and real time fluorescent quantitative PCR to detect the expression of Sox-9.ResultsCells were negative for CD34 and positive for CD44,CD54 and CD90,suggesting that the cells were BMSCs.Alcian blue staining revealed positive results in all the groups after 2 weeks of chondrogenesis induction,and no statistical difference was found between groups (P>0.05).Immunofluorescence staining and Western blotting showed that type Ⅱ collagen was expressed in all the three groups,its expression was significantly lower in blank group than that in TLR-3 and TLR-4 activated groups (P<0.05) and no statistical difference was found between the latter two groups (P>0.05).PCR showed that the relative expression level of Sox-9 was a 1-fold increase in TLR-3 and TLR-4 activated groups as compared with blank group.There was no significant difference in Sox-9 expression between TLR-3 and TLR-4 activated groups.ConclusionMatrix proteoglycan and type Ⅱ collagen were found to expresse in BMSCs after chondrogenesis induction,suggesting the differentiation of BMSCs into chondrocytes.TLR-3 and -4 have no significant effects on the formation of matrix proteoglycan,but they can promote the expression of type Ⅱ collagen,which may be related to the up-regulation of Sox-9.
Key wordsToll like receptor;stem cells;chondrogenesis;proteoglycan;type Ⅱ collagen
中图分类号:R329
DOI:10.3870/j.issn.1672-0741.2016.03.005
*国家自然科学基金资助项目(No.81401762);江苏大学博士创新基金资助项目(No.JDFYRC-2013017)
徐小峰,男,1962年生,主任医师,E-mail:13775534791@163.com
△通讯作者,Corresponding author,E-mail:jackiechanoth@163.com

