牛蒡子苷元诱导人鼻咽癌CNE-1细胞凋亡及其作用机制*
黄栋栋, 孟易禹, 孙栋勋, 金巧智, 陈武兵, 蔡志毅, △
(1温州医科大学第一临床医学院,浙江 温州 325000; 2台州市市立医院耳鼻咽喉头颈外科,浙江 台州 318000)
牛蒡子苷元诱导人鼻咽癌CNE-1细胞凋亡及其作用机制*
黄栋栋1,孟易禹1,孙栋勋1,金巧智2,陈武兵2,蔡志毅1, 2△
(1温州医科大学第一临床医学院,浙江 温州 325000;2台州市市立医院耳鼻咽喉头颈外科,浙江 台州 318000)
[摘要]目的: 探讨牛蒡子苷元(arctigenin,ARG)对人鼻咽癌CNE-1细胞凋亡的影响及其分子作用机制。方法: 经不同浓度的ARG处理CNE-1细胞后,采用CCK-8法检测ARG对CNE-1细胞活力的影响;caspase-3及caspase-9活性检测法检测CNE-1细胞caspase-3及caspase-9活性的变化;流式细胞术分析CNE-1细胞凋亡率的变化; real-time PCR法检测PI3K/AKT/XIAP信号通路相关分子mRNA表达水平的变化;Western blot法检测PI3K/AKT/XIAP通路蛋白水平的变化。结果: 随浓度和时间的增加,ARG可抑制鼻咽癌CNE-1细胞的活力(P<0.01);caspase-3及caspase-9活性的增加及细胞凋亡率的升高表明ARG可显著促进CNE-1细胞的凋亡;与对照组相比,PI3K/AKT/XIAP信号通路相关分子对mRNA表达均明显下调(P<0.01);ARG可明显下调PI3K/AKT/XIAP各蛋白水平(P<0.05)。结论: ARG可诱导鼻咽癌细胞凋亡,降低PI3K/AKT/XIAP相关分子水平可能是其促进细胞凋亡的机制。
[关键词]牛蒡子苷元; 细胞凋亡; 鼻咽癌
牛蒡子苷元(arctigenin,ARG)是从中国传统中药牛蒡子中提取出的木脂素类化合物[1],是牛蒡子重要的药理活性成分。近年来研究显示,ARG具有显著的抗炎[2]、调节免疫[3]、抗肿瘤[4]等作用。已有文献报道,ARG可以抑制大肠癌SW480细胞的增殖[5]和介导人白血病细胞的凋亡[6],并且能够显著增强肺癌H460细胞对顺铂等抗肿瘤药物的化学敏感性[7]。但是关于ARG对鼻咽癌的抗肿瘤效果仍未见文献报道,并且其具体的抗肿瘤分子机制也尚未阐明。本研究以鼻咽癌CNE-1细胞株为研究模型,检测ARG对CNE-1细胞凋亡的调控作用,并且对其分子机制进行初步探讨。
材料和方法
1材料
ARG购自Sigma;鼻咽癌细胞株CNE-1为高分化人鼻咽癌细胞株,购自中国科学院上海细胞库;RPMI-1640培养基、PBS缓冲液、胎牛血清和胰蛋白酶-EDTA消化液均购自Gibco;CCK-8试剂盒购自Dojindo;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自Thermo;caspase-3及caspase-9活性检测试剂盒购自碧云天生物技术研究所;TRIzol reagent、cDNA第一链合成试剂盒和Real Master Mix(SYBR Green)荧光定量PCR试剂盒购自Tiangen;兔抗人GAPDH、PI3K、AKT、p-AKT和XIAP单克隆 I 抗购自CST;ECL发光液购自Millipore;DMSO、辣根过氧化物酶标记的羊抗兔 II 抗购自北京索莱宝公司。
2主要方法
2.1细胞培养鼻咽癌CNE-1细胞接种于含10%胎牛血清的RPMI-1640培养液中,于37 ℃、5% CO2、95%湿度培养箱中孵育。细胞贴壁生长,平均2 d换液1次,按1∶3传代,取对数期生长的细胞进行实验。
2.2药物配制ARG溶于一定量DMSO,配制成浓度为1×105μmol/L的母液,避光,-20 ℃保存。实验前用RPMI-1640培养液稀释母液至所需药物浓度(10 μmol/L、20 μmol/L 、40 μmol/L和80 μmol/L ,DMSO终浓度均低于0.1%)。
2.3CCK-8法检测细胞活力的变化将CNE-1细胞按每孔3×103接种于96孔板中,并将96孔板在培养箱预培养24 h后换液。实验分3组:空白组(不含细胞)、对照组、实验组。空白组和对照组各加入含10%胎牛血清的RPMI-1640培养液100 μL;实验组每孔各加入含不同浓度的ARG的培养液(10 μmol/L、20 μmol/L、40 μmol/L和80 μmol/L)100 μL。置于培养箱中继续培养24 h、48 h和72 h后各孔分别加入10 μL CCK-8溶液,37 ℃孵育1~2 h后用酶标仪测定各孔在450 nm处的吸光度A值,观察细胞增殖抑制情况。各组设置3个复孔。细胞活力抑制率(%)=(对照组A-实验组A)/(对照组A-空白组A)×100%。
2.4流式细胞术检测细胞凋亡率将CNE-1细胞按每孔5×105接种于6孔板中,置于37 ℃、5% CO2培养箱中培养,待细胞贴壁生长后换液。实验分为对照组和实验组。对照组加未做处理的培养液,实验组加入含不同浓度的ARG培养液(10 μmol/L和20 μmol/L),培养24 h。按照Annexin V-FITC/PI试剂盒说明收集细胞,用PBS洗涤2次,离心去上清,加入200 μL 1×binding buffer悬浮细胞,在细胞悬液中加入5 μL Annexin V-FITC,轻轻混匀后于2~8 ℃避光条件下孵育15 min,再加入5 μL PI,混匀,室温避光5 min,然后上流式细胞仪检测,分析细胞凋亡率。
2.5Caspase-3及caspase-9活性的检测将CNE-1细胞按每孔4×105接种于6孔板中,细胞培养及处理同流式实验所述。培养24 h后收集细胞,PBS洗涤1次, 4 ℃、600×g离心5 min,弃上清,加入适量裂解液(每2×106个细胞加入100 μL裂解液),混匀,冰浴裂解15 min。4 ℃、20 000×g离心15 min后转移上清至预冷的1.5 mL离心管中,按照caspase-3及caspase-9活性检测试剂盒说明书顺序加入检测试剂进行活性检测。实验重复3次。37 ℃孵育2 h后酶标仪测定各个样本在405 nm的A值,观察caspase-3及caspase-9活性变化情况。
2.6Real-time PCR法检测mRNA的表达将CNE-1细胞以每孔4×105接种于6孔板,加药孵育24 h后收集细胞加1 mL TRIzol提细胞总RNA,紫外分光光度法测RNA纯度。按cDNA第一链合成试剂盒说明将RNA逆转录合成cDNA后,按SYBR Green荧光染料试剂盒说明进行PCR反应。反应以GAPDH为内参照。GAPDH的上游引物序列为5’-CAT CAG CAA TGC CTC CTG CAC-3’,下游引物序列为为5’-TGA GTC CTT CCA CGA TAC CAA AGT T-3’;PI3K的上游引物序列为5’-CTG TGT GGG ACT TAT TGA GGT GGT-3’,下游引物序列为5’-ACT GAT GTA GTG TGT GGC TGT TGA-3’;AKT的上游引物序列为5’-TGT GAA GGA GGG TTG GCT GC-3’,下游引物序列为5’-ACT GCG CCA CAG AGA AGT TGT T-3’;XIAP的上游引物序列为5’-TGT TTC AGC ATC AAC ACT GGC ACG-3’,下游引物序列为5’-GCA TGA CAA CTA AAG CAC CGG AC-3’。各组设置3个复孔。记录各孔Ct值,并采用2-ΔΔCt法对结果进行分析。
2.7Western blot法检测蛋白表达将CNE-1细胞以每孔2×105接种于6孔板,加药孵育48 h后每孔用预冷的PBS漂洗2次,加入胰蛋白酶消化收集细胞并离心,弃上清,加入适量细胞裂解液,重悬沉淀,冰浴裂解30 min后,4 ℃、15 000×g离心15 min,取上清液,Bradford法测蛋白质浓度。各个样本蛋白加入1×SDS上样缓冲液100 ℃变性10 min后,等量上样,采用SDS-PAGE法将蛋白通过电泳及转膜后移至PVDF膜。然后将膜置于5%脱脂奶粉中封闭1 h,加 I 抗4 ℃孵育过夜,加入TBST摇床充分洗膜,加 II 抗室温孵育1 h,TBST再次洗膜后加ECL发光液显影曝光。 I 抗稀释比例均为1∶1 000,II 抗稀释比例为1∶10 000。每个样本重复3次实验,分析灰度值,计算各组与内参照GAPDH灰度的相对比值。
3统计学处理
数据经SPSS 19.0软件进行统计学分析,数据以均数±标准差(mean±SD)表示,多样本均数之间比较采用单因素方差分析,组间采用SNK-q检验法进行两两比较,以P<0.05为差异有统计学意义。
结果
1ARG对CNE-1细胞活力的影响
CCK-8实验结果显示经ARG处理CNE-1细胞后,ARG(10 μmol/L)即可抑制细胞活力,ARG(80 μmol/L)的细胞抑制率显著增加;且各浓度ARG处理CNE-1细胞的抑制率与作用时间呈正相关,经ARG处理24 h的IC50为23.51 μmol/L,见图1。
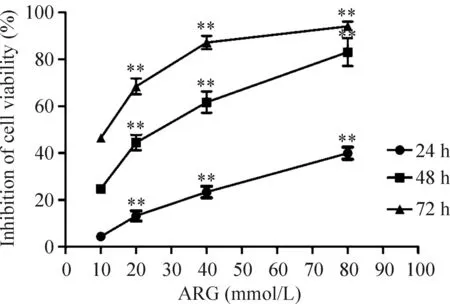
Figure 1.Arctigenin inhibited the viability of the CNE-1 cells. Mean±SD.n=3.**P<0.01vs10 μmol/L.
图1牛蒡子苷元对鼻咽癌CNE-1细胞活性的抑制
2ARG对CNE-1细胞凋亡率的影响
如图2所示, CNE-1细胞经0、10和20 μmol/L浓度的ARG处理后,凋亡率分别为1.46%、15.4%和25.7%,实验组的细胞凋亡率分别与对照组相比差异均有统计学意义(P<0.05)。
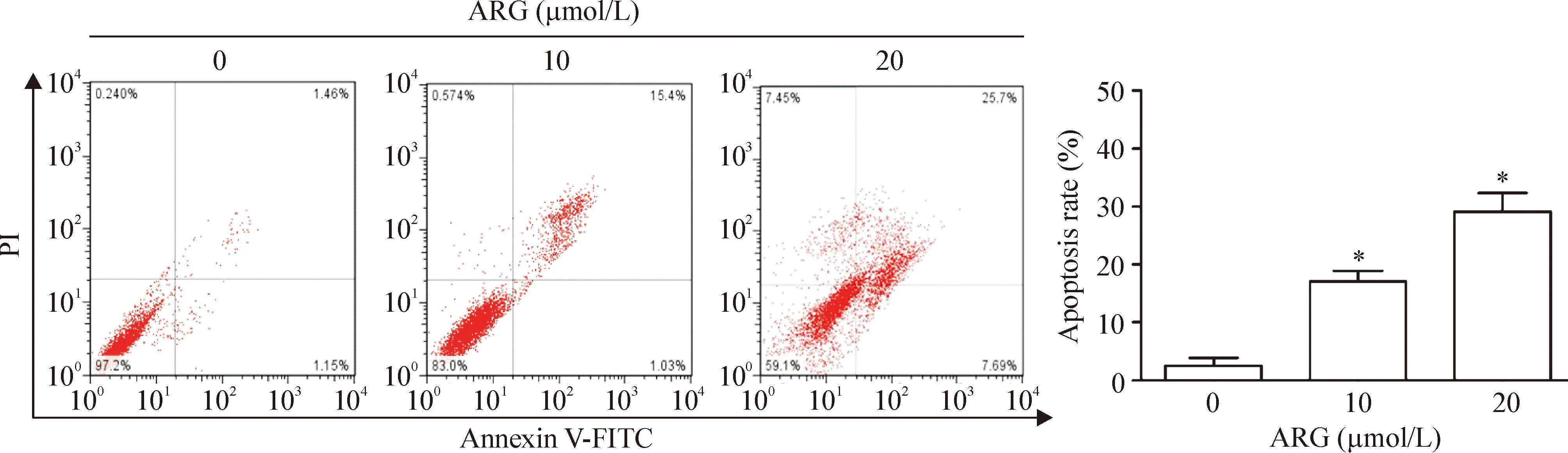
Figure 2.The apoptosis of the CNE-1 cells after treated with ARG. Mean±SD.n=3.*P<0.05vs0 μmol/L.
图2经不同浓度牛蒡子苷元处理后CNE-1细胞的凋亡率
3ARG对CNE-1细胞caspase-3及caspase-9活性的影响
应用caspase-3及caspase-9活性试剂盒检测经ARG处理的CNE-1细胞,将对照组活性值设为1,经10 μmol/L和20 μmol/L ARG处理24 h后caspase-3活性分别为1.59±0.08和5.31±0.34,caspase-9活性分别为1.34±0.11和3.55±0.27,提示ARG可上调caspase-3及caspase-9的活性,且与对照组比较差异有统计学意义(P<0.05),见图3。
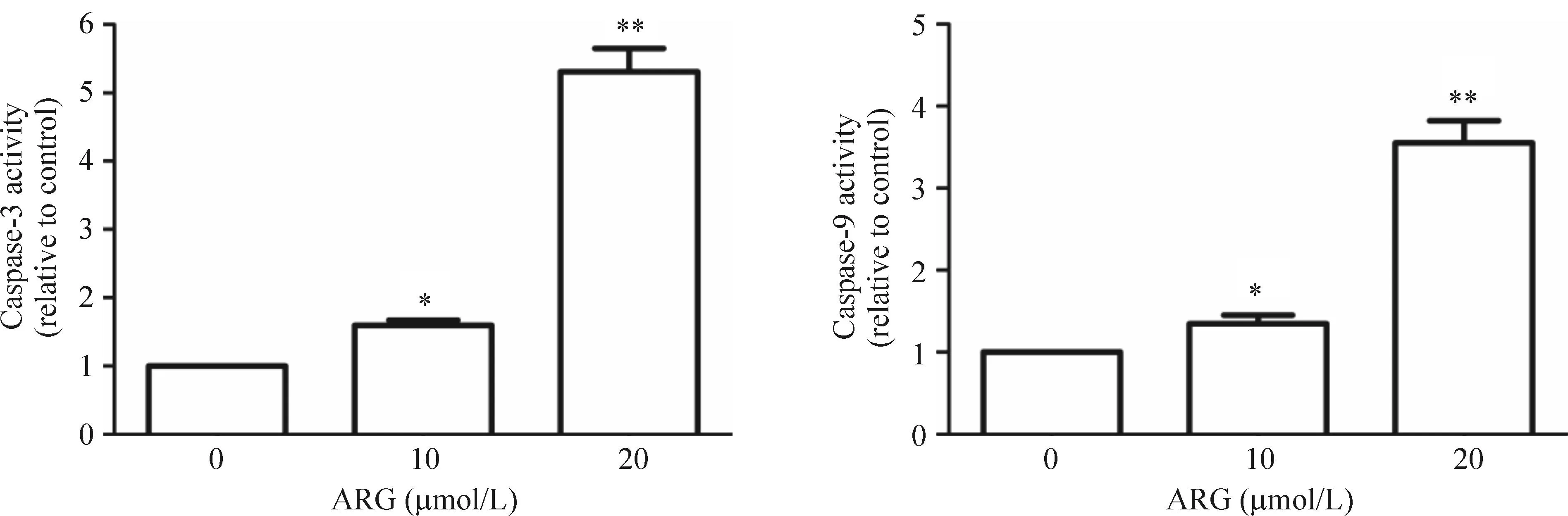
Figure 3.The effects of ARG on the activity of caspase-3 and -9 in the CNE-1 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图3牛蒡子苷元对CNE-1细胞caspase-3及caspase-9活性的影响
4ARG对PI3K/AKT/XIAP信号通路mRNA表达的影响
Real-time PCR结果显示,以对照组结果作为参照标准,运用2-ΔΔCt法计算得出10 μmol/L ARG组PI3K、AKT及XIAP 对mRNA相对表达量分别为0.78±0.02、0.90±0.03和0.79±0.03;20 μmol/L ARG组分别为0.60±0.02、0.72±0.01和0.55±0.04。说明ARG可下调PI3K/AKT/XIAP信号通路mRNA的表达,见图4。
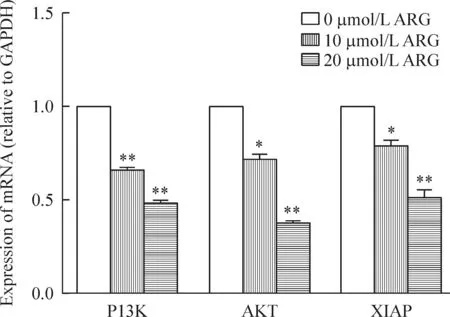
Figure 4.The effects of ARG on the mRNA expression of PI3K/AKT/XIAP pathway-related molecules in the CNE-1 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图4牛蒡子苷元对CNE-1细胞PI3K/AKT/XIAP 通路分子mRNA表达的影响
5ARG对PI3K/AKT/XIAP信号通路蛋白表达的影响
以GAPDH为内参照,计算各个蛋白与GAPDH灰度的相对比值,设置对照组各成员蛋白表达量为1,10 μmol/L ARG组PI3K、AKT、p-AKT和XIAP蛋白水平分别为0.85±0.04、0.81±0.01、0.45±0.02及0.78±0.03;20 μmol/L ARG组各成员的蛋白水平分别为0.38±0.02、0.66±0.01、0.19±0.02及0.23±0.02。如图5所示,10 μmol/L和20 μmol/L ARG处理CNE-1细胞后PI3K/AKT/XIAP信号通路蛋白表达量相对于对照组均出现明显下降,差异有统计学意义(P<0.05)。
讨论
鼻咽癌是我国广东、广西、福建和浙江等南方地区常见的一种恶性肿瘤,发病率占当地头颈外科肿瘤的首位。目前鼻咽癌的治疗多采取以放疗及化疗为主的综合疗法,但放射抗拒和化疗耐药及其副作用是治疗失败的重要原因[8]。而传统中药具有可以增加化疗疗效,降低放疗化疗毒副作用,延长生存时间,提高生活质量和增加免疫力的效果。因此许多国内外学者试图寻找天然药物或其活性成分用于鼻咽癌治疗,已有文献报道姜黄素衍生物T83可促进同源不同辐射抗性鼻咽癌细胞的凋亡,并且有学者也发现汉防己甲素可对人鼻咽癌细胞株的放射起增敏作用[9-10]。
牛蒡子是我国传统中药,其味苦、性寒,具有消炎、降糖、消肿等功效[11]。牛蒡子苷元是牛蒡子重要的木脂素提取物,现代药理学表明其具有一定的抗肿瘤作用。其发挥作用主要是通过阻滞细胞周期、抑制肿瘤血管生成及介导瘤细胞凋亡从而抑制肿瘤细胞生长[12-14]。但是关于ARG对鼻咽癌细胞的基础研究报道尚少。本实验通过CCK-8实验发现ARG可显著抑制鼻咽癌CNE-1的细胞活力,并且ARG对细胞的抑制作用随着药物浓度和作用时间的增加而提升,表明ARG对CEN-1细胞的抑制作用呈浓度和时间依赖性。进一步通过caspase-3和caspase-9活性检测发现ARG可上调caspase-3及caspase-9的活性,说明ARG可能是通过上调caspase-3及caspase-9的活性从而参与诱导细胞凋亡。
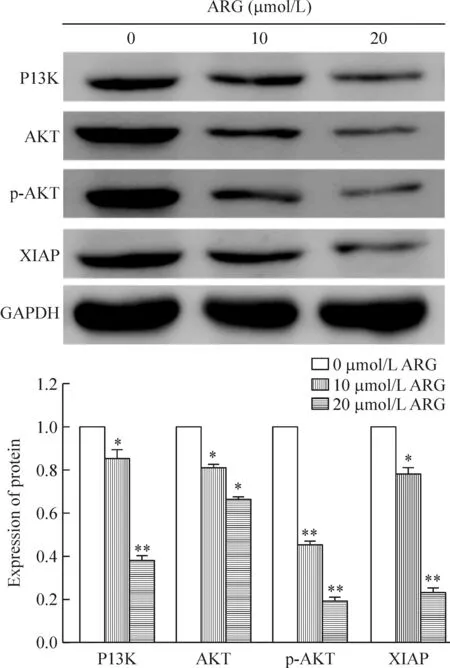
Figure 5.The effects of ARG on the protein levels of PI3K/AKT/XIAP pathway-related molecules in the CNE-1 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图5牛蒡子苷元对CNE-1细胞PI3K/AKT/XIAP 通路分子蛋白水平的影响
细胞凋亡是细胞主动性死亡的过程,涉及多种凋亡相关因子的相互作用。Caspase-3及caspase-9属于细胞凋亡内源性途径中caspase家族的重要成员,caspase-9活化后激活caspase-3,caspase-3是细胞凋亡过程中最主要的终末剪切酶,直接参与启动细胞凋亡[15]。而XIAP是属于凋亡抑制蛋白家族的主要成员,是IAP家族中最强的凋亡抑制因子,它可直接抑制caspases调节细胞凋亡。其机制主要可能是通过与caspase-3及caspase-9结合后保留caspase-3与caspase-9作用区域之间的突变位点,提高了caspase-3与caspase-9的位点突变率,当发生结合位点突变时则可发挥抑制细胞凋亡的作用[16]。Real-time PCR结果表明经ARG处理CNE-1细胞后,PI3K/AKT/XIAP信号通路mRNA表达降低。进一步在蛋白水平运用Western blot法检测得出,经ARG作用后 PI3K/AKT/XIAP蛋白表达下调。这表明ARG可能是通过下调XIAP的表达,激活caspaes-3和caspase-9,从而可降低XIAP对caspaes-3和caspase-9的拮抗作用,因此促进二者的活化,直接参与诱导细胞凋亡。
综上所述,本研究证实ARG可诱导鼻咽癌CNE-1细胞凋亡,其作用机制可能与下调PI3K/AKT/XIAP信号通路有关。本研究通过体外实验证实了ARG诱导鼻咽癌细胞的凋亡作用,仍需进行体内实验为进一步探讨ARG的抗肿瘤作用。本研究可为ARG用于鼻咽癌的治疗提供实验依据,为ARG应用于临床奠定实验基础。
[参考文献]
[1]Wang HY, Yang JS. Studies on the chemical constituents ofArcticumlappaL.[J]. Acta Pharm Sin, 1993, 28(12):911-917.
[2]Tsai WJ, Chang CT, Wang GJ, et al. Arctigenin fromArctiumlappainhibits interleukin-2 and interferon gene expression in primary human T lymphocytes[J]. Chin Med, 2011, 6(1):12-15.
[3]Tang X, Zhang J, Chen J, et al. Arctigenin efficiently enhanced sedentary mice treadmill endurance[J]. PLoS One, 2011, 6(8):224-227.
[4]Awale S, Lu J, Kalauni SK, et al. Identification of arctigenin as an antitumor agent having the ability to eliminate the tolerance of cancer cells to nutrient starvation[J]. Cancer Res, 2006, 66(3):1751-1757.
[5]Kang K, Lee HJ, Yoo JH, et al. Cell and nuclear enlargement of SW480 cells induced by a plant lignan, arctigenin: evaluation of cellular DNA content using fluorescence microscopy and flow cytometry[J]. DNA Cell Biol, 2011, 30(8):623-629.
[6]Wang L, Zhao F, Liu K. Induction of apoptosis of the human leukemia cells by arctigenin and its mechanism of action[J]. Acta Pharm Sin, 2008, 43(5): 542-547.
[7]Wang HQ, Jin JJ, Wang J. Arctigenin enhances chemosensitivity to cisplatin in human non-small lung cancer H460 cells through down-regulation of survivin expression[J]. J Biochem Mol Toxicol, 2014, 28(1):39-45.
[8]黄光武,邝国乾. 实用鼻咽癌临床诊疗学[M]. 北京:科学出版社, 2006: 150-156.
[9]王梦瑶,王苏美,左应林,等. 姜黄素衍生素T83对同源不同辐射抗性鼻咽癌细胞凋亡的作用[J]. 中国病理生理杂志, 2013, 29(4):654-659.
[10]吴喜福,张革化,黎景佳,等. 汉防己甲素对人鼻咽癌细胞株的放射增敏作用及其机制[J]. 中国病理生理杂志, 2012, 28(12):2187-2191.
[11]中华人民共和国卫生部药典委员会. 中华人民共和国药典2005年版[M]. 北京:化学工业出版社, 2005: 48-49.
[12]Susanti S, Iwasaki H, Inafuku M, et al. Mechanism of arctigenin-mediated specific cytotoxicity against human lung adenocarcinoma cell lines[J]. Phytomedicine, 2013, 21(1):39-46.
[13]Gu Y, Scheuer C, Feng D, et al. Inhibition of angiogenesis: a novel antitumor mechanism of the herbal compound arctigenin[J]. Anticancer Drugs, 2013, 24(8):781-791.
[14]Yang S, Ma J, Xiao J, et al. Arctigenin anti-tumor activity in bladder cancer T24 cell line through induction of cell-cycle arrest and apoptosis[J]. Anat Rec (Hoboken), 2012, 295(8):1260-1266.
[15]Ghavami S, Hashemi M, Ande SR, et al. Apoptosis and cancer: mutations within caspase genes[J]. J Med Genet, 2009, 46(8):497-510.
[16]Silke J, Hawkins CJ, Ekert PG, et al. The anti-apoptotic activity of XIAP is retained upon mutation of both the caspase 3 and caspase 9 interacting sites[J]. J Cell Biol, 2002, 157(1):115-124.
(责任编辑: 陈妙玲, 罗森)
Effect of arctigenin on apoptosis of human nasopharyngeal carcinoma cell line CNE-1
HUANG Dong-dong1, MENG Yi-yu1, SUN Dong-xun1, JIN Qiao-zhi2, CHEN Wu-bing2, CAI Zhi-yi1, 2
(1TheFirstClinicalMedicalInstitute,WenzhouMedicalUniversity,Wenzhou325000,China;2DepartmentofOtolaryngology,TaizhouMunicipalHospital,Taizhou318000,China.E-mail:caizy008@tom.com)
[ABSTRACT]AIM: To investigate the effect of arctigenin on the apoptosis of human nasopharyngeal carcinoma cell line CNE-1 and its potential mechanism. METHODS: The inhibition of cell viability was analyzed by CCK-8 assay. The activity of caspase-3 and caspase-9 was analyzed by caspase-3 and caspase-9 activity kit. Apoptotic cell percentage was evaluated by Annexin V-PI staining. The expression of PI3K/AKT/XIAP signal pathway-related molecules at mRNA and protein levels was analyzed by real-time PCR and Western blot. RESULTS: Arctigenin inhibited the cell activity in a dose- and time-dependent manner after treatment with arctigenin at concentrations of 10, 20, 40 and 80 μmol/L for 24 h, 48 h and 72 h (P<0.01). Arctigenin also increased the activity of caspase-3 and caspase-9 and the apoptotic rate (P<0.05), and down-regulated the mRNA and protein expression of PI3K/AKT/XIAP signal pathway-related molecules (P<0.05).CONCLUSION: Arctigenin induces the apoptosis of CNE-1 cells through PI3K/AKT/XIAP signal pathway.
[KEY WORDS]Arctigenin; Apoptosis; Nasopharyngeal carcinoma
[文章编号]1000- 4718(2016)01- 0101- 05
[收稿日期]2015- 06- 17[修回日期] 2015- 09- 28
*[基金项目]浙江省中医药科学研究基金项目(No. 2015ZB132)
通讯作者△Tel: 0576-88858023; E-mail: caizy008@tom.com
[中图分类号]R965; R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.017

