Mfn2在环孢素A诱导HeLa细胞生长停滞中的作用*
朱 敏, 张 雯, 鲍旭霞, 李文伟△
(复旦大学 1附属中山医院中西医结合实验室, 2附属眼耳鼻喉科医院实验研究中心,上海 200032)
Mfn2在环孢素A诱导HeLa细胞生长停滞中的作用*
朱敏1, 2,张雯1,鲍旭霞1,李文伟1△
(复旦大学1附属中山医院中西医结合实验室,2附属眼耳鼻喉科医院实验研究中心,上海 200032)
[摘要]目的: 探讨环孢素A (TSA) 对HeLa细胞中线粒体融合蛋白 2(Mfn2)表达水平极其下游通路的影响。方法: 运用不同浓度的TSA处理HeLa细胞,分别检测细胞增殖、细胞凋亡以及细胞的周期改变;Western blot检测Ras、p-Raf、Raf、p-ERK、ERK、p-Akt、Akt和Mfn2的蛋白水平;real-time PCR检测Mfn2 mRNA的表达水平;用免疫共沉淀法检测Mfn2与Ras结合的水平。将HeLa细胞过表达Mfn2后,观察上述指标的改变。结果: TSA对HeLa的抑制作用呈剂量依赖和时间依赖的特点。HeLa细胞经TSA处理后,Mfn2的mRNA和蛋白表达水平均显著增高,Mfn2与Ras的结合升高,Raf和ERK的磷酸化水平降低。过表达Mfn2抑制了Ras-Raf-ERK通路并诱导了HeLa细胞的生长阻滞,但对细胞的凋亡水平影响较小。结论: Mfn2参与了TSA诱导的HeLa细胞生长阻滞,其效应可能是通过抑制Ras-Raf-ERK通路实现的。
[关键词]环孢素A; Mfn2; HeLa细胞; 细胞增殖; Ras-Raf-ERK通路
宫颈癌是导致女性死亡的重要杀手,严重影响女性的生命健康。近年来多项研究表明,在宫颈癌的发生发展过程中,往往会出现组蛋白去乙酰化酶(histone deacetylase,HDAC)的表达增高,进而导致与抑肿瘤基因增强子结合的组蛋白乙酰化水平降低而促进肿瘤的进展[1-2]。环孢素A(trichostatin A,TSA)是一种HDAC抑制剂,越来越多的证据显示,TSA的确具有抑制宫颈癌细胞增殖的作用[3-4]。但是,TSA是一种广谱抑制剂,会影响很多分子的表达,因此,它具体通过哪些关键的分子途径而起作用仍不清楚,影响了TSA的进一步开发。我们最近的研究发现,在神经毒剂MPP+损伤的SH-SY5Y细胞中,低剂量的TSA(0.1 nmol/L)可以升高其线粒体融合蛋白2(mitofusin 2,Mfn2)的表达水平并起到保护作用,而对未损伤细胞中的Mfn2没有影响[5]。抑制肿瘤增殖一般采用高剂量的TSA,高剂量的TSA是否也是通过影响了Mfn2的表达水平而起作用尚不清楚。特别是Mfn2在恶性肿瘤的发生发展中是促进作用还是抑制作用仍然存在争议。为此,本文观察TSA对宫颈癌细胞系HeLa细胞中Mfn2表达水平及其下游通路的影响,为揭示TSA治疗宫颈癌的分子机制提供新的证据。
材料和方法
1试剂
TSA、小鼠抗人β-actin抗体(Sigma);PI/RNase染色液(BD), 线粒体定位蛋白-RFP试剂盒(Molecular Probes);BrdU ELISA试剂盒 (上海麦约尔公司);兔抗人Ras、p-Raf、Raf、p-ERK、ERK、p-Akt和Akt抗体(CST);小鼠抗人Mfn2抗体(Abcam);TRIzol试剂(Invitrogen);PrimeScript RT逆转录试剂盒和SYBR Premix Ex Taq试剂盒(TaKaRa)。
2细胞培养与处理
HeLa细胞购自美国标准生物品收藏中心(American Type Culture Collection,ATCC),用含有10%胎牛血清的DMEM培养液进行培养。传代过夜后进行转染或给药,给药前更换培养液为不含血清的DMEM培养液。
3主要方法
3.1细胞活力的测定将CCK-8直接加入HeLa细胞培养液中,37 ℃培养1 h后,经酶标仪检测450 nm的吸光度以反映细胞活力的变化。每组样品准备3个复孔,每次实验重复3次。
3.2细胞凋亡的测定收集HeLa细胞,通过Annexin V-FITC细胞凋亡检测试剂盒染色,用流式细胞术检测细胞凋亡的变化。
3.3细胞增殖的测定通过BrdU ELISA试剂盒染色细胞后,经酶标仪检测370 nm的吸光度以反映细胞增殖的变化。每组样品准备3个复孔,每次实验重复3次。
3.4细胞周期的检测收集HeLa细胞,用PBS缓冲液重悬,经75%乙醇固定细胞后,用PBS缓冲液清洗2遍。加入500 μL的PI/RNase染色液室温避光染色30 min。用流式细胞术检测细胞DNA含量的变化。
3.5线粒体形态的观察用线粒体定位蛋白-RFP试剂盒转染HeLa细胞,24 h后通过激光共聚焦显微镜观察细胞线粒体形态的变化。
3.6Western blot实验 收集HeLa细胞并裂解细胞,收集蛋白通过Western blot分析。使用的 I 抗如下:兔抗人Ras、p-Raf、Raf、p-ERK、ERK、p-Akt和Akt(稀释比例均为1∶1 000),小鼠抗人Mfn2(1∶1 000),β-actin(1∶5 000)。
3.7RNA提取和real-time PCR实验采用TRIzol试剂提取HeLa细胞的总RNA。用PrimeScript RT试剂盒将总RNA逆转录得到cDNA,再用SYBR Premix Ex Taq试剂盒进行PCR扩增。Mfn2的上游引物为5’-CTCTCGATGCAACTCTATCGTC-3’, 下游引物为5’-CTTGGCAGTGACAAAGTGCTT-3’; GAPDH的上游引物为5’-CCACTCCTCCACCTTTGAC-3’, 下游引物为5’-ACCCTGTTGCTGTAGCCA-3’。PCR反应条件为:95 ℃ 30 s; 58 ℃ 30 s,72 ℃ 30 s,共35个循环。每组样品准备3个复孔,得到的数据采用2-ΔΔCt进行计算,每次实验重复4次。
3.8蛋白免疫共沉淀收集HeLa细胞后通过RIPA裂解液冰上裂解,12 000×g离心20 min后取上清,加入小鼠抗人Mfn2的I 抗4 ℃孵育过夜,再加入protein A/G琼脂糖珠孵育2 h。经免疫共沉淀得到的蛋白再通过Western blot分析,检测Ras蛋白水平。
3.9瞬时转染首先通过分子克隆技术将人Mfn2全长cDNA装入pCMV6-AC-IRES-GFP表达质粒中,然后用FuGENE HD转染试剂瞬时转染HeLa细胞,6 h后更换为正常细胞培养液。
4统计学处理
实验数据以均数±标准误(mean±SEM)表示,用GraphPad Prism统计软件进行分析:先单因素或双因素方差分析再通过Bonferroni法进行两两比较,或非配对双尾t检验的方法进行比较,以P<0.05为差异有统计学意义。
结果
1TSA对 HeLa细胞增殖及其凋亡的影响
我们分别用0.2、0.4、0.8 μmol/L的TSA处理 HeLa细胞1~4 d后,用CCK-8染色的方法测定细胞的活力。结果显示,TSA对HeLa细胞活力的抑制作用随着TSA作用剂量的加大和作用时间的延长逐渐增强,呈剂量依赖和时间依赖的特点。最初2 d各剂量组间的差异不显著;自第3天观察时点开始,各剂量组间的差异有统计学意义(P<0.05),见图1。
我们进一步运用了流式细胞术检测了TSA对HeLa细胞凋亡的影响。结果显示, 随着TSA作用的剂量增加和时间延长,HeLa细胞的凋亡率逐渐上升, 经0.4和0.8 μmol/L TSA进一步处理3 d后,2组的凋亡率与对照组相比有显著差异(P<0.05); 经TSA处理4 d后,各处理组的凋亡率与对照组相比差异均有统计学意义(P<0.05)。此外,ELISA BrdU试剂盒检测TSA对HeLa细胞增殖的影响发现,细胞经0.4和0.8 μmol/L TSA处理3 d后,HeLa细胞增殖被有效抑制(P<0.05)。我们还运用流式细胞术分析了TSA对HeLa细胞周期相分布情况的影响,结果显示,细胞经0.4和0.8 μmol/L TSA处理3 d后,G2/M 相细胞的数量显著增加(P<0.05),而相应的G1和S相的数量显著减少(P<0.05),该结果更加证实了TSA对HeLa细胞增殖的抑制作用,见图1。

Figure 1.TSA reduces the viability of HeLa cells by inducing cell apoptosis and inhibiting cell proliferation. HeLa cells were treated with TSA and the cell viability was measured at 1, 2, 3 and 4 d of treatment. Meanwhile, cell apoptosis was analyzed by flow cytometry. TSA treatment reduced cell viability (A) and initiated apoptosis (B) both in a dose- and time-dependent manner. Cell proliferation was assayed using an ELISA BrdU kit at 3 d of TSA exposure, and meanwhile cell cycle phase distribution was detected by flow cytometry. TSA at 0.4 and 0.8 μmol/L resulted in a remarkable decrease in cell proliferation (C) and a significant increase in the number of cells at the G2/M phase (D). Mean±SEM.n=3.*P<0.05vscontrol.
图1TSA对HeLa细胞活力和增殖的影响
2TSA对HeLa细胞Mfn2表达的影响
0.4 μmol/L的TSA处理HeLa细胞3 d后收集细胞检测Mfn2蛋白及mRNA水平。结果显示,与对照组相比,HeLa细胞经TSA处理后,其Mfn2的蛋白水平及 mRNA表达水平均显著增高(P<0.05),见图2。
由于Mfn2是一种线粒体融合蛋白,于是,我们进一步观察TSA诱导的Mfn2表达上调是否伴随有线粒体形态的改变。先用线粒体靶向RFP 试剂盒转染HeLa细胞24 h,然后用不同剂量的TSA(0.2、0.4、0.8 μmol/L)处理细胞3 d,激光共聚焦图片显示与对照组细胞相比,经过TSA处理的HeLa细胞中的线粒体明显增长,见图2。

Figure 2.TSA caused mitochondrial elongation and promoted Mfn2 expression in the HeLa cells. HeLa cells were treated with TSA at doses of 0.2, 0.4 and 0.8 μmol/L for 3 d. A: representative images show that TSA induced mitochondrial elongation in the HeLa cells in a dose-dependent manner; B: representative immuno-blotting images and semi-quantitative analysis show that Mfn2 protein in the HeLa cells was remarkably elevated after exposed to 0.4 μmol/L TSA for 3 d; C: real-time PCR analysis demonstrate that Mfn2 mRNA level in the HeLa cells was magnificently increased after treatment with 0.4 μmol/L TSA for 3 d. Mean±SEM.n=4.*P<0.05vscontrol.
图2TSA对Mfn2表达和线粒体形态的影响
3TSA促进HeLa细胞中Mfn2与Ras的相互结合并抑制Ras-Raf-ERK通路
为研究Mfn2增高后的下游分子通路,我们观察了TSA 对Mfn2与Ras相互结合的影响。结果显示HeLa细胞经0.4 μmol/L的TSA处理3 d后,以Mfn2单克隆抗体沉淀细胞裂解液中的特定蛋白供co-IP分析,免疫沉淀复合物分离后用Western blot分析。结果显示, 在通常状态下,HeLa细胞中Mfn2与Ras存在少量结合,但细胞经TSA 处理后,与Mfn2结合的Ras显著升高(P<0.05);Ras-Raf-ERK通路的下游分子Raf和ERK的磷酸化水平则显著降低(P<0.05),见图3。
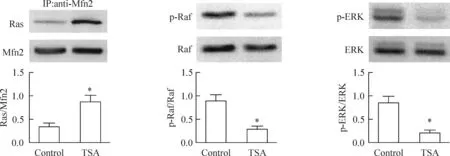
Figure 3.TSA(0.4 μmol/L) increased Mfn2 interaction with Ras and inhibited Ras-Raf-ERK pathway in the HeLa cells. Mean±SEM.n=4.*P<0.05vscontrol.
图3TSA对Mfn2与Ras 结合和Ras-Raf-ERK通路的影响
4Mfn2过表达抑制HeLa细胞的增殖
为了进一步分析Mfn2在TSA介导的生长阻滞和凋亡中可能的作用与地位,我们在HeLa细胞中转染了含人Mfn2 cDNA和IRES-GFP的质粒,转染3 d后收集细胞供Western blot分析;结果显示,与转染了空载体(vector)的细胞相比,过表达Mfn2组细胞的Mfn2蛋白表达显著升高。同时,我们观察了Mfn2过表达后线粒体的形态改变, HeLa细胞过表Mfn2蛋白3 d后,与转染了空载体的对照组细胞相比其线粒体的长度显著增长,这提示细胞Mfn2蛋白过表达的技术是成熟稳定的,并且过表达的蛋白质具有活性。接着我们观察了过表达Mfn2对HeLa细胞活力和凋亡的影响,结果显示Mfn2过表达第3天的HeLa细胞活力显著降低,第4天这种差别更加明显(P<0.05),但是,Mfn2过表达第3天 的HeLa细胞凋亡水平则无明显变化,延长观察1 d出现了少量的细胞凋亡(P< 0.05)。
我们采用ELISA BrdU试剂盒检测Mfn2过表达对HeLa细胞增殖的影响,并运用流式细胞术分析了Mfn2过表达对细胞周期时相的影响,结果发现细胞过表达Mfn2蛋白3 d后,HeLa细胞增殖明显受抑制,同时处于G2/M 相的细胞数量显著增加,而同时G1和S相的细胞则显著减少,见图4。
5Mfn2过表达促进Mfn2与Ras的结合并抑制Ras-Raf-ERK通路
为了揭示过表达Mfn2对HeLa 细胞中Ras-Raf-ERK通路的影响,我们运用免疫共沉淀的方法分析了过表达Mfn2蛋白3 d后,HeLa细胞中Mfn2与Ras相互结合的情况,同时,还检测了Raf和ERK的磷酸化水平,结果显示,与对照组相比,Mfn2过表达细胞中与Mfn2结合的Ras水平明显增高,而同时Raf和ERK的磷酸化水平则显著降低,见图5。
讨论
组蛋白乙酰化是启动转录的重要步骤,组蛋白的乙酰化水平是受2个作用相反的酶调节的:组蛋白乙酰转移酶和HDAC,HDAC通过与基因的增强子结合从而抑制该基因的转录。研究表明,很多的癌症患者存在该酶量的增加和活性的增强[6-7],导致抑癌基因的表达下调进而引发恶性肿瘤的发生和进展[2, 8-9];因此,HDAC抑制剂被认为是一种具有潜在前景的抗癌药物,但大多数的药物具有严重毒性。TSA是一种广泛运用的HDAC抑制剂,毒性相对较小,继往的研究显示,该药可以显著导致恶性肿瘤生长阻滞和癌细胞坏死[3, 10-11]。本研究中,我们观察到TSA可以显著抑制宫颈癌HeLa细胞的增殖,同时促进该细胞的凋亡。进一步,我们发现HeLa细胞经过TSA处理后,处于G2/M 相的细胞数量显著增加,而G1和S相的数量则显著减少;提示TSA对HeLa细胞增殖的抑制可能是由于诱发了细胞的生长阻滞于G2/M 相引起的。
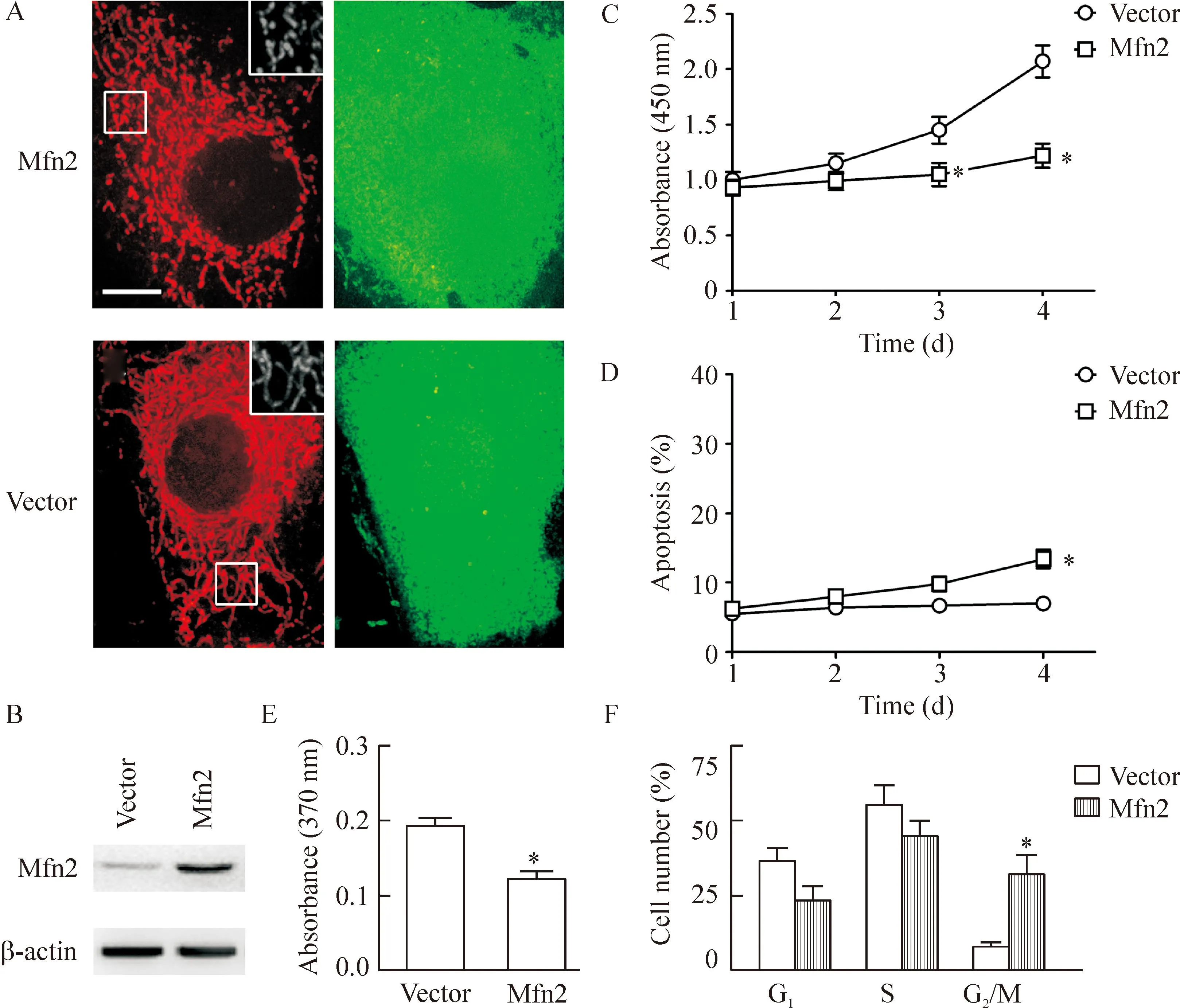
Figure 4.Mfn2 overexpression reduced cell viability mainly through inhibiting cell proliferation in the HeLa cells. Mitochondrial morphology was observed after Mfn2 transfection for 3 d, representative images (A) show that mitochondria were magnificently elongated in the cells overexpressed with Mfn2; representative immunoblotting images (B) show that Mfn2 level was remarkably elevated in the cells overexpressed with Mfn2; Mfn2 overexpression reduced cell viability remarkably since 3 d of transfection (C), whereas only a small amount of apoptotic cells was detected after transfection for 4 d (D); Mfn2 overexpression resulted in a robust decrease in cell proliferation (E) and a significant increase in the number of cells in the G2/M phase (F). Mean±SEM.n=4.*P<0.05vsvector.
图4Mfn2过表达对HeLa细胞活力的影响
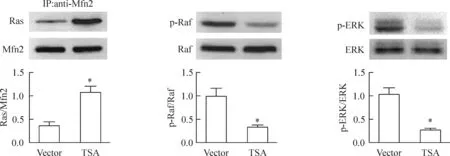
Figure 5.Mfn2 overexpression remarkably increased the interaction of Mfn2 with Ras and inhibited Ras-Raf-ERK pathway in the HeLa cells. Mean±SEM.n=4.*P<0.05vsvector.
图5Mfn2过表达对Ras-Raf-ERK通路的影响
TSA是一种广谱的HDAC抑制剂,有很多基因的表达会受到该抑制剂的影响,但具体为哪种基因的表达产物会对肿瘤细胞的生物学性状产生关键影响尚未阐释清楚。我们此前的研究发现,低剂量的TSA可以升高SH-SY5Y细胞损伤模型中Mfn2的表达,并对细胞起到保护作用,但对未损伤细胞中的Mfn2则没有影响[5],Mfn2是否在TSA介导的HeLa细胞生长阻滞中也起到重要作用值得关注。我们的结果显示,大剂量的TSA(0.4 μmol/L)可以显著促进Mfn2的表达,并且伴随有线粒体的延长;进一步的实验表明处理后的细胞中Mfn2 的mRNA表达水平也显著升高,提示大剂量的TSA可以在转录或转录前水平影响Mfn2的表达。众所周知,Mfn2是一种线粒体融合蛋白,而过去的研究表明线粒体的融合受损会导致癌细胞的凋亡减少而增殖增加[12-13];那么相应的Mfn2表达的增高可能导致癌细胞的凋亡减少和增殖增加。但另外的研究却表明,Mfn2除了参与线粒体融合外,可以与Ras结合并阻滞Ras-Raf-ERK通路的激活从而对细胞的增殖产生抑制效应[14-18]。我们的结果显示,过表达Mfn2 的确导致了HeLa细胞线粒体的延长,但过表达4 d后细胞的凋亡水平仅有少量增加;而细胞的增殖则受到显著抑制;在过表达Mfn2的细胞中,该蛋白与Ras的结合显著增加,而Raf和ERK的磷酸化水平则降低,提示细胞的增殖下降可能是由于Ras-Raf-ERK通路受到抑制导致的。给予高剂量的TSA处理后,在Mfn2表达增高的同时,也会出现Mfn2与Ras结合的增加,并且Raf和ERK的活化受到抑制。上述现象显示Mfn2在TSA诱导的HeLa细胞生长阻滞中具有重要地位,其效应可能是通过抑制了Ras-Raf-ERK通路实现的。需要指出的是,HeLa细胞经TSA处理后,细胞的凋亡显著增加,而过表达Mfn2后细胞的凋亡仅有少量增加,这表明还有其它重要机制参于了TSA的肿瘤抑制作用,这需要进一步的实验研究。
[参考文献]
[2]Huang BH, Laban M, Leung CH, et al. Inhibition of histone deacetylase 2 increases apoptosis and p21Cip1/WAF1 expression, independent of histone deacetylase 1[J]. Cell Death Differ, 2005, 12(4):395-404.
[3]You BR, Park WH. Trichostatin A induces apoptotic cell death of HeLa cells in a Bcl-2 and oxidative stress-dependent manner[J]. Int J Oncol, 2013, 42(1):359-366.
[4]Yu J, Mi J, Wang Y, et al. Regulation of radiosensitivity by HDAC inhibitor trichostatin A in the human cervical carcinoma cell line HeLa[J]. Eur J Gynaecol Oncol, 2012, 33(3):285-290.
[5]Zhu M, Li WW, Lu CZ. Histone decacetylase inhibitors prevent mitochondrial fragmentation and elicit early neuroprotection against MPP+[J]. CNS Neurosci Ther, 2014, 20(4):308-316.
[6]Lehmann A, Denkert C, Budczies J, et al. High class I HDAC activity and expression are associated with RelA/p65 activation in pancreatic cancerinvitroandinvivo[J]. BMC Cancer, 2009, 9:395.
[7]Wang L, Zou X, Berger AD, et al. Increased expression of histone deacetylaces (HDACs) and inhibition of prostate cancer growth and invasion by HDAC inhibitor SAHA[J]. Am J Transl Res, 2009, 1(1):62-71.
[8]Wilson AJ, Byun DS, Popova N, et al. Histone deacetylase 3 (HDAC3) and other class I HDACs regulate colon cell maturation and p21 expression and are deregulated in human colon cancer[J]. J Biol Chem, 2006, 281(19):13548-13558.
[9]Zhang Z, Yamashita H, Toyama T, et al. Quantitation of HDAC1 mRNA expression in invasive carcinoma of the breast[J]. Breast Cancer Res Treat, 2005, 94(1):11-16.
[10]Anh TD, Ahn MY, Kim SA, et al. The histone deacetylase inhibitor, Trichostatin A, induces G2/M phase arrest and apoptosis in YD-10B oral squamous carcinoma cells[J]. Oncol Rep, 2012, 27(2):455-460.
[11]He G, Wang Y, Pang X, et al. Inhibition of autophagy induced by TSA sensitizes colon cancer cell to radiation[J]. Tumour Biol, 2013, 35(2):1003-1011.
[12]Boland ML, Chourasia AH, Macleod KF. Mitochondrial dysfunction in cancer[J]. Front Oncol, 2013, 3:292.
[13]da Silva AF, Mariotti FR, Maximo V, et al. Mitochondria dynamism: of shape, transport and cell migration[J]. Cell Mol Life Sci, 2014, 71(12):2313-2324.
[14]Chen KH, Guo X, Ma D, et al. Dysregulation of HSG triggers vascular proliferative disorders[J]. Nat Cell Biol, 2004, 6(9):872-883.
[15]Guo X, Chen KH, Guo Y, et al. Mitofusin 2 triggers vascular smooth muscle cell apoptosis via mitochondrial death pathway[J]. Circ Res, 2007, 101(11):1113-1122.
[16]Shen T, Zheng M, Cao C, et al. Mitofusin-2 is a major determinant of oxidative stress-mediated heart muscle cell apoptosis[J]. J Biol Chem, 2007, 282(32):23354-23361.
[17]Wu L, Li Z, Zhang Y, et al. Adenovirus-expressed human hyperplasia suppressor gene induces apoptosis in cancer cells[J]. Mol Cancer Ther, 2008, 7(1):222-232.
[18]Chen KH, Dasgupta A, Ding J, et al. Role of mitofusin 2 (Mfn2) in controlling cellular proliferation[J]. FASEB J, 2014, 28(1):382-394.
(责任编辑: 林白霜, 余小慧)
Role of Mfn2 in mediating trichostatin A-induced growth arrest in HeLa cells
ZHU Min1, 2, ZHANG Wen1, BAO Xu-xia1, LI Wen-wei1
(1LaboratoryofIntegrativeMedicine,ZhongshanHospital,2ExperimentalResearchCenter,AffiliatedHospitalofOphthalmology&Otorhinolaryngology,FudanUniversity,Shanghai200032,China.E-mail:wenweili2000@aliyun.com)
[ABSTRACT]AIM: To investigate the roles of mitofusin 2 (Mfn2) in mediating trichostatin A (TSA)-induced growth arrest and the underlying mechanism. METHODS: After treating with different doses of TSA or over-expression of Mfn2, the proliferation, apoptosis and cell cycle of HeLa cells were analyzed. The protein levels of Ras, p-Raf, Raf, p-ERK, ERK, p-Akt, Akt and Mfn2 were determined by Western blot. The mRNA expression of Mfn2 was detected by real-time PCR. The interaction between Mfn2 and Ras was probed by co-immunoprecipitation. RESULTS: TSA inhibited cell proliferation by inducing apoptosis and a cell-cycle arrest at G2/M phase in a dose and time dependent manner in the HeLa cells. TSA induced up-regulation of Mfn2 at mRNA and protein levels, improved interaction between Mfn2 and Ras and decreased the phosphorylation levels of Raf and ERK. However, Mfn2 over-expression hardly caused cell apoptosis, yet it resulted in severe growth arrest by inhibiting Ras-Raf-ERK pathway in the HeLa cells. CONCLUSION: TSA might trigger HeLa cell arrest by increasing Mfn2 expression and thus inhibiting the activity of Ras-Raf-ERK pathway.
[KEY WORDS]Trichostatin A; Mfn2; HeLa cells; Cell proliferation; Ras-Raf-ERK pathway
[文章编号]1000- 4718(2016)01- 0095- 06
[收稿日期]2015- 06- 01[修回日期] 2015- 09- 01
*[基金项目]上海市中医药发展三年行动计划重大项目(No. ZY3-CCCX-1-1015);上海市科技支撑项目(No. 12401901003)
通讯作者△Tel: 021-64041990-3444; E-mail: wenweili2000@aliyun.com
[中图分类号]R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.016

