多电极转换射频消融系统治疗肝脏肿瘤临床疗效分析
谭运华 刘辉 蒋家云 王强 马宽生 别平
·论 著·(肝脏疾病微创治疗)
多电极转换射频消融系统治疗肝脏肿瘤临床疗效分析
谭运华 刘辉 蒋家云 王强 马宽生 别平
目的 总结第三军医大学西南医院肝胆外科研究所临床使用多电极转换系统射频消融治疗肝脏肿瘤的临床经验,以评估其有效性和安全性。方法 2014年12月至2015年12月第三军医大学西南医院肝胆外科研究所在178次多电极转换系统射频消融治疗304个肿瘤,平均直径4.72 cm(2.2~10.4 cm);入组病人176例(134例男性和42例女性),平均年龄52.95岁(22~83岁),术后24 h或者48 h行肝脏超声造影或者肝脏增强CT检查,以评估是否完全消融和是否有并发症的发生。结果 304个肝脏肿瘤,多电极转换系统完全消融率为98.68%(300/304),一次性完全消融率为98.02%(298/304),176例肝脏肿瘤病人多电极转换系统总消融时间为2 275 min,平均消融时间为(13.04±5.39) min,比单电极射频消融时间节约56.24%;入组的176例病人无住院死亡情况,并发症发生率为2.35%。统计学单因素分析证实消融区最大直径与肿瘤类型、肿瘤数目、电极数量、肿瘤直径、起始功率和治疗时间均有关,与肿瘤直径和肿瘤数目呈正相关。结论 多电极转换系统射频消融治疗肝脏肿瘤是一项安全、有效的操作方法,提高了射频消融治疗肝脏肿瘤一次性消融率,相对较短的射频消融时间降低了麻醉风险和手术风险。
多电极转换系统; 射频消融; 肝脏肿瘤; 有效性
在肝脏肿瘤治疗领域,射频消融具有较高的有效性、较低的并发症发生率和较短的住院日[1],同时也可避免开放性手术过程中对肝脏肿瘤的挤压,导致癌细胞的扩散,热毁损封闭效应使周围血管凝固,有利于减少肿瘤转移途径[2],作为肝脏肿瘤一线治疗性技术已经得到了推广[3],随着单电极射频消融技术的进步,以Covidien Cool-tip为代表的多电极转换射频消融系统的出现,使射频消融技术在治疗肝脏肿瘤领域的临床应用得到进一步发展[4]。
多电极转换射频消融系统的多针阵列组合能使脉冲电流同时发生在每个电针之间,1+1>2的热协同作用,可使消融面积进一步扩大[5],而且能量转换系统通过脉冲控制程序启动每个电极,能让多个射频电极同时工作,在多个电极之间连续地转换能量[6],利用热重叠效应提高消融中心点温度,使肿瘤组织最大程度的发生凝固性坏死[7];每个电极内部冷循环能适度降低射频消融电极针尖温度,避免电极针尖周围组织过快碳化引起阻抗上升,有利于热能的扩散,增加消融体积[8]。据报道,多电极转换系统射频消融治疗肝脏肿瘤的安全性和有效性曾有过报道[9-11],但缺乏大宗病例系统性报道。
我们回顾性分析了多电极转换射频消融治疗176例病人304个肝脏肿瘤的临床资料,以评估其安全性和有效性。
资料与方法
一、临床资料
1.伦理声明 本文中所有针对入组病人的检查和治疗均符合《赫尔辛基宣言》制定的道德原则,回顾性研究经第三军医大学西南医院的伦理审查委员会批准 (批准号2105042)。
2.176例病人和304个肝脏肿瘤进行了多电极转换射频消融178次,研究人群包括134例男性(76%)和42例女性(24%),平均年龄52.95岁(22~83岁)。具体资料见表1。
二、方法
1.多电极转换射频消融程序 多电极转换系统射频消融术前均获得病人的知情同意,所有操作都在监护麻醉下完成。所有消融都是应用多电极转换系统(冷循环射频转换控制器;Valley lab公司,博尔德,科罗拉多)。射频电极(covidienllc,15 Hampshire Street Mansfield,美国)在超声造影或者CT的引导下放置到肿瘤所在部位。肝脏肿瘤的大小、形状和位置决定了射频消融电极的数量。

表1 多电极转换系统射频消融治疗肝脏肿瘤的类型
2.术后评估 术后24~48 h行肝脏超声造影或肝脏增强CT评估疗效和并发症,在超声造影和增强CT下未见肿瘤消融区存在强化区域,则认为该技术有效,定义为完全消融。当出现残余肿瘤持续强化,经主管医生和影像学医生评估后为肿瘤残余,定义为未完全消融,则需再行射频消融治疗。本文中射频消融并发症和不良反应的描述均符合Goldberg等[12]制定的标准。
3.随访 随访是以射频消融后每3个月行肝脏增强CT或者肝脏超声造影检查,根据复查结果分析肿瘤的局部控制率和肿瘤消融治疗后的进展。本研究以消融后1、3、6、9、12个月进行复查随访,对于射频消融治疗后肿瘤肝内复发包括原位复发和远处复发,原位复发定义为随访期间发现病灶距离原消融区2 cm以内,距离原消融区2 cm以外则定义为远处复发。
三、统计学分析
对定量资料描述其均数、标准差、中位数、最大值和最小值;定性资料描述其例数与百分比。多组定量资料之间的比较采用GLM模型分析或多组样本的秩和检验;两组定量资料之间的比较采用独立样本t检验或两样本Wilcoxon秩和检验。同组定量资料之间的比较采用配对t检验或符号秩和检验。自变量与因变量均为定量资料的单因素分析采用Pearson相关检验或Spearman相关检验。多因素线性回归,对分类变量设置哑变量,入选变量标准为0.05,排除变量标准为0.10,采用逐步回归法。所有统计分析均采用SAS(9.3版)软件完成,P≤0.05视为差异有统计学意义。
结 果
在整个研究期间,178次射频消融应用于176人次的304个肿瘤,415根射频消融电极应用于治疗过程中,平均使用2.0根射频消融电极,多电极转换系统总消融时间为2275 min,平均消融时间为(13.04±5.39) min,比单针射频消融系统治疗时间节约3 350 min,节约56.24%(表2);入组病人肝脏肿瘤平均直径4.72 cm(2.2~10.4 cm);304个肝肿瘤中,新发的原发性肝癌42例、复发的原发性肝癌75例、转移性肝癌29例、血管瘤30例。304个肿瘤中300个(98.68%)获得了完全性消融,298个(98.02%)肿瘤获得了一次性完全消融,无住院死亡情况发生,4例并发症,其中1例血胸、1例空肠穿孔、2例术后肝穿刺点少量出血,并发症发生率为2.35%。
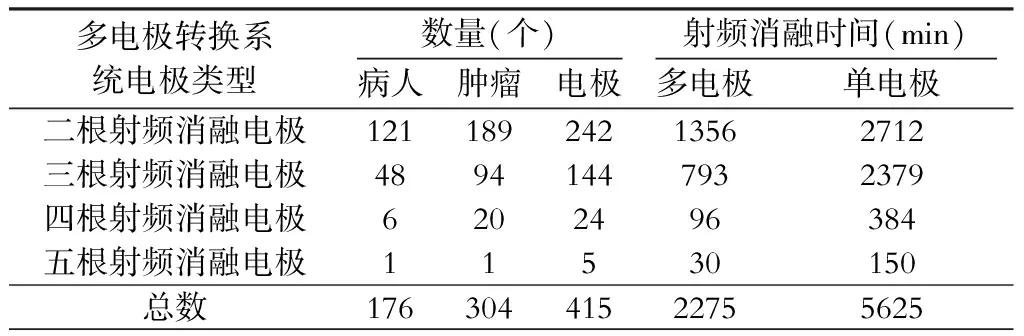
表2 射频消融系统消融时间和电极使用数量
注:单电极系统射频消融时间是按每根电极依次顺序消融时间计算,测算公式:多电极转换射频消融系统消融时间×电极数量
研究中,我们在每组中遇到了消融区最大直径的差异。我们对消融区最大直径进行了多因素和单因素分析:单因素分析中肿瘤类型、肿瘤数目、电极数量、肿瘤大小、起始功率和治疗时间均与消融区最大直径相关(表3、表4);多因素分析中各相关因素对消融区最大直径的影响,结果显示:肿瘤大小的回归系数为0.449(0.325~0.573)、肿瘤数目的回归系数为1.938(1.630~2.245),均与消融区最大直径呈正相关。VIF均小于10,调整R2=0.5158,表明方程无共线性,拟合良好。详见表5。
我们对恶性肝脏肿瘤和良性肝脏肿瘤经多电极转换射频消融前后效果进行配对t检验,恶性肿瘤消融后,消融区最大直径相比消融前肿瘤最大直径增加,前后差值有统计学意义;良性肿瘤消融后,消融区最大直径相比消融前肿瘤最大直径减小,前后差值有统计学意义;恶性肿瘤与良性肿瘤消融前后的变化值,差异有统计学意义,F=58.79,P<0.001。详见表6。
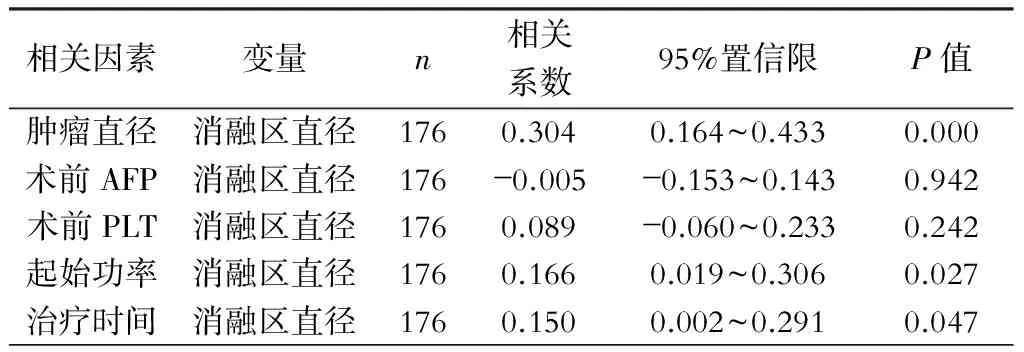
表4 Pearson 相关统计量(Fisher z 转换)
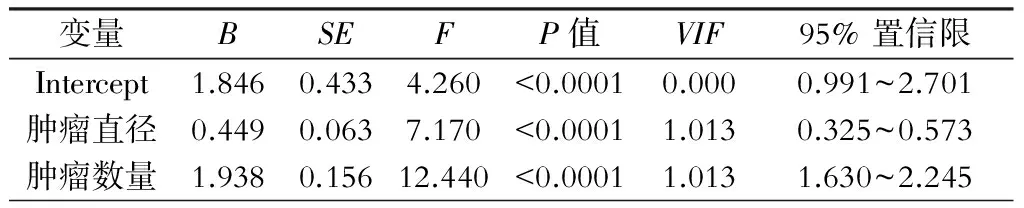
表5 多因素分析对消融区大小的影响
注:调整R2=0.5158
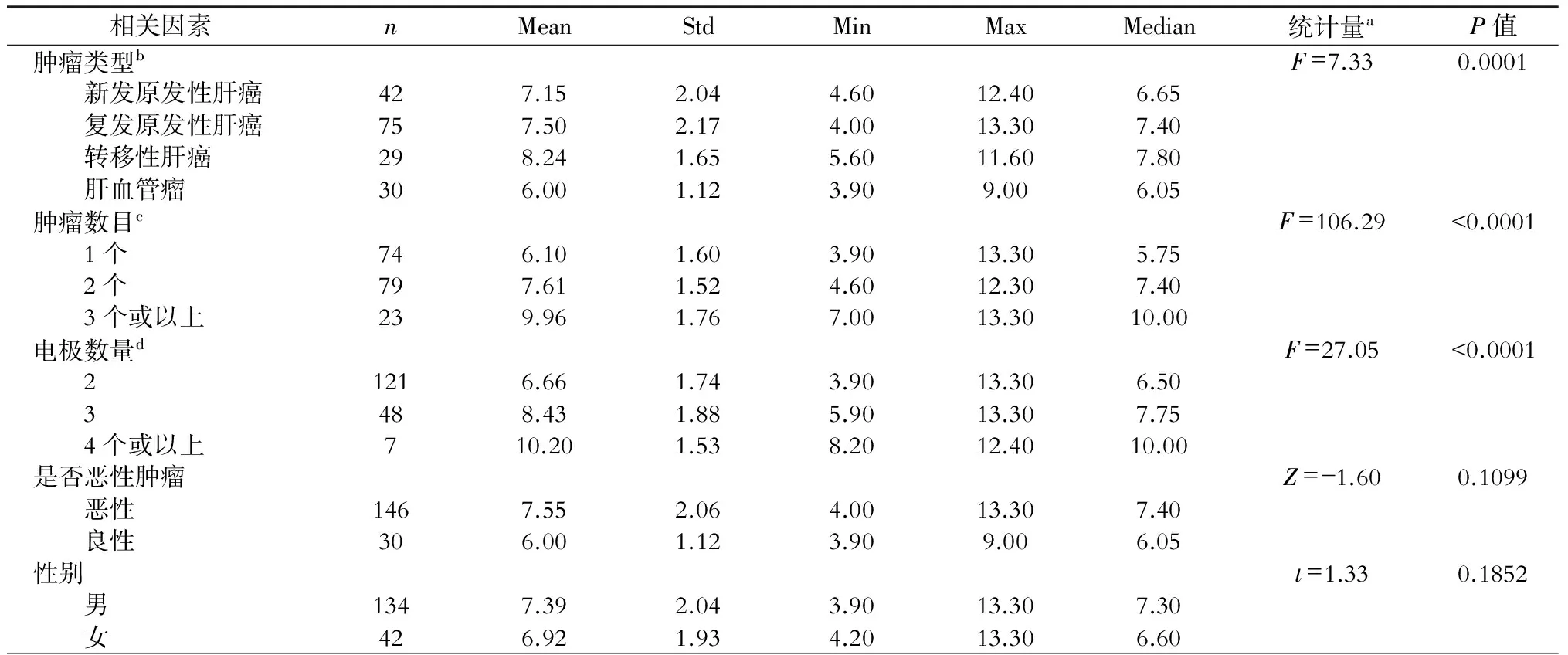
表3 各相关因素对消融区最大直径的影响
注:a.F为GLM模型检验统计量;Z为Wilcoxon秩和检验统计量;t为独立样本t检验统计量。b.LSD检验,良性与其他三组差异均有统计学意义;原发与转移之间的差异有统计学意义。c.LSD检验,任意两组差异均有统计学意义。d.LSD检验,任意两组差异均有统计学意义

表6 恶性肿瘤与良性肿瘤的消融效果比较
注:对两组差值校正基线后比较,F=58.79,P<0.001;a.t为配对t检验统计量;b.差值为消融区大小减去肿瘤大小
在整个研究时限内共发生并发症4例,并发症发生率为2.35%,其中1例血胸、1例空肠穿孔、2例肝穿刺点少量出血,其中2例肝穿刺点少量出血病人经临床观察治疗无特殊处理。血胸经胸腔镜手术治愈,空肠穿孔经肠修补术治愈。空肠穿孔并发症发生在开腹肝癌切除术后复发病人,因空肠粘连肝脏脏面,经射频消融电极热传导导致空肠壁穿孔,术后6 h出现症状并临床确诊后行手术治愈。
讨 论
据我们所知,本研究是第一次较大样本量临床病例来描述多电极转换射频消融系统治疗肝脏肿瘤的报道。
其结果显示,多电极转换射频消融系统能够获得肿瘤完全消融率为98.68%,一次性完全消融率为98.02%,这些结果要高于以前各种单电极射频消融系统的结果(91.1%~96.8%)[13-14]。根据以往观点,不完全消融是影响病人术后复发的危险因素[15],虽然其复发因素存在多样性,但早期单电极射频消融系统较低的完全消融率是其很重要的因素之一[16],单电极消融系统为了达到消融的目的,需要按顺序分步进行层层消融,尽管层层消融能够达到较大的消融区域,但是随着时间的消耗,存在着大量的能量损失,没有多电极转换射频消融系统的热重叠效应[17],而且单电极射频消融后在局部肿瘤组织形成气泡[18],影响局部组织的阻抗,干扰了射频消融系统的阻抗反馈,此外,单电极射频消融系统的按顺序分步层层消融的方法需要精准的重叠,针对肿瘤组织容易造成潜在的不完全消融[19],实际上,已有研究表明要消融直径3 cm的肿瘤外加安全边界单电极射频消融系统需要14次重叠消融[16]。Laeseke等[20]报道了在猪肝上应用由3个相距1.5 cm的能量转换系统电极16 min内,平均消融最大直径4.2 cm,比单电极消融2.2 cm更大,也比集束电极消融3.2 cm更大。
在我们的研究中,平均消融时间为(13.04±5.39) min,要低于以前的报道(17.2±2.69) min[21],在相同样本量的情况下,比单电极射频消融系统要节约手术时间56.26%。多电极转换射频消融系统可同时使用多根射频消融电极,而且每个射频消融电极都是相对独立的,当几个电极近距离放置的时候,它们的热效应相互影响,消融区可相互重叠,从而导致消融区产生更高的温度,核心区域温度越高,增加了消融周围区域的热传导的作用,而且多电极转换射频消融系统能够同时阻断消融区的血流,加快局部血管血栓形成,减少热量损失,从而增加消融效率。特别是在消融肝脏血管瘤,冗长的消融时间不可避免地导致溶血,导致血红蛋白尿,溶血性黄疸、贫血,甚至肾衰竭等并发症[22]。并发症的发病率与消融时间成正比,消融时间越长,并发症发生率越高[23]。所以多电极转换射频消融系统相对较短的手术时间减少了术后并发症的发生,更降低麻醉风险。
在我们的研究中,多电极转换射频消融系统治疗肝脏肿瘤的主要并发症发生率为2.35%,均低于以前报道单电极射频消融系统的并发症发生率(2.5%~8%)[24-25]和同样使用多电极射频消融系统的并发症发生率(4%~9.5%)[26-27],在我们的研究中,1例并发症发生在肝癌术后复发的病人,空肠粘连在肝脏的断面,由于复发肿瘤离断面较近,射频消融过程中热损伤空肠肠壁导致空肠穿孔,术后6 h症状,确认后经空肠修补治愈;1例血胸为术后12 h出现呼吸费力,经胸部CT确认为血胸,考虑为射频消融电极穿破膈静脉,经胸腔镜下局部缝合止血治愈;其余2例为术后第2天复查超声造影时发现肝周少量积血,病人无症状,考虑射频消融电极穿刺点少量渗血,经临床观察,确认肝周少量积血无进一步增加。已有研究表明,射频消融术引起并发症的原因分为两种:电极的位置和热传导[28]。另外,操作者的射频消融经验亦是并发症发生发主观因素。
在我们的研究中,我们发现每组中遇到了消融大小的变异。通过统计学单因素分析证实消融区最大直径与肿瘤类型、肿瘤数目、电极数量、肿瘤直径、起始功率和治疗时间均有关,与肿瘤直径与肿瘤数目呈正相关。在本研究中,我们对恶性肝脏肿瘤和良性肝脏肿瘤经多电极转换射频消融前后效果进行配对t检验,发现恶性肿瘤消融后,消融区最大直径相比消融前肿瘤最大直径增加;良性肿瘤消融后,消融区最大直径相比消融前肿瘤最大直径减小。我们认为这种现象跟多电极转换系统射频消融治疗肝脏血管瘤不同策略有关,我们在消融肝血管瘤的过程中,其中一根射频消融电极高选择性的放置在肝脏血管瘤入瘤动脉,而且射频消融前快速回抽血管瘤内的部分血液,使血管瘤瘤体变小,以降低热沉降效应,减少消融时间,杜绝红细胞破坏所导致的溶血性黄疸、血红蛋白尿甚至肾衰竭等并发症的发生。多电极转换系统射频消融治疗肝脏大血管未见系统性报道。在本次研究中,由于多电极转换系统射频消融治疗肝脏血管瘤样本量较小,未进行亚组分析,我们将后续的研究中,经大样本量长期随访后评估多电极转换系统不同策略射频消融治疗肝脏大血管瘤的疗效。
总之,多电极转换射频消融是一种提高一次性完全消融率且安全有效、节约手术时间的操作,本研究表明多电极转换射频消融在治疗原发性肝癌、转移性肝癌以及肝内大血管瘤显示出短期的有效性,并且还可以同时治疗多个肿瘤病灶。多电极转换射频消融系统的进一步发展将会改善和增加治疗肝脏肿瘤领域的实效性。由于多电极转换射频消融系统微创治疗肝脏肿瘤进入国内时间较短,样本量有限,在后续的研究中,我们将采用多中心、大样本量随访方式,针对不同肿瘤的治疗疗效进行前瞻性研究。
1 Kao WY,Chiou YY,Hung HH,et al.Younger hepatocellular carcinoma patients have better prognosis after percutaneous radiofrequency ablation therapy. J Clin Gastroenterol,2012,46:62-70.DOI:10.1097/Mcg. 0b013e31822b36cc
2 Hasegawa K,Makuuchi M,Takayama T,et al.Surgical resection vs. percutaneous ablation for hepatocellular carcinoma: a preliminary report of the Japanese nationwide survey.J Hepatol,2008,49:589-594.DOI: 10.1016/j.jhep.2008.05.018
3 Tiong L,Maddern GJ.Systematic review and meta-analysis of survival and disease recurrence after radiofrequency ablation for hepatocellular carcinoma.Br J Surg,2011,98:1210-1224.DOI:10.1002/bjs.7669
4 Krokidis M,Ahmed I.Overview of thermal ablation devices:radiofrequency ablation.Interventional Radiology Techniques in Ablation: Springer, 2013.5-11
5 Lee JM,Han JK,Kim HC,et al.Switching monopolar radiofrequency ablation technique using multiple, internally cooled electrodes and a multichannel generator -Ex vivo and in vivo pilot study.Invest Radiol,2007,42:163-171.DOI:10.1097/01.rli.000025249 5.44818.b3
6 Lee ES,Lee JM,Kim WS,et al.Multiple-electrode radiofrequency ablations using Octopus? electrodes in an in vivo porcine liver model.Br J Radiol,2012,85: e609-615.
7 Woo S,Lee JM,Yoon JH,et al.Small- and Medium-sized Hepatocellular Carcinomas: Monopolar Radiofrequency Ablation with a Multiple-Electrode Switching System- Mid-term Results.Radiology,2013,268:589-600.DOI:10.1148/radiol.13121736
8 Shibata T,Maetani Y,Isoda H,et al.Radiofrequency ablation for small hepatocellular carcinoma: prospective comparison of internally cooled electrode and expandable electrode.Radiology,2006,238:346-353.DOI:238/1/346 [pii]10.1148/radiol.2381041848
9 Lee J,Lee JM,Yoon JH,et al.Percutaneous radiofrequency ablation with multiple electrodes for medium-sized hepatocellular carcinomas.Korean J Radiol,2012,13:34-43.DOI:10.3348/kjr.2012.13.1.34
10Laeseke PF,Frey TM,Brace CL,et al.Multiple-electrode radiofrequency ablation of hepatic malignancies: initial clinical experience.AJR Am J Roentgenol,2007,188:1485-1494.DOI:188/6/1485 [pii]10. 2214/AJR.06.1004
11Hansler J,Frieser M,Tietz V,et al.Percutaneous radiofrequency ablation of liver tumors using multiple saline-perfused electrodes.J Vascul Intervent Radiol,2007,18:405-410.DOI:10.1016/j.jvir.2006.12.729
12Goldberg SN,Grassi CJ,Cardella JF,et al.Image-guided tumor ablation: standardization of terminology and reporting criteria.Radiology,2005,235:728-739.DOI:2353042205 [pii]10.1148/radiol.2353042205
13Lin SM,Lin CC,Chen WT,et al.Radiofrequency ablation for hepatocellular carcinoma:A prospective comparison of four radiofrequency devices.J Vasc Interv Radiol,2007,18:1118-1125.DOI:10.1016/j.jvir.2007.06.010
14Solmi L,Nigro G,Roda E.Therapeutic effectiveness of echo-guided percutaneous radiofrequency ablation therapy with a LeVeen needle electrode in hepatocellular carcinoma.World J Gastroenterol,2006,12:1098-1104. [PMID: 16534852 PMCID: 4087903]
15Nakazawa T,Kokubu S,Shibuya A,et al.Radiofrequency ablation of hepatocellular carcinoma:Correlation between local tumor progression after ablation and ablative margin.AJR Am J Roentgenol,2007,188:480-488.DOI: 10.2214/Ajr.05.2079]
16Dodd GD,Frank MS,Aribandi M,et al.Radiofrequency thermal ablation: computer analysis of the size of the thermal injury created by overlapping ablations.AJR Am J Roentgenol,2001,177:777-782.DOI:10.2214/ajr.177.4.17 70777
17Weisbrod AJ,Atwell TD,Callstrom MR,et al.Percutaneous radiofrequency ablation with a multiple-electrode switching-generator system.J Vasc Intervl radiol,2007,18:1528-1532.DOI:18/12/1528 [pii]10.1016/j.jvir.2007.08.004
18Koda M,Mandai M,Matono T,et al.Assessment of the ablated area after radiofrequency ablation by the spread of bubbles: comparison with virtual sonography with magnetic navigation. Hepatogastroenterology,2011,58:1638-1642.DOI:10.5754/hge08641
19Okuwaki Y,Nakazawa T,Kokubu S,et al.Repeat radiofrequency ablation provides survival benefit in patients with intrahepatic distant recurrence of hepatocellular carcinoma.Am J Gastroenterol,2009,104:2747-2753.DOI:10.1038/ajg.2009.414ajg2009414 [pii].
20Laeseke PF,Sampson LA,Haemmerich D,et al.Multiple-electrode radiofrequency ablation creates confluent areas of necrosis:in vivo porcine liver results.Radiology,2006,241:116-124.DOI:2411051271[pii]10.11 48/radiol. 4110 51271].
21Nakamuta M,Kohjima M,Morizono S,et al.Comparison of tissue pressure and ablation time between the LeVeen and cool-tip needle methods.Comparative Hepatology,2006,5:10.
22Tak WY,Park SY,Jeon SW,et al.Ultrasonography-guided percutaneous radiofrequency ablation for treatment of a huge symptomatic hepatic cavernous hemangioma.J Clin Gastroenterol,2006,40:167-170.DOI:00004836-2006020 00-00015 [pii].
23Park SY,Tak WY,Jung MK,et al.Symptomatic-enlarging hepatic hemangiomas are effectively treated by percutaneous ultrasonography-guided radiofrequency ablation.J Hepatology,2011,54:559-565.DOI:10.1016/j. jhep.2010.07.024S0168-8278(10)00813-5 [pii].
24Chen MH,Yang W,Yan K,et al.Treatment efficacy of radiofrequency ablation of 338 patients with hepatic malignant tumor and the relevant complications.World J Gastroenterology,2005,11:6395-6401.
25Wood TF,Rose DM,Chung M,et al.Radiofrequency ablation of 231 unresectable hepatic tumors: indications, limitations,and complications.Ann Surg Oncol,2000,7:593-600.
26Lu MD,Yin XY,Xie XY,et al.Percutaneous thermal ablation for recurrent hepatocellular carcinoma after hepatectomy.Br J Surg,2005,92:1393-1398.DOI:10.1002/bjs.5102.
27Gao J,Ke S,Ding XM,et al.Radiofrequency ablation for large hepatic hemangiomas:initial experience and lessons. Surgery,2013,153:78-85.DOI:10.1016/j.surg.2012.06.004S0039-6060(12)00291-7 [pii].
28Kong WT,Zhang WW,Qiu YD,et al.Major complications after radiofrequency ablation for liver tumors:Analysis of 255 patients.World J Gastroenterol,2009,15:2651-2656.DOI:10.3748/Wjg.15.2651.
Clinical effectiveness of radiofrequency ablation with a multiple-electrode switching system for liver tumors
TanYunhua,LiuHui,JiangJiayun,WangQiang,MaKuansheng,BiePing.
InstituteofHepatobiliarySurgery,XinanHospital,ChongqingThirdMilitaryMedicalUniversity,Chongqing400038,China
MaKuansheng,Email:makuansheng@vip.sina.com
Objective To assess the effectiveness and safety of a novel radiofrequency ablation (RFA) with a multiple-electrode switching system for the treatment of liver tumors.Methods We performed a total of 178 RFAs with a multiple-electrode switching system on 176 patients from Dec. 2014 to Dec. 2015. There were a total of 304 tumors treated with an average diameter of 4.72±1.7 cm (range, 2.2±10.4 cm). There were 134 male patients and 42 female patients with a mean age of 52.95±11.87 years old (range, 22-83). Ultrasonography or contrast-enhanced CT of the liver was performed 48 h after the surgery to determine whether the ablation was complete and whether complications occurred.Results For the treatment of 304 liver tumors, the complete ablation rate of multi-electrode switching system was 98.68% (300/304), and the complete ablation rate with one procedure was 98.02% (298/304). The total ablation time was 2 275 min, and the mean ablation time per procedure was 13.04±5.39 min, and there was a 56.24% reduction relative to that of single-electrode RFA. No hospital deaths occurred in any of the enrolled 176 patients. The complication rate was 2.35%.Conclusions Multiple-electrode switching RFA is a safe and effective method for treating liver tumors. It was here found to improve the complete ablation rate with one procedure in RFA treatment of liver tumors and to shorten the RFA time, which reduces surgical risks.
Multiple-electrode switching system; Radiofrequency ablation; Liver tumor; Effectiveness
400038 重庆,第三军医大学西南医院肝胆外科研究所
马宽生,Email:makuansheng@vip.sina.com
R735.7
A
10.3969/j.issn.1003-5591.2016.02.004
2015-0-0)

