半胱氨酸蛋白酶参与调节ephrinBs/EphBs信号通路活化诱发神经病理性疼痛研究
杨 梅,李 建,杨 蕊,王浩伟,袁红斌
半胱氨酸蛋白酶参与调节ephrinBs/EphBs信号通路活化诱发神经病理性疼痛研究
杨梅,李建,杨蕊,王浩伟,袁红斌
[摘要]目的观察小鼠鞘内注射酪氨酸激酶受体EphB1及其配体ephrinB2-Fc对其神经病理性疼痛行为的作用及对半胱氨酸蛋白酶3(caspase-3)表达水平的影响。方法昆明小鼠36只,采用数字表法随机分为假手术+生理盐水组(Sham+NS,n=6)、假手术+酪氨酸蛋白激酶受体B1组(Sham+EphB1,n=6)、坐骨神经压迫性损伤+生理盐水组(CCI+NS,n=12)以及CCI+EphB1组(n=12),于制模前1 d及制模后1、3、5、7、14 d时测定各组小鼠的机械刺激缩足反射阈值(mechanical withdrawal threshold,MWT)和热缩足反射潜伏期(thermal withdrawal latency,TWL),并于第5天将CCI+NS和CCI+EphB1组中的6只小鼠处死,取L4-5段脊髓,采用免疫组化方法测定caspase-3阳性细胞数的含量。 另取昆明小鼠24只,采用数字表法随机分为4组,每组6只,即空白对照组、生理盐水对照组(NS, 鞘内注射5 μl NS)、ephrinB2-Fc 0.1 μg组(注射浓度0.02 g/L,体积5 μl)、ephrinB2-Fc 0.5 μg组(注射浓度0.1 g/L,体积5 μl)。于给药前3 h和给药后3、6、9、12、24、48 h测定各组小鼠MWT和TWL,术后48 h取L4-5段脊髓,采用免疫组化方法测定脊髓中caspase-3阳性细胞数的含量。结果在CCI模型中,与Sham+NS和Sham+EphB1比较,CCI+EphB1与CCI+NS 组术后第1、3、5、7 d MWT及术后第3、5、7 d TWL疼痛阈值明显下降,差异有统计学意义(P<0.05);与CCI+NS相比,CCI+EphB1组MWT和TWL显著提高, caspase-3阳性细胞数明显减少,差异有统计学意义(P<0.05)。与空白对照组及NS对照组相比,ephrinB2-Fc 0.1 μg、0.5 μg组MWT和TWL显著降低, caspase-3阳性细胞数的含量明显增多,差异均有统计学意义(P<0.05),且浓度越高痛阈值越低,阳性细胞数越多。结论鞘内注射ephrinB2-Fc、EphB1可分别引起小鼠机械痛敏和热痛敏的升高和降低,其机制可能与调节caspase-3表达变化有关。
[关键词]神经病理性疼痛;半胱氨酸蛋白酶3;ephrinB2-Fc ;EphB1 ;鞘内注射
神经病理性疼痛(neuropathic pain,NPP)是指由中枢或者外周神经系统损伤和病变所引起的一种疼痛综合征,以自发性疼痛、痛觉过敏和疼痛超敏为主要表现[1],目前发病机制不明,但已成为临床亟待解决的难题之一[2]。新近研究证实,轴突导向因子参与了神经病理性痛的病理生理过程,其中,受体型酪氨酸蛋白激酶(receptor tyrosine kinase,RTKs)亚家族Ephs及其配体ephrins在成年大鼠神经组织,尤其是伤害性信息调制相关的脊髓后角I-III板层以及脊神经节的中小直径的神经元中有表达[3-4],并在疼痛调节及炎症反应等多种病理生理过程中发挥重要作用。Ephs分为EphA(A1~A8)和EphB(B1~B6)两大亚家族,其配体分别为ephrinA(A1~A5)和ephrinB(B1~B6)。除此之外,还有研究发现,神经元凋亡也与神经病理性疼痛关系密切。 de Novellis 等[5]发现 ,阻滞谷氨酸mGlu5受体可减少凋 亡基因的表达及凋亡状态,从而减轻痛觉过敏,脊髓背角神经元的凋亡对神经病理性疼痛起着重要作用[6]。而caspase-3是半胱氨酸蛋白酶caspase家族的一员,是细胞凋亡的关键酶,那么在ephrinBs/EphBs信号通路诱发的神经病理性疼痛的过程中,caspase-3调节的神经元凋亡是否发挥作用还需进一步研究。因此,本研究以正常小鼠和坐骨神经结扎模型(CCI)小鼠为对象,对其鞘内注射ephrinB2-Fc(Fc标记)和EphB1来观察、明确ephrinBs/EphBs信号通路在神经病理性疼痛中的作用及其此过程中caspase-3的表达变化,从而探讨caspase-3在ephrinB2/EphB1引起疼痛过程中可能发挥的作用。现报道如下。
1材料与方法
1.1动物来源与主要试剂雄性昆明小鼠,体质量22~25 g,购自第二军医大学实验动物中心[动物生产许可证号SCXK(沪)2012- 0003,使用许可证号SYXK(沪)2012- 0003]。ephrinB2-Fc购自R&D公司;小鼠EphB1/Aek5蛋白购自SB公司;兔抗caspase-3购自Cell Signaling公司;羊抗兔IgG二抗购自Abcam公司。多聚甲醛(PFA)、PBS等其他常用试剂均由第二军医大学附属东方肝胆外科医院疼痛诊疗教研室提供。Von Frey细丝购自美国Stoelting公司,热痛刺激仪ME-410C购自中国医学科学院生物医学工程研究所。
1.2鞘内给药及CCI动物模型的制备小鼠按简化后的Hylden和Wilcox[7]方法鞘内给药:腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉后,定位L6并剪毛、消毒。按压小鼠腰骶两侧固定,自L5-6棘突间隙进针,以鼠尾突然出现侧向摆动为进针成功标志。注射用10 μl微量进样器进行,注射容积为5 μl,注射时间为10 s,留针20 s。 36只雄性小鼠随机分为4组,参考Bennett等[8]的方法建立左后肢CCI模型。小鼠称质量后,腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉,俯卧位固定于手术台上,暴露出坐骨神经主干,用4-0铬制肠线环绕神经干分别做 4个轻度结扎环,间距1 mm,结扎强度以引起小腿肌肉轻度颤动反应但不影响神经血运为宜。局部敷以青霉素粉,缝合肌筋膜及各层组织后缝合皮肤。假手术组只暴露坐骨神经,不做神经结扎。术毕将大鼠放入底部铺有热毯的塑料盒中待其自由苏醒,后于安静、温暖环境自由喂养。
1.3实验分组及处理取36只雄性昆明小鼠,随机分为4组:(1)假手术(Sham)+生理盐水(NS)对照组(n=6),鞘内注射NS,0.5 h后暴露左后肢坐骨神经主干,但不予结扎,后逐层缝合;(2)Sham+磷酸化酪氨酸蛋白激酶受体B1(EphB1)组(n=6),鞘内注射EphB1 0.1 g/L,0.5 h后暴露左后肢坐骨神经主干,但不予结扎,后逐层缝合;(3)坐骨神经压迫性损伤(CCI)+NS组(n=12),鞘内注射NS,0.5 h后暴露左后肢坐骨神经主干并结扎,后逐层缝合;(4)CCI+EphB1组(n=12),鞘内注射EphB1 0.1 g/L,0.5 h后暴露左后肢坐骨神经主干并结扎,后逐层缝合。各组小鼠均于术前1 h测基础痛阈值,术前0.5 h行鞘内注射,注射剂量均为5 μl,术后第1、3、5、7、14天测定小鼠的机械性缩足阈值(mechanical withdrawal threshold,MWT)和热缩足反射潜伏期(thermal withdrawal latency,TWL),其中CCI+NS和CCI+EphB1组在术后第5天将其中6只处死灌流取L4-5段脊髓做免疫组化,剩余6只继续参与后续行为测定。另取24只昆明小鼠,随机分为4组(每组6只):(1)空白对照组,不做任何处理,只在相应的时间点测定MWT、TWL和caspase-3;(2)NS对照组,鞘内注射 NS;(3)ephrinB2-Fc 0.1 μg组,鞘内注射ephrinB2-Fc 0.02 g/L;(4)ephrinB2-Fc 0.5 μg组,鞘内注射ephrinB2-Fc 0.1 g/L。各组注射剂量均为5 μl,于测定完MWT和TWL基础值(术前3 h)后1 h给予鞘内注射相应溶剂,之后分别于3、6、9、12、24、48 h测定MWT和TWL,并于48 h测定完所有数值后将小鼠处死,灌流,取L4-5段脊髓做免疫组化染色。
1.4行为学测定机械痛测定参照Dixon[9]的测试方法,Von Frey纤维细丝测定MWT,将一有机玻璃箱(20 cm×25 cm×15 cm)置于金属筛网上,小鼠放置于玻璃箱中,待小鼠在有机玻璃箱中适应30 min后,用Von Frey纤维丝垂直刺激小鼠后肢足底中部,持续时间≤4 s,小鼠出现抬足或者舔足行为视为阳性反应,否则为阴性反应。测定首先从1.0 g开始,4.0 g结束,当该力度的刺激不能引起阳性反应,则给予相邻大一级力度的刺激;如果出现阳性反应则给予相邻小一级力度的刺激,如此连续进行,直至出现第2次阳性和阴性反应的骑跨,再连续测定4次。每次刺激间隔30 s,以此向下推算小鼠50%缩足阈值。
热痛测定按Hargreaves法[10]测定TWL,将有机玻璃箱(7 cm×9 cm×11 cm)置于3 mm厚的玻璃板上,将小鼠放入其中并适应1 h,后用热痛刺激仪照射小鼠足底,照射开始至小鼠出现抬腿回避时即为TWL。自动切断时间为20 s,以防止组织损伤。热刺激强度在整个实验中维持一致。每只动物测定5次,每次间隔3 min,取后3次平均值为小鼠TWL值。
1.5免疫组织化学染色按实验安排时间点及个数取小鼠脊髓背角测定caspase-3阳性细胞数的变化。所有小鼠腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉后开胸,分离暴露心脏,用事先将针头磨平的头皮针插至小鼠左心室,剪破右心耳,4 ℃的0.1 mol/L PBS 40 ml快速冲洗,继之以4 ℃ 4%多聚甲醛溶液(内含0.1 mol/L PBS,pH7.4)60 ml灌注固定,后取L4-5脊髓,在4 ℃ 4%多聚甲醛中固定8 h,然后石蜡包埋,每个标本于石蜡切片机上切取6张(同一部位),片厚5 μm。免疫组织化学染色采用ABC复合物(1∶200)室温30 min,最后用DAB/H2O2溶液进行呈色反应。用0.01 mol/L PBS代替一抗作为阴性对照。每只小鼠取6张脊髓切片染色(其中1张用于阴性对照染色),在脊髓背角浅层先于20×10倍光镜下观察,然后用MoticB5显微摄像系统(MotieChina,北京)进行图片采集,后在图片上以中央管为标志,横竖均垂直90°观察约1/4脊髓即一侧脊髓背角内caspase-3的阳性细胞数量,每个分组统计5张切片的数量,汇总后求平均数得所需结果。
1.6统计学处理计量数据采用均数±标准差(x±s)表示,采用SPSS 21.0统计软件进行处理。各组术前痛的比较采用单因素方差分析;术后各组机械痛和热痛的比较采用重复测量资料方差分析。各组小鼠在CCI前后疼痛的比较以及caspase-3免疫组化结果变化的比较采用单因素方差分析。检验水平α为0.05。P<0.05为差异具有统计学意义。
2结果
2.1鞘内注射EphB1对CCI小鼠痛阈值及脊髓背角凋亡的影响
(1)鞘内注射EphB1对CCI模型小鼠热痛及机械痛阈值的影响与鞘内注射前比较,Sham+NS组与Sham+Eph组小鼠的MWT和TWL差异均无统计学意义(P>0.05)。与Sham+NS组和Sham+Eph组比较,CCI+NS和CCI+Eph组小鼠MWT、TWL降低,差异有统计学意义(P<0.05),根据均值可得在第5天痛阈值达到最低,14 d接近正常; CCI+Eph组与CCI+NS组小鼠MWT、TWL明显有所提高,即机械痛及热痛均减轻,第3、5、7天尤为明显。结果提示,在CCI模型中,鞘内注射EphB1可以明显减轻CCI小鼠3~7 d机械痛及热痛阈值。见图1、2。
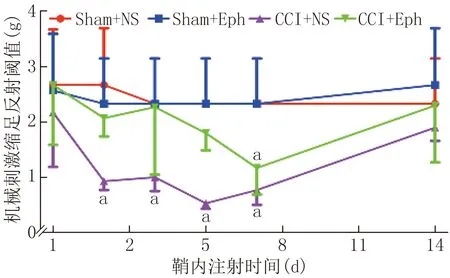
注:与Sham+NS及Sham+Eph组比较,aP<0.01;与CCI+NS组比较,aP<0.05图1 鞘内注射EphB1的CCI模型小鼠各测试点的机械痛阈值(n=6)

注:与Sham+NS及Sham+Eph组比较,aP<0.05;与CCI+NS组比较,aP<0.05图2 鞘内注射EphB1的CCI模型小鼠各测试点的热潜伏期(n=6)
2.1.2鞘内注射EphB1对CCI模型小鼠脊髓背角caspase-3表达的影响免疫组化染色结果显示CCI+Eph组与CCI+NS组小鼠相比,阳性细胞数明显减少,差异有统计学意义(P<0.05)。见图3。以上结果综合提示,CCI模型组小鼠鞘内注射EphB1可明显提高疼痛阈值并减少Caspse-3阳性细胞表达。

注:与CCI+NS比较,CCI+Eph组阳性细胞数明显减少。A:CCI+Eph组; B:CCI+NS组图3 CCI各组小鼠脊髓背角caspase-3免疫组化图(HE×200)
2.2鞘内注射ephrinB2-Fc对正常小鼠痛阈值及脊髓背角凋亡的影响
2.2.1鞘内注射ephrinB2-Fc对正常小鼠热痛及机械痛阈值的影响与鞘内注射前比较,空白对照组与NS对照组小鼠无明显差异(P>0.05)。 与空白对照组或NS对照组相比,鞘内注射0.5 g/L或0.1 g/L ephrinB2-Fc会导致热痛阈值和机械痛阈值随时间变化的降低,且浓度越高痛阈值降低越明显,恢复越慢,其中痛阈值在鞘内注射后6 h达到最低(P<0.01),24 h后回升,48 h基本接近正常,该结果提示鞘内注射ephrinB2-Fc可引起时间及剂量依赖性的疼痛反应。见图4、5。
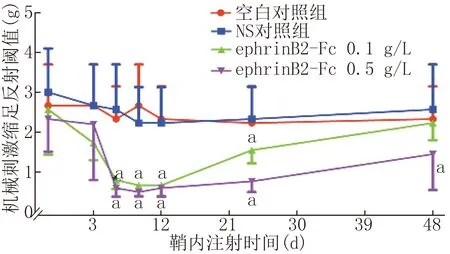
注:与空白对照线及对NS对照组比较,aP<0.01;与ephrinB2-Fc 0.1 g/L组比较,aP<0.01图4 鞘内注射ephrinB2-Fc的正常小鼠各测试点的机械痛阈值

注:与空白对照组及NS对照组相比,aP<0.01;与ephrinB2-Fc 0.1 g/L组相比,aP<0.01图5 鞘内注射ephrinB2-Fc的正常小鼠各测试点的热潜伏期

注:A为NS对照组;B为空白对照组;C为ephrinB2-Fc 0.02 g/L组;D为ephrinB2-Fc 0.5 g/L组图6 正常小鼠鞘内注射ephrinB2-Fc后脊髓背角caspase-3免疫组化HE染色结果(×200)
2.2.2鞘内注射ephrinB2-Fc对正常小鼠脊髓背角caspase-3表达的影响免疫组化染色显示(图6、7)空白对照组与NS对照组小鼠caspase-3阳性细胞数无明显差异(P>0.05)。与空白对照组或NS对照组小鼠相比,鞘内注射0.02 g/L或0.1 g/L ephrinB2-Fc的caspase-3阳性细胞数明显增多,且注射浓度越高阳性细胞数越多(P<0.01)。

注:与空白对照组及NS对照组比较,aP<0.05;与ephrinB2-Fc 0.1 g/L组比较,aP<0.05图7 正常小鼠鞘内注射ephrinB2-Fc后脊髓背角caspase-3免疫组化指数(n=6)
3讨论
EphB/ephrinB参与脊神经节段性组织[11],在脊髓和脊神经的发展中持续表达[12],通过正向与逆向传导通路调控树突棘的细胞骨架促进树突棘的生长间接诱导NPP的产生[13],包含轴索导向、血管发生、组织结构的形成、细胞迁移以及树突形态和突触的发生等多种生物功能[14]。近有研究证实在新生小鼠鞘内或足底注射ephrinB1-Fc可引起小鼠时间及剂量依赖性的痛觉过敏,术后2~8 h尤为明显,持续约24 h后基本接近正常[15],这与本研究中鞘内注射ephrinB2-Fc后出现与基础值相比的MWT和TWL降低,6~12 h明显,24 h开始恢复,且浓度越高疼痛越重、恢复越慢的结果基本一致。该现象可能与脊髓星形胶质细胞参与疼痛调节,通过C纤维诱发脊髓背角神经元的长时程增强(LTP)及降低LTP的刺激阈值有关[16]。另外,直接进行鞘内注射作用于中枢也保证了效果的确切性,比外周注射更有优势,更易诱发疼痛的产生。CCI模型小鼠鞘内注射EphB1,发现CCI+NS组小鼠疼痛阈值在第5 d达最低,后逐渐回升,其中CCI+EphB1组小鼠与CCI+NS组相比MWT和TWL均上升,疼痛减轻,说明EphB1与ephrinB1一样参与疼痛的产生过程。
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中caspase-3为关键的执行分子。关于caspase-3在疼痛中的作用的研究,Scholz[17]等就有神经病理性疼痛及炎症性疼痛模型上发现神经元凋亡的相关报道,同时发现在疼痛刺激下caspase-3表达上调。基于上述理论不难发现,caspase-3在多种类型的疼痛中均发挥作用,那么caspase-3与ephrinBs/EphBs信号通过诱发的疼痛关系怎样,笔者提出如下假设:caspase与疼痛关系密切,是NPP中的调节分子,并且该调节作用同样适用于ephrinBs/EphBs信号通路引发的疼痛。在结果中可见,ephrinB2-Fc诱发的疼痛模型中随着小鼠疼痛的产生,脊髓caspase-3阳性细胞数的含量明显比NS和空白对照组增多,且随着时间及浓度的增加小鼠的疼痛也增加,呈现出时间及剂量依赖性;在CCI+NS组与CCI+Eph组中,后者caspase-3表达减少,说明EphBs在减轻疼痛的过程中可能通过caspase-3发挥作用。上述结果间接验证了假设的合理性。
综上所述,不难得出结论,ephrinB2/EphB1信号通路参与疼痛过程,其中ephrin引起疼痛而Eph可减轻疼痛,并且此信号通路是通过caspase-3机制发挥作用,这一理论提示脊髓背角神经元的凋亡可能是ephrinB2/EphB1信号通路作用于疼痛的机制之一,该通路将成为临床治疗疼痛的又一新靶点。
[参考文献]
[1]Kunihiro N, Aya N, Sosuke O, et al. P2X4 receptor expression in a rat model of trigeminal neuropathic pain[J].Neuroreport , 2010,21(8):559-563. DOI: 10.1097/WNR.0b013e32833980b2.
[2]Attal N. Neuropathic pain: mechanisms, therapeutic approach, and interpretation of clinical trials[J].Continuum(MinneapMinn),2012,18(1):161-175. DOI:10.1212/01.CON.0000411564.41709.2d.
[3]吕正涛,牟子君,李熳. 轴突导向因子与疼痛之间关系的研究进展[J]. 中国医药导报,2014,10(21):34-37. DOI: 10.3969/j.ism.1673-7210.2013.21.010.
[4]de Wit J, Verhaagen J. Proteoglycans as modulators of axon guidance cue function[J]. Adv Exp Med Biol , 2007,600(7):73- 89.DOI: 10.1007/978-0-387-70956-7_7.
[5]de Novellis V, Siniscalco D, Galderisi U, et al.Blockade of glutamate mGlu5 receptors in a rat model of neuropathic pain prevents early over-expression of pro-apoptotic genes and morphological change in dorsal horn lamina II[J]. Neuropharmacology,2004,46(4):468-479.
[6]Sekiquchi M, Sekiquchi Y, Konno S, et al. Comparison of neuropathic pain and neuronal apoptosis following nerve root or spinal nerve compression[J]. Eur Spine J, 2009,18(12):1978-1985. DOI: 10.1007/s00586-009-1064-z.
[7]Hylden JL, Wilcox GL. Intrathecal morphine in mice: a new technique[J]. Eur J Pharmacol,1980,67(2-3):313-316.
[8]Bennett GJ, Xie YK.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87- 107. DOI: 10.1016/0304-3959(88)90209-6.
[9]Dixon WJ. Efficient analysis of experimental observations[J]. Annu Rev Pharmacol Toxicol,1980,20:441-462 . DOI: 10.1146/annurev.pa.20.040180.002301.
[10] Hargreaves K, Dubner R, Brown F, et al. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32(1):77-88.DOI: 10.1016/0304-3959(88)90026-7.
[11] Yu LN, Zhou XL, Yu J,et al. PI3K contributed to modulation of spinal nociceptive information related to ephrinBs/EphBs[J]. PLoS ONE, 2012,7(8):e40930. DOI: 10.1371/journal.pone.0040930.
[12] Barthet G, Dunys J, Shao Z, et al. Presenilin mediates neuroprotective functions of efnB and BDNF and regulates ligand-induced internalization and metabolism of EphB2 and TrkB receptors[J]. Neurobiol Aging,2013 34(2): 499-510. DOI: 10.1016/j.neurobiolaging.2012.02.024.
[13] Krull CE, Lansford R, Gale NW, et al. Interactions of Eph-related receptors and ligands confer rostrocaudal pattern to trunk neural crest migration[J]. Curr Biol, 1997,7(8):571-580.
[14] 黄小丽,彭彬.突触可塑性与神经病理性疼痛[J].中国疼痛医学杂志,2014,20(9):655-657. DOI:10.3969/j.issn.1006-9852.2014.09.012.
[15] Ruan JP, Zhang HX, Lu XF, et al.EphrinBs/EphBs sisllaling is involved in modulation of spinal nocieeptive processing through a mitogen-activated protein kinases-dependent mechanism[J].Anesthesiology,2010,112(5):1234-1249. DOI: 10.1097/ALN.0b013e3181d3e0df.
[16] Song XJ, Zheng JH, Cao JL, et al. EphrinB-EphB receptor signaling contributes to neuropathic pain by regulating neural excitability and spinal synaptic plasticity in rats[J]. Pain, 2008, 139(1):168-180.DOI: 10.1016/j.pain.2008.03.019.
[17] Scholz J, Broom DC, Youn DH, et al.Blocking caspase Activity Prevents Transsynaptic Neuronal Apoptosis and the Loss of Inhibition in Lamina II of the Dorsal Horn after Peripheral Nerve Injury[J]. J Neurosci,2005,25(32):7317-7323.
(本文编辑:张阵阵)
Research on the role of caspase-3 in the regulation of neuropathic pain induced by ephrinBs/EphBs signal pathway in mice
Yang Mei, Li Jian, Yang Rui, Wang Haowei, Yuan Hongbin
(DepartmentofAnesthesiology,ChangzhengHospital,SecondMilitaryMedicalUniversity,Shanghai200003,China)
[Abstract]ObjectiveTo observe the effect of intrathecal ephrinB2-Fc and EphB1 treatment on the neuropathic pain and the expression level of caspase-3 in dorsal horn of spinal cord in mice.Methods A total of 36 KM mice were evenly randomized into 4 groups: the Sham surgery + normal saline control group (or the Sham + NS group) (n=6), the Sham surgery + EphB1 group (or the Sham+ EphB1 group)( n=6), the CCI + NS group(n=12)and the CCI + EphB1 group(n=12). Mechanical withdrawal threshold (MWT)and thermal withdrawal latency(TWL)were detected one day before and 1, 3, 5, 7 and 14 days after the development of the model. Then, at day 5, 6 mice from the CCI+NS and CCI+EphB1 groups were sacrificed, and L4-5 segments of the spinal cord were collected for the detection of caspase-3 positive cell counts by immunohistochemistry. Another 24 KM mice were taken for study and they were randomly divided into the 4 groups, i.e. the blank control group, normal saline control group (intrathecal injection of 5 μl NS), the 0.1 μg ephrinB2-Fc group (at a dosage of 0.02 g/L, volume 5 μl) and the 0.5 μg ephrinB2-Fc group(at a dosage of 0.1 g/L, volume 5 μl). MWT and TWL of various groups were detected 3 hours before medication and 3, 6, 9, 12, 24 and 48 hours after medication. Forty-eight hours after surgery, L4-5 segments of the spinal cord were collected for the detection of caspase-3 positive cell counts by immunohistochemistry.ResultsIn the CCI+EphB1 and CCI+NS groups of the CCl model, the MWT levels at day 1, 3, 5 and 7 after surgery and TWL levels at day 3, 5 and 7 after surgery were all significantly decreased, as compared with those of the Sham+NS and Sham+EphB1 groups (P<0.05). As compared with the blank control and NS control groups, the expression level of caspase-3 was obviously decreased, and MWT and TWL were significantly increased(P<0.05). In the ephrin B2-Fc group, there were no significant changes in MWT, TWL and caspase-3 levels for the bland control and NS groups, as compared with those before treatment(P>0.05). As compared with those before treatment, the MWT and TWL levels for the 0.1 μg and 0.5 μg ephrinB2-Fc groups were significantly decreased, positive Caspase-3 counts were significantly increased. Statistical significance could be seen, when comparisons were made(P<0.05). The higher the concentrations, the lower the levels of MWT and TWL, and there were more positive cells.ConclusionIntrathecal injection of ephrinB2-Fc and EphB1 could increase and reduce the mechanical and heat hyperalgesia, the mechanism of which might be associated with the regulation of the expression of caspase-3.
[Key words]Neuropathic pain; Caspase-3; EphrinB2-Fc; EphB1; Intrathecal injection
[基金项目]国家自然科学基金面上项目(81371253、81171054),上海市教委创新基金重点项目(1477083)
[作者单位]200003上海,第二军医大学长征医院麻醉科
[通信作者]袁红斌,电子信箱:jfjczyy@aliyun.com
[中图分类号]R747
[文献标识码]A[DOI]10.3969/j.issn.1009-0754.2016.03.009
(收稿日期:2016-01-03)
·基础医学··论著·

