早产低出生体质量儿的肠外营养管理
唐彬秩,李茂军,吴 青,阳 倩,石 伟,陈昌辉
(四川省医学科学院·四川省人民医院儿科,四川 成都 610072)
早产低出生体质量儿的肠外营养管理
唐彬秩,李茂军,吴青,阳倩,石伟,陈昌辉
(四川省医学科学院·四川省人民医院儿科,四川 成都610072)
[摘要]肠外营养(parenteral nutrition,PN)是早产/低出生体质量儿(preterm or low birth weight infants,P/LBWI)在生后早期和(或)某些疾病状态下所必需的营养方式,作为肠内营养(enteral nutrition,EN)的一种辅助方式,可最大限度地降低P/LBWI营养不良的风险,尽快达到P/LBWI生后营养的目标。本文从PN的适应证、不良反应、规范使用、尚待解决的问题等方面,就近年来P/LBWI尤其是极低出生体质量儿(very low birth weight infants,VLBWI)和超低出生体质量儿(extremely low birth weight infants,ELBWI)的PN管理的最新实践进行归纳整理,旨在为P/LBWI的营养供给提供参考。
[关键词]早产儿;低出生体质量儿;极低出生体质量儿;超低出生体质量儿;肠外营养
优先数字出版地址:http://www.cnki.net/kcms/detail/51.1688.R.20160516.1741.006
新生儿重症监护室(NICU)的重要目标之一是防止营养不良、宫外生长迟缓以及由此继发的病死率增加[1]。早产儿生后营养的目标是“提供维持与宫内生长速度相当的生长速度,与同胎龄段早产儿发育程度相当的营养”[2]。早产/低出生体质量儿[(preterm or low birth weight infants, P/LBWI),出生胎龄<37 周,出生体质量<2 500 g]受多种因素影响,仅通过肠内营养(enteral nutrition,EN)要达到这一目标很困难,尤其是在生后早期,常需借助肠外营养(parenteral nutrition,PN)补给。
1肠外营养的重要性和适应证
1.1重要性P/LBWI出生时尚未具备良好的胃肠道功能和(或)受各种疾病的影响,无法在生后很快启动经胃肠道喂养,往往需要通过一段时间的训练和功能锻炼才能开始EN。P/LBWI的营养储备有限,发生营养不良的风险较高,容易出现神经系统发育不良等后果[1]。胎龄越小,水分所占身体体积质量就越大。胎龄24周的早产儿其体内90%是水,剩余一些蛋白质成分和少许矿物质[3]。这些含量有限的蛋白质成分是早产儿体内最大的能量储备库,当机体不能获得足够的外源性能量物质时,它们就会被动员用于供能,从而失去作为组织器官组成成分的生理意义。超低出生体质量儿(extremely low birth weight infants, ELBWI)出生体质量<1 000 g,生后如果不给予外源性能源物质,体内的能量储备只够维持2~3 d。因此,所有ELBWI和胎龄<28周的超早产儿都应被视为“营养紧急状态”[1]。
新生儿PN(足量的葡萄糖、电解质、氨基酸、搭配静脉脂肪乳或其他营养物质)最初起源于20世纪60年代晚期1例关于“新生儿全部从静脉获得营养”的病案报道[4]。目前PN被认为是大多数早产儿生后最初几天所必需的医疗干预,对坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、消化道畸形、肠梗阻等胃肠道疾病或因心/肺等疾病需要有创机械通气不能经胃肠道喂养的患儿至关重要[5]。
1.2适应证与大多数医疗干预一样,PN有利也有弊。需要根据不同的临床实际情况来综合评估,作出是否使用PN的合理判断。一般认为,极早早产儿(≥22周~<28 周)、极低出生体质量儿[(very low birth weight infants,VLBWI),出生体质量<1 500 g]和ELBWI能从PN中获益。目前,多数发达国家主张PN常规用于胎龄<30 周和(或)出生体质量<1 250 g者。发展中国家推荐,胎龄<32周和(或)出生体质量<1 500 g也可使用。依据发育成熟度,在完全建立EN之前,使用PN的“过渡期”通常为1~2 周[6]。
PN的目的是尽可能地满足患儿的营养需要,在条件允许时,应当优先考虑通过EN(尤其是母乳喂养)获得能量。PN使循序渐进的经口喂养成为可能,加量过快的经口喂养可能导致NEC的发生率增加,但这一论点尚需作进一步的研究来证实。PN能有效地防止P/LBWI和部分经胃肠道喂养的患儿发生负氮平衡[7],促进体质量增长[8],也有助于神经系统认知功能的发展[9]。
2肠外营养的潜在风险和不良反应
2.1潜在风险PN也会带来一系列的风险,包括氧化物超载、代谢紊乱(如高血糖、低血糖、高三酰甘油血症、代谢性骨病)、肝功能异常(如胆汁淤积、肝损伤);一些有毒元素(如铝)在大组制备过程中可能被带入PN溶液;静脉置管阻塞和(或)位置不当、液体外渗、静脉血栓、导管相关性血行感染;PN配方计算错误[液量和(或)配方组分不当]所致的高血糖症/低血糖症、高氯性酸中毒等电解质失衡、微量元素和(或)维生素缺乏、细菌或真菌感染的风险大大增加等问题[1]。
PN作为建立EN前的“桥梁”,也适用于一些胃肠道结构或功能异常的患儿。NEC患儿术前及术后应用PN就是典型例子。NEC患儿通常需要单独使用数日或数周PN,应注意渐渐发生的营养缺乏,尤其是一些微量元素(如锌、锰、碘)和维生素(如脂溶性维生素)的缺乏[10]。与PN相关的氧化物超载等因素还可导致肝功能异常,加重不能正常使用EN的风险,这类问题在长期接受PN的新生儿显得尤为突出[11]。
NICU大多经脐静脉置管或经皮行中心静脉置管(peripherally inserted central catheter, PICC)。推荐预计较长时间接受PN的患儿使用PICC。需要注意,PICC可引起局部皮肤感染、血栓性静脉炎、侵袭性细菌和真菌感染,甚至引起致命的心包填塞(由于导管尖端戳破心房壁)和导管位置错误进入实体器官(例如肝脏)或体腔(例如胸腔、腹腔等等)。PN也可通过外周静脉进行,以避免或降低上述风险。尽管有关经外周PN的张力和渗透压的上限尚无定论,但PN溶液通常是高渗的,一旦渗透压超过800~1 200 mOsm/L易引起局部液体外渗导致长期损伤[1]。PN溶液输入量过多、输注速度过快还将导致VLBWI发生支气管肺发育不良(bronchopulmonary dysplasia,BPD)的风险增加[12]。
2.2不良反应研究表明,铝的摄入与成年后神经系统发育不良、腰椎和髋骨骨盐沉积不良有关[13]。这些长期不良效应提示,应注意在PN溶液的制备和使用过程中减少或完全避免铝的污染。
还需重视静脉滴入脂肪所带来的短期内血液循环中胆固醇和三酰甘油水平上升等不良反应。1项长期随访研究显示,新生儿脂类物质的输注增加了青年期主动脉硬化的风险,这与输注期间血清胆固醇的水平变化有关[14]。与同龄足月儿比较,早产儿更易发生肥胖和异常脂肪分布,这与过分强调脂肪乳供能的早期营养策略有关[15]。在严重出血倾向、出凝血指标异常、血浆间接胆红素升高等情况下,需要酌情减少脂肪乳制剂的剂量。
已有很多PN所致高氨血症的报道。氨基酸组分由必需氨基酸和非必需氨基酸搭配以满足机体对氮的需求,但在早产儿领域,尚无PN氨基酸配方的“金标准”,氨基酸组分的最佳配比仍不清楚。目前大多数商品配方的设计原则是使接受PN的患儿的血浆组分与脐血或母乳喂养患儿的相似[16]。由于不同氨基酸的利用代谢途径存在很大差异,花费较大的人力物力检测血浆氨基酸代谢相关产物的水平以预测最佳摄入质量分数,对临床实际工作并无太大意义。高剂量的氨基酸补充可能导致早期代谢紊乱,出现过高的或不成比例的血清氨基酸水平,这在超早产儿中特别明显[17]。最近Bonsante等[18]在报道早产儿(胎龄≤33 周)早期氨基酸摄入对钙磷平衡的影响时发现,在高剂量组[平均氨基酸摄入>2 g/(kg·d)],低磷血症和高钙血症的发生率较中剂量组[1.5~2 g/(kg·d)]和低剂量组 [<1.5 g/(kg·d)]明显增加。这种血清中钙/磷不平衡的可能机理是胃肠道外氨基酸和能量被摄入后处于持续的同化状态,从而促进了细胞对磷的摄入,并导致骨骼中钙的动员增加,增加了早产儿骨组织矿化(mineralization)不全的风险。Blanco等[16]的研究表明,在ELBWI中,早期和高剂量的氨基酸供给,尽管是暂时性的,与生后18个月时神经系统预后不良存在一定关联,提示不应忽视患儿血浆中特定氨基酸过高对发育中脑组织的潜在毒性。由此可见,早期肠道外氨基酸营养供给并非“越多越好”;当然,氨基酸水平不足也会阻碍正常的生长发育。
早产儿体内儿茶酚胺、胰岛素等激素分泌调节不稳定和激素抵抗,在PN期间易出现血糖的较大波动。低血糖症对大脑的损伤已有共识。近年的研究已表明,高血糖症与病死率、脑室内出血、脓毒症及慢性肺疾病的增加有关[1]。
新生儿医护人员需要高度关注和重视P/LBWI接受PN可能发生的上述风险和问题,在PN开始之前即做好与家属的沟通和解释工作。
3肠外营养的规范使用
PN对P/LBWI具有重要意义,使用中存在多种风险。PN的合理应用需要解决好几个问题,包括合理的溶液组配方、把能量物质浓缩到高渗状态而没有沉淀渗出、静脉通道的安全、制备和使用过程中的无菌操作、对可能出现的代谢平衡问题要有充分的估计、恰当的监测和及时的处理。
3.1肠外营养配方国外指南推荐,VLBWI和ELBWI的氨基酸(蛋白质)摄入为3.5~4 g/(kg·d),脂肪摄入为3~4 g/(kg·d),再加上足够的碳水化合物,使总热量达到377~461 kJ/(kg·d)[1]。已有系统评价对卡尼汀、半胱氨酸、谷氨酸、牛磺酸等营养素添加的意义[19]和脂肪乳的添加时机进行评估[20]。但启用PN时,什么是三大营养素的最佳搭配配方、生后最初几天以什么速度增加这些营养物质合适,尚无定论。
3.1.1氨基酸为防止VLBWI出现负氮平衡,一般推荐氨基酸的最小起始剂量为1.0~1.5 g/(kg·d)。低于此水平,胎龄越小的VLBWI,体内蛋白质丢失的速度越快。超早产儿蛋白质的丢失速度大约是足月儿的2倍[21]。一些NICU 采用“早期和激进的PN方案”,其目的是在生后数小时内开始应用相对高剂量的氨基酸[2~3 g/(kg·d)],以预防负氮平衡,减少宫外营养不良的发生率和严重程度[1]。超早产儿生后早期能耐受的氨基酸剂量为3 g/(kg·d),并能获得理想的蛋白质累积和氮平衡[22]。1项比较了不同剂量的随机临床研究表明,PN氨基酸的剂量为3.5 g/(kg·d)对生后最初几周的早产儿是安全的[21]。目前尚无证据证明比这更高的剂量还能带来更多的益处。大多数RCT试验表明,早期和高剂量[目标剂量3.5~4.9 g/(kg·d)]氨基酸方案并不会促进长期体格和神经系统发育[17]。蛋白质/能量比是很重要的指标,但最佳的比例是多少尚无定论。大多数专家建议,PN大组每提供大约84~105 kJ的非蛋白性能量就需要配套有1 g氨基酸(或等量蛋白质),这样才能满足体质量增长的需要[23]。1项纳入102例VLBWI的观察表明,如果采用“激进的”PN营养方案,可大大降低宫外生长迟缓(extrauterine growth retardation, EUGR)的发生率。使用标准的PN溶液(100 mL含有2.7 g氨基酸和12 g葡萄糖以及一些电解质和矿物质),可以达到生后第1周平均3.2 g/(kg·d)的氨基酸摄入量和335 kJ/(kg·d)的能量[24]。
3.1.2脂肪脂肪乳是很好的能量来源。在生后早期(第1天)用2 g/(kg·d)剂量的脂肪乳很安全[7]。只要没有发生高脂血症(血三酰甘油水平>2 mmol/L),就应当快速达到3.0~4.0 g/(kg·d)的剂量[25]。早产儿短期使用脂肪乳不会增加呼吸道疾病和代谢异常(例如高血糖)的发生率,但不推荐长期大剂量地使用。脂肪乳制剂可提供必需脂肪酸,维持足量的长链不饱和脂肪酸(polyunsaturated fatty acids, PUFA)水平,减少脂质过氧化。目前广泛用于新生儿的是大豆油乳剂(soybean oil, SO)。SO富含ω-6 PUFA亚油酸,在过氧化代谢过程中可能引起毒性作用及促炎因子的活化。在最新的制备技术中,已用椰子油(富含中链三酰甘油)、橄榄油等代替SO,从而减少亚油酸的含量[26]。也有人开始应用富含长链ω-3 脂肪酸(EPA、DHA)的鱼油。长链ω-3脂肪酸是抗炎介质的前体,短期益处包括脂质过氧化的减少及对脂肪酸组分结构的优化[27]。已有研究证实,使用混合有鱼油的SO脂肪乳或使用低剂量的仅含鱼油配方的脂肪乳制剂,可减少PN相关的肝脏疾病[28]。
3.1.3碳水化合物碳水化合物(葡萄糖)应用的上限[12~14 mg/(kg·min)]取决于葡萄糖氧化供能和糖原储备的能力,也受胎龄和临床状况的影响。早产儿血糖水平应维持在2.6 mmol/L以上。在感染、应激等状态下,早产儿血糖常常>10 mmol/L,此时只需暂停或通过下调葡萄糖输入速度至4 mg/(kg·min)以下即可纠正高血糖。常规的胰岛素输注并无多大益处,反而会增加低血糖及由此带来的致死事件[29]。PN中氨基酸的应用对控制高血糖有所帮助,这可能是一些氨基酸(例如精氨酸和支链氨基酸)活化了胰岛素/IGF-1信号轴[30]。
3.1.4个体化和标准化的肠外营养配方个体化的PN配方(individual prescriptions for PN, IPN)q 24~48 h开具1次。Devlieger 等[31]认为,大部分早产儿能耐受输注液体配方的改变,可以使用标准化PN (standard PN, SPN)的搭配组合,不会出现明显的电解质紊乱。与IPN比较,SPN的优势体现在能提供更好的营养、减少处方的开具和处方错误、减少污染机会及节省花费[32]。国外一些NICU随时备有现成的SPN。
有的病区提供压缩体积的SPN以满足营养需求及限液要求,或者用于那些已经开始经口喂养的患儿。新西兰的1个NICU为生后最初3天的ELBWI的起始PN配方是每30 mL提供 2 g/(kg·d)氨基酸的溶液,此后及更大一些的患儿每100 mL提供 3.5~4 g/(kg·d)氨基酸的溶液[1]。英国的1项研究认为,使用标准化的浓缩型肠外营养(standardized concentrated added macronutrients parenteral,SCAMP),即使限液也可满足能量需要[33]。
近年已开发出商品化的即用型多隔层PN溶液包。溶液包含有3个独立的溶液小室(第3个小室的脂肪乳可选择是否添加),每100 mL配方溶液提供3.1 g氨基酸、13.3 g葡萄糖和2.5 g脂肪乳。其优点是被污染的机会少,可储存时间长,可提供足量的早期营养供给。为了增加稳定性及减少过氧化反应,维生素、微量元素和常规电解质由医院药房或临床医护人员临用前添加。这能为生后第1周提供足够的营养供给[>2.5 g/(kg·d)氨基酸和>314 kJ/(kg·d)的能量],并促进体质量增长达到合理水平[生后第1周达到22 g/(kg·d)][34]。需要注意的是,长期使用PN可抑制胆汁分泌导致胆汁淤积和肝损伤,加用熊去氧胆酸则可促进胆汁分泌。
3.2肠外营养制备、存储及输注中的质量控制PN须在严格的质量控制下制备和使用,包括严格的无菌操作和营养师的指导。氨基酸、葡萄糖和电解质溶液为高渗,葡萄糖质量分数>12.5%的溶液需要通过中心静脉输入,通常情况下不超过20%。在渗透压允许的情况下,PN可通过外周静脉输注,但大多数情况下还是需要通过中心静脉置管输注。标准的PN配方在生后最初几天都可以满足患儿需要,对输入液量的限制往往意味着营养物质尤其是氨基酸不能足量输入。
目前国内NICU多采用所谓的“全合一(All-in-One)”输注方式,脂肪乳制剂、氨基酸、葡萄糖、维生素、电解质和微量元素等各种营养素在无菌条件下混于一体经静脉途径输注。全合一静脉营养是一种安全、有效、低风险的策略,优点是易管理,减少相关并发症,有利于各种营养素的利用,并节省费用;缺点是混合后不能临时改变配方。采用输液瓶串联或并联的多瓶输液方式,适用于不具备无菌配制条件的单位,可根据患儿病情变化情况灵活地调整配方。目前较少采用,因其工作量相对大,易出现血糖、电解质紊乱,且不利于营养素充分利用[35]。
无论是自行配制或购买现成的商品,都需要在严格的“清洁环境”下制备PN溶液,包括层流室、使用确认合格的材料。定期对制备的PN溶液抽样进行无菌和质量检查,定期培训制备溶液的工作人员。加入溶液中的电解质必须较好地溶于溶剂;钙和磷盐可能会形成沉淀,加入溶液的量需要控制。所有的溶液都需要仔细观察是否清澈、有无颗粒物和渗漏。电脑打印的工作表和标签有助于减少错误概率[1]。制备好的PN溶液在临用前可以进行过滤。有人推荐,在PN输注时再加用管路过滤器以保护患儿不受磷酸钙沉淀、容器中的颗粒物或者微生物污染的影响。
暴露于光源所产生的氧化反应可能在PN溶液中生成具有潜在毒性的过氧化物。脂肪乳制剂也是过氧化物的来源之一,应尽量在避光的条件下输注脂肪乳制剂。有趣的是,在外周静脉输液时,静脉使用脂肪乳制剂可减少静脉炎的发生。一些病房采用在脂肪乳制剂中加入脂溶性和水溶性维生素的策略,因为脂肪乳制剂可以减少光照对维生素的破坏。维生素加入到脂肪乳制剂中,比在氨基酸/葡萄糖溶液中更容易被吸收利用[1]。
应当使用一次性的输液包、输液瓶、注射器等器具进行溶液的输注,器具一旦破损则严禁使用。最好不要向PN溶液中加入药物或与其他液体混在一起输注,这会引起一些不相溶反应或污染溶液。
PN的稳定性取决于溶液成分。商品化的氨基酸/葡萄糖/电解质一般能保存数月。考虑到污染的可能性,PN大组一旦配好需在48 h内用完。
3.3接受肠外营养早产儿/低出生体质量儿的监测目前尚无公认的评估PN安全性和有效性的最佳方法,对PN在早产儿的应用监测也因病区不同而异。监测指标合格与否,可参照相关的标准参考范围值。典型的监测策略见表1。
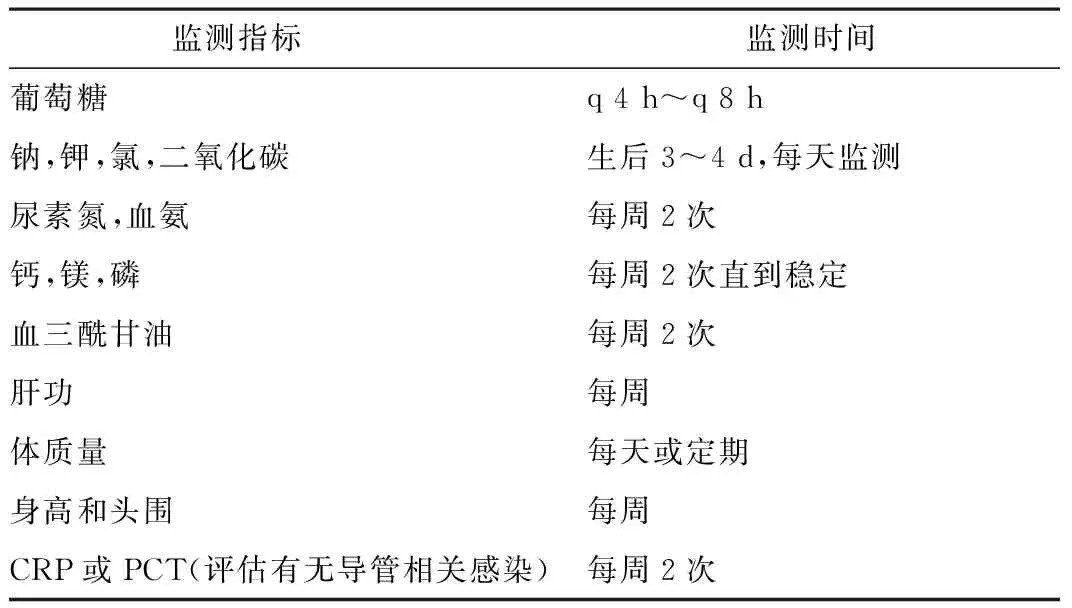
表1 早产儿PN应用监测的参考策略[1]
生后生长曲线可用于比较VLBWI和病情稳定的同龄儿。尽管有人认为这样的比较有参考意义,但可能增加被诊断为EUGR的早产儿的比例。是否应当促进早期的追赶生长,已成为EUGR早产儿营养学研究的热点。即便对神经系统预后有潜在好处,但人们越来越关注到一味追求快速的追赶生长对成年后心血管系统和代谢系统健康的不利影响,尤其是LBWI或有宫内生长受限(intrauterine growth restriction,IUGR)的早产儿[36]。
4肠外营养策略及尚需解决的问题
多年来一直在新生儿领域推广使用PN,其适应证、配方组分、合理的制备、给予方式、是否需要建立中心静脉通道、监测策略等方面还存在一些争议。PN是一种相对安全的满足营养摄入需要的方式,在早产儿生后早期得到广泛应用,其短期应用的益处显而易见,PN的长期益处尚缺乏研究。
4.1肠外营养策略不同的病区应根据当地的具体情况,制定PN和经胃肠道喂养的策略,从而趋利避害。国外指南推荐的PN策略见表2。
P/LBWI合理、规范的PN包括[1]:(1)制定出符合病区实际、有据可循的指南,与营养学专家保持联系,最好团队中有一名新生儿营养师。(2)标准化PN溶液可以随时取得,制备和使用过程中严格无菌操作,保证静脉通道的安全。(3)生后最初几天起始PN的管理应达到表2的要求。(4)鼓励母乳喂养,除病情极其不稳定的患儿外,尽量让患儿在生后24 h内摄入母亲的初乳。(5)有明显电解质紊乱、高血糖、液体限制时,需要制定个体化的PN方案[组成成分、体积分数和(或)质量分数]。(6)如果母乳摄入量增加,则需要相应减少PN量,生后最初几天总液体量不应超过150~175 mL/(kg·d)。当胃肠道可耐受125~150 mL/(kg·d)的进奶量时,可考虑停止PN。(7)参照表1定期做好相应的结果检查和效果评估。

表2 生后第1周推荐经PN摄入营养物质的目标量[1]
4.2肠外营养存在的问题1项纳入264例新生儿PN应用的问卷调查发现,规范使用PN的比例仅有24%,28%没有及时认识到PN的必要性,即便上级医师下达了PN医嘱仍有17%没有及时执行,37%的起始PN处方没有满足患儿需求,19%在使用过程中被发现没有提供足够能量;患儿病程记录中,通常没有记录PN应用情况,极少有医院拥有多学科营养团队。需要综合考虑PN配方成分、输注方式、质量控制具有高度变异,最佳的使用方法尚无定论。
2005年欧洲儿科胃肠病肝病和营养学协会(ESPGHAN)和欧洲临床营养与代谢学会(ESPEN)发布了指南,许多人借鉴作为应用依据,应注意指南只是建立在有限的证据和专家们的判断之上。在此之后仅仅开展过屈指可数的几项大型随机对照试验。最佳的蛋白质/能量比是多少?怎样的氨基酸配比可以提供最优化的蛋白质积累并减少氨基酸过量或不足带来的毒副作用?怎样的PN方案最有利于婴儿和儿童期神经认知预后并使长期代谢风险降至最低?胎龄大于32周、情况稳定的早产儿PN的使用是否仍然利大于弊?这一系列的问题仍有待于新生儿科医师的进一步探索和解答。
参考文献:
[1]EMBLETON N D, SIMMER K. Practice of parenteral nutrition in VLBW and ELBW infants[J]. World Rev Nutr Diet, 2014, 110(1): 177-189.
[2]AGOSTONI C, BUONOCORE G, CARNIELLI V P, et al. Enteral nutrient supply for preterm infants: commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition[J]. J Pediatr Gastroenterol Nutr, 2010, 50(1): 85-91.
[3]KOLETZKO B, GOULET O, HUNT J, et al. Guidelines on paediatric parenteral nutrition of the European Society of Paediatric Gastroenterology,Hepatology and Nutrition(ESPGHAN)and the European Society for Clinical Nutrition and Metabolism(ESPEN),supported by the European Society of Paediatric Research(ESPR)[J]. J Pediatr Gastroenterol Nutr, 2005, 41(Suppl 2): S1-S87.
[4]WILMORE D W, DUDRICK S J. Growth and development of an infant receiving all nutrients exclusively by vein[J]. JAMA, 1968, 203(10): 860-864.
[5]KOLETZKO B K, GOULET K, SHAMIR R. A practical reference guide[M]. Basel: Karger, 2008: 3-6.
[6]TAN M J, COOKE R W. Improving head growth in very preterm infants-a randomised controlled trial Ⅰ: neonatal outcomes[J]. Arch Dis Child Fetal Neonatal Ed, 2008, 93(5): F337-F341.
[7]VLAARDINGERBROEK H, VERMEULEN M J, ROOK D, et al. Safety and efficacy of early parenteral lipid and high-dose amino acid administration to very low birth weight infants[J]. J Pediatr, 2013, 163(3): 638-644.e1.
[8]MOYSES H E, JOHNSON M J, LEAF A A, et al. Early parenteral nutrition and growth outcomes in preterm infants: a systematic review and meta-analysis[J]. Am J Clin Nutr, 2013, 97(4): 816-826.
[9]STEPHENS B E, WALDEN R V, GARGUS R A, et al. First-week protein and energy intakes are associated with 18-month developmental outcomes in extremely low birth weight infants[J]. Pediatrics, 2009, 123(5): 1337-1343.
[10]SHAH M D, SHAH S R. Nutrient deficiencies in the premature infant[J]. Pediatr Clin North Am, 2009, 56(5): 1069-1083.
[11]CHESSEX P, WATSON C, KACZALA G W, et al. Determinants of oxidant stress in extremely low birth weight premature infants[J]. Free Radic Biol Med, 2010, 49(9): 1380-1386.
[12]OH W, POINDEXTER B B, PERRITT R, et al. Association between fluid intake and weight loss during the first ten days of life and risk of bronchopulmonary dysplasia in extremely low birth weight infants[J]. J Pediatr, 2005, 147(6): 786-790.
[13]FEWTRELL M S, BISHOP N J, EDMONDS C J, et al. Aluminum exposure from parenteral nutrition in preterm infants: bone health at 15-year follow-up[J]. Pediatrics, 2009, 124(5): 1372-1379.
[14]LEWANDOWSKI A J, LAZDAM M, DAVIS E, et al. Short-term exposure to exogenous lipids in premature infants and long-term changes in aortic and cardiac function[J]. Arterioscler Thromb Vasc Biol, 2011, 31(9): 2125-2135.
[15]GRIFFIN I J, COOKE R J. Development of whole body adiposity in preterm infants[J]. Early Hum Dev, 2012, 88(Suppl 1): S19-S24.
[16]BLANCO C L, GONG A K, GREEN B K, et al. Early changes in plasma amino acid concentrations during aggressive nutritional therapy in extremely low birth weight infants[J]. J Pediatr, 2011, 158(4): 543-548.e1.
[17]LEE B S. Nutritional strategy of early amino acid administration in very low birth weight infants[J]. Korean J Pediatr, 2015, 58(3): 77-83.
[18]BONSANTE F, IACOBELLI S, CHANTEGRET C, et al. The effect of parenteral nitrogen and energy intake on electrolyte balance in the preterm infant[J]. Eur J Clin Nutr, 2011, 65(10): 1088-1093.
[19]TUBMAN T R, THOMPSON S W, MCGUIRE W. Glutamine supplementation to prevent morbidity and mortality in preterm infants[J]. Cochrane Database Syst Rev, 2005(1): CD001457.
[20]VLAARDINGERBROEK H, VELDHORST M A, SPRONK S, et al. Parenteral lipid administration to very-low-birth-weight infants-early introduction of lipids and use of new lipid emulsions: a systematic review and meta-analysis[J]. Am J Clin Nutr, 2012, 96(2): 255-268.
[21]EMBLETON N D. Optimal protein and energy intakes in preterm infants[J]. Early Hum Dev, 2007, 83(12): 831-837.
[22]THUREEN P J, MELARA D, FENNESSEY P V, et al. Effect of low versus high intravenous amino acid intake on very low birth weight infants in the early neonatal period[J]. Pediatr Res, 2003, 53(1): 24-32.
[23]TE BRAAKE F W, VAN DEN AKKER C H, RIEDIJK M A, et al. Parenteral amino acid and energy administration to premature infants in early life[J]. Semin Fetal Neonatal Med, 2007, 12(1): 11-18.
[24]SENTERRE T, RIGO J. Optimizing early nutritional support based on recent recommendations in VLBW infants and postnatal growth restriction[J]. J Pediatr Gastroenterol Nutr, 2011, 53(5): 536-542.
[25]UTHAYA S, THOMAS E L, HAMILTON G, et al. Altered adiposity after extremely preterm birth[J]. Pediatr Res, 2005, 57(2): 211-215.
[26]DESHPANDE G, SIMMER K. Lipids for parenteral nutrition in neonates[J]. Curr Opin Clin Nutr Metab Care, 2011, 14(2): 145-150.
[27]RAYYAN M, DEVLIEGER H, JOCHUM F, et al. Short-term use of parenteral nutrition with a lipid emulsion containing a mixture of soybean oil, olive oil, medium-chain triglycerides, and fish oil: a randomized double-blind study in preterm infants[J]. JPEN J Parenter Enteral Nutr, 2012, 36(Suppl 1): 81S-94S.
[28]KOLETZKO B, GOULET O. Fish oil containing intravenous lipid emulsions in parenteral nutrition-associated cholestatic liver disease[J]. Curr Opin Clin Nutr Metab Care, 2010, 13(3): 321-326.
[29]BEARDSALL K, VANHAESEBROUCK S, OGILVY-STUART A L, et al. Early insulin therapy in very-low-birth-weight infants[J]. N Engl J Med, 2008, 359(18): 1873-1884.
[30]MAHAVEER A, GRIME C, MORGAN C. Increasing early protein intake is associated with a reduction in insulin-treated hyperglycemia in very preterm infants[J]. Nutr Clin Pract, 2012, 27(3): 399-405.
[31]DEVLIEGER H, DE POURCQ L, CASNEUF A, et al. Standard two-compartment formulation for total parenteral nutrition in the neonatal intensive care unit: a fluid tolerance based system[J]. Clin Nutr, 1993, 12(5): 282-286.
[32]KROHN K, BABL J, REITER K, et al. Parenteral nutrition with standard solutions in paediatric intensive care patients[J]. Clin Nutr, 2005, 24(2): 274-280.
[33]MORGAN C, HERWITKER S, BADHAWI I, et al. SCAMP: standardised, concentrated, additional macronutrients, parenteral nutrition in very preterm infants: a phase Ⅳ randomised, controlled exploratory study of macronutrient intake, growth and other aspects of neonatal care[J]. BMC Pediatr, 2011, 11(1): 53.
[34]RIGO J, MARLOWE M L, BONNOT D, et al. Benefits of a new pediatric triple-chamber bag for parenteral nutrition in preterm infants[J]. J Pediatr Gastroenterol Nutr, 2012, 54(2): 210-217.
[35]中华医学会肠外肠内营养学分会儿科学组.中华医学会儿科学分会新生儿学组,中华医学会小儿外科学分会新生儿外科学组.中国新生儿营养支持临床应用指南[J].中华小儿外科杂志,2013,34(10):782-787.
[36]ROGERS L K, VELTEN M. Maternal inflammation, growth retardation, and preterm birth: insights into adult cardiovascular disease[J]. Life Sci, 2011, 89(13/14): 417-421.
基金项目:四川省人民医院博士基金资助项目(项目号:30305030580)
通信作者:陈昌辉,chen966888@126.com
[中图分类号]R722.1
[文献标识码]A
DOI:10.11851/j.issn.1673-1557.2016.03.030
(收稿日期:2015-12-09)

