新型蛋白酶体抑制剂MLN2238对胃癌细胞增殖、凋亡及细胞周期的影响
郭 锰 万里新 张成辉 徐 赟
(南阳市中心医院肿瘤内科,河南 南阳 473000)
新型蛋白酶体抑制剂MLN2238对胃癌细胞增殖、凋亡及细胞周期的影响
郭锰万里新张成辉徐赟
(南阳市中心医院肿瘤内科,河南南阳473000)
〔摘要〕目的探讨新型蛋白酶体抑制剂MLN2238对胃癌细胞增殖、凋亡及细胞周期的影响。方法取对数生长期胃癌细胞系 BGC-823和SGC-7901,按照MLN2238终浓度0、25、50、75、100 nmol/L分为5组,处理24、48、72 h后采用四甲基偶氮唑蓝比色法(MTT)检测各孔吸光值并计算存活率以评价MLN2238对胃癌细胞的增殖抑制作用;处理48 h后经膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙啶(PI)双标或PI标记后,采用流式细胞术检测胃癌细胞凋亡率及细胞周期的变化。结果相同作用时间(24、48或72 h)下,随着MLN2238浓度的增加,MLN2238处理后BGC-823、SGC-7901细胞的存活率降低(P<0.05);相同MLN2238浓度(25、50、75或100 nmol/L)情况下,除100 nmol/L MLN2238作用24 h和48 h的BGC-823细胞存活率间无统计学差异外(P>0.05),随MLN2238作用时间的延长,MLN2238对BGC-823、SGC-7901细胞的增殖抑制作用也基本呈递增趋势(P<0.05);MLN2238处理BGC-823、SGC-7901细胞48 h后,除75、100 nmol/L MLN2238作用BGC-823细胞各周期细胞比例的差异无统计学意义外(P>0.05),随MLN2238浓度的增加,BGC-823、SGC-7901细胞的凋亡率、G0/G1期细胞比例均升高,S、G2/M期细胞比例降低,且MLN2238的促凋亡效应和促细胞周期G0/G1期阻滞作用呈浓度依赖性(P<0.05)。结论MLN2238可抑制胃癌细胞的增殖并诱导细胞凋亡及G0/G1期阻滞,MLN2238的以上作用与作用时间和作用浓度有关。
〔关键词〕MLN2238;胃癌细胞;增殖;凋亡;细胞周期
目前蛋白酶体已成为一个有效的抗癌治疗靶点〔1,2〕。MLN2238是一种口服活性蛋白酶体抑制剂,为第二代蛋白酶体抑制剂〔3〕。有研究表明,MLN2238有较为广谱的强抗肿瘤作用,不仅在体外可抑制肿瘤细胞株,而且在前列腺癌裸鼠移植瘤上亦有较好的抗癌效果〔4〕。目前MLN2238对胃癌细胞是否有抑制作用尚不清楚,本研究旨在探讨MLN2238对胃癌细胞增殖、凋亡及细胞周期的影响。
1材料与方法
1.1主要试剂胃癌细胞系 BGC-823、SGC-7901购自中国科学院上海生命科学研究院细胞库,新型蛋白酶体抑制剂MLN2238购自美国Selleck公司,青霉素、链霉素购于北京索莱宝科技有限公司,胰蛋白酶、胎牛血清均购自美国Hyclone公司,RPMI-1640培养基购自美国Gibco BRL公司,二甲亚砜(DMSO)、四甲基偶氮唑盐(MTT)及碘化丙锭(PI)购自美国Sigma公司,膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/PI凋亡检测试剂盒购自北京宝赛生物技术有限公司。
1.2细胞培养常规方法复苏于液氮中保存的BGC-823、SGC-7901细胞,培养于含10%灭活胎牛血清、100 U/ml青霉素和100 μg/ml 链霉素的RPMI-1640培养液中,将CO2细胞培养箱的温度设置为37℃、CO2体积分数设置为5%,每2~3天换液一次,待培养至对数生长期时,收集细胞进行实验。
1.3MTT法检测细胞增殖情况采用0.25%胰蛋白酶消化对数生长期BGC-823、SGC-7901细胞后加入新鲜RPMI-1640培养基配制单细胞悬液,以每孔1×104个细胞接种于96孔板中,每孔体积200 μl,常规条件培养24 h后按照MLN2238终浓度0、25、50、75、100 nmol/L分为5组,每组设 3个复孔,处理24、48、72 h后向每孔加入MTT溶液,避光反应4 h后,采用150 μl DMSO溶液替换MTT溶液,在490 nm波长下检测各孔吸光值(A490)并计算存活率以评价MLN2238对胃癌细胞的增殖抑制作用。存活率(%)=(加药组A490/对照组A490)×100%。实验重复3次。
1.4细胞凋亡率及细胞周期检测将密度为3×106/ml的细胞悬液接种于6孔板中,按照MLN2238终浓度0、25、50、75、100 nmol/L分为5组,每组设 3个复孔,常规培养48 h后收集细胞并等分为两部分:(1)经磷酸盐缓冲液(PBS)冲洗及Binding Buffer悬浮后,加入10 μl Annexin V-FITC和5 μl PI,避光反应15 min后上流式细胞仪测定检测细胞凋亡率;(2)加入PI上流式细胞仪测定检测细胞周期。以上操作均严格依据凋亡检测试剂盒说明书。实验重复3次。
1.5统计学处理采用SPSS19.0软件进行t检验、单因素方差分析、LSD-t检验。
2结果
2.1MLN2238处理对胃癌细胞增殖的影响相同作用时间(24、48或72 h)下,随着MLN2238浓度的增加,MLN2238处理后BGC-823、SGC-7901细胞的存活率降低(P<0.05);相同MLN2238浓度(25、50、75或100 nmol/L)情况下,除100 nmol/L MLN2238作用24 h和48 h的BGC-823细胞存活率间无统计学差异外(P>0.05),随MLN2238作用时间的延长,MLN2238对BGC-823、SGC-7901细胞的增殖抑制作用也基本呈递增趋势(P<0.05)。见表1。
2.2MLN2238处理对胃癌细胞凋亡的影响MLN2238处理BGC-823、SGC-7901细胞48 h后,随着MLN2238浓度的增加,BGC-823、SGC-7901细胞的凋亡率均升高,且MLN2238的促凋亡效应呈浓度依赖性(P<0.05)。见表2。
2.3MLN2238处理对胃癌细胞周期的影响MLN2238处理BGC-823、SGC-7901细胞48 h后,除75、100 nmol/L MLN2238作用BGC-823细胞各周期细胞比例的差异无统计学意义外(P>0.05),随MLN2238作用浓度的升高,BGC-823、MLN2238作用后的G0/G1期细胞比例升高,S、G2/M期细胞比例降低,MLN2238对BGC-823、SGC-7901细胞周期G0/G1阻滞作用基本上呈递增趋势(P<0.05)。见表3。
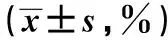
表1 MLN2238处理后BGC-823、SGC-7901细胞的存活率变化
与0 nmol/L比较:1)P<0.05;与25 nmol/L比较:2)P<0.05;与50 nmol/L比较:3)P<0.05;与75 nmol/L比较:4)P<0.05;下表同
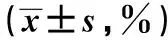
表2 不同浓度MLN2238处理胃癌细胞48 h后的凋亡率
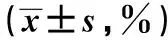
表3 MLN2238处理BGC-823、SGC-7901细胞48 h后细胞周期分布情况
3讨论
蛋白酶体抑制剂硼替佐米和卡非佐米在临床试验的成功运用,表明蛋白酶体抑制剂在抗肿瘤治疗中的重要作用〔5〕。此外,包括Marizomib(又名NPI-0052)、雷公藤红素和EGCG等天然产物在内的多种蛋白酶体抑制剂已进行了临床或临床前阶段〔6〕。MLN2238目前已进入了临床I期试验,研究表明MLN2238具有较强的抗肿瘤效果,可增强第一代蛋白酶体抑制剂或其他化疗药物的抗肿瘤效果〔3,4〕,同时对利妥昔单抗化疗耐药的B细胞淋巴瘤也有较好的杀灭效果〔7〕。本研究发现MLN2238可抑制胃癌BGC-823、SGC-7901细胞的增殖,且该抑制作用呈浓度和时间依赖性,与Wei等〔4〕在前列腺癌细胞中报道的结果一致,表明抑制蛋白酶体活性可能成为多种恶性肿瘤的治疗策略。
蛋白酶体底物在细胞凋亡和细胞周期进程中起重要作用,而阻断蛋白酶体活性可导致蛋白酶体底物的积累,继而影响细胞凋亡和细胞周期进程〔8,9〕。本研究发现MLN2238可升高胃癌BGC-823、SGC-7901细胞的凋亡率,通过直接证据表明MLN2238可诱导胃癌细胞凋亡。有研究表明MLN2238可调控促凋亡蛋白p53 或NOXA的表达,继而诱导多种恶性肿瘤的凋亡〔7〕。因此本研究推测MLN2238可能也通过诱导p53 或NOXA表达来促进胃癌细胞的凋亡。此外,细胞周期调控紊乱是胃癌恶性的主要表现之一〔10,11〕。本研究进一步表明MLN2238可抑制胃癌细胞周期的进程,将细胞阻滞在G0/G1期。但目前MLN2238影响胃癌细胞周期的机制尚不清楚,推测可能与调控G1向S期转化的细胞周期蛋白表达有关。
4参考文献
1韩玉杰,赵松,杨洋,等.蛋白酶体抑制剂MG132联合顺铂诱导肺癌A549细胞凋亡的机制〔J〕.中国老年学杂志,2014;34(9):2496-8.
2Guo N,Peng Z.MG132,a proteasome inhibitor,induces apoptosis in tumor cells〔J〕.Asia Pac J Clin Oncol,2013;9(1):6-11.
3Engür S,Dikmen M,Öztürk Y.Comparison of antiproliferative and apoptotic effects of a novel proteasome inhibitor MLN2238 with bortezomib on K562 chronic myeloid leukemia cells〔J〕.Immunopharmacol Immunotoxicol,2015;15:1-11.
4Wei X,Zhou P,Lin X,etal.MLN2238 synergizes BH3 mimetic ABT-263 in castration-resistant prostate cancer cells by induction of NOXA〔J〕.Tumour Biol,2014;35(10):10213-21.
5周亮华,王明元,王星,等.Carfilzomib联合CP T-11对胃癌SGC-7901细胞增殖、凋亡及NF-κB的影响〔J〕.临床肿瘤学杂志,2014,19(12):1069-74.
6Ma L,Diao A.Marizomib,a potent second generation proteasome inhibitor from natural origin〔J〕.Anticancer Agents Med Chem,2015;15(3):298-306.
7Gu JJ,Hernandez-Ilizaliturri FJ,Mavis C,etal.MLN2238,a proteasome inhibitor,induces caspase-dependent cell death,cell cycle arrest,and potentiates the cytotoxic activity of chemotherapy agents in rituximab-chemotherapy-sensitive or rituximab-chemotherapy-resistant B-cell lymphoma preclinical models〔J〕.Anticancer Drugs,2013;24(10):1030-8.
8刘勇,龙捷,莫祥兰,等.蛋白酶体抑制剂MG132对Raji细胞凋亡、细胞周期及UBE1基因表达的影响〔J〕.中山大学学报(医学科学版),2011;32(3):321-6.
9Gu JJ,Hernandez-Ilizaliturri FJ,Kaufman GP,etal.The novel proteasome inhibitor carfilzomib induces cell cycle arrest,apoptosis and potentiates the anti-tumour activity of chemotherapy in rituximab-resistant lymphoma〔J〕.Br J Haematol,2013;162(5):657-69.
10He J,Zhu G,Gao L,etal.Fra-1 is upregulated in gastric cancer tissues and affects the PI3K/Akt and p53 signaling pathway in gastric cancer〔J〕.Int J Oncol,2015;47(5):1725-34.
11Yao Y,Feng S,Xiao M,etal.MTA1 promotes proliferation and invasion in human gastric cancer cells〔J〕.Oncol Targets Ther,2015;8:1785-94.
〔2015-08-10修回〕
(编辑滕欣航)
〔中图分类号〕R73
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2621-03;
doi:10.3969/j.issn.1005-9202.2016.11.024
第一作者:郭锰(1981-),男,副主任医师,硕士,主要从事恶性肿瘤的介入治疗研究。

