预防性电针对不同月龄大鼠组织自由基及其骨骼肌中MyoD、Myogenin和eMyHC相关蛋白表达的影响
马长春 徐 平 魏 媛 虎 力 温佩彤 张 潮
(上海中医药大学,上海 201203)
预防性电针对不同月龄大鼠组织自由基及其骨骼肌中MyoD、Myogenin和eMyHC相关蛋白表达的影响
马长春1徐平魏媛2虎力温佩彤张潮
(上海中医药大学,上海201203)
〔摘要〕目的探讨预防性电针干预后对不同月龄大鼠组织自由基的影响及机制。方法将30只雄性SD大鼠,随机分为正常对照组3个组和电针组3个组,各组分别为8MN组,14MC组,16MC组;14MEA6组,16MEA6组和16MEA8组。麻醉后快速取腓肠肌,Western印迹测定大鼠腓肠肌中MyoD、Myogenin和eMyHC相关蛋白表达。结果16MEA6组骨骼肌超氧化物歧化酶(SOD)活力明显上升;14MEA6组骨骼肌丙二醛(MDA)值明显下降,血清SOD活力显著上升,血清MDA值明显下降。14MEA6组MyoD值、Myogenin值、eMyHC值比14MC组均有明显上升,16MEA6组MyoD值比16MC组有显著上升,16MEA8组Myogenin值比16MC组有明显上升。结论预防性电针干预增龄性大鼠后,显著提高了机体的抗氧化能力,减轻自由基损伤,尤其在8月龄开始干预,较佳干预周期为6个月。此外,对衰老大鼠的预防性干预作用与IGF-1/AKT信号相关的骨骼肌再生有关。
〔关键词〕预防性电针;增龄衰老;低频电针
骨骼肌萎缩与胰岛素样生长因子(IGF)-1信号通路关系密切〔1,2〕,目前研究〔3〕发现运动可以使IGF-1在局部骨骼肌组织内表达增高。IGF-1的局部作用体现在肌细胞形成过程中,可促进肌细胞分化。严金慧等〔4〕发现吊尾去负荷模型的大鼠比目鱼肌萎缩可能与内源性IGF-1多肽下降有关,随后用小强度耐力练习对其进行干预,发现比目鱼肌恢复更快,这可能由IGF-1多肽表达增加实现。 本研究选用足三里及肾俞作为针刺的穴位,从先天肾精和后天脾胃的角度出发,对预防增龄性骨骼肌萎缩进行研究。
1材料与方法
1.1动物健康6月龄雄性SD大鼠,30只,体质量(420±20)g,清洁级,由上海西普尔-必凯实验动物有限公司提供,动物许可证号:SCXK(沪)2013-0016。
1.2主要实验试剂与药品超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒购自南京建成生物工程研究所,MyoD、Myogenin、内参GAPDH均购于美国abcam公司,eMyHC购于美国DSHB公司,ATP购于美国Fermentas公司。
蛋白定量采用Bradford法,波长595 nm测定蛋白浓度,用标准牛血清白蛋白绘制标准曲线,对制备样品蛋白溶液定量。
1.3主要实验仪器老年大鼠固定装置(上海中医药大学自制);针灸针(0.25 mm×25 mm,无锡佳健医疗器械公司);分光光度计(UV-2000),上海UNICO;离心机(MICRO 17TR),韩国Hanil公司;摇床(TS-92)(其林贝尔);电泳仪(MV-3)和转膜仪(ST-2)(J-MAX);PCR仪(2720型)(美国ABI公司);电泳槽(Mupid 2plus)(日本TAKARA公司);凝胶成像系统(EUV-LDUV)(韩国KoreaBiotech公司)。
检测骨骼肌组织SOD活力和MDA含量结果显示:(1)与8MN组相比,14MC组和16MC组骨骼肌SOD活力显著降低(P<0.01);与14MC组相比,14MEA6组骨骼肌SOD活力升高,但差异不显著;与16MC组相比,16MEA6组骨骼肌SOD活力明显升高(P<0.05)。(2)与8MN组相比,14MC组骨骼肌MDA值明显上升(P<0.01);16MC组骨骼肌MDA值明显上升(P<0.05);与14MC组相比,14MEA6组骨骼肌MDA值明显下降(P<0.05);与16MC组相比,16MEA6组和16MEA8组骨骼肌MDA含量降低,但没有明显差异,见表2。
1.4.5Western印迹测定大鼠腓肠肌中蛋白表达取腓肠肌组织50 mg,粉碎后高速离心,按照BCA蛋白定量试剂盒说明测定蛋白浓度。用分光光度计测定蛋白浓度,加入6倍蓝色电泳上样缓冲液60 μl,将蛋白在沸水中煮5 min后,以20 μl的量上样至SDS-PAGE胶加样孔。用PVDF膜,电压100 V,置于冰浴中进行转膜2 h。将5 g脱脂奶粉加入到100 ml TBS缓冲液配置5%封闭液,将膜置于封闭液中摇摆30 min后,用封闭液将膜立即放入稀释好的MyoD、Myogenin和eMyHc一抗,并置于摇床上均匀摇摆,4℃过夜,用TBS-T洗3次,每次5 min。用封闭液将膜立即放入稀释好的二抗( 1∶1 500的比例)中,放置在摇床上室温内均匀摇摆2 h,用TBS-T洗3次,每次5 min。将膜置于红外荧光扫描成像系统上扫描。以GAPDH作为内参,校正并计算蛋白灰度值。
1.4.1动物分组和造模大鼠适应性饲养1 w后,随机分为正常对照组3个组(分别从6月龄饲养至8、14、16月龄):8个月正常组(8MN组),14个月正常组(14MC组)和16个月正常组(16MC组);电针组分为3个组(分别从8月龄电针干预至14、16月龄和从10月龄电针6个月):14月龄电针6个月组(14MEA6组),16月龄电针6个月组(16MEA6组)和16月龄电针8个月组(16MEA8组)。各组大鼠均自由饮水和饮食,室温(25±1)℃,光照明暗各12 h(7∶00~19∶00开灯,19∶00~7∶00熄灯)。
1.4.4大鼠血清、骨骼肌SOD活力和MDA含量将大鼠比目鱼肌与0.1 mol/L PBS(pH7.4)按1 g∶9 ml比例在冰浴条件下用电动匀浆机匀浆后,以3 500 r/min离心5 min,取上清、分装,置于-80℃恒温冰箱内保存,集中检测。从低温冰箱中取出事先分离好的血清和组织匀浆上清液,严格依试剂盒说明检测骨骼肌和血清中SOD活力及MDA含量。
1.5统计学处理应用SPSS19.0软件,多组计量资料使用单因素方差分析法(one-way ANOVA)。
1.4.2动物干预方法采用自制老年大鼠固定装置固定,电针组参照《实验针灸学》对足三里和肾俞定位。用0.25 mm×25 mm毫针针刺双侧足三里和肾俞穴,接华佗牌G6805-Ⅱ型电针仪,采用疏密波,频率2 Hz,以大鼠四肢轻微抖动为度,通电时间15 min,每周3次,隔日1次,3 w后休息1 w为1个疗程。正常对照组不进行电针,但与电针组一样固定。
1.4方法
1.4.3标本采集末次电针48 h后,用2%戊巴比妥钠麻醉,迅速完整剥离SD大鼠腓肠肌和比目鱼肌,将腓肠肌和比目鱼肌分别用锡纸包裹并标记后立即置于液氮中,待所有标本收集结束后立即将标本放置在-80℃超低温冰箱保存以备用,分别用于Western印迹和定量PCR检测。打开腹腔,腹主动脉采血,用台式离心机分离血清后备用,与取出的比目鱼肌一同用于检测SD大鼠血清和骨骼肌中SOD活力和MDA含量。
2结果
测定血清、肌肉中SOD、MDA水平可以推测机体整体和肌肉中自由基生成和抗氧化能力,有效推断机体整体和肌肉衰老的程度。目前多数研究者证明〔5,6〕,人体血清的SOD值与年龄增长呈负相关,MDA的产生与年龄增长呈正相关,这就提示机体的衰老程度可以通过体内血清的SOD和MDA值来判定〔7,8〕。与这一结果一致,本研究中,14月龄和16月龄SD大鼠抗氧化能力急剧下降,氧自由基过量积聚,脂质过氧化终产物增多,增龄性氧化应激增强。提示8月龄大鼠通过预防性电针6个月后,改善了衰老,降低了肌肉MDA值。
工程机械电气自动化维护技术包含电气设备的监测、故障维修,完善的维护制度是确保工程机械电气自动化维护技术实施一个重要因素,它确保了自动化设备维护工作的正常运行,而且保证了电气设备的监测和故障维修的科学性。同时,严格要求维护人员详细的记录设备日常的运行情况,根据设备运行状况有针对性的制度方案,预防设备可能出现。
2.2预防性电针干预对MyoD、Myogenin和eMyHC蛋白表达的影响与8MN组相比,14MEA6组eMyHC值明显上升(P<0.05);与14MC组相比,14MEA6组MyoD值、Myogenin值、eMyHC值均明显上升(P<0.05),见图1。与8MN组相比,16MEA8组eMyHC值明显上升(P<0.05);与16MC组相比,16MEA6组MyoD值显著上升(P<0.01),16MEA8组Myogenin值显著上升(P<0.05),见图2。
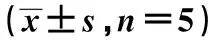
表1 各组大鼠血清、骨骼肌SOD活力、MDA含量比较
与8MN组比较:1)P<0.01,2)P<0.05;与14MC组比较:3)P<0.05,4)P<0.05;与16MC组比较:5)P<0.05

与14MC组比较:1)P<0.05;与8MN组比较:2)P<0.05图1 预防性电针后14月龄大鼠骨骼肌信号蛋白MyoD、Myogenin和eMyHC表达变化
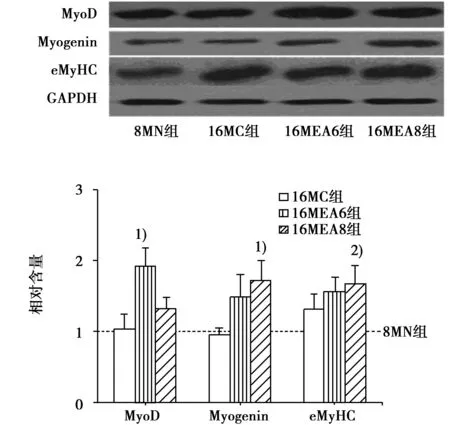
与16MC组比较:1)P<0.01;与8MN组比较:2)P<0.05图2 预防性电针后16月龄大鼠骨骼肌信号蛋白MyoD、Myogenin和eMyHC表达变化
3讨论
2.1预防性电针干预对大鼠血清、骨骼肌SOD活力和MDA含量的影响检测血清SOD活力和MDA含量结果显示:(1)与8MN组相比,14MC组和16MC组血清SOD活力显著降低(P<0.01),与14MC组相比,14MEA6组血清SOD活力显著上升(P<0.01);与16MC相比,16MEA8组血清SOD活力明显上升(P<0.05),16MEA6组升高,但不明显。(2)与8MN组相比,14MC组和16MC组血清MDA值显著升高(P<0.01);与14MC组相比,14MEA6组血清MDA值明显下降(P<0.05);与16MC组相比,16MEA6组、16MEA8组血清MDA含量有不同程度降低,但不明显,见表1。
Current situation and suggestion for the product standard of the detergent for fabric 5 42
在传统高中语文作文教学中,教师作为教学主体,学生只能被动接受。学生写好作文后,由教师一一审阅,教师虽是教学的引导者,但是教师作为一个个体,思想也有局限性,因此站在教师的角度和立场去评判所有学生的作文,未免太过片面,而不同的学生有不同的思想,不同思想的碰撞,会发出耀眼的光芒,所以应该开展学生之间的互相评审和自评,让学生在自评和互评的过程中认识自己的不足。通过学生的探讨,学习别人的长处,认识自己的短处,做到优势互补,共同进步。最后,教师和学生进行共同总结,为了以后更好地写作。
由于油墨清洗废水色度较高,色度由油墨等难生化降解物质构成,因此,必须对该废水进行预处理,防止废水难降解污染物含量过高影响生物反应,因此,需采用混凝沉淀装置进行脱色预处理。
衰老性的肌萎缩与肌卫星细胞肌肉激活、增殖和分化能力逐渐降低有关。肌卫星细胞是位于肌纤维肌膜和基底层的肌源性祖细胞〔9〕,肌源性祖细胞作为肌组织的干细胞,能转化为成肌细胞,促进骨骼肌细胞的再生。大量研究表明,卫星细胞的激活与MyoD和Pax7的上调往往是同步进行的,上调MyoD会使骨骼肌基因表达并启动肌生成程序〔10〕,促进肌卫星细胞的增殖和分化。调控骨骼卫星细胞分化的MRFs包括初级生肌因子和次级生肌因子〔11,12〕。初级因子中包含MyoD等,其中MyoD主要功能是促进成肌细胞转化为成熟的肌纤维,被称为骨骼肌形成的最早标志物,阻止肌萎缩的发生〔13〕,被认为是激活肌卫星细胞的标记蛋白〔14〕。8月龄预防性电针6个月可激活生肌调节因子,加速MyoD的生成。次级生肌因子包括Myogenin和MRF4,Myogenin可作为细胞分化的标志。本实验结果显示,8月龄SD大鼠预防性电针干预8个月对生肌调节因子中次级因子有调节作用。IGF-1主要是通过诱导骨骼肌生长调节因子家族MRFs中的MyoD、MyoG基因表达来完成。此外,MRFs能够调节肌生成过程中的肌肉特异性蛋白,如胚胎肌球蛋白重链(eMyHC)的转录〔15,16〕。本实验结果显示,8月龄SD大鼠预防性电针干预6个月和8个月有可能开启 IGF-1/AKT通路,诱导生肌调节因子MyoD、Myogenin、eMyHC,完成卫星细胞增殖和成熟肌纤维的形成。同时从另一方面也提示IGF-1/AKT通路诱导生肌调节因子MyoD、Myogenin、eMyHC的表达与预防性电针干预效果的正相关性。早期预防性电针干预后IGF-1/AKT通路诱导的生肌调节因子MyoD表达活跃,卫星细胞增殖促进再生,8月龄起始预防性电针干预6个月同时还出现Myogenin、 eMyHC明显升高,卫星细胞增殖、分化和肌管融合各阶段有完整表现。
综上所述,预防性电针干预对自由基代谢及抗氧化酶均产生了不同程度的干预作用,其中14MEA6组显著提高了机体的抗氧化能力,明显减轻自由基损伤,改善骨骼肌细胞功能,延缓衰老进程。此外,对衰老大鼠的预防性干预作用与IGF-1/AKT信号相关的骨骼肌再生有关。
4参考文献
1Glass DJ.Signaling pathways perturbing muscle mass〔J〕.Curr Opin Clin Nutr Metab Care,2010;13(3):225-9.
2Park S,Brisson BK,Liu M,etal.Mature IGF-1 excels in promoting functional muscle recovery from disuse atrophy compared with pro-IGF-1A〔J〕.J Appl Physiol,2014;116(7):797-806.
3余刚,熊伟平,黄元汛.IGF-1的研究进展及与运动的联系〔J〕.体育科技文献通报,2008;16(6):121-2.
4严金慧,陆耀飞.大鼠骨骼肌废用性萎缩与运动恢复中内源性IGF-1的作用〔J〕.体育科研,2005;26(1):61-3.
5Bejma J,Ji LL.Aging and acute exercise enhance free redical generation in rat skeletal muscle〔J〕.J Appl Physiol,2005;87(2):465-70.
6Ji LL,Leeuwenburgh C,Leichtweis S,etal.Oxidative stress and aging〔J〕.Ann N Y Acad Sci,1998;788(1):62-71.
7Dei R,Takeda A,Niwa H,etal.Lipid peroxidation and advanced glycation end products in the brain in normal aging and in Alzheimer′s disease〔J〕.Acta Neuropathol(Berl),2002;101(2):113-22.
8Meccocci P,Fano G,Fulle S,etal.Age-dependent increases in oxidative damage to DNA,lipids,and proteins in human skeletal muscle〔J〕.Free Radic Biol Med,2006;26(3-4):303-8.
9Verdijk LB,Dirks ML,Snijders T,etal.Reduced satellite cell numbers with spinal cord injury and aging in humans〔J〕.Med Sci Sports Exerc,2012;44(12):2322-30.
10Olguín HC,Pisconti A.Marking the tempo for myogenesis:Pax7 and the regulation of muscle stem cell fate decisions〔J〕.J Cell Mol Med,2012;16(5):1013-25.
11Fujimaki S,Hidaka R,Asashima M,etal.Wnt-mediated satellite cell conversion in adult and aged mice following voluntary wheel running〔J〕.J Biol Chem,2014;289(11):7399-412.
12Watts R,McAinch AJ,Dixon JB,etal.Increased Smad signaling and reduced MRF expression in skeletal muscle from obese subjects〔J〕.Obesity(Silver Spring),2013;21(3):525-8.
13Legerlotz K,Smith HK.Role of MyoD in denervated,disused,and excised muscle〔J〕.Muscle Nerve,2008;38(3):1087-100.
14沈燕国,徐建光,顾玉东,等.成肌调节因子MyoD和Myf-5在人体失神经骨骼肌中的表达及其临床意义〔J〕.复旦学报(医学版),2002;29(4):264-7.
15Singh K,Dilworth FJ.Differential modulation of cell cycle progression distinguishes members of the myogenic regulatory factor family of transcription factors〔J〕.FEBS J,2013;280(17):3991-4003.
16Zanou N,Gailly P.Skeletal muscle hypertrophy and regeneration:interplay between the myogenic regulatory factors(MRFs)and insulin-like growth factors(IGFs)pathways〔J〕.Cell Mol Life Sci,2013;70(21):4117-30.
〔2016-01-17修回〕
(编辑李相军)
基金项目:国家自然科学基金面上项目(81373755);国家自然科学基金青年科学基金项目(81403470)
通讯作者:徐平(1952-),女,教授,博士生导师,主要从事针灸与骨骼肌代谢性疾病、中医教育研究。
〔中图分类号〕R2
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2571-04;
doi:10.3969/j.issn.1005-9202.2016.11.002
1长春中医药大学2东营市胜利油田中心医院
第一作者:马长春(1973-),男,副教授,博士,主要从事针灸与骨骼肌代谢性疾病研究。

