不同剂量阿司匹林对大鼠心肌微血管内皮细胞血管新生功能的影响
王永彬 张 璐 陈美娜 秦桥基 张学志 黄 欢
(青岛大学附属医院急诊科,山东 青岛 266003)
不同剂量阿司匹林对大鼠心肌微血管内皮细胞血管新生功能的影响
王永彬张璐陈美娜秦桥基张学志黄欢
(青岛大学附属医院急诊科,山东青岛266003)
〔摘要〕目的探讨不同剂量阿司匹林对大鼠心肌微血管内皮细胞(CMECs)血管新生功能的影响。方法4周龄雄性SPF级SD大鼠,处死后分离右心室,提取原代心肌微血管内皮细胞进行培养,依据阿司匹林浓度不同分为对照组、实验组(1、10、100、1 000、5 000 μmol/L),分别检测其对CMECs的增殖能力、细胞迁移能力和纤维连接蛋白(FN)水平的影响。结果培养48 h后,阿司匹林1、10、100 μmol/L组与对照组比较细胞量和凋亡指数(AI)值均无统计学意义(P>0.05),仅浓度为1 000和5 000 μmol/L组与对照组比较细胞量和AI值差异显著(P<0.05);划痕实验显示1、10、100 μmol/L阿司匹林组的划痕间距均显著小于对照组,10、100 μmol/L阿司匹林组的Transwell迁移数显著高于对照组,10、100 μmol/L阿司匹林组的成管个数显著高于对照组,5 000 μmol/L阿司匹林组的成管个数显著低于对照组(P<0.05),其余组的相应指标与对照组无统计学意义(P>0.05);FN的分析结果显示除1 μmol/L阿司匹林组外其余浓度组均显著高于对照组(P<0.05)。结论阿司匹林对CMECs作用低浓度时表现为促进细胞增殖和迁移作用,并能显著诱导FN分泌;高浓度时表现为抑制增殖和迁移作用,但是对FN的分泌具有促进作用。
〔关键词〕阿司匹林;心肌;微血管内皮细胞;血管新生
心肌微血管内皮细胞(CMEC)是心脏微循环的重要组成部分,占整个心脏细胞总量的1/3,可以影响心肌灌流水平〔1〕。CMECs能够分泌一氧化氮和前列环素等舒张血管的活性物质,调节心肌组织的血氧供应平衡〔2〕。阿司匹林能够调控内皮祖细胞的功能〔3〕,但鲜有研究报道其对CMECs的作用。本研究旨在探讨不同浓度的阿司匹林对CMECs的作用。
1材料与方法
1.1动物与试剂4周龄雄性SD大鼠,体重90~110 g,购自成都达硕实验动物有限公司,动物许可证号:SYXK(蓉)2007-2002,SPF级,饲养于我院动物实验中心。磷酸盐缓冲液(PBS)、杜尔伯科改良伊格尔培养基(DMEM)(含4 mmol/L谷氨酰胺和4 500 mg/ml葡萄糖)、胰蛋白酶、青霉素/链霉素溶液(含10 000 U/ml青霉素,10 000 μg/ml链霉素)均购自Hyclone(Logan,UT,USA),胎牛血清(FBS)购自Gibco(Auckland,NZ),基质胶、原位末端标记法(TUNEL)试剂盒购自BD(NJ,USA),纤维连接蛋白(FN)ELISA试剂盒购自R&D(MN,USA),丝氨酸苏氨酸蛋白激酶(AKT)抗体、山羊抗兔IgG二抗、辣根过氧化物酶(HRP)标记均购自Abcam(MA,USA),偏聚二氟乙烯(PVDF)膜和化学增强发光法(ECL)发光试剂盒均购自北京索莱宝科技有限公司。
1.2方法
1.2.1CMECs培养颈椎脱臼法处死大鼠,无菌条件下分离心脏,去除心外膜,分离右心室并用PBS冲洗,剪碎后加入3 g/ml Ⅱ型胶原酶吹打混匀,8 min后加入2.5 g/L的胰蛋白酶,在37℃水浴中消化15 min,加入适量DMEM培养基(含10%FBS和1%的青霉素/链霉素溶液)终止消化,转移至离心管中1 000 r/min离心5 min,弃上清,加DMEM培养基重悬后接种至培养皿中,37℃培养6 h后弃去未贴壁细胞,更换新鲜培养基继续培养,其后每2 d换液1次,每4 d传代1次。
1.2.2细胞处理和分组CMECs培养2~3代后,消化离心,重悬后制成细胞悬液,按实验需求接种至细胞培养板上,分为实验组和对照组,实验组添加不同浓度(1、10、100、1 000、5 000 μmol/L)的阿司匹林,对照组仅添加培养基。
1.2.3CMECs的增殖能力检测CMECs以5×103/孔接种于96孔板上,培养24 h待细胞全部贴壁后,按实验分组添加不同浓度的阿司匹林及DMEM培养基200 μl,培养48 h后加入25 μl的MTT试剂,37℃反应4 h后,弃上清,用200 μl二甲基亚砜(DMSO)溶解细胞内的甲瓒,用酶标仪在490 nm波长处测量吸光度值,以对照组细胞为100%,计算其余孔内细胞量。
1.2.4CMECs的凋亡细胞检测10×10 mm的盖玻片灭菌后置于24孔细胞培养板内,CMECs以1×105/孔接种于24孔板内,24 h后按实验分组添加不同浓度的阿司匹林及DMEM培养基2 ml,培养48 h后,进行TUNEL染色,在荧光倒置显微镜下观察染色结果。细胞核被4,6-二脒基-2-苯基吲哚(DAPI)染成蓝色荧光,为有核细胞;染色阳性呈绿色荧光,为凋亡细胞。计数10个视野内CMECs总数和凋亡细胞数的平均数,凋亡指数(AI)=凋亡细胞数/细胞总数×100%。
1.2.5CMECs的划痕实验CMECs以2×105/孔接种于24孔板内,培养24 h后待细胞密度达到90%,用灭菌后的一次性1 ml吸头在细胞生长平面上划动,每孔划动一次,保持每孔的划痕长度和深度一致。划动后去除漂浮的细胞,更换新鲜培养基,依据实验设计添加不同浓度的阿司匹林,培养24 h后在显微镜下观察划痕间距。
1.2.6CMECs迁移能力的Transwell检测CMECs以1×105/室接种于Transwell小室的上室,并按照实验分组添加不同浓度的阿司匹林及DMEM培养基,下室中添加DMEM培养基和10 ng/ml血管内皮生长因子。培养8 h后用多聚甲醛固定2 h,足量PBS清洗去除滤膜上没有迁移的细胞,采用结晶紫染色,在普通光学显微镜下观察并计数。
1.2.7CMECs成管能力检测向24孔板内以200 μl/孔添加Matrigel基质胶,按照实验分组添加不同浓度的阿司匹林及DMEM培养基培养CMECs 48 h后,将细胞重悬并以1×105/孔接种至已经铺胶的24孔板中,培养6 h后在普通光学显微镜下观察,计数5个视野并取平均数。
1.2.8CMECs中FN水平的测定CMECs以1×105/孔接种至12孔板中,按实验分组添加不同浓度的阿司匹林及DMEM培养基培养48 h后,收集培养上清液,按照操作说明书进行ELISA检测,用酶标仪在450 nm波长处测量吸光度值,计算各样本中FN水平。
1.3统计学方法采用SPSS19.0进行单因素方差分析和SNK检验。
2结果
2.1阿司匹林对CMECs增殖和凋亡的影响成功分离培养得到的原代CMECs呈“鹅卵石”或“铺路石”状贴壁生长〔3〕,阿司匹林浓度为1、10、100 μmol/L组与对照组比较细胞量和AI值均无统计学意义(P>0.05),仅浓度为1 000和5 000 μmol/L组与对照组比较细胞量和AI值差异显著(P<0.05)。见表1。
2.2阿司匹林对CMECs迁移能力及分泌FN水平的影响1、10、100 μmol/L阿司匹林组的划痕间距均显著小于对照组,10、100 μmol/L阿司匹林组的Transwell迁移数显著高于对照组,10、100 μmol/L阿司匹林组的成管个数显著高于对照组,5 000 μmol/L阿司匹林组的成管个数显著低于对照组(均P<0.05),其余组的相应指标与对照组无统计学意义(P>0.05)。CMECs中FN表达水平随阿司匹林浓度增加而增加,除1 μmol/L阿司匹林组外其余浓度组均显著高于对照组(P<0.05,P<0.01)。见表2。
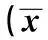
表1 阿司匹林对CMECs增殖和凋亡的影响±s)
与对照组比较:1)P<0.05
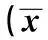
表2 阿司匹林对CMECs迁移能力及分泌FN水平的影响±s)
与对照组比较:1)P<0.05,2)P<0.01
3讨论
冠心病是我国第二顺位的死亡原因,且发病率仍在不断增加,其基本病理过程是心肌缺血,所以亦被称为缺血性心肌病,其治疗关键是恢复心肌的有效血液灌注,因此延长缺血心肌的存活能力,防止不可逆的损伤是治疗和预防心肌缺血/再灌注损伤的关键〔4〕。CMECs是近年来研究发现的心肌微循环的重要部分,在维持心肌微环境中发挥重要作用,CMECs直接接触血液和组织细胞,受到来自血液和组织细胞的双重调节,也是心肌细胞受损时最早且最易受损的靶细胞,CMECs的变化是心脏损伤/恢复过程的关键〔5〕。阿司匹林是广泛应用于心血管疾病治疗和预防的药物,其作用机制为抑制环氧化酶(COX)、降低血栓素(TX)A2和抑制前列腺素合成达到抑制炎症和血小板聚集的作用,因为血小板没有细胞核,不能自行合成COX,所以阿司匹林对血小板的抑制作用持久且不可逆转〔6〕。目前普遍认为抗血小板聚集的作用是阿司匹林保护心血管作用的主要机制,但是亦有证据显示阿司匹林的其他效应也发挥了重要作用,如对EPCs的增殖能力、迁移能力等〔7〕。
本研究发现,阿司匹林对CMECs的增殖和凋亡具有一定的影响,但是仅在浓度较大的时候表现出显著的效应。研究发现内皮细胞可以通过垂体生长激素的作用产生PGI2,可以代偿性地弥补阿司匹林对COX的抑制作用。这可能是其增殖活性和AI在低浓度阿司匹林的诱导下并未表现出差异的解释之一。血管新生的过程包括内皮和基底膜的溶解连接,内皮细胞的迁移和黏附,最终形成新的毛细血管,因此CMECs的迁移能力是其是否能够影响血管新生功能的作用评价指标〔8〕。FN是内皮细胞分泌的一族高分子蛋白,具有多种生物活性,能够增强细胞间粘连及细胞与基质的粘连,是血管修复的重要因子。研究显示血管硬化程度与FN水平具有显著的负相关性,血浆中FN的缺乏将导致血管通透性增加,引起血浆外渗,有效循环血量降低,导致局部供养不足〔9〕。本研究发现,阿司匹林同样具有促进CMECs分泌FN的作用,且这一作用表现出剂量依赖性。然而阿司匹林作用的剂量-效应关系尚不清楚,有待进一步实验验证。
4参考文献
1朱晋坤,毛华,尹扬光,等.阿司匹林和氯吡格雷对体外血小板黏附内皮细胞基质活性的影响及其机制研究〔J〕.中国全科医学,2015;18(3):283-7.
2刘珍珍,李国强,刘萌,等.阿司匹林对人脐血晚期内皮祖细胞功能的影响〔J〕.中国实验血液学杂志,2013;21(4):1032-7.
3Szukiewicz D,Wojciechowska M,Bilska A,etal.Aspirin action in endothelial cells:different patterns of response between chemokine CX3CL1/CX3CR1 and TNF-α/TNFR1 signaling pathways〔J〕.Cardiovasc Drugs Ther,2015;29(3):219-29.
4左凤同,刘辉,吴慧君,等.阿司匹林联合氯吡格雷治疗伴有血管狭窄的脑梗死的临床观察〔J〕.现代生物医学进展,2015;15(31):6104-6,6149.
5张晓月,张维东,王兆朋,等.阿司匹林对小鼠S180肉瘤生长及血管和淋巴管生成的影响〔J〕.山东大学学报(医学版),2013;51(1):1-6,11.
6李张鹏,邓亚萍,赵婷,等.抗血小板药阿司匹林对内皮祖细胞的影响〔J〕.第二军医大学学报,2013;34(7):787-9.
7王丽,陈庆伟,李桂琼,等.生长激素促分泌物受体的内源性配体ghrelin促进大鼠心肌微血管内皮细胞体外血管生成〔J〕.中华心血管病杂志,2012;40(1):50-6.
8辛毅,许秀芳,黄益民,等.小鼠心肌微血管内皮细胞的原代培养及生物学特性〔J〕.中国病理生理杂志,2013;29(3):565-70.
9王圣,程兆云,赵子牛,等.谷胱甘肽S-转移酶P1对鼠心肌微血管内皮细胞的作用〔J〕.中华实验外科杂志,2014;31(6):1294-6.
〔2015-08-10修回〕
(编辑袁左鸣/滕欣航)
〔中图分类号〕R54
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2617-03;
doi:10.3969/j.issn.1005-9202.2016.11.022
第一作者:王永彬(1974-),男,硕士,主治医师,主要从事心血管内科方面的研究。

