DNA聚合酶β高表达与食管癌放化疗敏感性的临床研究
丁继强,宁召锋,李 梁,刘 霞,李瑞卿
(泰安市肿瘤防治院,山东 泰安 271000)
DNA聚合酶β高表达与食管癌放化疗敏感性的临床研究
丁继强,宁召锋,李梁,刘霞,李瑞卿
(泰安市肿瘤防治院,山东 泰安 271000)
[摘要]目的观察DNA聚合酶β(DNA polβ)表达对食管癌放化疗疗效的影响。方法98例食管癌患者根据DNA polβ表达分为阴性单纯放疗组、阴性放化疗组、阳性单纯放疗组、阳性放化疗组4组。各组均进行常规分割放疗,2 Gy/次,5次/周,中位处方剂量60 Gy。2个放化疗组放疗的同时给予顺铂、5-Fu和亚叶酸钙方案化疗,于放疗开始的第1、5周给予。结果阴性单纯放疗组、阴性放化疗组、阳性单纯放疗组、阳性放化疗组的3 a局部控制率分别为54.5%、61.5%、41.7%、53.8%,3 a生存率分为31.8%、38.4%、25.0%、26.9%。结论DNA polβ表达阴性者放疗联合化疗可改善其生存。
[关键词]食管肿瘤;放疗;化疗;DNA聚合酶β;预后
食管癌是我国常见肿瘤之一,放化疗是非手术食管癌的标准治疗手段[1]。临床上相同的治疗方法对不同人群疗效有较大差异。DNA聚合酶(DNA polβ)是哺乳动物细胞内主要的碱基切除修复酶,参与DNA损伤的修复,在正常机体内呈低表达,而高表达或结构异常是导致肿瘤发生的相关因素[2]。DNA polβ表达与食管癌放化疗疗效的关系尚未有研究探讨。本研究对2008年1月至2011年5月收治的98例食管癌患者进行了同期对照研究,以期为临床治疗提供数据参考。
1资料与方法
1.1纳入标准全部患者均在我院取活检,病理学确诊鳞癌;放疗前测量食管钡剂造影病变长度≤9 cm;无严重外侵或穿孔征象;无严重基础疾病及合并症;治疗前完善血常规、肝功能、肾功能、肺功能等检查。
1.2主要试剂与仪器Trizol 试剂(美国Qiagen公司);β-actin引物(上海宝莱生物科技技术有限公司);PCR仪(德国Peqlab公司);AMV、Taq酶、dNTP(美国Promega公司);PCR引物(北京索莱宝科技有限公司);PCR Marker(DL2000)(上海凯斯泰尔生物科技有限公司);凝胶自动成像仪、水浴式电转印槽、电泳仪(美国Bio-Rad公司)。
1.3患者一般资料及分组情况98例患者共分为4组,DNA polβ阴性者随机分为常规分割放疗(阴性单纯放疗组)和常规分割放疗+化疗组(阴性放化疗组);DNA polβ阳性者随机分为常规分割放疗(阳性单纯放疗组)和常规分割放疗+化疗组(阳性放化疗组)。见表1。
表198例食管癌患者的一般资料
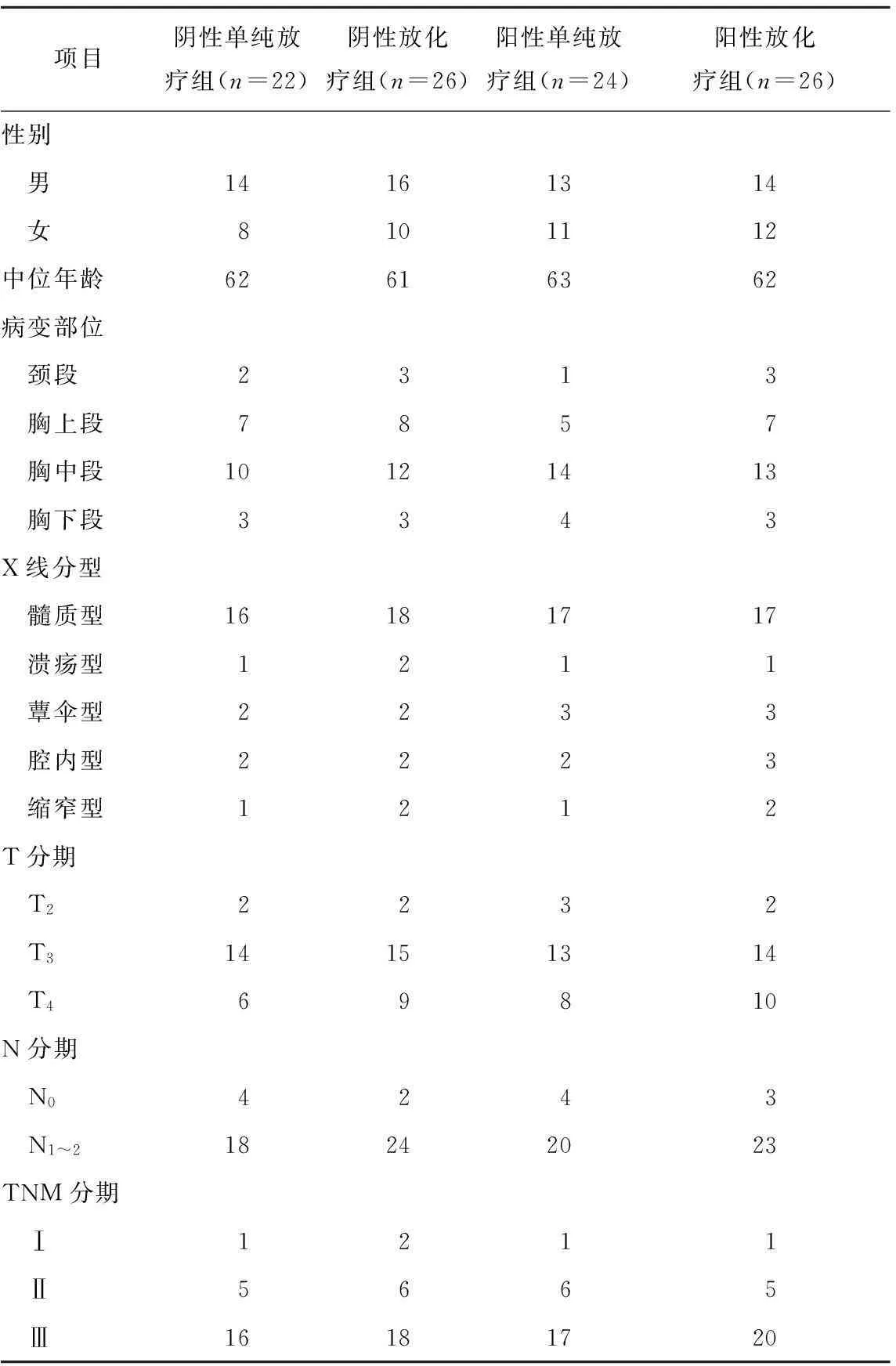
项目阴性单纯放疗组(n=22)阴性放化疗组(n=26)阳性单纯放疗组(n=24)阳性放化疗组(n=26)性别 男14161314 女8101112中位年龄62616362病变部位 颈段2313 胸上段7857 胸中段10121413 胸下段3343X线分型 髓质型16181717 溃疡型1211 蕈伞型2233 腔内型2223 缩窄型1212T分期 T22232 T314151314 T469810N分期 N04243 N1~218242023TNM分期 Ⅰ1211 Ⅱ5665 Ⅲ16181720
1.4方法
1.4.1polβ mRNA检测1)总RNA的提取:胃镜取得组织后15 min内即放入液氮中保存。取出食管癌组织后加入液氮在研钵中研碎,用总RNA提取试剂盒提取出总RNA,后溶于灭菌超纯水中,然后用紫外分光分度计测定总RNA的浓度和纯度,用琼脂糖电泳观察其完整性;2)在逆转录酶作用下完成逆转录,polβ引物上游: 5’-TTGGGTGTTTGCCAGCTTCCC-3’,下游: 5’-CTCCCAAGGGACGGATGGTG-3’,其产物大小为200 bp。β-actin引物上游: 5’-GTGGGGCGCCCCAGGCACCA-3’,下游:5’-CTCCTTAATGTCACGCACGATTTC-3’,其产物大小为600 bp。PCR反应体系30 μL,转录产物3 μL,Taq DNA聚合酶2 u,4×dNTP 0.2 mmol·L-1,0.5 μmol·L-1polβ和0.2 μmol·L-1β-actin引物。具体反应条件:94 ℃ 5 min预变性;94 ℃ 50 s,55 ℃ 50 s,72 ℃ 60 s,72 ℃ 10 min;共30个循环;3)产物经SYNGENE凝胶成像系统分析,以目的基因和β-actin积分灰度值的比值作为目的基因mRNA的相对表达量,后根据正常黏膜表达水平推断,若该比值>0.446 9(可信区间为95%)为高表达,反之为低表达。见图1。

图1 食管癌组织不同表达PCR结果
1.4.2放疗常规碘造影血管强化,行螺旋CT模拟定位,在TPS系统上勾画靶区。肿瘤靶区(GTV)为CT显示食管壁厚度>0.5 cm或不含气腔的管壁直径≥1 cm,并参考食管造影确定病变范围。临床靶区(CTV)为GTV头脚方向各外扩2 cm,四周各扩0.5 cm,并根据解剖屏障进行修正。计划靶区(PTV)为CTV头脚方向各扩1 cm,四周均匀扩0.5 cm。纵隔淋巴结CT诊断标准为短径≥1 cm,食管旁、气管食管沟等淋巴结为短径≥0.5 cm,外扩0.5 cm为CTV,CTV外扩0.5 cm为PTV。2个放化疗组处方剂量50.4~64 Gy/28~32次,中位剂量60 Gy。2个单纯放疗组为58~66 Gy/29~33次,中位剂量60 Gy。要求PTV 95%体积接受>100%的处方剂量照射,全肺V20≤30%,V5≤65%,肺平均剂量<17 Gy,心脏平均剂量≤30 Gy,脊髓最大剂量<44 Gy。
1.4.3化疗采用顺铂、5-Fu和亚叶酸钙方案,顺铂(山东齐鲁制药有限公司,批号:1WAIA0602035A)25 mg·m-2·d-1,连用3 d;5-Fu(上海旭东海普药业有限公司,批号:H20052384)500 mg·m-2·d-1,连用5 d;亚叶酸钙(江苏恒瑞医药股份有限公司,批号:06042435)200 mg,连用5 d。放疗第1天同步化疗,于第5周行第2周期。2个放化疗组共52例患者中,有32例放疗结束后又接受1~2周期化疗。
1.5近期疗效及毒副反应评价标准治疗结束后以钡餐检查和CT评价近期疗效。近期疗效参照实体瘤治疗疗效评价标准RECIST 1.1版进行评价,分为完全缓解(CR)、部分缓解(PR)、病变进展(PD)、稳定(SD)。完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径总和缩小≥30%;进展(PD):基线病灶长径总和增加≥20%,包括其绝对值增加5 mm或出现新病灶;稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。以CR+PR计算总有效率。毒副反应客观评价参考文献[3]进行。
1.6统计学处理采用SPSS 11.0进行数据处理,计数资料比较采用χ2检验,生存分析采用Kaplan-Meier法,比较采用log rank检验,检验水准α=0.05。
2结果
2.1治疗完成情况与随访阴性放化疗组1例患者未完成放疗,实际照射剂量52 Gy,其余患者均完成放疗;阳性放化疗组患者均完成放疗。2个放化疗组患者中,2周期化疗完成者38例(73.07%),1周期化疗完成者14例(26.92%)。2个单纯放疗组患者全部如期完成放疗。全部病例观察时间16~44个月,生存时间从治疗开始算起。共失访3例,其中阴性单纯放疗组1例,阴性放化疗组1例,阳性放化疗组1例,失访病例从失访日期起按死亡计算,总随访率96.9%。
2.2近期疗效见表2。
表2各组食管癌患者的近期疗效比较
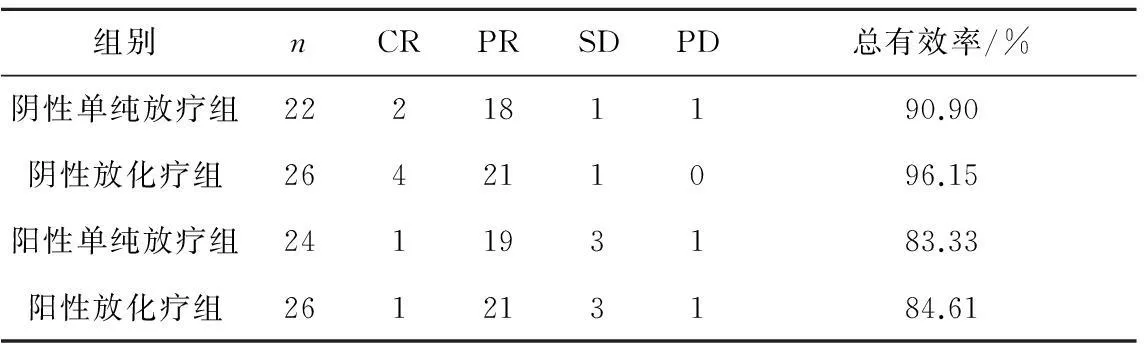
组别nCRPRSDPD总有效率/%阴性单纯放疗组222181190.90阴性放化疗组264211096.15阳性单纯放疗组241193183.33阳性放化疗组261213184.61
注:各组近期疗效比较差异均无统计学意义,P均>0.05
2.3生存情况见表3。
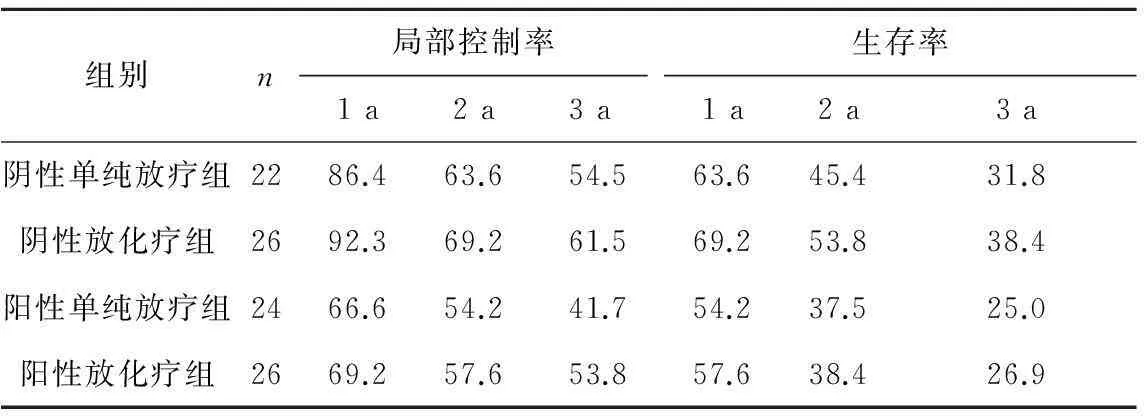
表3 各组食管癌患者的生存情况比较 %
注:各组内随着时间的增加,局部控制率和生存率降低;各组间局部控制率越高,其生存率也越高。阳性单纯放疗组、阳性放化疗组局部控制率和生存率均低于阴性单纯放疗组和阴性放化疗组,比较差异均有统计学意义,P均<0.05
2.4生存曲线见图2。
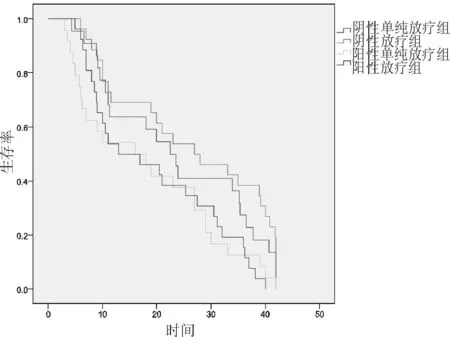
图2 各组生存曲线比较
阴性放化疗组与阴性单纯放疗组3 a生存率比较差异有统计学意义(P<0.05);阴性放化疗组与阳性放化疗组3 a生存率比较差异有统计学意义(P<0.05);阴性单纯放疗组与阳性单纯放疗组3 a生存率比较差异有统计学意义(P<0.05);阳性单纯放疗组与阳性放化疗组3 a生存率比较差异无统计学意义(P>0.05)。
2.5毒副反应治疗过程中所有患者均未出现严重的急性毒副反应,未出现Ⅱ级以上心脏、脊髓损伤及出血和穿孔。见表4。
表4各组毒副反应发生情况比较

毒副反应阴性单纯放疗组(n=22)阴性放化疗组(n=26)阳性单纯放疗组(n=24)阳性放化聊组(n=26)χ2P放射性肺炎 Ⅰ、Ⅱ级20222124 Ⅲ级以上24320.9170.821放射性食管炎 Ⅰ、Ⅱ级16201821 Ⅲ级以上66650.4710.925骨髓抑制 Ⅰ、Ⅱ级20212320 Ⅲ级以上25164.6520.199
2.6死亡原因截止到随访日期,阴性单纯放疗组、阴性放化疗组、阳性单纯放疗组、阳性放化疗组死亡病例分为15、16、18、19例。见表5。

表5 各组死亡原因分析结果比较 n
3讨论
食管癌是我国常见恶性肿瘤,居死亡原因的第4位[4]。食管癌的发生呈多因素多阶段过程,可受外界因素影响,有个体易感性。而肿瘤易感性涉及多个基因位点和单倍体变异,与细胞周期调控、DNA损伤修复等有关[5]。DNA polβ是哺乳动物细胞内主要的碱基切除修复酶之一,主要参与DNA损伤的修复,在正常机体内呈低表达,而高表达或结构异常可引起修复功能障碍,造成突变基因的积累,从而导致肿瘤的发生。有研究[6-7]报道在食管癌、卵巢癌、乳腺癌、肺癌等多种肿瘤中存在pol基因异常。赵四敏等[8]报道食管癌组织中存在DNA polβ的突变,突变率达36%。DNA polβ的高表达或突变增加了肿瘤的发生风险,而与肿瘤治疗的相关性已有报道。杜柳涛等[9]报道高表达的polβ与肿瘤细胞抗药性有一定关系。刘瑾等[10]报道pol Ⅰ在食管鳞癌组织中过表达,增加细胞对顺铂和放射线的抵抗性。崔杰等[11]报道polβ高表达具有更强的DNA氧化损伤的修复作用,增加细胞的辐射抗性。
放化疗是非手术食管鳞癌的标准治疗手段。同步放化疗较单纯放疗降低死亡风险及局部复发率,提高了生存率[12]。食管癌疗效有个体差异性,即不同个体对放化疗的敏感性不同,考虑放射线及化疗药物敏感性与肿瘤细胞的蛋白表达、基因型有关[13-14]。DNA polβ表达是否与个体差异性,能否作为一种放化疗敏感性的预测手段,目前国内报道较少见。本研究结果显示:1)对于DNA polβ阴性单纯放疗组与阴性放化疗组,后者的3 a局部控制率、3 a生存率均明显提高,提示加用化疗提高了局部控制率和生存率;对比失败原因,放化疗组远处转移减少,提示对于DNA polβ阴性者放疗加用化疗可带来长期生存获益,这与国内报道食管癌放化疗有益于生存相一致[15-16];2)对于DNA polβ阳性单纯放疗组和阳性放化疗组,2组的3 a局部控制率和3 a生存率相近,提示DNA polβ阳性者放疗加用化疗未见生存率提高。对比两者的远处转移,未见明显差异,可能与DNA polβ对化疗药物的耐药性有关;3)将DNA polβ阴性放疗组和阳性放疗组比较,前者的3 a局部控制率和3 a生存率更高,提示DNA polβ阴性者的生存率较高。对比失败原因,2组都以局部复发或未控多见,但阳性者更多,可能与DNA polβ的射线耐受有一定的相关。
总之,DNA polβ高表达影响了肿瘤细胞对射线和药物的敏感性,可能是决定治疗效果的因素之一。但尚需从分子水平进一步了解DNA polβ在放化疗前后的表达变化、耐受治疗的机制等多方面问题。另外,本研究由于病灶数较少,尚需扩大病例数及加用其他治疗方法进一步研究。
参考文献:
[1]杨原源,郝大选,王建华.中国食管癌非手术治疗研究进展[J].肿瘤基础与临床,2014,27(6):542-545.
[2]朱涵,樊红琨,章茜.互隔交链孢酚对NIH/3T3细胞中DNA聚合酶β的致突变作用[J].中国组织工程研究,2012,16(15):2831-2834.
[3]韩晶,王澜,韩春,等.食管癌同期放化疗的临床观察 [J].中华肿瘤防治杂志,2011,18(23):1859-1863.
[4]赫捷,邵康.中国食管癌流行病学现状、诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501-504.
[5]黄标通,周新民,龙建平.Toll样受体基因多态与肿瘤易感性的研究进展[J].癌变·畸变·突变,2014,26(3):231-233,238.
[6]方明珠,王志举,赵国强,等.卵巢癌组织中DNA聚合酶β检测 [J].中国现代医学杂志,2008,18(11):1493-1495.
[7]赵国强,王涛,赵明耀,等.食管正常、癌前及癌变组织中DNA聚合酶βmRNA检测 [J].郑州大学学报(医学版),2005,40(4):603-605.
[8]赵四敏,陈旭东,张成娟,等.DNA聚合酶β在食管癌组织中的修复功能[J].世界华人消化杂志,2010,18(23):2460-2463.
[9]杜柳涛,徐雷,杨杏芬,等.人pol-β高表达对细胞应对DNA损伤反应时的影响 [J].中华劳动卫生职业病杂志.2006,24(2):88-91.
[10]刘瑾,吴锦昌,周俊东.POLⅠ基因对人食管癌细胞放化疗敏感性的影响 [J].南京医科大学学报(自然科学版), 2013,33(1):6-10.
[11]崔杰,徐昕,杨沫,等.DNA聚合酶β表达水平与60Coγ射线放射敏感性的研究[J].四川大学学报,2011,42(6):745-750.
[12]王澜,韩春,李晓宁,等.中晚期食管癌三维适形放疗联合同期化疗的临床观察[J].中华肿瘤防治杂志,2010,17(24):2053-2056.
[13]邰宵辉,赵达,关泉林,等.同步放化疗与序贯放化疗治疗食管癌的Meta分析[J].实用肿瘤杂志,2013,28 (6):605-611.
[14] Wong RK,Malthaner R.Combined chemotherapy and radiotherapy (without surgery) compared with radiotherapy alone in localized carcinoma of the esophagus[J].Cochrane Database Syst Rev, 2016,(1):CD002092.
[15]石明宏,程节凤,王俐,等.三维适行放疗同期多西紫杉醇和顺铂化疗治疗中晚期食管癌的临床观察 [J].肿瘤基础与临床,2013,26(6):501-503.
[16]李基胜,张汉雄,黎荣光.三维适形放射治疗联合顺铂和5氟尿嘧啶同步治疗食管癌的疗效分析[J].中国肿瘤临床与康复,2013,20(7):707-709.
Clinical Study of High Expression of DNA polβ and Sensitivity of Radiotherapy and Chemotherapy in the Esophageal Cancer
Ding Jiqiang,Ning Zhaofeng,Li Liang,Liu Xia,Li Ruiqing
(TaianTumorHospital,Taian271000,China)
[Abstract]ObjectiveTo investigate the relationship between expression of DNA polβ and efficacy of radiotherapy and chemotherapy for esophageal cancer.MethodsThe 98 patients with esophageal cancer were divided into four groups: the DNA polβ negative radiotherapy group,the DNA polβ negative chemoradiotherapy group,the DNA polβ positive radiotherapy group and the DNA polβ positive chemoradiotherapy group.All the patients received the common radiotherapy,2 Gy each time,5 times per week and the median prescription dose for four groups was both 60 Gy.The cisplatin,5-Fu and calcium folinate regimen was selected for the two chemoradiotherapy group.ResultsThe 3-year local control rates were 54.5%,61.5%,41.7% and 53.8% respectively in the four groups,and the 3-year survival rates were 31.8%,38.4%,25% and 26.9% respectively in the four groups.ConclusionChemoradiotherapy can improve the survival rate of patients with DNA polβ negative.
[Key words]esophageal neoplasms; radiotherapy; chemotherapy; DNA polβ; prognosis
基金项目:泰安市科技发展一般计划项目(编号:201440774-43B)
作者简介:丁继强(1975-),男,学士,副主任医师,主要从事肿瘤放疗工作。E-mail:taishandjq@126.com 通信作者:李瑞卿(1964-),男,学士,主任医师,主要从事肿瘤治疗工作。E-mail:zlyylrq@163.com
DOI:10.3969/j.issn.1673-5412.2016.03.006[中图分类号]R735.1;R730.53
[文献标识码]A
[文章编号]1673-5412(2016)03-0201-05
(收稿日期:2015-01-30)

