索坦治疗14例晚期肾透明细胞癌的疗效和安全性临床观察
王 伟,乔亚敏,朱玉楠
(1.郑州大学第一附属医院肿瘤科,河南 郑州 450052;2.郑州大学第一附属医院生物治疗中心,河南 郑州 450052;3.郑州市第三人民医院、郑州市肿瘤医院,河南 郑州 450002)
索坦治疗14例晚期肾透明细胞癌的疗效和安全性临床观察
王伟1,3,乔亚敏2,朱玉楠3
(1.郑州大学第一附属医院肿瘤科,河南 郑州 450052;2.郑州大学第一附属医院生物治疗中心,河南 郑州 450052;3.郑州市第三人民医院、郑州市肿瘤医院,河南 郑州 450002)
[摘要]目的观察苹果酸舒尼替尼胶囊(索坦)对晚期肾透明细胞癌患者常用化疗剂量的疗效和安全性。方法设置2个剂量观察组:4/2方案组按50 mg·d-1,用4周歇2周,6周为1周期;持3方案组按37.5 mg·d-1,持续治疗直至疾病进展;出现不良事件后,4/2方案可调整为2/1方案(按25 mg·d-1,用2周停1周,3周为1周期)。每组7例,若每组≥2例出现剂量限制性毒性(DLT),将停止继续用药。结果14例可评价疗效患者中3例PR,8例SD,3例PD。4/2方案组7例患者中,出现2例严重不良事件和2例次DLT,而持3方案组7例患者未出现DLT。结论索坦具有显著抗肿瘤活性,DLT是手足皮肤毒性和血小板减少。持3方案患者耐受性较好。对中国人而言,4/2方案出现不良事件后调整为2/1方案较为安全,而对于年轻和体质好的患者优先采用4/2方案。
[关键词]肾透明细胞癌;苹果酸舒尼替尼;安全性;剂量限制性毒性
苹果酸舒尼替尼胶囊(商品名:索坦)是临床上常用的一线治疗晚期肾透明细胞细胞癌的多靶点酪氨酸激酶抑制剂。索坦一线治疗中国晚期肾癌患者的中位疾病无进展时间为14.2个月,中位生存期为30.7个月。与干扰素相比,索坦一线治疗目标缓解率高达47%,索坦较索拉非尼能显著降低42%~53%的进展风险。但是临床用药中我们发现,服用该药期间患者极易出现皮疹、手足综合征、乏力、腹泻、高血压、甲状腺功能减低等不良事件,严重者可出现致命的感染或肺栓塞,甚至导致患者死亡。为解决这一临床问题,为临床医生推荐其安全有效的使用方法和剂量,我们对14例肾透明细胞癌患者进行了如下临床观察。
1资料与方法
1.1病例选择入组标准:经病理组织学确诊的肾透明细胞癌患者入组;有较好的骨髓储备情况:白细胞计数≥3.5×109·L-1,中性粒细胞绝对值≥1.5×109·L-1,血红蛋白≥10.0 g·L-1,血小板计数≥3.5×109·L-1;无明显肝肾功能异常;至少有一个影像学可评价或可测量病灶;年龄≥18岁;体力状态ECOG评分≤2分;预计生存期≥3个月。所有入组患者均签署知情同意书。排除标准:有其他恶性肿瘤病史的患者;经影像学证实存在有症状的中枢系统转移灶或存在癌性脑膜炎患者;正在接受其他抗肿瘤治疗的患者;有活动性急性感染的患者;高血压患者;左心室功能障碍患者;下颌骨坏死患者;有各类出血倾向患者。
1.2药品来源索坦由意大利辉瑞公司,内容物为黄色至橙色的颗粒,规格和注册证号分别为每粒12.5 mg:H20130258、H20130275;25 mg: H20130259、H20130276;37.5 mg:H20130260、H20130277;50 mg: H20130261、H20130278。1.3剂量使用方法4/2方案组:50 mg·d-1,1次/d,口服,用4周停2周,6周为1周期;持3方案组:37.5 mg·d-1,1次/d,口服,维持到病情进展或不能耐受。1.4剂量限制性毒性从首次给药开始到第2周期用药结束后30 d,对所有不良事件和剂量限制性毒性(dose limiting toxicity,DLT)进行分类和评估。依据美国国家癌症研究所通用标准对毒性进行分级。DLT则定义为任何与索坦相关的Ⅳ级皮肤毒性和Ⅲ级非皮肤性毒性。
1.5观察项目
1.5.1疗效评价对于可评估疗效的肾透明细胞癌患者进行疗效观察。疗效评价以影像学资料为证据,参照实体瘤疗效评价标准即RECIST标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PR),以CR+PR计算总有效率,以CR+PR+SD计算疾病控制率。
1.5.2安全性评价涉及的安全性指标是指观察每例受试者索坦治疗后出现的不良事件发生率及组成。检查项目包括身高、体质量、体力状态ECOG评分,每周期前和最后1周期后均行全身影像学检查,血常规,肝、肾功能。

2结果
2.1入组情况从2012年9月至2014年10月共纳入郑州大学第一附属医院收治的14例肾透明细胞癌患者进行索坦治疗,均完成了4周期治疗,均可进行疗效和安全性评价。4/2方案组和持3方案组各入组7例,2组入组情况见表1。
表12组患者基线情况比较
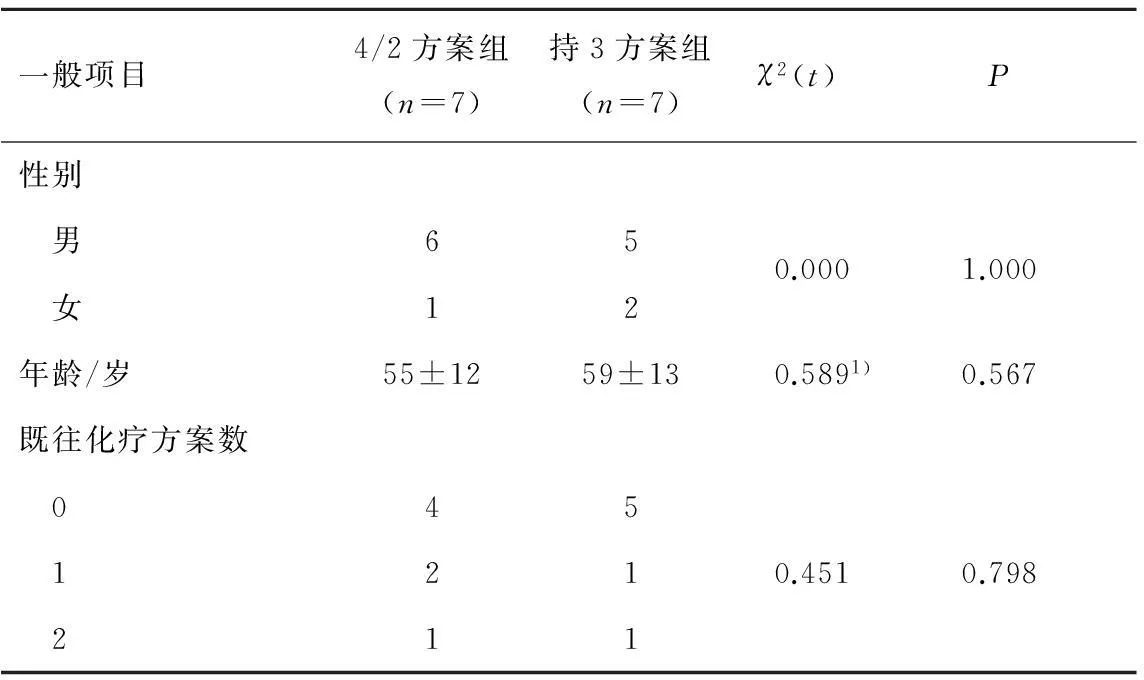
一般项目4/2方案组(n=7)持3方案组(n=7)χ2(t)P性别 男650.0001.000 女12年龄/岁55±1259±130.5891)0.567既往化疗方案数 045 1210.4510.798 211
注:1)为t
2.2疗效评价14例可评价疗效患者中,3例部分缓解(PR),8例稳定(SD),3例进展(PD)。4/2方案组的7例患者疗效评价结果显示,2例PR,4例SD, 1例PD,总有效率为28.6%,疾病控制率为85.7%。持3方案组的7例患者疗效评价结果显示,1例PR,4例SD,2例PD,总有效率为14.3%,疾病控制率为 71.4%。2组总有效率、疾病控制率比较差异均无统计学意义(χ2=0.000、0.000,P=1.000、1.000)。
2.3安全性分析
2.3.1毒副反应4/2方案组的7例患者中,Ⅲ、Ⅳ级毒副反应:皮肤毒性和血小板减少各1例,发生率为14.3%,乏力、恶心、腹泻、高血压、甲状腺功能减低等均为Ⅰ、Ⅱ级。持3方案组的7例患者中,Ⅲ、Ⅳ级皮肤毒性1例,发生率为14.3%,乏力、食欲减退、心脏毒性、高血压、味觉改变、甲状腺功能减低等均为Ⅰ、Ⅱ级。2组Ⅲ、Ⅳ级毒副反应比较差异无统计学意义。详见表3。

表3 不良反应发生例数 n(%)
注:Ⅲ、Ⅳ级毒副反应比较
2.3.2严重不良事件和DLT观察过程中共出现2例严重不良事件和2例次DLT,均发生在4/2方案组。例1受试者为男性,63岁,肾透明细胞癌骨转移,既往经历3种化疗方案共计12周期化疗,本研究第4周期用药后出现严重的皮疹(1例次DLT),因大面积皮肤破溃难忍而住院治疗,报告了严重不良事件,经皮肤科治疗后缓解。例2受试者为女性,45岁,肾透明细胞癌广泛转移,既往经历2种化疗方案共计4周期化疗,本研究第4周期用药后出现严重的血小板减少(1例次DLT),后积极给予输血小板及应用升血小板药物等好转。2组严重不良事件和DLT发生率比较差异均无统计学意义(P>0.05)。
3讨论
索坦由于疗效确切、口服方便等诸多优点,已成为临床上治疗晚期肾细胞癌的一线首选药物。但我们在临床用药过程中发现,患者经常出现皮肤毒性,非皮肤毒性中最常见的是血液系统毒性、心脏毒性。此外,服用索坦期间还易导致患者出现乏力、恶心、呕吐、腹泻等胃肠道反应,严重者可出现致命感染或肺栓塞,甚至导致患者死亡。
目前国外推荐的口服剂量为50 mg·d-1,1次/d,用4周停2周方案,即4/2方案;本研究发现,4/2方案组的7例患者,用药总计28周期,1例发生Ⅳ级皮肤毒性,1例发生严重的血小板减少。非皮肤学毒性主要有疲乏、恶心、腹泻、高血压等,程度多数为Ⅰ、Ⅱ级;持3方案组的7例患者,用药总计28周期,无Ⅳ级皮肤毒性发生。非皮肤学毒性主要有疲乏、腹泻等,均为Ⅰ、Ⅱ级。根据临床资料进行分析,出现DLT的2例患者具有较为类似的特点:年龄较大、一般状况较差、合并有心肺疾病、既往经过多疗程的化疗且病变范围较广泛。
本研究结果显示索坦具有明确的抗肿瘤活性。但由于病例数太少,还需要扩大临床规模以观察疗效。该药物在临床应用时,推荐持3方案,或者应用4/2方案出现毒副反应后应该减量,减量后推荐采用2/1方案继续服用。而对于年轻、体质好、既往化疗程度较轻的患者,优先推荐采用4/2方案进行治疗。
参考文献:
[1]Keizman D,Maimon N,Mishaeli M,et al.The current approach to metastatic renal cell carcinoma[J].Harefuah,2015,154 (8): 535-539.
[2]Han KS,Li N,Raven PA,et al.Inhibition of endoplasmic reticulum chaperone protein glucose-regulated protein 78 potentiates anti-angiogenic therapy in renal cell carcinoma through inactivation of the PERK/eIF2α pathway[J].Oncotarget,2015,6 (33): 34818-34830.
[3]Shi HZ,Tian J,Li CL.Safety and efficacy of sunitinib for advanced non-clear cell renal cell carcinoma[J].Asia Pac J Clin Oncol,2015,11 (4): 328-333.
[4]Kawakubo K,Hata H,Kawakami H,et al.Pazopanib-Induced Severe Acute Pancreatitis[J].Case Rep Oncol,2015,8 (2): 356-358.
[5]Cui C,Li S,Chi Z,et al.A pilot study of sunitinib as first-line therapy for metastatic renal cell carcinoma on a 2 weeks on/1 week off intermittent dosing schedule[J].Chin J Oncol,2015,37 (5): 375-378.
[6]Eisen T,Loembé AB,Shparyk Y,et al.A randomised,phase Ⅱ study of nintedanib or sunitinib in previously untreated patients with advanced renal cell cancer: 3-year results[J].Br J Cancer,2015,113 (8): 1140-1147.
[7]Messina C,Di Meglio A,Nuzzo PV,Boccardo F,Ricci F.Very late recurrence of renal cell carcinoma experiencing long-term response to sunitinib: a case report[J].Tumori,2015,101 (3): e79-e81.
[8]Kuroki H,Oyama N,Koike H.A Case of an Orbital Metastasectomy in a renal cell carcinoma after Sunitinib treatment : a case report[J].Hinyokika Kiyo,2015,61 (8): 335-339.
[10]Boers-Sonderen MJ,Desar IM,Fütterer JJ,et al.Biological Effects After Discontinuation of VEGFR Inhibitors in Metastatic Renal Cell Cancer[J].Anticancer Res,2015,35 (10): 5601-5606.
Efficacy and Safety Evaluation of Sutent in the Treatment of 14 Patients with Advanced Renal Clear Cell Carcinoma
Wang Wei1,3,Qiao Yamin2,Zhu Yunan3
(1.DepartmentofOncology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China;2.BiotherapyCenter,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China;3.TheThirdPeople’sHospitalofZhengzhou,Zhengzhou450002,China)
[Abstract]ObjectiveTo investigate the efficacy and safety of sunitinib malate capsules (sutent) for advanced renal clear cell carcinoma.MethodsThere were two dose groups ( 4/2 scheme group and continuous 3 scheme group) and 7 patients every dose group.If dose limiting toxicity (DLT) happened in more than 2 patients in a dose level,the dose would stop.ResultsOf the 14 patients with advanced renal clear cell carcinoma,3 patients of PR,8 patients of SD,3 patients of PD.In the 4/2 scheme dose group,DLT occurred in the 2 patients,severe adverse events occurred in the 2 patients; no DLT occurred in the continuous 3 scheme dose group.ConclusionSutent has antitumor activity,DLT is skin toxicity and,the maximum tolerated dose is 4/2 scheme,the patients good tolerance is continuous 3 scheme and adjustment to 2/1 scheme after adverse events of 4/2 scheme.For the young and good physique patients,4/2 scheme is good choice.
[Key words]renal clear cell carcinoma; :sunitinib malate capsules; safety; dose limiting toxicity
基金项目:国家自然科学基金项目(编号:812111102、81171986、81271815);河南省科技攻关项目(编号:142102310330、152102310180、162102310153);河南省基础与前沿技术研究计划项目(编号:122300410102);河南省教育厅自然科学基础研究计划项目(编号:12A320053);郑州市普通科技攻关计划项目(编号:141PPTGG454);郑州市国际合作及交流项目(编号:141PGJHZ539);郑州大学第一附属医院院内青年创新基金项目
作者简介:王伟(1973-),女,副教授,副主任医师,硕士生导师,主要从事食管癌、肺癌、乳腺癌、肾癌等恶性肿瘤的临床治疗和基础研究。E-mail:wangwei669@qq.com
DOI:10.3969/j.issn.1673-5412.2016.03.011
[中图分类号]R737.11
[文献标识码]A
[文章编号]1673-5412(2016)03-0222-04
(收稿日期:2016-03-10)

