319例晚期肺腺癌患者临床预后因素分析
王 彩,魏素菊,洪 雷,王俊艳,张 帆,李艳华
(1.德州市人民医院,山东 德州 253000;2.河北医科大学第四医院,河北 石家庄 050011)
319例晚期肺腺癌患者临床预后因素分析
王彩1,魏素菊2,洪雷2,王俊艳2,张帆2,李艳华2
(1.德州市人民医院,山东 德州 253000;2.河北医科大学第四医院,河北 石家庄 050011)
[摘要]目的分析影响晚期肺腺癌患者的临床预后因素。方法回顾性研究319例Ⅲb~Ⅳ期肺腺癌患者的临床资料,应用Kaplan-Meier方法计算生存率,采用Cox多因素回归对预后因素进行分析。结果319例患者的中位生存期为13.0个月,1、2、3 a生存率分别为53.0%、26.1%、18.1%。单因素分析显示PS评分,治疗前外周血红蛋白、白蛋白及中性粒细胞,TNM分期,首诊伴骨、肝、脑转移及转移器官数目,一线化疗周期数,是否应用EGFR-TKI与晚期肺腺癌患者生存有关(P<0.05)。多因素分析显示PS评分,治疗前外周血红蛋白、白蛋白、中性粒细胞,TNM分期,首诊伴脑转移,转移器官数目,一线化疗周期数及EGFR-TKI的应用与晚期肺腺癌患者生存有关(P<0.05)。在对接受EFGR-TKI治疗的83例患者的亚组分析中发现,既应用EFGR-TKI又接受化疗者的中位生存期最长,但各亚组间生存期差异无统计学意义(P>0.05)。结论PS评分,治疗前外周血红蛋白、白蛋白、中性粒细胞,TNM分期,首诊伴脑转移,转移器官数目,一线化疗周期数及EFGR-TKI的应用是影响晚期肺腺癌患者预后的独立危险因素。EFGR-TKI的应用可以为晚期肺腺癌患者带来生存获益,既应用EFGR-TKI又化疗的患者可能为获益最大。
[关键词]晚期肺腺癌;预后;酪氨酸激酶抑制剂
据《2014年世界癌症报告》显示,全球癌症负担正以惊人的速度不断加重,平均每8例死亡患者中就有1例死于癌症。作为全球第一大杀手,肺癌占总数的19.4%[1]。肺癌已位居我国癌症死因的首位,是我国死亡率上升最快的肿瘤[2],长期生存率低,预后较差。其中80%的肺癌为非小细胞肺癌(non-small-cell lung cancer,NSCLC),75%以上的肺癌患者在确诊时已为失去手术机会的Ⅲb~Ⅳ期患者。作为最常见的肺癌组织学类型之一,肺腺癌的发病率在世界范围内呈逐年上升的趋势[3]。近年来由于有计划地综合应用以手术、放疗、化疗、分子靶向治疗及生物免疫治疗为主的多学科治疗模式,尤其是分子靶向治疗的参与,晚期肺腺癌患者的生存明显改善。但由于肺腺癌患者的个体差异及肿瘤的异质性,不同肺腺癌患者对同一治疗的反应也是不同的。因此,肺腺癌患者临床预后因素的预测对个体化治疗的选择具有重要的指导意义。为进一步明确晚期肺腺癌患者的临床预后因素,本文回顾性研究了就诊于河北医科大学第四医院的319例晚期肺腺癌患者的临床资料,应用Cox风险比例模型,总结出影响晚期肺腺癌预后的独立因素,以期为临床更科学选择个体化治疗方案提供帮助。
1资料与方法
1.1病例入选标准2009年1月至2013年5月间首次在河北医科大学第四医院就诊的经病理组织学和(或)细胞学检查确诊的Ⅲb~Ⅳ期肺腺癌患者。纳入标准:至少有1个可测量的病灶;无严重合并症;治疗前未接受过全身化疗、放疗、手术、分子靶向或免疫治疗;预计生存时间>3个月。符合条件的共319例患者。
1.2资料收集对319例肺腺癌患者的性别、年龄、吸烟史、PS评分、肿瘤家族史、治疗前外周血红蛋白、白蛋白、中性粒细胞、乳酸脱氢酶、TNM分期、首诊有无转移(骨、肝、脑)及转移器官数目、一线化疗周期数和是否应用酪氨酸激酶抑制剂(EGFR-TKI)等16项临床资料进行记录,建立Access数据库。
1.3随访以患者确诊时间为研究起点,最后随访时间、死亡日期或失访为研究终点。随访至2013年12月1日,生存期以月表示。研究结局定为因肺癌死亡,因意外或其他疾病死亡不计入。失访、研究期间因其他原因死亡或至随访日仍生存者均记为截尾值。总生存期定义为从肿瘤确诊至随访截止日期或死亡的时间。
1.4统计学处理采用SPSS 13.0处理,应用Kaplan-Meier 法估计生存率,log rank检验进行生存率显著性检验,采用单因素方差分析法及Cox回归模型进行单因素及多因素分析,检验水准α=0.05。
2结果
2.1生存及随访情况本研究共纳入具有明确病理学诊断依据的晚期肺腺癌患者319例,Ⅲb期52例,Ⅳ期267例;男174例,女145例;年龄23~87岁,中位年龄59岁;随访时间为2~58个月,失访32例,随访率90.0%。全部获得随访的287例患者中,存活34例(10.66%),死亡253例(79.3%),中位生存期13个月,1、2、3 a生存率分别为53.0%、26.1%和18.1%。生存曲线见图1。
2.2预后因素分析
2.2.1预后单因素分析对性别,年龄,吸烟史,PS评分,肿瘤家族史,治疗前血红蛋白、白蛋白、中性粒细胞、乳酸脱氢酶,TNM分期,首诊有无骨、肝、脑转移及转移器官数目,一线化疗周期数及是否应用EGFR-TKI进行单因素分析。单因素分析显示PS评分,治疗前外周血红蛋白、白蛋白及中性粒细胞,TNM分期,首诊伴骨、肝、脑转移及转移器官数目,一线化疗周期数,是否应用EGFR-TKI与晚期肺腺癌患者生存有关(P<0.05)。具体结果见表1。PS评分为0~1者240例(75.2%),PS评分≥2有79例(24.8%),中位生存期分别为16个月、5个月,差异有统计学意义(P<0.001)。EGFR-TKI应用与否的中位生存期分别为21个月、11个月,差异有统计学意义(P<0.001)。
表1晚期肺腺癌预后因素的单因素分析结果
续表1
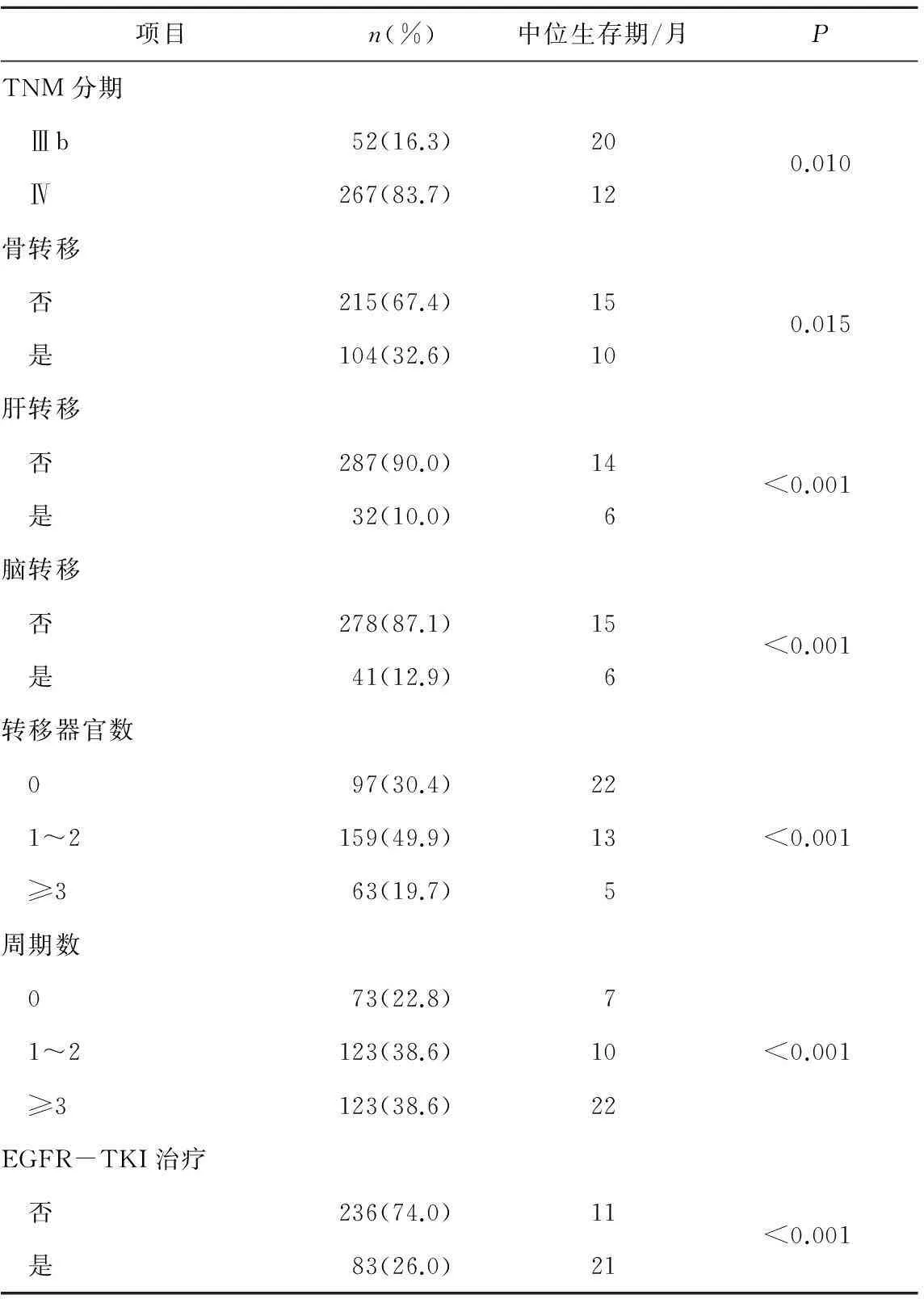
项目n(%)中位生存期/月PTNM分期 Ⅲb52(16.3)200.010 Ⅳ267(83.7)12骨转移 否215(67.4)150.015 是104(32.6)10肝转移 否287(90.0)14<0.001 是32(10.0)6脑转移 否278(87.1)15<0.001 是41(12.9)6转移器官数 097(30.4)22 1~2159(49.9)13<0.001 ≥363(19.7)5周期数 073(22.8)7 1~2123(38.6)10<0.001 ≥3123(38.6)22EGFR-TKI治疗 否236(74.0)11<0.001 是83(26.0)21
2.2.2多因素分析多因素分析显示PS评分,治疗前外周血红蛋白、白蛋白、中性粒细胞,TNM分期,首诊伴脑转移,转移器官数目,一线化疗周期数及EGFR-TKI的应用与晚期肺腺癌患者生存有关(P<0.05)。见表2。
2.3EGFR-TKI对生存期的亚组分析在接受EGFR-TKI治疗的83例晚期肺腺癌患者中,口服吉非替尼治疗者59例(71.1%),厄洛替尼治疗者17例(20.5%),口服埃克替尼者7例(8.4%)。83例患者中一线接受EFGR-TKI治疗者39例(47%),二线及以上应用EGFR-TKI治疗者44例(53%)。在对接受EFGR-TKI治疗的83例患者的亚组分析中发现,仅应用EFGR-TKI治疗者11例(13.3%),中位生存期20个月;既应用化疗又应用EGFR-TKI者49例(59.0%),中位生存期30个月;应用过放疗又接受EGFR-TKI治疗者17例(20.5%),中位生存期20个月;既应用放、化疗又应用EGFR-TKI者6例(7.2%),中位生存期15个月。各亚组中,既应用EGFR-TKI又接受化疗者的中位生存期最长,但各亚组间差异无统计学意义(P>0.05)。见表3。
表2晚期肺腺癌预后因素的Cox多因素分析结果

变量BSEWalddfPRRPS评分0.8240.16126.0821<0.0012.280血红蛋白水平-0.3900.1844.50010.0340.677白蛋白水平-0.9570.14643.1771<0.0010.384中性粒细胞水平0.4110.1408.59610.0031.509TNM分期-0.6400.2139.04910.0030.527脑转移0.6160.2078.87710.0031.852转移器官数0.9210.14242.1361<0.0012.511周期数-0.3410.09413.1161<0.0010.711EGFR-TKI-0.4500.1558.40210.0040.638
表383例EGFR-TKI治疗各亚组的生存分析结果

亚组n(%)中位生存期/月PEGFR-TKI11(13.3)20化疗+EGFR-TKI49(59.0)300.344放疗+EGFR-TKI17(20.5)20放疗+化疗+EGFR-TKI6(7.2)15
3讨论
目前肺癌位居我国癌症死因的首位,是我国死亡率上升最快的肿瘤,长期生存率低,预后较差。本组319例晚期肺腺癌患者的中位生存期为13个月,1、2、3 a生存率分别为53.0%、26.1%和18.1%。本文着重对多因素分析有意义的变量进行讨论。
3.1PS评分目前PS评分是公认的非小细胞肺癌患者的预后因素,PS评分低(3~4分)的患者预后差,并且不能从化疗中获益。Pan等[6]回顾性分析了PS评分0~2分能接受二线药物治疗的Ⅲb期或Ⅳ期的NSCLC患者的治疗情况,研究结果显示PS评分1~2者较PS评分0者预后差。本研究将319例晚期肺腺癌患者,按PS评分分为<2和≥2 2组,中位生存期分别为16个月、5个月,差异有统计学意义(P<0.05)。Cox多因素分析同样显示2组生存期差异有统计学意义(P<0.05)。考虑与PS评分低者能接受进一步治疗,且耐受性良好有关。临床工作中应重视患者的一般状态,灵活结合PS评分更加科学、合理地选择治疗方案。
3.2基线血红蛋白、白蛋白和中性粒细胞贫血是肺癌常见并发症之一,发生率高达50%~77%。贫血可降低抗肿瘤治疗效果,并显著降低肺癌患者的生存率。目前很多研究[20-21]证实治疗前外周血红蛋白是影响肺癌生存率的独立预后因素。本研究显示治疗前血红蛋白≥110 g·L-1组的中位生存期长于血红蛋白<110 g·L-1组(P<0.05),多因素分析也显示2组生存期差异有统计学意义(P<0.05)。故贫血可以作为晚期肺腺癌患者的独立预后指标,低血红蛋白含量往往预示患者生存期较短。这与Tomita等[22]的研究结果一致。分析原因:贫血可导致肿瘤组织缺氧,进而引起肿瘤细胞基因组和蛋白质组发生改变,导致肿瘤侵袭性增强;此外,缺氧可以促进肿瘤新生血管形成及促凝因子的表达,同时增加对放化疗的抵抗力,进而影响预后[21]。
传统意义上白蛋白是评价营养的生化指标,也是反映内脏蛋白水平的简易参数。近年来29个肿瘤研究中心的流行病学调查提示:外周血白蛋白水平是恶性肿瘤患者存活的预示因子[24]。Hannan等[25]研究发现,≥60岁的住院患者的死亡率与较低的白蛋白水平有关。本研究治疗前白蛋白水平≥35 g·L-1与<35 g·L-1组的中位生存期分别为20个月、8个月,差异有统计学意义(P<0.05)。Cox多因素分析亦显示低白蛋白与预后差相关。考虑患者白蛋白水平与基础营养状况、PS评分和对化疗的耐受性相关。
白细胞增高可为肺癌的首发症状。目前很多研究已证实基线白细胞水平与多种恶性肿瘤预后不良有关。欧洲肺癌工作组[28]认为升高的中性粒细胞水平是不能手术的晚期非小细胞肺癌预后差的独立因素。有研究显示肺癌肿瘤细胞可通过分泌单细胞集落刺激因子和粒细胞集落刺激因子引起粒细胞升高。此外,肿瘤相关性炎症或感染的存在亦能使粒细胞升高[28],并通过抑制机体的抗肿瘤免疫,促进肿瘤的生长。本研究中基线中性粒细胞水平≥4.7×109·L-1和<4.7×109·L-1组的中位生存期分别为10个月和14个月,3 a生存率分别为6.8%和22.8%。Cox多因素分析显示同样差异有统计学意义(P<0.05)。我们认为基线外周血中性粒细胞水平可作为晚期肺腺癌的独立预后因素。
3.3TNM分期目前大多数研究结果均显示TNM分期是NSCLC的独立预后因子。分期越晚,预后越差。有研究[5,14]提示早期NSCLC的生存率明显高于晚期患者。张凤鸣等[4]分析了105例晚期NSCLC患者的预后因素,多因素分析提示临床分期是其独立的预后因素。本研究采用AJCC第7版肺癌分期,结果显示Ⅲb期和Ⅳ期患者的中位生存期分别为20个月、12个月,差异有统计学意义(P<0.05),多因素分析同样显示2组的生存期差异有统计学意义(P<0.05),我们认为TNM分期为晚期肺腺癌患者的独立预后因素。
3.4转移器官(骨、脑、肝)及其数目晚期肺癌往往发生多脏器的转移,常见的肺外转移器官为骨、脑、肝。许多文献资料显示首诊伴发脏器转移与肺癌生存期有关。本研究单因素分析显示初诊伴骨转移、肝转移、脑转移均与预后不良相关(P<0.05),但Cox多因素分析提示初诊伴脑转移为影响晚期肺腺癌患者的独立预后因素(P<0.05)。分析原因可能与首诊即出现脏器转移多提示临床分期晚、肿瘤自身侵袭性强、失去根治性手术机会且化疗耐受性差有关。
除了转移部位对NSCLC预后有预测价值外,转移器官数目亦可影响其预后。Paralkar等[41]分析了172例晚期NSCLC患者的潜在预后因素,结果提示1个以上的脏器转移为预后不良的临床因素。本研究通过对319例晚期肺腺癌患者研究发现,单器官转移者与多器官转移者的中位生存期分别为13个月和5个月(P<0.05),单因素、多因素分析结果均显示首诊转移器官数目为影响晚期肺腺癌预后的独立因素。
3.5一线化疗周期数对于一线化疗周期数是否对晚期肺癌患者的预后有影响,不少学者进行了报道。彭红等[39]按照一线化疗周期数将1 742例NSCLC患者分为未化疗组、接受≤4周期化疗组和>4周期化疗组,3组的中位生存期分别为6、9和23个月(P<0.05),在生存率方面具有显著性差异。本研究通过参考文献及结合临床实际,将319例晚期肺腺癌患者按一线化疗周期数分为未化疗组、化疗周期1~2组和化疗周期≥3组,3组的中位生存期分别为7、10和22个月,差异具有统计学意义(P<0.05)。Cox多因素分析显示一线化疗周期数是晚期肺腺癌患者的独立预后因素。这提示我们在考虑到化疗毒副反应的同时,积极合理的化疗对提高患者生存率来说也是十分必要的。
3.6EGFR-TKI近年来,伴随着吉非替尼、厄洛替尼、埃克替尼这些小分子EGFR-TKI在临床的逐步应用,晚期NSCLC患者的传统治疗模式发生重大变革。针对亚洲人群的IPASS试验[42]研究了一线接受吉非替尼或卡铂联合紫杉醇治疗的1 217例晚期肺腺癌患者,结果显示,吉非替尼组中EGFR突变患者的有效率和疾病无进展生存期优于化疗组(71.2%vs47.3%;9.5个月vs6.3个月)。IPASS试验证实了EGFR突变状态对于靶向药物在肺癌治疗选择中的重大影响,成为了肺癌靶向治疗的里程碑,同时为后来众多靶向治疗的临床研究奠定了基础。2012年ASCO年会上公布了一项迄今规模最大的针对EGFR突变肺癌的全球前瞻性临床试验LUX-Lung3[45]。该试验对比研究了345例阿法替尼和顺铂联合培美曲塞一线治疗EGFR突变型Ⅲb期或Ⅳ期肺腺癌患者。结果显示阿法替尼组较化疗组的中位无进展生存期显著延长(11.1个月vs6.9个月),尤其对于存在外显子19缺失或L858R突变的患者,阿法替尼治疗组的无进展生存期较联合化疗组延长更为明显(13.6个月vs6.9个月)。综合上述结果,不难发现对于EGFR突变阳性的晚期NSCLC患者,一线EGFR-TKI治疗组的PFS较传统化疗组显著延长。
一项针对760例EGFR突变状态未知的晚期NSCLC设计的3期临床试验[46],随机分为2组,一组一线给予厄洛替尼至疾病进展后给予吉西他滨和顺铂治疗,另一组为标准顺序疗法,首先采用吉西他滨和顺铂,进展后应用厄洛替尼。主要终点为生存期,结果显示EGFR突变阳性患者更倾向于一线应用厄洛替尼,而EGFR突变阴性患者更倾向于一线使用化疗。FASTACT-2研究[7]结果表明非选择性晚期NSCLC患者可以从一线化疗、EGFR-TKI交替治疗模式获益,但亚组分析提示该获益仅来源于EGFR突变患者。FASTACT模式可能为EGFR突变状态不明的晚期NSCLC患者的治疗带来新思路。SATURN研究[47]则显示了厄洛替尼在晚期NSCLC维持治疗中的作用,结果提示厄洛替尼组较安慰剂组的疾病无进展生存期和总生存期均显著延长,推动了肺癌治疗模式的多元化发展。
基于众多临床试验的研究结果,2014版NCCN指南建议非鳞和不吸烟的鳞癌患者在一线治疗前进行EGFR突变检测,若为EGFR突变型,则进行EGFR-TKI一线治疗,若在一线化疗过程中检测出EGFR突变,可在化疗过程中加用EGFR-TKI治疗或进行EGFR-TKI的维持治疗。
本研究显示,EGFR-TKI治疗组与未应用EGFR-TKI治疗组的中位生存期分别为21个月和11个月,2组间生存期差异具统计学意义(P<0.05)。多因素分析显示EGFR-TKI的应用是影响晚期肺腺癌预后的独立因素(P<0.05)。与张亚雷等[48]的研究结果一致。在对EGFR-TKI治疗组的亚组分析中发现,既应用EGFR-TKI又接受化疗者的中位生存期最长,为30个月,仅接受EGFR-TKI治疗组的中位生存期为20个月,但各亚组间生存期差异无统计学意义(P>0.05)。据此,我们认为既应用EGFR-TKI又接受化疗的人群可能为EGFR-TKI治疗组中获益最大的人群。下一步我们需扩大样本量、细化治疗分组,明确EFGR基因突变情况继续研究。
众多国内外专家一直致力于肺癌的治疗,EGFR-TKI的应用已经开启了肺癌治疗的新模式,为广大肺癌患者带来了福音。伴随着肺癌治疗新靶点的发现和抗癌新药的不断涌现,肺癌的治疗出现一个又一个突破,我们相信,在科技发展日新月异的今天,人类迟早会攻克肺癌这一医学难题。
参考文献:
[1]Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin, 2014 ,64(1):9-29.
[2]陈万青,张思维,邹小农,等.中国肺癌发病死亡的估计和流行趋势研究[J].中国肺癌杂志,2010,13(5):488-493.
[3]Lortet-Tieulent J,Soerjomataram I,Ferlay J,et al.International trends in lung cancer incidence by histological subtype: adenocarcinoma stabilizing in men but still increasing in women[J].Lung Cancer, 2014,84(1):13-22.
[4]张凤鸣,张晓芹,王红,等.105例晚期非小细胞肺癌预后因素分析[J].肿瘤学杂志,2010,16(8):629-632.
[5]Babacan NA,Yucel B,Kilickap S,et al.Lung cancer in women: a single institution experience with 50 patients[J].Asian Pac J Cancer Prev, 2014,15(1):151-154.
[6]Koizumi T,Agatsuma T,Ikegami K,et al.Prospective study of gefitinib readministration after chemotherapy in patients with advanced non-small-cell lung cancer who previously responded to gefitinib[J].Clin Lung Cancer, 2012 ,13(6):458-463.
[7]Wu YL,Lee JS,Thongprasert S,et al.Intercalated combination of chemotherapy and erlotinib for patients with advanced stage non-small-cell lung cancer (FASTACT-2): a randomised,double-blind trial[J].Lancet Oncol, 2013 ,14(8):777-786.
[8]Jubelirer SJ,Varela NL,Welch CA,et al.Does sex make a difference in survival of patients undergoing resection for early stage non-small cell lung cancer(NSCLC)?[J].W V Med J, 2009 ,105(4):18-22.
[9]Pitz MW,Musto G,Navaratnam S.Sex as an independent prognostic factor in a population-based non-small cell lung cancer cohort[J].Can Respir J, 2013 ,20(1):30-34.
[10]裴俊,韩宝惠,张杰,等.Ⅰ期非小细胞肺癌术后预后的多因素分析[J].中国肺癌杂志,2011,14(12):926-932.
[11]葛辰蕾,李醒亚,尚可,等.非小细胞肺癌预后影响因素分析[J].郑州大学学报(医学版),2011,46(2):216-219.
[12]Wakelee HA,Dahlberg SE,Brahmer JR,et al.Differential effect of age on survival in advanced NSCLC in women versus men: analysis of recent Eastern Cooperative Oncology Group (ECOG) studies,with and without bevacizumab[J].Lung Cancer, 2012 ,76(3):410-415.
[13]曹建忠.局部晚期非小细胞肺癌放疗或化放综合治疗预后因素分析 MicroRNA在小细胞肺癌中的预后价值[D].北京:中国协和医科大学,2009.
[14]Kawaguchi T,Takada M,Kubo A,et al.Performance status and smoking status are independent favorable prognostic factors for survival in non-small cell lung cancer: a comprehensive analysis of 26,957 patients with NSCLC[J].J Thorac Oncol, 2010 ,5(5):620-630.
[15]Meguid RA,Hooker CM,Harris J,et al.Long-term survival outcomes by smoking status in surgical and nonsurgical patients with non-small cell lung cancer: comparing never smokers and current smokers[J].Chest, 2010 ,138(3):500-509.
[16]Pan IW,Mallick R,Dhanda R,et al.Treatment patterns and outcomes in patients with non-squamous advanced non-small cell lung cancer receiving second-line treatment in a community-based oncology network[J].Lung Cancer, 2013 ,82(3):469-476.
[17]Buccheri G,Ferrigno D.Familial and personal history of cancer in bronchogenic carcinoma--frequency and clinical implications[J].Acta Oncol, 2004,43(1):65-72.
[18]Haraguchi S,Koizumi K,Mikami I,et al.Clinicopathological characteristics and prognosis of non-small cell lung cancer patients associated with a family history of lung cancer[J].Int J Med Sci, 2012,9(1):68-73.
[19]Aoe K,Hiraki A,Maeda T,et al.Serum hemoglobin level determined at the first presentation is a poor prognostic indicator in patients with lung cancer[J].Intern Med, 2005,44(8):800-804.
[20]许崇安,高艳,李琳,等.贫血对晚期非小细胞肺癌患者化疗疗效及预后的影响 [J].中国肺癌杂志,2010,13(10):968-974.
[21]王剑,马若冰,陈雪琴,等.晚期非小细胞肺癌患者贫血相关因素及其对预后的影响[J].肿瘤学杂志,2013,19(9):718-721.
[22]Tomita M,Shimizu T,Hara M,et al.Preoperative leukocytosis,anemia and thrombocytosis are associated with poor survival in non-small cell lung cancer[J].Anticancer Res, 2009 ,29(7):2687-2690.
[23]Piskorz L,Lesiak T,Brocki M,et al.Biochemical and functional indices of malnutrition in patients with operable,non-microcelullar lung cancer[J].Nutr Hosp, 2011 ,26(5):1025-1032.
[24]Gupta D,Vashi PG,Lammersfeld CA,et al.Role of nutritional status in predicting the length of stay in cancer: a systematic review of the epidemiological literature[J].Ann Nutr Metab,2011,59(2/4):96-106.
[25]Hannan JL,Radwany SM,Albanese T.In-hospital mortality in patients older than 60 years with very low albumin levels[J].J Pain Symptom Manage, 2012 ,43(3):631-637.
[26]石荟,韩宝惠.ⅢB-T4期非小细胞肺癌141例预后因素分析[J].现代实用医学,2011,23(8):852-855.
[27]Carus A,Gurney H,Gebski V,et al.Impact of baseline and nadir neutrophil index in non-small cell lung cancer and ovarian cancer patients: Assessment of chemotherapy for resolution of unfavourable neutrophilia[J].J Transl Med, 2013 ,11:189.
[28]Teramukai S,Kitano T,Kishida Y,et al.Pretreatment neutrophil count as an independent prognostic factor in advanced non-small-cell lung cancer: an analysis of Japan Multinational Trial Organisation LC00-03[J].Eur J Cancer, 2009 ,45(11):1950-1958.
[29]梁颖莹,廖永德,梁宾勇.肺癌伴白细胞增多的诊断、机制及预后:附4例病例报告 [J].临床肺科杂志,2011,16(1):74-75.
[30]燕翔,赵晓,焦顺昌,等.晚期肺腺癌患者一线化疗后T淋巴细胞亚群变化及临床意义[J].中国肺癌杂,2012,15(3):164-171.
[31]赵晓,燕翔,孙胜杰,等.晚期肺腺癌患者外周血T淋巴细胞亚群检测的临床意义[J].南方医科大学学报,2012,32(5):752-754.
[32]张瑞萍,徐冰心,王社论,等.晚期非小细胞肺癌调节性 T 细胞与预后的关系[J].现代肿瘤医学,2013,21(3):521-524.
[33]田建春.急性颅脑损伤患者血清中C反应蛋白及乳酸脱氢酶的表达及关系的研究 [J].中国现代医生,2010,48(3):79-80.
[34]Inoue R,Takahashi A,Takasugi S,et al.Prognostic factors in patients with metastatic renal cell carcinoma[J].Hinyokika Kiyo, 2010,56(2):75-79.
[35]Haas M,Heinemann V,Kullmann F,et al.Prognostic value of CA 19-9,CEA,CRP,LDH and bilirubin levels in locally advanced and metastatic pancreatic cancer: results from a multicenter,pooled analysis of patients receiving palliative chemotherapy[J].J Cancer Res Clin Oncol, 2013 ,139(4):681-689.
[36]Li G,Gao J,Tao YL,et al.Increased pretreatment levels of serum LDH and ALP as poor prognostic factors for nasopharyngeal carcinoma[J].Chin J Cancer, 2012,31(4):197-206.
[37]Danner BC,Didilis VN,Wiemeyer S,et al.Long-term survival is linked to serum LDH and partly to tumour LDH-5 in NSCLC[J].Anticancer Res, 2010 ,30(4):1347-1351.
[38]胡娟,林大欢.乳酸脱氢酶在非小细胞肺癌患者血清中的表达及意义[J].广东医学院学报,2012,30(2):185-187.
[39]彭红,马美丽,韩宝惠,等.1742例IV期非小细胞肺癌的预后分析[J].中国肺癌杂志,2011,14(4):362-366.
[40]Laohavinij S1,Maneechavakajorn J.Prognostic factors for survival in advanced non-small cell lung cancer[J].J Med Assoc Thai, 2004,87(9):1056-1064.
[41]Paralkar VR,Li T,Langer CJ.Population characteristics and prognostic factors in metastatic non-small-cell lung cancer: a Fox Chase Cancer Center retrospective[J].Clin Lung Cancer, 2008 ,9(2):116-121.
[42]Mok TS,Wu YL,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med, 2009 ,361(10):947-957.
[43]Mitsudomi T,Morita S,Yatabe Y,et al.Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label,randomised phase 3 trial[J].Lancet Oncol, 2010 ,11(2):121-128.
[44]Zhou C,Wu YL,Chen G,et al.Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL,CTONG-0802): a multicentre,open-label,randomised,phase 3 study[J].Lancet Oncol, 2011 ,12(8):735-742.
[45]Sequist LV,Yang JC,Yamamoto N,et al.Phase Ⅲ study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations[J].J Clin Oncol, 2013 ,31(27):3327-3334.
[46]Gridelli C,Ciardiello F,Gallo C,et al.First-line erlotinib followed by second-line cisplatin-gemcitabine chemotherapy in advanced non-small-cell lung cancer: the TORCH randomized trial[J].J Clin Oncol, 2012,30(24):3002-3011.
[47]Cappuzzo F,Ciuleanu T,Stelmakh L,et al.Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre,randomised,placebo-controlled phase 3 study[J].Lancet Oncol, 2010 ,11(6):521-529.
[48]张亚雷,欧阳铭,郜靓,等.晚期非小细胞肺癌临床预后因素分析[J].山东医药,2010,50(17):78-80.
Analysis of Clinical Prognostic Determinants of 319 Patients with Advanced Lung Adenocarcinoma
Wang Cai1,Wei Suju2,Hong Lei2,Wang Junyan2,Zhang Fan2,Li Yanhua2
(1.DezhouPeople′sHospital,Dezhou253000,China;2.DepartmentofOncology,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China)
[Abstract]ObjectiveTo investigate the cilinical prognostic factors of advanced lung adenocarcinoma.MethodsThe clinical data of 319 patients with Ⅲb or IV lung adenocarcinoma were collected.The survival rate was evaluated by Kaplan-Meier method.The prognosis were analyzed by Cox multivariate regression.ResultsThe median survival time of 319 patients was 13.0 months.One,two and three-year survival rates were 53.0%,26.1%,18.1% respectively.Univariate analysis showed that PS scores,baseline serum hemoglobin level,baseline serum albumin level,baseline serum neutrophil level,TNM stage,bone metastasis,hepatic metastasis,brain metastasis at initial diagnosis,numbers of metastatic organs,first-line chemotherapy periodicity and therapy with EGFR-TKI had influence on the overall survival of patients with advanced lung adenocarcinoma (P<0.05).Cox multivariate analysis showed that PS scores,baseline serum hemoglobin level,baseline serum albumin level,baseline serum neutrophil level,TNM stage,brain metastasis at initial diagnosis,numbers of metastatic organs,first-line chemotherapy periodicity and therapy with EGFR-TKI were independent prognostic factors (P<0.05).In subgroup analysis of 83 patients with advanced lung adenocarcinoma treated with EGFR-TKI,median survival time for patients who received chemotherapy and EGFR-TKI was the longest in all subgroups,presenting no significant difference in each subgroup (P>0.05).ConclusionPS scores,baseline serum hemoglobin level,baseline serum albumin level,baseline serum neutrophil level,TNM stage,brain metastasis at initial diagnosis,numbers of metastatic organs,first-line chemotherapy periodicity and therapy with EGFR-TKI were independent prognostic factors for the overall survival of advanced lung adenocarcinoma.The application of EGFR-TKI has extended the lives of patients of advanced lung adenocarcinoma and the patients with treatment history of EGFR-TKI and chemotherapy may benefit most from this kind of treatment modality.
[Key words]advanced lung adenocarcinoma; prognosis; tyrosine kinase inhibitor
作者简介:王彩(1988-),女,硕士,主要从事呼吸系统肿瘤基础与临床研究。E-mail:sdnjking@126.com 通信作者:魏素菊(1963-),女,教授,主要从事肿瘤化疗与分子靶向治疗研究。E-mail:weisuju@126.com
DOI:10.3969/j.issn.1673-5412.2016.03.017
[中图分类号]R734.2
[文献标识码]A
[文章编号]1673-5412(2016)03-0240-07
(收稿日期:2015-07-14)

