秦皮素对脑缺血再灌注损伤小鼠的保护作用
陈美华 张 燕 陈 伟 马 健
(泰山医学院药学院,山东 泰安 271016)
秦皮素对脑缺血再灌注损伤小鼠的保护作用
陈美华张燕陈伟马健
(泰山医学院药学院,山东泰安271016)
〔摘要〕目的观察秦皮素对小鼠脑缺血再灌注损伤的保护作用及其可能机制。 方法采用反复夹闭双侧颈总动脉制备小鼠脑缺血再灌注损伤模型,秦皮素高、中、低3个剂量于造模前分别腹腔注射给药,术后24 h及48 h,用跳台法分别测定小鼠的学习记忆能力,测定脑组织中超氧化物歧化酶(SOD)活性,丙二醛(MDA)含量及髓过氧化物酶(MPO)活性,并测定Na+-K+-ATPase,Ca2+-Mg2+-ATPase活性,HE染色观察脑组织的病理形态学变化。结果模型组小鼠的学习记忆能力降低,秦皮素各剂量组小鼠的学习记忆能力明显提高(P<0.05)。秦皮素高、中、低剂量组可提高脑缺血再灌注小鼠脑组织SOD活性,降低MDA含量和MPO活性,与模型组差异显著(P<0.05)。秦皮素各剂量组可明显提高脑组织Na+-K+-ATPase,Ca2+-Mg2+-ATPase活性(P<0.05)。结论秦皮素对脑缺血再灌注损伤小鼠有保护作用,其机制与抗氧化、抑制炎症反应及改善细胞能量代谢有关。
〔关键词〕秦皮素;脑缺血再灌注;氧化应激:髓过氧化物酶;ATPase
脑缺血再灌注后自由基生成增多和炎症反应是导致脑损伤的主要原因〔1〕。近年来,有研究表明香豆素类化合物有很好的抗炎作用及保护脑缺血性损伤的作用〔2〕。秦皮素是传统中药秦皮中的香豆素类化合物,来源于木犀科植物白蜡树的树皮。现代药理研究表明,秦皮具有抗氧化,抗炎,抗菌,抗凝血和防治骨质疏松等多种生物学活性〔3〕。近年来的研究主要集中在秦皮素的抗肿瘤和神经保护作用〔4,5〕,本研究观察秦皮素对脑缺血再灌注小鼠学习记忆及脑组织生化代谢的影响。
1材料与方法
1.1材料秦皮素,购自南京郎泽医药有限公司,纯度98%;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、髓过氧化物酶(MPO)试剂盒、ATP酶试剂盒、考马斯亮蓝测定试剂盒,购自南京建成生物工程研究所;DT-200小鼠跳台仪,成都泰盟科技有限公司。
1.2方法
1.2.1实验动物与分组实验前1 d用跳台法对小鼠进行筛选,淘汰对电击反应过于迟钝或敏感的小鼠。将筛选合格小鼠随机分成五组,每组10只,即假手术组,模型组及秦皮素高剂量组(20 mg/kg),中剂量组(10 mg/kg),低剂量组(5 mg/kg),腹腔注射给药,连续7 d,假手术组,模型组给予等体积的生理盐水。
1.2.2脑缺血再灌注模型的制备根据文献〔6〕制备脑缺血再灌注小鼠模型,10%水合氯醛(0.4 g/kg)腹腔注射麻醉,将小鼠仰卧固定,切开颈部皮肤,分离两侧颈总动脉,缝合线牵拉,阻断血流,每牵拉10 min松开10 min,反复3次后缝合皮肤,适宜条件饲养,假手术组只分离两侧颈总动脉但不阻断血流。
1.2.3学习记忆能力测定〔7〕实验时将小鼠放入跳台仪内,适应环境3 min,调节电压为36 V,通电后小鼠受到电击的正常反应是跳上跳台逃避电击。学习成绩用反应时间(小鼠受到电击后跳上跳台的时间)和错误次数(5 min内小鼠受到电击的次数)表示,24 h 后再次测试,将小鼠放在平台上,开始通以电流,记录小鼠的潜伏期(通电后第1次跳下平台的时间)和错误次数(5 min 内跳下平台的次数)作为记忆成绩。
1.2.4脑组织生化指标的测定取脑组织,用冰生理盐水制备10%匀浆液,4℃、2 500 r/min,离心10 min,取上清液,按照试剂盒操作步骤进行测定,蛋白定量采用考马斯亮蓝法。
1.2.5脑组织形态学观察 取视交叉部位脑组织,依次经4%多聚甲醛固定,蒸馏水洗,梯度乙醇脱水,二甲苯透明,石蜡包埋,连续冠状切片,片厚5 μm,常规HE染色,观察脑组织形态学变化。
1.3统计学方法应用SPSS12.0统计软件行方差分析。
2结果
2.1学习记忆能力测试 缺血再灌注损伤组小鼠的跳台测试中反应时间延长,受到的电击次数(错误次数)增加,学习能力降低。记忆能力测定显示,模型组小鼠记忆潜伏期缩短,错误次数增加,与假手术组相比差异显著(P<0.05),与模型组相比,秦皮素高,中剂量组均可改善脑缺血再灌注小鼠的学习记忆能力(P<0.05),而秦皮素低剂量组效果不明显,见表1。
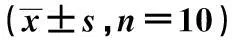
表1 各组小鼠学习记忆成绩
与假手术组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01;表2同
2.2脑组织SOD活性、MDA 含量和MPO活性模型组小鼠脑组织SOD活性降低,MDA 含量和MPO活性明显高于假手术组(P<0.05)。与模型组比较,秦皮素高、中、低剂量组小鼠脑组织SOD活性升高,MDA 含量和MPO活性降低(P<0.05),秦皮素各剂量组差别无统计学意义,见表2。
2.3秦皮素对小鼠脑组织Na+-K+-ATPase,Ca2+-Mg2+-ATPase活性的影响与假手术组相比,模型组Na+-K+-ATPase,Ca2+-Mg2+-ATPase活性明显降低,表明脑组织能量代谢异常。与模型组相比,秦皮素各剂量组脑组织Na+-K+-ATPase活性升高,秦皮素高、中剂量组脑组织Ca2+-Mg2+-ATPase活性升高(P<0.05),见表3。
2.4脑组织HE染色HE染色结果显示,假手术组大鼠海马结构正常,神经元排列正常,核仁明显,未见神经元坏死及中性粒细胞浸润等明显病理改变,模型组神经元数目明显减少,排列紊乱,出现程度不同的核深染,核固缩,核体不规则,秦皮素给药组能减轻神经元及细胞核的损伤,抑制局部组织坏死,提示秦皮素对脑缺血再灌注海马区神经元有保护作用,见图1。
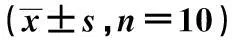
表2 秦皮素对小鼠脑组织中SOD活性,MDA

表3 各组小鼠Na+-K+-ATPase,Ca2+-Mg2+-
与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05

假手术组
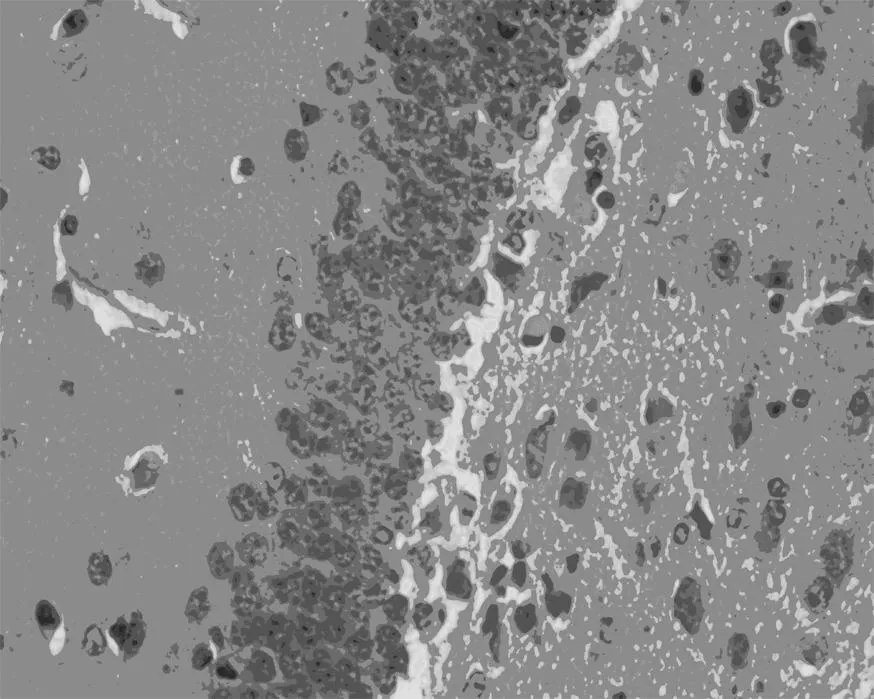
模型组

高剂量组
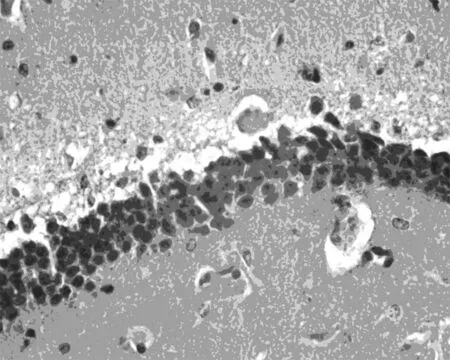
中剂量组

低剂量组
图1各组小鼠海马HE染色(×400)
3讨论
学习记忆功能障碍是缺血性脑血管疾病患者常见的临床表现,本研究显示,脑缺血再灌注损伤小鼠在跳台测试中反应时间延长,受到的电击次数增加,记忆潜伏期缩短,学习记忆能力降低,预先给予秦皮素可改善小鼠的学习记忆障碍。脑缺血再灌注损伤的发生是由多种机制参与的复杂病理生理过程,其中自由基的毒性作用和炎症反应是产生缺血再灌注损伤的关键性病理环节〔8〕。SOD具有显著抗脂质过氧化的作用,其活性与机体的抗氧化能力相关,MDA为脂质过氧化过程中的最终分解产物。研究表明,秦皮素通过抗凋亡和抗氧化作用,具有保护鱼藤酮诱导的人成神经细胞瘤细胞的细胞毒作用〔9〕。本研究显示,秦皮素能降低MDA含量,提高SOD活性,支持秦皮素的神经保护作用与其抗氧化作用密切相关。中性粒细胞含有MPO,其活性程度主要反映中性粒细胞的浸润程度,因而间接提示局部组织的炎性反应程度,MPO可诱导炎症相关基因的表达,促进炎症效应细胞的增殖与活化〔10〕。秦皮素预处理后脑组织MPO活性降低,提示秦皮素对缺血再灌注损伤后中性粒细胞浸润为标志的炎症反应有明显改善作用。能量代谢障碍是缺血性脑细胞损伤发生的另一关键环节,而ATP酶活性的改变是神经元损伤的重要环节〔11〕。Na+-K+-ATPase和 Ca2+-Mg2+-ATPase是存在于生物膜上的一种蛋白酶,在物质运送、能量转换及信息传递方面具有重要的作用,可维持细胞内外离子平衡,维持细胞的兴奋性和传导性,已成为评价神经元质膜功能状态的标志之一〔12〕。模型组小鼠脑组织ATPase活性下降,神经元质膜的功能异常,引起细胞内Na+和Ca2+增加,从而诱发一系列病理生理反应。本实验结果表明,秦皮素能明显提高脑缺血小鼠脑组织Na+-K+-ATPase和 Ca2+-Mg2+-ATPase活性,提示秦皮素可改善脑组织的能量代谢,对脑缺血再灌注损伤起保护作用。本研究证实,秦皮素对脑缺血再灌注造成的学习记忆减退和组织损伤有明显的保护作用,其机制涉及抗氧化,抑制炎症反应和改善脑组织能量代谢。
4参考文献
1韩云飞,惠康丽,吴智方,等.富氢液多次给药对大鼠全脑缺血再灌注损伤的影响〔J〕.中风与神经疾病杂志,2012;29(4):318-20.
2孔令雷,胡金凤,陈乃宏.香豆素类化合物药理和毒理作用的研究进展〔J〕.中国药理学通报,2012;28(2):165-9.
3方莲花,吕扬,杜冠华.秦皮的药理作用研究进展〔J〕.中国中药杂志,2008;33(23):2732-6.
4霍洪楠,谢鲲鹏,王丽梦,等.秦皮素体外抗乳腺癌作用与雌激素信号通路的关系〔J〕.生理学报,2013;65(3):323-8.
5Wang C,Pei AJ,Chen J,etal.A natural coumarin derivative esculetin offers neuroprotection on cerebral ischemia/reperfusion injury in mice〔J〕.Neurochemistry,2012;121:1007-13.
6Rehni AK,Singh N.Role of phosphoinositide 3-kinase in ischemic postconditioning-induced attenuation of cerebral ischemia-evoked behavioral deficits in mice〔J〕.Pharmacol Rep,2007;59(2):192-8.
7徐叔云,卞如濂,陈修.药理实验方法学〔M〕.第3 版.北京:人民卫生出版社,2002:826.
8邹金发,吴秀香.原花青素对脑缺血再灌注损伤大鼠炎症及自由基水平的影响〔J〕.中国老年学杂志,2012;32(19):4239-40.
9Molina-Jimnez MF,Snchez-Reus MI,Andres D,etal.Neuroprotective effect of fraxetin and myricetin against rotenone induced apoptosis in neuroblastom a cells〔J〕.Brain Res,2004;1009(1/2):9.
10Wong ND,Gransar H,Narula J,etal.Myeloperoxidase,subclinical atherosclerosis,and cardiovascular discade events〔J〕.JACC Cardiovasc Imaging,2009:2(9):1093-9.
11Abramov AY,Scorziello A,Duchen MR,etal.Three distinct mechanisms generate oxygen free radicals in neurons and contribute to cell death during anoxia and reoxygenation〔J〕.J Neurosci,2007;27(5):1129-38.
12Foggia L,Aronchik I,Aberg K,etal.Activity of the hSPCA1 Golgi Ca2+pump is essential for Ca2+-mediated Ca2+response and cell viability in Darier disease〔J〕.J Cell Sci,2006;119(Pt4):671-9.
〔2014-12-07修回〕
(编辑安冉冉/曹梦园)
基金项目:泰山医学院自然科学基金项目(No.2010ZR080)
〔中图分类号〕R285
〔文献标识码〕A
〔文章编号〕1005-9202(2016)10-2350-03;
doi:10.3969/j.issn.1005-9202.2016.10.016
第一作者:陈美华(1977-),女,讲师,硕士,主要从事神经药理学研究 。

