FILIP-1L 蛋白的原核表达及多克隆抗体制备①
都景芳 顿国庆 张舒曼 褚留杰 李淑莲 胡延忠 马远方
(抗体药物河南省工程实验室,河南大学医学院细胞与分子免疫学实验室,开封475004)
FILIP-1L 蛋白的原核表达及多克隆抗体制备①
都景芳顿国庆张舒曼褚留杰李淑莲②胡延忠②马远方②
(抗体药物河南省工程实验室,河南大学医学院细胞与分子免疫学实验室,开封475004)
[摘要]目的:表达、纯化GST-FILIP-1L融合蛋白,制备FILIP-1L多克隆抗体。方法:pGEX-4T3-FILIP-1L重组质粒转化E.coliBL21大肠杆菌,IPTG诱导GST-FILIP-1L融合蛋白表达,Glutathion Sepharse 4B纯化GST-FILIP-1L融合蛋白。将纯化的GST-FILIP-1L融合蛋白免疫新西兰大耳白兔,制备FILIP-1L多克隆抗体,用ELISA方法检测多克隆抗体效价,Western blot检测多克隆抗体与FILIP-1L蛋白、细胞转染FILIP-1L蛋白及细胞FILIP-1L蛋白的结合能力。结果:在大肠杆菌中诱导出高表达的FILIP-1L融合蛋白,经Glutathion Sepharse 4B纯化后免疫新西兰大耳白兔,获得了高效价的抗FILIP-1L多克隆抗体,亲和层析获得纯度较高的多克隆抗体,WB检测显示多克隆抗体能够与FILIP-1L蛋白、293细胞转染FILIP-1L蛋白及肝癌细胞FILIP-1L蛋白结合。结论:成功表达、纯化了GST-FILIP-1L融合蛋白,制备了高效价的抗FILIP-1L多克隆抗体,为研究FILIP-1L蛋白生物学功能提供了有用的实验工具。
[关键词]FILIP-1L;融合蛋白;多克隆抗体
肿瘤细胞的迁移性与肿瘤侵袭、转移相关[1,2],肿瘤转移是肿瘤患者死亡的重要原因,因此肿瘤侵袭及迁移的机制研究与临床肿瘤治疗策略的发展密切相关。FILIP-1L(Filamin A interacting protein 1-like,FILIP-1L;previously known as down-regulated in ovarian cancer 1,DOC1)是在卵巢癌细胞系低表达蛋白,其功能尚不完全清楚,研究发现FILIP-1L与乳腺癌、结肠癌等多种肿瘤的侵袭负相关[3],我们前期研究还发现FILIP-1L与热休克转录因子1(Heat shock factor 1,Hsf1)的降解有关[4],为了进一步研究FILIP-1L的生物学作用,我们构建了pGEX-4T3-FILIP-1L表达载体,应用FILIP-1L融合蛋白免疫新西兰大耳白兔,制备FILIP-1L多克隆抗体,为FILIP-1L生物学功能的深入研究提供有用工具。
1材料与方法
1.1材料pGEX-4T3、pGEX-4T3-FILIP-1L(288)、pGEX-4T3-FILIP-1L(893)、PcDNA3-FLAG-FILIP-1L(893)及E.coliBL21,本实验室保存。新西兰大耳白兔购自河南省实验动物中心。肝癌细胞系HepG2、smmc-7721、bel-7402、plc/prf/5及肝永生化细胞changliver购于中国医学科学院上海细胞生物研究所。Glutathion Sepharse 4B购自 GE Healthcare Bio-Sciences AB。L-Gluthion Reduced 为SCIENTIFIC RESEARCH SRECIAL产品。Freund′,s Adjuant Complete及Freund′,s Adjuant Incomplete购于Sigma。Active Ester Agrose购自Bio-Rad。Protease Inhibitor Cocktail购自Sigma。辣根过氧化酶标记抗兔IgG 为北京中杉金桥生物技术有限公司产品。
1.2方法
1.2.1GST-FILIP-1L蛋白诱导表达分别将pGEX-4T3、pGEX-4T3-FILIP-1L(288)质粒转化E.coli BL21感受态细菌。挑取单个菌落接种于1 ml LB培养基中,37℃振荡培养14 h,按照1∶100的体积接种培养于新鲜LB液体培养基中, 37℃ 180 r/min振荡培养至A600约为0.6时,加入终浓度为1 mmol/L的IPTG诱导培养6 h。取200 μl菌液加入5×Loading Buffer 50 μl,沸水浴8 min;另取6 ml菌液, 4 000 r/min,4℃离心10 min。弃上清,加200 μl PBS重悬沉淀,再加入5×Loading Buffer 50 μl,沸水浴8 min。将菌液与细菌裂解液进行SDS-PAGE蛋白电泳,考马斯亮蓝染色,观察GST-FILIP-1L蛋白表达。
1.2.2GST-FILIP-1L蛋白溶解性分析如上方法将pGEX-4T3-FILIP-1L质粒转染E.coliBL21, LB液体培养基中扩大培养,加入终浓度为1 mmol/L的IPTG诱导培养6 h,4 000 r/min,4℃离心10 min,PBS洗涤菌体沉淀2次,重悬沉淀,加入溶菌酶,冰上超声破碎,加1%Triton X-100,冰上放置30 min, 4℃,10 000 r/min,离心10 min,分别收集上清和沉淀,进行10%SDS-PAGE蛋白电泳。
1.2.3提取GST-FILIP-1L蛋白如上方法收集菌液,10 000 r/min,4℃离心10 min,弃上清。沉淀中加入浓度为8 mol/L的尿素溶液20 ml,混合均匀,置冰上超声30 s,间隔30 s,共6个循环。9 000 r/min,4℃离心10 min,收集上清于透析袋内,将透析袋置入2 mol/L尿素溶液中,4℃透析过夜。将透析液更换为1×PBS , 4℃透析24 h,期间更换PBS液一次。收集透析袋内液体, 9 000 r/min,4℃离心20 min,收集上清GST-FILIP-1L蛋白溶液备用。
1.2.4纯化GST-FILIP-1L蛋白取Glutathion Sepharse 4B 2 ml加入PBS溶液5 ml,混匀,4 000 r/min,4℃离心5 min,弃上清。重复上述操作三次,加入1 ml PBS溶液悬浮beads。将Glutathion Sepharse 4B 悬液与上述收集的GST-FILIP-1L蛋白溶液混合,置4℃旋转过夜。加预冷PBS液10 ml,混悬,洗涤Glutathion Sepharse 4B,4 000 r/min,4℃离心5 min,重复操作5次。加入Glutathion Reduced缓冲液1 ml, 旋转混合20 min,4℃ 4 000 r/min,离心5 min,将上清收集至新EP管内。重复Glutathion Reduced缓冲液洗脱,共3次。标明洗脱液顺序,检测洗脱液蛋白纯度后,置-80℃保存备用。
1.2.5多克隆抗体制备取新西兰大耳白兔1只,免疫前耳缘静脉取血作为阴性血清对照。将纯化的GST-FILIP-1L(288)蛋白与弗氏完全佐剂等体积充分乳化后,于动物背部皮下多点注射,每只动物的蛋白抗原用量为400 μg。初次免疫后第21天、35天分别以同剂量的GST-FILIP-1L蛋白,加弗氏不完全佐剂乳化后,采用同样方法加强免疫2次。第二次加强免疫10 d后,耳缘静脉取血测定抗血清的效价。抗体效价达到实验要求后,自颈总动脉插管放血, 收集血液, 37℃培养箱静置3 h,2 000 r/min离心10 min,取血清于-80℃保存。
1.2.6间接ELISA方法检测抗体效价用抗原稀释液稀释GST-FILIP-1L蛋白,使其浓度为1 μg/ml,每孔加入 100 μl蛋白稀释液包被96孔酶标板。以动物免疫前血清作为阴性对照,用磷酸盐缓冲液稀释血清(1∶250,1∶500,1∶1 000,1∶2 000,1∶4 000,1∶8 000,1∶16 000~1∶128 000 ),间接ELISA方法检测抗体效价。
1.2.7多克隆抗体纯化
1.2.7.1饱和硫酸铵纯化抗体 用PBS 1∶5倍稀释免疫动物血清,4℃缓慢逐滴加入饱和硫酸铵溶液(体积比1∶1),4℃磁力搅拌过夜。4℃、10 000 r/min离心20 min, PBS悬浮沉淀。PBS透析4次,每次12 h,收集透析袋内抗体溶液。
1.2.7.2去除抗GST抗体取Glutathion Sepharse 4B 1 ml,加预冷PBS液5 ml, 4 000 r/min,4℃离心5 min,弃上清。PBS悬浮沉淀,重复上述操作3次。加1 ml PBS液悬浮beads,加入GST蛋白5 mg,4℃旋转孵育2 h, 4 000 r/min,4℃离心5 min。PBS洗5次后,加1 ml PBS混悬。加入上述饱和硫酸铵纯化的血清50 ml, 4℃旋转孵育4 h, 离心,收集上清。
1.2.7.3亲和层析纯化抗体(1)取Active Ester Agrose混悬液1 ml, 4 000 r/min,4℃离心5 min,弃上清。加入预冷单蒸水1 ml,混悬,4 000 r/min,4℃离心10 min。重复上述操作5次。(2)取纯化的GST-FILIP-1L蛋白5 mg于透析袋内,将透析袋置入1 mol/L HEPES溶液中,4℃透析过夜。(3)混合Active Ester Agrose和GST-FILIP-1L蛋白溶液,4℃旋转孵育过夜。4 000 r/min,4℃离心10 min,弃上清。(4)依次用PBS溶液10 ml、0.1 mol/L Glycine HCl(pH2.5)5 ml、PBS溶液10 ml洗涤,4 000 r/min,4℃离心10 min。(5)取上述处理的抗血清1 ml,置56℃恒温水浴锅内30 min,PBS稀释10倍,加入resin-column混合,4℃旋转孵育过夜,4 000 r/min,4℃离心10 min,回收上清,沉淀进行下述操作。(7)分别用1×PBS、0.5 mol/L NaCl、0.5%tritonX-100 10 ml洗涤antibody-resin-column,4 000 r/min 4℃离心10 min;转移antibody-resin-column至柱子中,用1×PBS 10 ml及去离子水10 ml洗涤。(8)用0.1 mol/L Glycine.HCl(pH2.5)0.9 ml洗涤antibody-resin-column,收集洗脱液于干净无菌EP管内(EP管内预先加入一定体积的2 mol/L Tris-HCl pH8.0),共洗脱3次,分管收集,分别测定每管蛋白(抗体)含量,-80℃保存备用。
1.2.8检测多克隆抗体与目的蛋白的结合制备SDS-PAGE凝胶,加入不同剂量的纯化GST-FILIP-1L融合蛋白,常规蛋白质电泳,转印PVDF膜。将PVDF膜置1∶50稀释的FILIP1L抗体稀释液中,4℃旋转孵育过夜。TBST溶液洗膜。加入稀释好的二抗,室温,置摇床孵育1 h。化学发光显色,于暗室中曝光、显影。图像扫描仪上拍照后分析。
1.2.9检测多克隆抗体与细胞FILIP-1L蛋白结合常规培养293T细胞,待细胞状态良好,按照Lipofetamine 2000 Reagent说明书,分别转染PcDNA3.0及PcDNA3.0-FILIP-1L(893)质粒,置 37℃ 5% CO2培养箱培养48 h,收集细胞,提取细胞蛋白,SDS-PAGE电泳、转印PVDF膜。以制备的多克隆抗体为一抗,Western blot方法检测多抗与细胞FILIP-1L蛋白的结合。
1.2.10检测肝癌细胞FILIP-1L蛋白表达常规培养肝癌细胞HepG2、smmc-7721、bel-7402、plc/prf/5及永生化肝细胞 changliver,收集生长状态良好的细胞,提取细胞蛋白,SDS-PAGE凝胶电泳,转印PVDF膜。以制备的多克隆抗体为一抗,Western blot方法检测肝癌细胞FILIP-1L蛋白表达。
2结果
2.1GST-FILIP-1L蛋白原核诱导表达将质粒转化BL21菌株,挑取单克隆培养,IPTG诱导,SDS-PAGE分析FILIP-1表达。结果显示,与未加IPTG诱导组相比,经IPTG诱导后,转化pGEX-4T3及pGEX-4T3-FILIP-1L(288)质粒的细菌裂解后,分别在25、55 kD处有明显的蛋白条带出现,但其菌液电泳后无明显条带显示。表明融合蛋白诱导成功,且主要在细胞内表达(见图1)。
2.2GST-FILIP-1L蛋白溶解性分析取诱导表达FILIP-1L的菌体洗涤后裂解, 4℃,10 000 r/min,离心10 min,分别收集上清和沉淀,并取上清液和沉淀悬液进行10%SDS-PAGE蛋白电泳。结果显示转染FILIP-1L(288)的细菌沉淀悬液电泳后,在分子量为55 kD处有明显条带,而上清液电泳后无明显条带显示,提示FILIP-1L(288)蛋白在细胞内主要以包涵体形式高表达[分子量应为90 kD的FILIP-1L(893)未完全表达,见图2]。
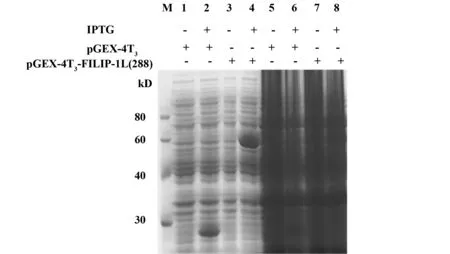
图1 GST-FILIP-1L蛋白表达Fig.1 Expression of FILIP-1L fusion proteinNote: M.Protein marker;1,2,3,4.Bacterial lysis;5,6,7,8.Bacterial culture fluid.
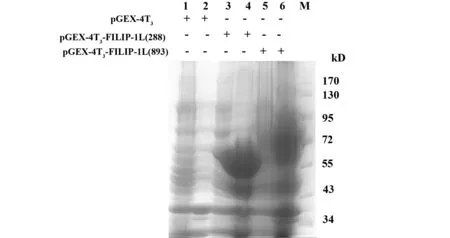
图2 GST-FILIP-1L蛋白溶解性分析Fig.2 Solubility analysis of FILIP-1L proteinNote: M.Protein marker;1,3,5.Supernatant; 2,4,6.Sediment suspension.
2.3GST-FILIP-1L蛋白纯化原核表达的GST及GST-FILIP-1L蛋白与Glutathion Sepharse 4B Beads结合,经Glutathion Reduced(GSH)缓冲液洗脱后,进行SDS-PAGE分析,结果显示,在分子量25 、55 kD处获得了纯度较高的GST及GST-FILIP-1L(288)蛋白,而分子量为90 kD的GST-FILIP-1L(893)蛋白表达量及纯度均较低(见图3)。
2.4多克隆抗体效价用纯化的FILIP-1L(288)融合蛋白包被酶标板,间接ELISA方法检测兔抗人FILIP-1L多克隆抗体,以大于阴性血清A450nm值4倍的最小值作为多克隆抗体效价。检测结果表明,制备的FILIP-1L多克隆抗体效价为1∶2 048 000(表1,图4)。
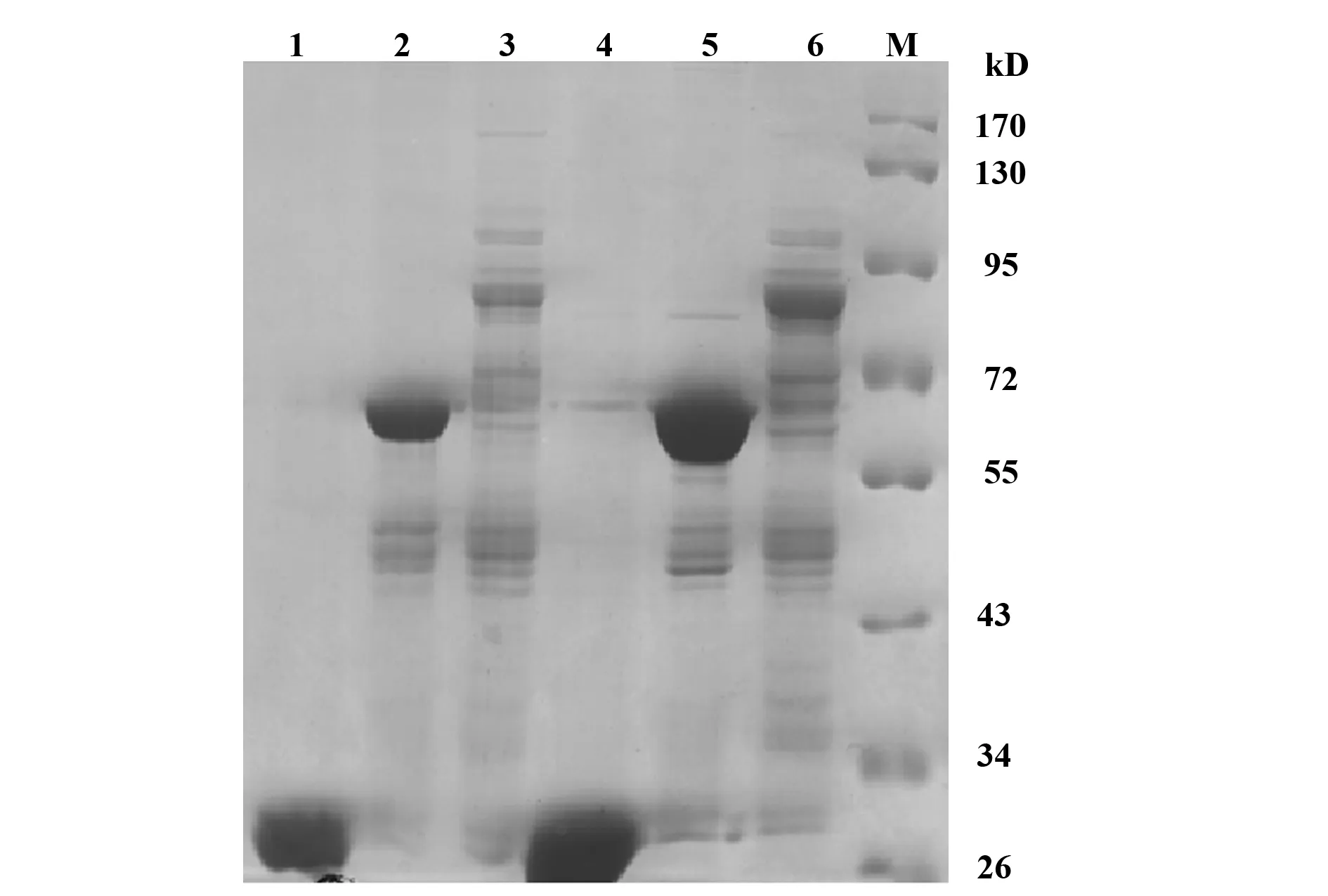
图3 GST-FILIP-1L融合蛋白纯化Fig.3 Purification of pGEX-4T3-FILIP-1L fusion proteinNote: M.Protein marker;1,4.pGEX-4T3;2,5.pGEX-4T3-FILIP-1L(288);3,6.pGEX-4T3-FILIP-1L(893).
表1FILIP-1L多克隆抗体效价(A450nm值)
Tab.1ELISA detection FILIP-1L polyclonal antibody titer(A450nm value)
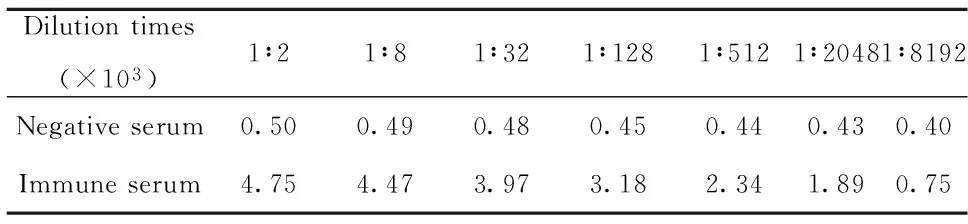
Dilutiontimes(×103)1∶21∶81∶321∶1281∶5121∶20481∶8192Negativeserum0.500.490.480.450.440.430.40Immuneserum4.754.473.973.182.341.890.75

图4 ELISA检测多克隆抗体效价Fig.4 ELISA detection FILIP-1L polyclonal antibody titer
2.5多克隆抗体的纯化利用Active Ester Agrose纯化血清中抗FILIP-1L抗体, SDS-PAGE电泳结果显示,获得了纯度较高的IgG,SDS-PAGE电泳中IgG重链和轻链间的二硫键被打开,电泳中显示分子量25、50 kD的两条蛋白条带(见图5)。
2.6多克隆抗体与目的蛋白结合应用Western blot方法, 检测制备的多克隆抗体与FILIP-1L蛋白的结合能力。结果发现不同剂量的GST-FILIP-1L融合蛋白(1~6泳道)与多抗孵育后均有条带显示,且随着 FILIP-1L蛋白量的增加,条带逐渐增粗,但GST蛋白(第7泳道)处无条带显示。提示多抗与GST-FILIP-1L蛋白有良好的结合能力,但不与GST蛋白结合。结果见图6。
2.7多克隆抗体与细胞FILIP-1L蛋白结合293T细胞转染PcDNA3.0及PcDNA3.0-flag-FILIP-1L(893)质粒48 h, 提取细胞蛋白,Western blot检测多克隆抗体与细胞FILIP-1L蛋白的结合,同时以Flag抗体检测转染FILIP-1L蛋白的表达。实验发现转染PcDNA3.0-flag-FILIP-1L(893)的细胞裂解液与多抗孵育后,在分子量95 kD(转染FILIP-1L)及110 kD(细胞FILIP-1L)处均有条带显示; 而转染PcDNA3.0的细胞裂解液与多抗孵育后,仅在分子量 110 kD处有条带显示,分子量95 kD处无条带出现,提示制备的多抗能与细胞FILIP-1L蛋白及细胞转染FILIP-1L蛋白结合(见图7)。
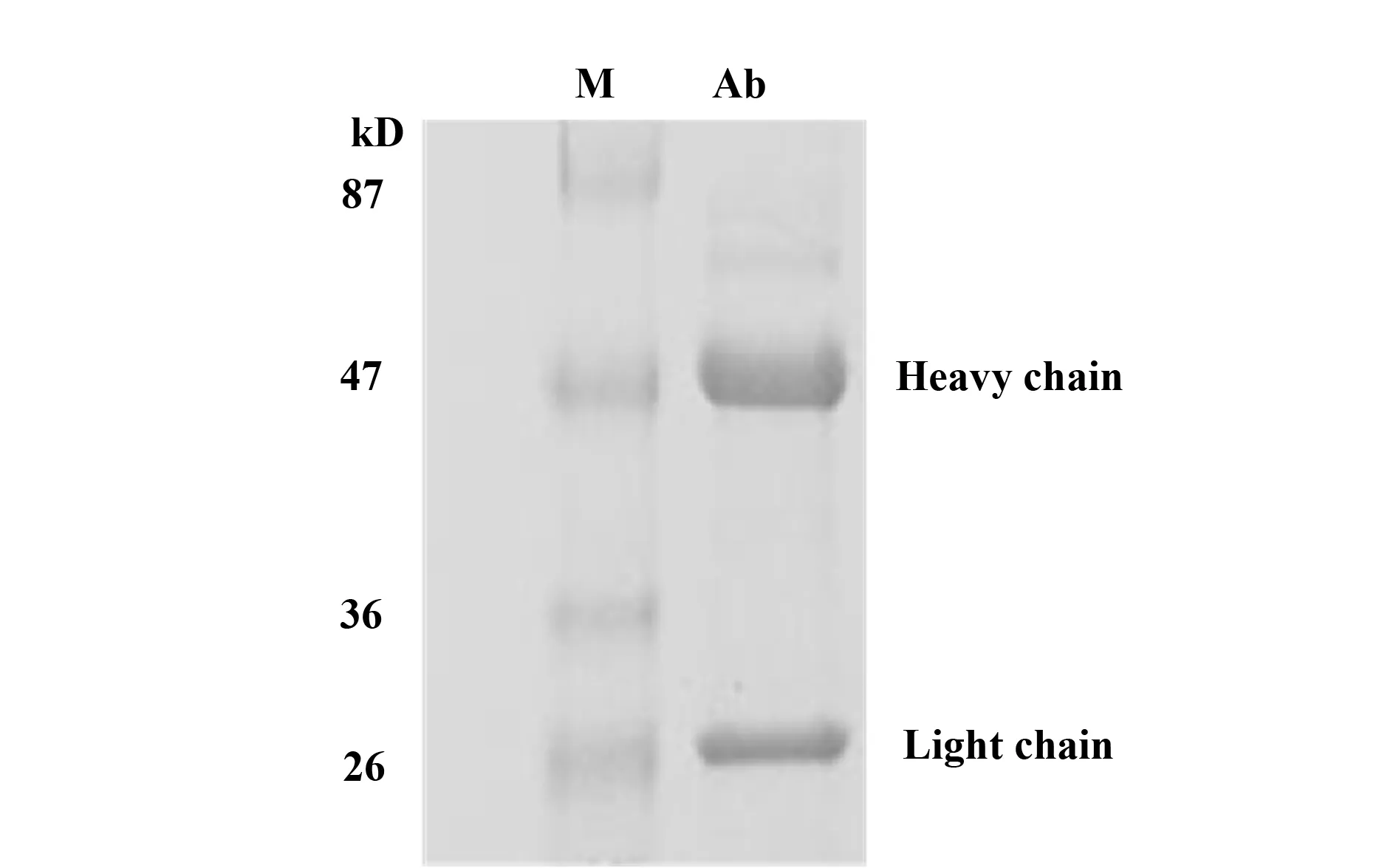
图5 多克隆抗体纯化Fig.5 Polyclonal antibody purification
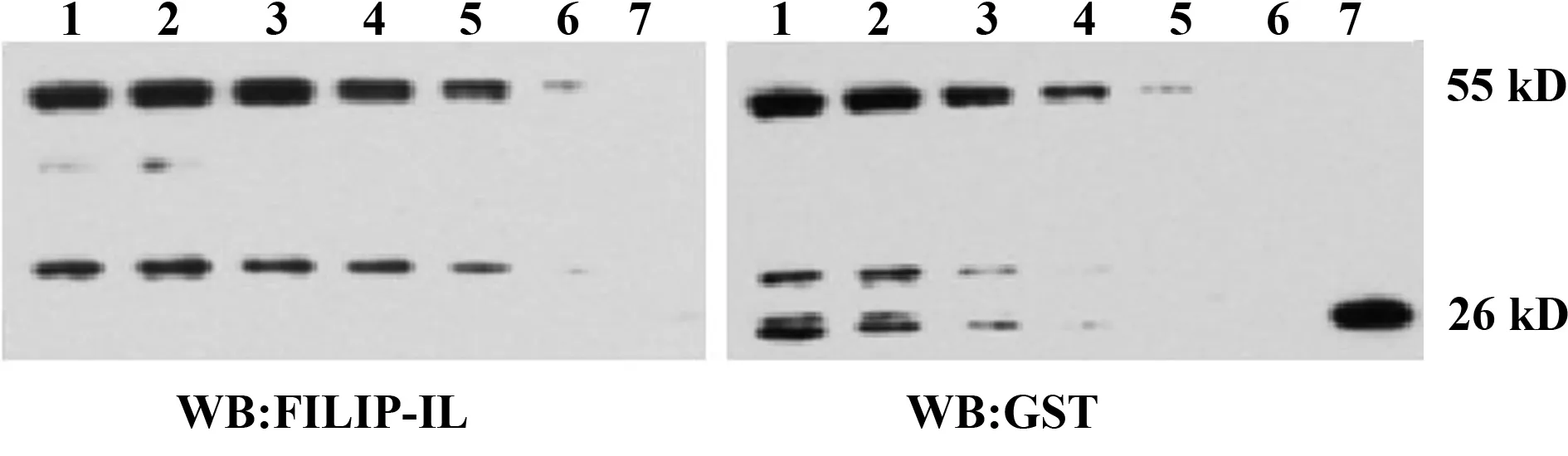
图6 FILIP-1L抗体与目的蛋白结合Fig.6 Combination of polyclonal antibody and proteinNote: 1-6: GST-FILIP-1L fusion protein loading amount:10 μl,8 μl,6 μl,4 μl,2 μl,1 μl;7.GST protein loading amount:10 μl.
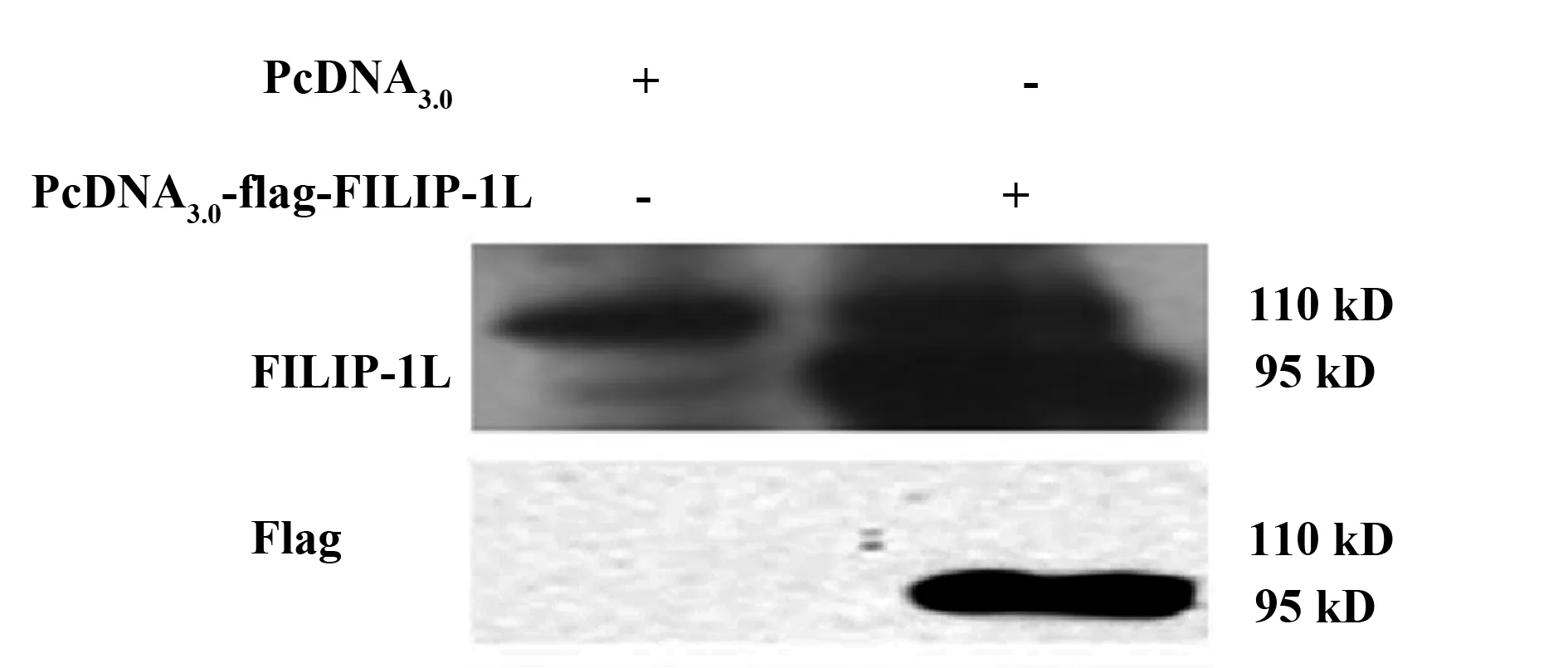
图7 多克隆抗体与293T细胞FILIP-1L蛋白结合Fig.7 Combination of polyclonal antibody and FILIP-1L protein in 293T cell line
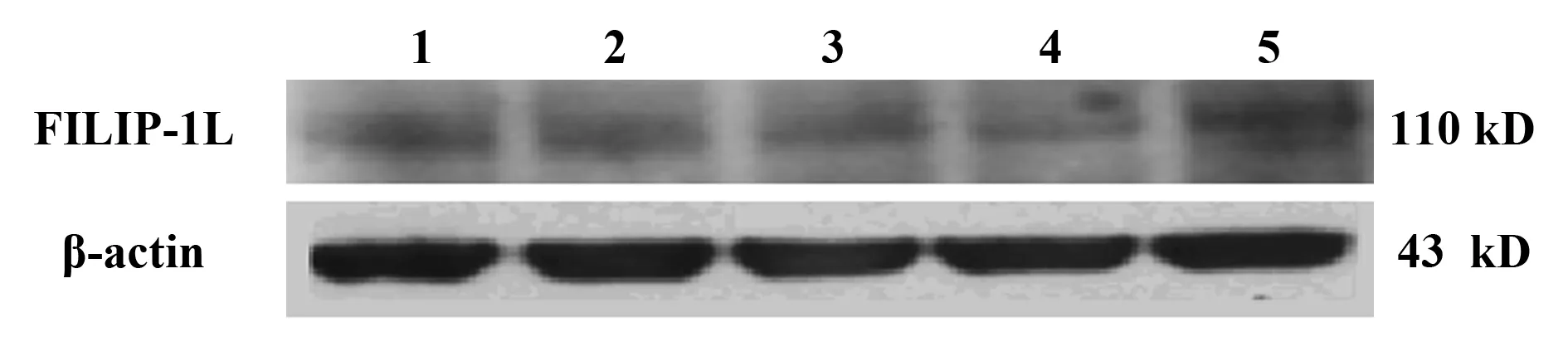
图8 肝癌细胞FILIP-1L蛋白表达Fig.8 FILIP-1L expression of liver cancer cellsNote: 1.HepG2;2.smmc-7721;3.Bel-7402; 4.plc/prf/5;5.Changliver.
2.8检测肝癌细胞FILIP-1L蛋白表达应用制备的FILIP-1L多抗,Western blot方法检测不同肝癌细胞FILIP-1L蛋白的表达,结果显示不同的肝癌细胞在分子量110 kD处均有条带显示,永生化肝细胞Changliver FILIP-1L表达量较高,而肝癌细胞HepG2、smmc-7721、Bel-7402及plc/prf/5细胞FILIP-1L表达量较低(见图8)。
3讨论
野生型FILIP-1L由893个氨基酸组成,含有4个双螺旋、2个亮氨酸拉链结构域,在不同的细胞内,存在有不同分子量的FILIP-1L剪切体形式。目前FILIP-1L的生物学功能尚不完全清楚,研究发现 FILIP-1L与肿瘤转移、血管生成有关, FILIP-1L表达与卵巢癌细胞系和卵巢癌的侵袭力负相关,侵袭严重的肿瘤组织的FILIP-1L表达较非侵袭的交界瘤组织的FILIP-1L表达显著降低[5];肿瘤血管系统定向表达FILIP-1L蛋白,能够抑制肿瘤生长[6]; 过表达FILIP-1也可抑制内皮细胞的增殖和迁移,并增加细胞凋亡;腹腔内接种FILIP-1L基因能够抑制卵巢癌扩散至腹膜及腹腔内器官[7],这些研究结果提示,FILIP-1可能是细胞增殖、迁移的主要抑制剂和凋亡诱导剂。为了深入研究FILIP-1L在肿瘤转移中的作用及机制,我们构建了pGEX-4T3-FILIP-1L(288)、pGEX-4T3-FILIP-1L(893)两个表达质粒,经转化BL21菌株,IPTG诱导 ,表达出GST-FILIP-1L融合蛋白(图3),并且pGEX-4T3-FILIP-1L(288)表达量明显高于pGEX-4T3-FILIP-1L(893)。pGEX-4T3-FILIP-1L(288)、pGEX-4T3-FILIP-1L(893)均以包涵体形式表达。我们用高浓度的变性剂(8 mol/L尿素)溶解包涵体,经过透析、Glutathion Sepharse 4B纯化,得到浓度高、纯度好的GST-FILIP-1L(288)融合蛋白。我们用纯化的GST-FILIP-1L(288)融合蛋白免疫新西兰大耳白兔,应用间接ELISA方法检测抗血清效价,结果显示动物血清抗体效价达到1∶2 048 000,提示动物接种GST-FILIP-1L(288)融合蛋白后,体内产生了高滴度的抗FILIP-1L抗体。亲和层析纯化动物血清中FILIP-1L抗体,经免疫印迹检测显示,制备的FILIP-1L抗体能够特异结合FILIP-1L蛋白、细胞转染FILIP-1L蛋白及细胞FILIP-1L蛋白。应用制备的FILIP-1L抗体, WB检测显示永生化肝细胞changliver FILIP-1L表达量较高,而肝癌细胞hepG2、smmc-7721、bel-7402及plc/prf/5细胞FILIP-1L表达量较低。实验结果表明我们制备的FILIP-1L抗体能够特异识别FILIP-1L,可以用于后续的FILIP-1L功能学研究。
肿瘤转移是肿瘤病人死亡的主要原因,FILIP-1L通过抑制WNT信号通路及MMP表达抑制肿瘤细胞的侵袭和迁移[8-10],是一个潜在的重要抗肿瘤分子。我们前期实验还发现FILIP-1L是热休克转录因子1的作用蛋白,参与Hsf1的降解过程[4]。目前FILIP-1L的生物学功能尚不完全清楚,而市面上尚无性能良好的商品化抗体,我们制备的FILIP-1L抗体为深入研究FILIP-1L的生物学功能提供了有用工具。
参考文献:
[1]Kwon M,Libutti SK. Filamin A interacting protein 1-like as a therapeutic target in cancer Expert[J].Opin Ther Targets,2014,18(12):1435-1447.
[2]Bravo-Cordero JJ,Hodgson L,Condeelis J.Directed cell invasion and migration during metastasis[J].Curr Opin Cell Biol,2012,24(2):277-283.
[3]Kwon M,Lee SJ,Reddy S.Down-regulation of filamin ainteracting protein 1-like is associated with promoter methylation and an invasive phenotype in breast,colon,lung and pancreatic[J]. Cancers,2013,8(12):e82620.
[4]Yanzhong Hu,Nahid F.Mivechi promotion of heat Shock factor hsf1 degradation via adaptor protein filamin A-interacting Protein 1-Like(FILIP-1L)[J]. J Biol Chem,2011,286(36):31397-31408.
[5]Burton ER,Gaffar A,Lee SJ,etal.Downregulation of Filamin A interacting protein 1-like is associated with promoter methylation and induces an invasive phenotype in ovarian cancer[J].Mol Cancer Res,2011,9(8):1126-1138.
[6]Kwon M,Hanna E,Lorang D,etal.Functional characterization of filamin a interacting protein 1-like,a novel candidate for antivascular cancer therapy[J].Cancer Res,2008,68(18):7332-7341.
[7]Xie C,Gou ML,Yi T,etal.Efficient inhibition of ovarian cancer by truncation mutant of FILIP1L gene delivered by novel biodegradable cationic heparin-polyethyleneimine nanogels[J].Hum Gene Ther,2011,22(11):1413-1422.
[8]Desotelle J,Truong M,Ewald J,etal.CpG island hypermethylation frequently silences FILIP1L isoform 2 expression in prostate cancer[J].J Urol,2013,189(1):329-335.
[9]Kwon M,Lee SJ,Wang Y,etal.Filamin A interacting protein 1-like inhibits WNT signaling and MMP expression to suppress cancer cell invasion and metastasis[J].Int J Cancer,2014,135(1):48-60.
[10]Yao H,Ashihara E,Maekawa T.Targeting the Wnt/β-catenin signaling pathway in human cancers[J].Expert Opin Ther Targets,2011,15(7):873-887.
[收稿2015-11-27修回2015-12-09]
(编辑张晓舟)
Prokaryotic expression of FILIP-1L and preparation of its polyclonal antibody
DU Jing-Fang,DUN Guo-Qing,ZHANG Shu-Man,CHU Liu-Jie,LI Shu-Lian,HU Yan-Zhong,MA Yuan-Fang.
Engineering Laboratory of Henan Province for Antibody Drug, Laboratory of Cellular and Molecular Immunology, Henan University School of Medicine, Kaifeng 475004,China
[Abstract]Objective:To express and purify the fusion protein of GST-FILIP-1L and prepare its polyclonal antibody.Methods: The constructed recombinant expression vectors pGEX-4T3-FILIP-1L were transformed into Escherichia Coli BL21.FILIP-1L fusion protein was induced by IPTG and purified by Glutathion Sepharse 4B .The rabbit was immunized by the purified fusion protein,and produced serum with anti-FILIP-1L antibody. The titer of polyclonal antibody was detected by ELISA,the anti-FILIP-1L polyclonal antibody was purified by Active and its combining specificity with FILIP-1L protein was further identified by Western blot.Results: The GST-FILIP-1L fusion protein was highly expressed in E.coli,and its specific polyclonal antibody was obtained after the immunization.The polyclonal antibody purified by Active Ester Agrose was able to combine specially with FILIP-1L protein and transformed FILIP-1L protein in 293 cells and FILIP-1L protein of liver cancer cells,respectively.Conclusion: The GST-FILIP-1L fusion protein was expressed successfully,the anti-GST-FILIP-1L polyclonal antibodies with high titer and specificity are successfully prepared,these antibodies provide an useful experimental tool to research the biological function of the FILIP-1L protein.
[Key words]Filamin A interacting protein 1-like;Fusion protein;Polyclonal antibody
doi:10.3969/j.issn.1000-484X.2016.06.014
通讯作者②,E-mail:LshL92627@163.com。
作者简介:都景芳(1963年-),女,实验师,主要从事肿瘤免疫方面的研究,E-mail:kfdjf@henu.edu.cn。
中图分类号R392
文献标志码A
文章编号1000-484X(2016)06-0832-06
·免疫学技术与方法·
①本文为国家自然科学基金资助项目(No. 30971508)。