苦参碱抑制LPS诱导巨噬细胞IL-1β、TNF-α分泌及机制研究
杨雪梅 吴 刚
(恩施土家族苗族自治州中心医院,恩施445000)
苦参碱抑制LPS诱导巨噬细胞IL-1β、TNF-α分泌及机制研究
杨雪梅吴刚①
(恩施土家族苗族自治州中心医院,恩施445000)
[摘要]目的:探讨苦参碱抑制脂多糖(lipopolysaccharide ,LPS) 诱导巨噬细胞分泌炎症因子包括肿瘤坏死因子α (TNF-α) 、白细胞介素1β ( IL-1β)对Toll 样受体4(TLR4) 、c-Jun 表达的影响。方法:购买并培养小鼠RAW264.7 巨噬细胞株,分成四组,即空白对照组、苦参碱组、LPS组、苦参碱干预组,通过浓度为100 μg /L 的LPS DMEM孵育1 h,之后将LPS弃去,然后加入不含血清的DMEM 或125.25 mg /L 苦参碱DMEM 继续培养。分别收集上述四组细胞处理完毕后5、30、60、120 min 的细胞及培养液。通过PCR法检测小鼠RAW264.7巨噬细胞TLR4及c-Jun mRNA 的表达,通过免疫细胞化学法检测小鼠RAW264.7巨噬细胞c-Jun 蛋白的表达;通过ELISA法测定各组培养液中TNF-α、IL-1β的分泌。结果:苦参碱诱导组与空白对照组相比,TLR4 mRNA、c-Jun mRNA及c-Jun 蛋白的表达量和TNF-α及IL-1β分泌量各项指标差异无统计学意义(P>0.05);LPS组各个时间点TLR4 mRNA、c-Jun mRNA及c-Jun 蛋白的表达量和TNF-α及IL-1β分泌量明显高于空白对照组,且高水平能够维持2 h以上(P<0.05);苦参碱干预组能够有效的抑制LPS诱导的巨噬细胞TLR4 mRNA、c-Jun mRNA及c-Jun 蛋白的表达量,降低炎症因子TNF-α、IL-1β 的分泌量。结论:苦参碱可能通过抑制LPS诱导的巨噬细胞丝裂原活化的蛋白激酶信号通路上TLR4、c-Jun的过表达从而有效的降低终末炎症因子TNF-α及IL-1β的释放,进而有效的抑制炎症反应,减轻内毒素炎症反应的程度。
[关键词]苦参碱;脂多糖;巨噬细胞;TLR4;c-Jun;IL-1β;TNF-α
脂多糖(Lipopolysaccharide,LPS)是细菌内毒素的主要成分,可以诱导炎症因子IL-1β、TNF-α 等的表达,导致组织受到损伤[1,2]。Toll 样受体4(Toll-like receptor 4,TLR4)是巨噬细胞表明的受体,LPS通过识别该受体刺激信号传导,进一步激活转录因子细胞内激活子蛋白1、核因子κB(Nuclear factor-kappa B,NF-κB),诱导炎症因子的表达[3]。c-Jun 是AP-1 的主要成分之一,是AP-1 的主要活性形式,主要参与LPS 胞内信号转导及转录调控。
苦参碱是中药苦参、山豆根和苦豆子的主要成分,具有抗肿瘤、抗病毒、抗炎、镇静及强心等多方面作用[4],有学者研究结果显示能够有效的抑制机体的炎症反应[5,6]。本研究探讨苦参碱抑制LPS诱导巨噬细胞分泌炎症因子包括TNF-α 、IL-1β对TLR4、c-Jun 表达的影响。
1材料与方法
1.1材料小鼠RAW264.7 巨噬细胞株从北京生命科学院购买,苦参碱(含量>99%,熔点75.5~77.5℃)购自宁夏制药厂;LPS购自Sigma 公司;多克隆抗体兔抗小鼠c-Jun、DMEM 高糖培养基购自Gibco 公司;蛋白提取试剂盒购自碧云天公司;反转录PCR 试剂盒购自Promega 公司;TNF-α、IL-1β ELISA 试剂盒购自广州英韦创津生物科技有限公司。
1.2方法
1.2.1RAW264.7 巨噬细胞培养将RAW264.7 巨噬细胞冻存细胞复苏后,置于含有100 ml/L的胎牛血清的DMEM高糖培养基上在37℃、5%CO2培养箱中培养48 h后,细胞达到对数生长期,融合至80%以上时,将培养细胞进行分组,即空白对照组、苦参碱组、LPS诱导组、苦参碱干预组,空白对照组使用不含有血清的DMEM对细胞进行孵育,苦参碱组用浓度为125.25 mg/L的苦参碱DMEM培养基对细胞进行孵育,LPS组及苦参碱干预组分别以浓度为100 μg/L LPS 的DMEM高糖培养基孵育1 h后,将LPS丢弃,之后分别加入无血清DMEM 或浓度为125.25 mg/L 苦参碱的DMEM 继续进行培养,四组细胞在不同时间点后将培养液及细胞收集。
1.2.2反转录PCR对巨噬细胞TLR4、c-Jun mRNA表达的检测将处理过的细胞采用4℃ PBS漂洗3次后,用细胞刮刀将细胞刮去并收集到EP 管中,根据RNA提取试剂盒的步骤进行提取RNA,并对其纯度及完整性进行检测。之后根据逆转录试剂盒的说明合成cDNA。引物由xxx公司设计合成,引物序列如表1所示。
表1反转录PCR基因引物序列及产物碱基数
Tab.1Primer seqnences for RT-PCR and size of gene product

GenePrimerSize(bp)TLR4-Forward5'-TCTGCCTTCACTACAGAGACT-3'TLR4-Reveres5'-AGTCTTCTCCAGAAGATGTGC-3'318c-Jun-Forward5'-CGGACCGTTCTATGACTGC-3'c-Jun-Reveres5'-AGCGTGTTCTGGCTATGC-3'394β-actin-Forward5'-TTGTTACCAACTGGGACG-3'β-actin-Reveres5'-GGCATAGAGGTCTTTACGG-3'662
PCR反应体系由10 μl 5×缓冲液、2 μl 25 mmol/L MgSO4、1 μl 10 mmol/L dNTP、2 μl上游引物和下游引物、1 μl AMV 逆转录酶、1 μl DNA 聚合酶、1 μl 1 ng/μl RNA、32 μl焦碳酸二乙酯处理水组成;反应结束后进行半定量分析,表达方式为目的基因RNA量/β-actin量。
1.2.3免疫细胞化学法测定巨噬细胞c-Jun的表达对处理过的巨噬细胞在室温下用浓度为40 g/L 多聚甲醛固定30 min,PBS处理30 min、过氧化氢(30 ml/L)封闭10 min、山羊血清(50 ml/L)封闭10 min;加兔抗小鼠c-Jun抗体(1∶200)37℃孵育2 h,洗涤后加山羊抗兔IgG二抗(1∶200),37℃孵育1.5 h;经过显色、复染、封片及图片采集后判读结果,即c-Jun阳性细胞细胞核内为棕黄色,c-Jun阴性细胞细胞核内着色为蓝色。计算3个高倍镜视野下所有细胞及c-Jun阳性细胞,计算c-Jun阳性细胞率。
1.2.4ELISA法测定培养液中炎症因子IL-1β,TNF-α 的含量按照ELISA试剂盒说明书检测收集的培养液中炎症因子TNF-α、IL-1β的含量。

2结果
2.1苦参碱对LPS诱导的小鼠RAW264.7 巨噬细胞TLR4 mRNA表达影响研究从图1和表2中可以看出TLR4 mRNA表达量在苦参碱组与空白对照组处理后各个时间点相比差异无统计学意义(P>0.05);与空白对照组相比,LPS组经过诱导后5 min,TLR4 mRNA表达量瞬间达到高峰,2 h内始终未见降低,明显高于空白对照组,两组各时间点比较,差异有统计学意义(P<0.05); 与LPS组相比,苦参碱干预组在苦参碱处理后5 min,TLR4 mRNA表达量明显降低,随着时间的推移,在30、60、120 min 时与LPS组相同时间点相比差异有统计学意义(P<0.05),120 min时,mRNA表达量仍明显高于空白对照组,差异有统计学意义(P<0.05)。
2.2苦参碱对LPS诱导的小鼠RAW264.7 巨噬细胞c-Jun mRNA表达影响研究从图2及表3中可以看出c-Jun mRNA 表达在苦参碱组与空白对照组处理后各个时间点相比差异无统计学意义(P>0.05);与空白对照组相比,LPS组经过诱导后5 min,c-Jun mRNA表达量瞬间达到高峰,2 h内始终未见降低,明显高于空白对照组,两组各时间点比较,差异有统计学意义(P<0.05); 与LPS组相比,苦参碱干预组在苦参碱处理后5 min,TLR4 mRNA表达量明显降低,随着时间的推移,而仅在120 min 时与LPS组相同时间点相比差异有统计学意义(P<0.05),与空白对照组相比,差异无统计学意义(P>0.05)。
2.3苦参碱对LPS诱导后的小鼠巨噬细胞c-Jun 蛋白表达水平的影响从表4中可以看出c-Jun 阳性细胞数在苦参碱组与空白对照组处理后各个时间点相比差异无统计学意义(P>0.05);与空白对照组相比,LPS组经过诱导后5 min,c-Jun 阳性细胞数目瞬间达到高峰,2 h内始终未见降低,明显高于空白对照组,两组各时间点比较,差异有统计学意义(P<0.05); 与LPS组相比,苦参碱干预组在苦参碱处理后5 min,c-Jun 阳性细胞数目明显降低,随着时间的推移,在30、60、120 min 时与LPS组相同时间点相比差异有统计学意义(P<0.05),至120 min时,c-Jun 阳性细胞数目与空白对照组阳性细胞数相当,相比差异无统计学意义(P>0.05)。

图1 苦参碱对LPS诱导的小鼠RAW264.7 巨噬细胞TLR4 mRNA表达影响Fig.1 Matrine promotes TLR4 mRNA expression in RAW264.7 macrophages in mice induced by LPS Note: M.Marker;1.Control group;2.LPS group;3.Matrine group;4.Matrine intervention group.

图2 苦参碱对LPS诱导的小鼠RAW264.7 巨噬细胞c-Jun mRNA表达影响Fig.2 Matrine promotes c-Jun mRNA expression in RAW264.7 macrophages in mice induced by LPS Note: M.Marker;1.Control group;2.LPS group;3.Matrine group;4.Matrine intervention group.
2.4苦参碱对LPS 诱导后小鼠巨噬细胞培养液中IL-1β 水平的影响从表5中可以看出IL-1β在苦参碱组与空白对照组处理后各个时间点相比差异无统计学意义(P>0.05);与空白对照组相比,LPS组经过诱导后5 min,IL-1β水平瞬间达到高峰,2 h内始终未见降低,明显高于空白对照组,两组各时间点比较,差异有统计学意义(P<0.05);与LPS组相比,苦参碱干预组在苦参碱处理后5 min,IL-1β明显降低,随着时间的推移,在60、120 min 时与LPS组相同时间点相比差异有统计学意义(P<0.05);苦参碱干预组各时间点的IL-1β 含量明显高于空白对照组,相比差异有统计学意义(P<0.05)。
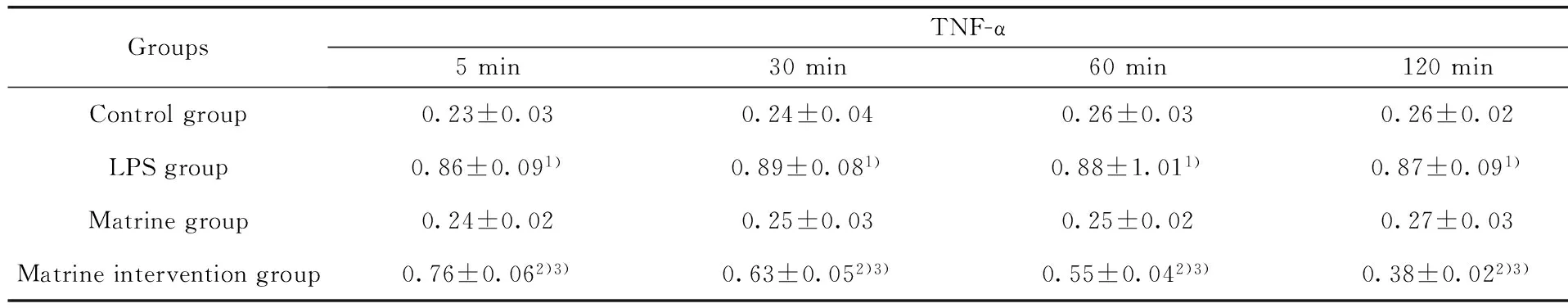
2.5苦参碱对LPS 诱导后小鼠巨噬细胞培养液中TNF-α 水平的影响从表6中可以看出TNF-α在苦参碱组与空白对照组处理后各个时间点相比差异无统计学意义(P>0.05);与空白对照组相比,LPS组经过诱导后5 min,TNF-α水平瞬间达到高峰,2 h内始终未见降低,明显高于空白对照组,两组各时间点比较,差异有统计学意义(P<0.05); 与LPS组相比,苦参碱干预组在苦参碱处理后5 min,TNF-α明显降低,随着时间的推移,与LPS组相同时间点相比差异有统计学意义(P<0.05);苦参碱干预组各时间点TNF-α 含量高于空白对照组对照组,相比差异有统计学意义(P<0.05)。
表2苦参碱对LPS诱导的小鼠RAW264.7 巨噬细胞TLR4 mRNA表达影响
Tab.2Matrine promotes TLR4 mRNA expression in RAW264.7 macrophages in mice induced by LPS
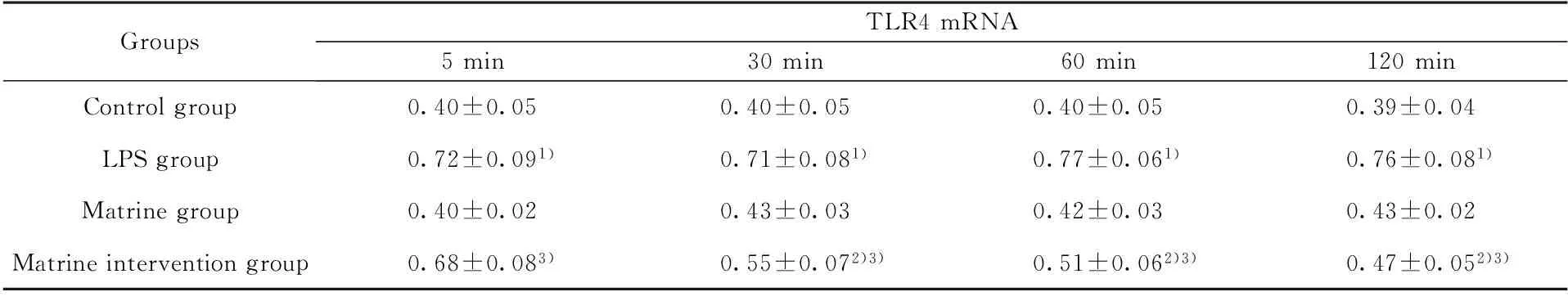
GroupsTLR4mRNA5min30min60min120minControlgroup0.40±0.050.40±0.050.40±0.050.39±0.04LPSgroup0.72±0.091)0.71±0.081)0.77±0.061)0.76±0.081)Matrinegroup0.40±0.020.43±0.030.42±0.030.43±0.02Matrineinterventiongroup0.68±0.083)0.55±0.072)3)0.51±0.062)3)0.47±0.052)3)
Note:1)P<0.05 compared with control group;2)P<0.05 compared with LPS group;3)P<0.05 compared with control group.
表3苦参碱对LPS诱导的小鼠RAW264.7 巨噬细胞c-Jun mRNA表达影响
Tab.3Matrine promotes c-Jun mRNA expression in RAW264.7 macrophages in mice induced by LPS
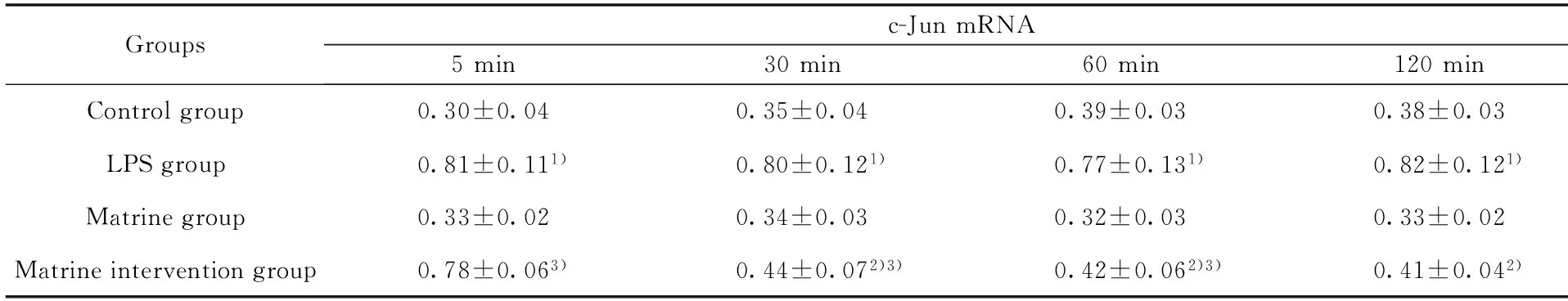
Groupsc-JunmRNA5min30min60min120minControlgroup0.30±0.040.35±0.040.39±0.030.38±0.03LPSgroup0.81±0.111)0.80±0.121)0.77±0.131)0.82±0.121)Matrinegroup0.33±0.020.34±0.030.32±0.030.33±0.02Matrineinterventiongroup0.78±0.063)0.44±0.072)3)0.42±0.062)3)0.41±0.042)
Note:1)P<0.05 compared with control group;2)P<0.05 compared with LPS group;3)P<0.05 compared with control group.
表4苦参碱对LPS诱导后的小鼠巨噬细胞c-Jun蛋白表达水平的影响(%)
Tab.4Matrine promotes c-Jun protein expression in RAW264.7 macrophages in mice induced by LPS(%)
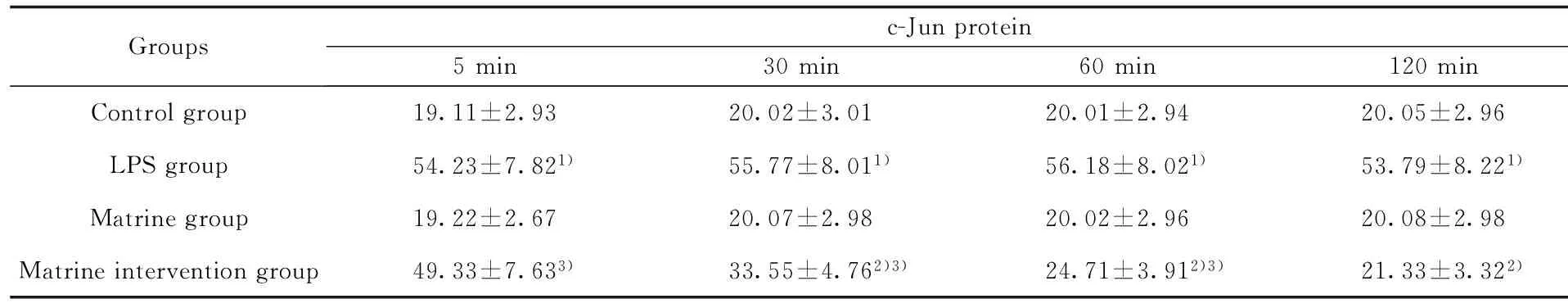
Groupsc-Junprotein5min30min60min120minControlgroup19.11±2.9320.02±3.0120.01±2.9420.05±2.96LPSgroup54.23±7.821)55.77±8.011)56.18±8.021)53.79±8.221)Matrinegroup19.22±2.6720.07±2.9820.02±2.9620.08±2.98Matrineinterventiongroup49.33±7.633)33.55±4.762)3)24.71±3.912)3)21.33±3.322)
Note:1)P<0.05 compared with control group;2)P<0.05 compared with LPS group;3)P<0.05 compared with control group.
表5苦参碱对LPS 诱导后小鼠巨噬细胞培养液中IL-1β 水平的影响(pg/ml)
Tab.5Matrine promotes IL-1β expression in RAW264.7 macrophages in mice induced by LPS(pg/ml)

GroupsIL-1β5min30min60min120minControlgroup9.11±1.939.02±2.019.01±1.949.05±1.96LPSgroup48.32±6.821)47.77±7.011)49.18±7.021)49.79±7.221)Matrinegroup9.22±1.679.07±1.989.02±1.969.08±1.95Matrineinterventiongroup46.35±7.662)3)38.57±4.782)3)28.75±3.912)3)19.34±2.972)3)
Note:1)P<0.05 compared with control group;2)P<0.05 compared with LPS group;3)P<0.05 compared with control group.
表6苦参碱对LPS 诱导后小鼠巨噬细胞培养液中TNF-α 水平的影响(μg/ml)
Tab.6Matrine promotes TNF-α expression in RAW264.7 macrophages in mice induced by LPS(μg/ml)
GroupsTNF-α5min30min60min120minControlgroup0.23±0.030.24±0.040.26±0.030.26±0.02LPSgroup0.86±0.091)0.89±0.081)0.88±1.011)0.87±0.091)Matrinegroup0.24±0.020.25±0.030.25±0.020.27±0.03Matrineinterventiongroup0.76±0.062)3)0.63±0.052)3)0.55±0.042)3)0.38±0.022)3)
Note:1)P<0.05 compared with control group;2)P<0.05 compared with LPS group;3)P<0.05 compared with control group.
3讨论
机体内一种重要的免疫细胞是巨噬细胞,它是机体免疫防御作用的一道重要防线,巨噬细胞表面有众多病原相关分子模式的模式识别受体。在这些模式识别受体中,TLR4 显得较为重要,是重要的模式识别受体之一。而LPS 是G-菌的主要的病原相关分子模式[7]。众所周知,G-菌侵入到机体死亡后,菌体裂解释放大量的LS到机体血液系统内,LPS即可结合到与血液中游离的巨噬细胞膜表面TLR4上,从而有效的激活巨噬细胞内的丝裂原活化的蛋白激酶和NF-κB等相关信号转导通路。MAPK相关信号通路通过LPS被激活,激活后的信号通路上的c-JunN 末端激酶(c-Jun N-terminal kinase,JNK)活化使c-Jun蛋白N-末端磷酸化,使AP-1形成。AP-1一种稳定的异源二聚体,主要通过Jun与Fos 蛋白相互嵌合形成的,是细胞中的一种活性形式,AP-1结合位点位于基因启动子区域,AP-1可以结合到该位点,从而使炎症因子相关基因的转录活性增强,使IL-1β、TNF-α炎症因子表达增强[8-10]。有学者研究显示通过有效阻断TLR4 及AP-1的激活能够有效的降低LPS导致的炎症反应[11-14]。
苦参碱是豆科植物苦参中的重要的成分之一,具有广泛的药理作用,目前已在临床上广泛应用[15],有学者研究显示苦参碱能显著抑制小鼠腹腔巨噬细胞释放TNF,以及细菌脂多糖诱导的大鼠肝脏枯否细胞释放TNF 和IL-6 ,并能降低小鼠血清TNF 和IL-6 水平,从而有效的减轻肝脏、肾脏及肺脏等组织器官炎性损伤[16,17]。TNF-α、IL-1β是众多的炎症因子中学者们关注较多的炎症介质,主要与内毒素造成疾病有关[18]。本研究通过LPS诱导小鼠巨噬细胞1 h后,在转至无血清DMEM 经过5 min的培养后,炎症因子TNF-α、IL-1β的分泌已经达到高峰,且维持2 h保持不变。当给予LPS诱导的巨噬细胞苦参碱处理5 min后发现,炎症因子TNF-α、IL-1β的分泌明显降低,说明,苦参碱对与LPS诱导的巨噬细胞炎症因子TNF-α、IL-1β的分泌具有明显的抑制作用,且随着时间的推移,对炎症因子的抑制作用越强,这也进一步说明苦参碱是通过抑制炎症因子的过表达而参与了机体的抗炎症反应的过程。
LPS 诱导巨噬细胞1 h后,再转至无血清DMEM中培养5 min后,炎症因子TNF-α、IL-1β的表达趋势与TLR4 mRNA、c-Jun mRNA及c-Jun 蛋白表达趋势基本一致,说明TLR4 mRNA、c-Jun mRNA及c-Jun的表达与炎症因子TNF-α、IL-1β的表达有明显的相关性。故通过抑制TLR4、c-Jun 基因及蛋白的表达,能够有效的改善内毒素血症患者最后的结局,本研究通过苦参碱干预LPS诱导巨噬细胞,结果显示在苦参碱干预5 min时,LPS诱导的巨噬细胞TLR4、c-Jun 的mRNA 转录及c-Jun 蛋白表达明显降低,虽然苦参碱对TLR4、c-Jun 的mRNA 转录及c-Jun 蛋白发挥抑制作用显示的时间点有所不同,但从总体上来说是一致的,说明苦参碱抑制LPS造成的炎症因子的过表达与丝裂原活化的蛋白激酶通路有相关性。本研究结果显示LPS诱导巨噬细胞1 h后再加入苦参碱培养5 min后,TLR4 mRNA、c-Jun mRNA及c-Jun 蛋白表达与空白对照组相比差异无统计学意义(P>0.05),表明苦参碱能够有效的抑制丝裂原活化的蛋白激酶通路上TLR4 mRNA、c-Jun mRNA及c-Jun 蛋白的表达,进而抑制炎症因子IL-1β、TNF-α的表达。
总之,苦参碱可能通过抑制LPS诱导的巨噬细胞丝裂原活化的蛋白激酶信号通路上TLR4、 c-Jun的过表达从而有效的降低终末炎症因子IL-1β、TNF-α 的释放,进而有效的抑制炎症反应,减轻内毒素炎症反应的程度。
参考文献:
[1]Takaoka Y,Goto S,Nakano T,etal.Glyceraldehyde-3-phosphate dehydrogenase(GAPDH)prevents lipopolysaccharide(LPS)-induced,sepsis-related severe acute lung injury in mice[J].Sci Rep,2014,4:5204.
[2]Christoph R,Thomas H.Systematic review of membrane components of gram-positive bacteria responsible as pyrogens for inducing human monocyte/macrophage cytokine release[J].Front Pharmacol,2012,3:56.
[3]Molinaro A,Holst O,Di Lorenzo F,etal.Chemistry of lipid A:At the heart of innate immunity[J].Chemistry,2015,21(2):500-519.
[4]冯晓,汤焕梅,沈烈行.苦参碱的药理学研究概况[J].药物流行病学杂志,2005,14(6):331 -333.
[5]吕建芳,范恒,沈霖,等.氧化苦参碱对实验性结肠炎大鼠肠黏膜细胞因子和核因子-κB p65表达的影响[J].世界华人消化杂志,2008,16(36):2289-2294
[6]聂红明,陈建杰,高月求,等.苦参碱与氧化苦参碱体外抗乙肝病毒的比较[J].世界华人消化杂志,2008,16(36):4046-4050.
[7]Christoph R,Thomas H.Systematic review of membrane components of Gram-positive bacteria responsible as pyrogens for inducing human monocyte/macrophage cytokine release[J].Front Pharmacol,2012,3:56.
[8]Keshet Y,Seger R.The MAP kinase signaling cascades:a system of hundreds of components regulates adiverse array of physiological functions[J].Methods Mol Biol,2010,661:3-38.
[9]Chen X,Zong C,Gao Y,etal.Curcumol exhibits anti-inflammatory properties by interfering with the JNK-mediated AP-1 pathway in lipopolysaccharide-activated RAW264.7 cells[J].Eur J Pharmacol,2014,723:339-345.
[10]崔树娜,Bilitewski.金雀异黄素对脂多糖诱导的巨噬细胞MAPK和TLR 信号转导通路的影响[J].细胞与分子免疫学杂志,2014,30(3):233-236.
[11]Fengyang L,Yunhe F,Bo L,etal. Stevioside suppressed inflammatory cytokine secretion by downregulation of NF-kappaB and MAPK signaling pathways in LPS-stimulated RAW264.7 cells[J].Inflammation,2012,35(5):1669-1675.
[12]Ji G,Chen R,Zheng J.Atractylenolide I inhibits lipopolysaccharide-induced inflammatory responses via mitogen-activated protein kinase pathways in RAW264.7 cells[J].Immunopharmacol Immunotoxicol,2014,36(6):420-425.
[13]Oh YC,Jeong YH,Cho WK,etal.Lactobacilli-fermented Hwangryunhaedoktang has enhanced anti-inflammatory effects mediated by the suppression of MAPK signaling pathway in LPS-stimulated RAW264.7 cells[J].Pharmacogn Mag,2014,10(Suppl 3):S645-S654.
[14]Chun JM,Nho KJ,Kim HS,etal. An ethyl acetate fraction derived from houttuynia cordata extract inhibits the production of inflammatory markers by suppressing NF-кB and MAPK activation in lipopolysaccharide-stimulated RAW264.7 macrophages[J].BMC Complement Altern Med,2014,14:234.
[15]张丽华,陈邦恩,潘明佳.苦参碱药理作用研究进展[J].中草药,2009,40(6):1000-1003.
[16]林文,张俊平,胡振林,等.苦参碱对细菌脂多糖诱导大鼠枯否细胞释放肿瘤坏死因子及白细胞介素-6 的影响[J].药学学报,1997,32(2):93-96.
[17]张俊平,胡振林,林文,等.苦参碱对巨噬细胞释放肿瘤坏死因子及其蛋白激酶C 活性的影响[J].第二军医大学学报,1995,16(6):513-514.
[18]Cho BO,Ryu HW,So Y,etal.Anti-inflammatory effect of mangostenone F in lipopolysaccharide-stimulated RAW264.7 macrophages by suppressing NF-κB and MAPK activation[J].Biomol Ther(Seoul),2014,22(4):288-294.
[收稿2015-09-22修回2015-11-12]
(编辑许四平)
Inhibitory effect of Matrine on IL-1β,TNF-α of macrophages induced by LPS
YANG Xue-Mei,WU Gang.
Central Hospital of Enshi Tujia and Miao Autonomous Prefecture,Enshi 445000,China
[Abstract]Objective:To investigate the effect of Matrine on inhibiting lipopolysaccharide(lipopolysaccharide ,LPS) - induced macrophages to secrete inflammatory cytokines,including tumor necrosis factor-α (TNF-α),leukocyte mediated element 1β (IL-1β) on Toll like receptor 4 (TLR4),c-jun expression.Methods: Cultured macrophage RAW264.7 of mouse and divided into four groups,including blank control group,matrine group,LPS group,matrine intervention group.Incubated by the concentration was 100 μg/L LPS DMEM for 1 h,then the LPS was discard.Added free serum DMEM or 125.25 mg/L matrine DMEM to culture.The cells and culture solution of 5,30,60,120 min after the treatment of the above four groups were collected respectively.Detected of mouse RAW264.7 macrophage TLR4 and c-jun mRNA expression by PCR.Detected of mouse macrophage RAW264.7 cells c-jun protein expression by immunocytochemical.Measured secretion in cultured solution of TNF-α and IL-1β by ELISA.Results: Expression TLR4 mRNA,c-jun mRNA and c-jun protein and TNF -α and IL-1β secretion quantity indexes of matrine induced and blank group had no statistical significant differences (P>0.05).TLR4 mRNA,c-jun mRNA and c-jun protein expression secretion of and TNF-α and IL-1β LPS group at each time point were significantly higher than that of blank group,and the high level to maintain more than 2 h (P<0.05);matrine intervention group could effectively inhibit LPS induced macrophage TLR4 mRNA,c-jun mRNA and c-jun protein expression and reduce the secretion of inflammatory cytokines TNF-α and IL-1β.Conclusion: Matrine may inhibit LPS induced macrophage mitogen activated protein kinase signal pathway of TLR4 and c-jun expression so that it can effectively reduce the end inflammatory cytokines TNF-α and IL-1β release,effectively inhibit the inflammatory reaction and reduce the degree of endotoxin inflammatory response.
[Key words]Matrine;Lipopolysaccharide;Macrophage;TLR4;c-Jun;IL-1β;TNF-α
doi:10.3969/j.issn.1000-484X.2016.06.011
作者简介:杨雪梅(1969年-),女,副主任药师,主要从事医院药学方面的研究,E-mail:yxm1969_22@sina.com。
中图分类号R967
文献标志码A
文章编号1000-484X(2016)06-0820-05
①湖北民族学院医学院基础教研室,恩施445000。