激活TLR5和NLRC4通路对小鼠先天免疫细胞的影响①
卓召振 李 伟 袁 军
(贵州医科大学免疫学教研室,贵阳550004)
激活TLR5和NLRC4通路对小鼠先天免疫细胞的影响①
卓召振李伟②③袁军③
(贵州医科大学免疫学教研室,贵阳550004)
[摘要]目的:探讨用重组鞭毛素蛋白同时或者分别激活C57BL/6小鼠模型TLR5和NLRC4通路对小鼠先天免疫细胞的影响。方法:首先,表达和纯化重组鞭毛素蛋白即全长鞭毛素蛋白FliC(同时激活TLR5和NLRC4两条通路); FliCΔ90-97(不能激活TLR5通路);FliC-L3A(不能激活NLRC4通路);FliCΔ90-97:L3A(两条通路都不激活)。将小鼠分为5组,分别为:PBS组、FliC组、FliC-L3A组、FliCΔ90-97和FliCΔ90-97:L3A组。分别用PBS和10 μg重组鞭毛素蛋白腹腔注射C57BL/6小鼠,每组3只。12 h后收集腹腔灌洗液,流式抗体染色检测腹腔灌洗液中的中性粒细胞和NK细胞的比例。同时,取小鼠脾脏制成脾细胞悬液,流式抗体染色检测DC表面共刺激分子CD80和CD86的表达情况及脾细胞中调节性T细胞(Treg)的比例。结果:激活TLR5(FliC组和FliC-L3A组)和NLRC4通路(FliCΔ90-97组)小鼠的腹腔灌洗液中中性粒细胞和NK细胞的比例都显著高于PBS组和FliCΔ90-97:L3A组(P<0.01)。激活TLR5通路的FliC组和FliC-L3A组的DC表面CD80和CD86表达水平显著高于PBS组、FliCΔ90-97和FliCΔ90-97:L3A组(P<0.01)。FliC-L3A组调节性T细胞的比例高于其他组(P<0.05)。结论:激活TLR5和NLRC4通路可以趋化中性粒细胞、NK细胞,两条通路激活对中性粒、NK细胞有相同的趋化能力。鞭毛素蛋白只有激活TLR5通路才可以上调DCs表面共刺激分子CD80和CD86,促进DCs的成熟。
[关键词]鞭毛素蛋白;TLR5;NLRC4;先天免疫细胞;DC;调节性T细胞
先天免疫系统是免疫系统抵挡外来微生物感染和异种物质入侵的第一道防线,而且其免疫监视的功能对机体的稳态起重要作用。模式识别受体(Pattern recognition receptors,PRR)主要包括Toll样受体(Toll-like receptors,TLRs),Nod样受体(Nucleotide binding digomerization domain-like recep-tors,NLRs)等[1]。PRRs识别病原相关分子模式(Pathogen associated molecular patterns,PAMPs)[2],诱导先天免疫细胞分泌Ⅰ型干扰素、炎性细胞因子、趋化因子而发挥先天防御的功能[3]。
鞭毛素是细菌鞭毛的重要构成组件,也是一种重要的PAMPs。鞭毛素蛋白作为TLR5的天然配体,激活TLR5介导的信号通路,启动促炎基因的表达。同时可以被胞内的NAIP5/NLRC4结合识别,组装成NLRC4炎症小体(Inflammasome)。NLRC4炎症小体激活Caspase-1切割IL-1β和IL-18的前体并释放成熟的IL-1β和IL-18,同时亦可引起细胞的凋亡[4,5]。在获得性免疫方面,鞭毛素蛋白的佐剂效应及其特异性的抗体应答与TLR5和NLRC4通路密切相关[6]。李伟等报道了NLRC4通路的激活减弱了TLR5介导的鞭毛素特异性的获得性免疫应答[7]。另外,鞭毛素蛋白可以通过激活乳腺癌细胞上的TLR5抑制肿瘤细胞的增殖,NLRC4炎症小体在结直肠癌的发生发展中起重要作用[8],而且肿瘤微环境是免疫抑制性的,限制了杀伤性T细胞和NK细胞等对肿瘤细胞的杀伤作用。也有文献报道鞭毛素蛋白能够增强疫苗的抗肿瘤效果[9]。鞭毛素蛋白的免疫学特性与其对TLR5和NLRC4两条通路的激活密切相关。目前,TLR5和 NLRC4通路的激活在对先天免疫细胞的影响中的差异还不清楚。本研究通过利用重组的鞭毛素蛋白同时或者单独激活TLR5和NLRC4通路探讨了其对先天免疫细胞的影响,为今后鞭毛素蛋白在抗肿瘤免疫中的应用提供依据。
1材料与方法
1.1材料
1.1.1实验动物8周龄SPF级雌性C57BL/6小鼠(购自重庆腾鑫生物技术有限公司),所有的实验动物都饲养在清洁级的环境条件下,动物实验操作按照动物保护指导条例进行。
1.1.2主要试剂IPTG;30 kD透析袋,镍离子螯合树脂层析柱,Western配胶试剂,胰蛋白胨和酵母提取物(北京索莱宝公司);考马斯亮蓝R-250,Bradford蛋白定量试剂盒;LDH检测试剂盒(碧云天公司);人IL-8 ELISA KIT,小鼠IL-1βELISA KIT(武汉博士德公司);荧光标记抗小鼠流式抗体均购自BD公司;Gibco DMEM,0.25%胰酶(Hyclone);鲎试剂(厦门鲎试剂有限公司)。
1.2方法
1.2.1鞭毛素蛋白的制备已构建的带有His标签的鞭毛素蛋白不同突变体质粒的大肠埃希菌(中科院武汉病毒所黏膜免疫学科组惠赠)分别是:全长鞭毛素蛋白FliC(同时激活TLR5和NLRC4两条通路);缺失90-97氨基酸的FliC克隆FliCΔ90-97 (仅能激活NLRC4通路);FliC末端三个亮氨酸突变为丙氨酸的克隆FliC-L3A(仅能激活TLR5通路);同时缺失90-97氨基酸和末端 3个亮氨酸突变为丙氨酸的克隆FliCΔ90-97:L3A(两条通路都不能激活)。具体方法如下:将带有四种FliC质粒菌扩大培养,IPTG诱导表达FliC蛋白。超声破碎仪破碎菌液(置于冰水中)至清亮,离心12 000 r/min,20 min收集上清,镍离子亲和树脂层析纯化目的蛋白(图1)。根据电泳结果选取蛋白量较多的管转到透析袋,PBS透析两次,2 h/次,第三次透析过夜。
1.2.2Triton X-114去除内毒素透析后的鞭毛素蛋白转到小烧杯中,按1%(v/v)加入Triton X-114,4℃磁力搅拌30 min。将上述蛋白液吸到EP管,37℃放置10 min。12 000 r/min,37℃离心20 min,将上清小心吸出,不要吸到沉淀。重复上述步骤4次,离心后的蛋白上清在超净台无菌分装,冻存在-80℃冰箱备用。
1.2.3蛋白浓度定量(Bradford法)和内毒素检测(鲎试验)经鲎试剂检测四种蛋白的内毒素残留均低于0.01 EU/mg蛋白(见表1)。
1.2.4重组鞭毛素蛋白活性检测方法见参考文献[7,10],利用人肠上皮细胞系Caco-2细胞检测TLR5通路激活:Caco-2细胞系组成性表达TLR5,激活TLR5可导致炎症细胞因子IL-8的分泌。将培养好的Caco-2细胞传代接种至24孔板,约2×105个细胞/孔,10%FBS高糖DMEM,37℃,5%CO2培养。细胞极化好后换用无血清DMEM培养基进行培养。待细胞饥饿8~12 h后,吸弃培养基。用无血清培养基将各鞭毛素蛋白稀释成10 μg/ml,每组三个重复,刺激6 h收集上清,检测IL-8的浓度。
LDH释放被看做细胞膜完整性的重要指标,并被广泛用于细胞毒性检测。因为NLRC4通路的激活可以引起细胞的死亡,并释放LDH和IL-1β[10]。因此,我们取鞭毛素蛋白刺激小鼠腹腔原代巨噬细胞通过检测IL-1β和LDH释放来检测NLRC4的激活。眼球放血后处死小鼠,在超净台中PBS灌洗腹腔,灌洗液离心后弃上清后加约1 ml 10%FBS的RPMI1640,混匀后细胞计数。调整细胞数量,每孔约5×105个细胞铺于96孔板。过夜洗去未贴壁细胞,LPS(50 ng/ml)预处理3 h,加鞭毛素蛋白(10 μg/ml)刺激20 h,以上均严格无菌操作,收集上清检测LDH和IL-1β。
1.2.5IL-8和IL-1β的检测方法见博士德公司IL-8和IL-1β试剂盒操作说明书。
1.2.6流式细胞术检测重组鞭毛素蛋白对小鼠先天免疫细胞的影响制备小鼠腹腔细胞和脾细胞悬液。随机将C57BL/6小鼠分成5组,每组3只,每只小鼠分别腹腔注射100 μl PBS和10 μg重组鞭毛素蛋白。刺激12 h,眼球放血后,颈椎脱臼处死小鼠。用PBS灌洗腹腔,制成腹腔细胞悬液;并取小鼠脾脏,制成脾细胞悬液。PBS清洗一遍,离心弃上清剩余约1 ml PBS充分混匀。取30 μl细胞悬液做流式染色:脾细胞(CD11c-PE、CD86-PEcy7、CD80-FITC、CD4-PerCP和CD25-FITC);腹腔细胞(CD11b-PerCP、Gr1-FITC和NK1.1-PE),同时做同型对照染色,上流式细胞仪BD FACSCalibur 检测。

2结果
2.1鞭毛素蛋白的表达纯化及定量经镍离子树脂柱纯化的鞭毛素蛋白,电泳显示分子量约50 kD,杂蛋白量较少(图1)。经鲎试验检测,纯化的蛋白内毒素均小于0.01 EU/mg,满足实验要求。同时,我们也检测了重组鞭毛素蛋白的浓度,结果见表1。
2.2鞭毛素蛋白的活性检测四种重组鞭毛素蛋白刺激Caco-2细胞系,结果显示能够激活TLR5通路的全长FliC组和FliC-L3A组IL-8分泌与对照组相比有显著差异(P<0.01),而不能激活TLR5通路的FliCΔ90-97和FliCΔ90-97:L3A组IL-8分泌跟对照组相比无统计学差异(P>0.05)(图2A)。

图1 纯化所得四种重组鞭毛素蛋白SDS-PAGE电泳Fig.1 Four purified recombinant flagellin by SDS-PAGENote: From left to right are FliC,FliCΔ90-97,FliC-L3A,FliCΔ90-97:L3A and marker.
四种重组鞭毛素蛋白刺激小鼠腹腔原代巨噬细胞,通过检测IL-1β和LDH释放来检测激活NLRC4的能力。结果显示,全长FliC和FliCΔ90-97有激活NLRC4的活性(P<0.01),而FliC-L3A和FliCΔ90-97:L3A无激活NLRC4的能力(P>0.05)(图2B和2C)。结果显示重组鞭毛素蛋白生物学活性符合预期。
2.3流式细胞术检测鞭毛素蛋白对先天免疫细胞的影响
2.3.1对腹腔NK和粒细胞比例的影响结果显示,单独或同时激活TLR5和NLRC4通路,对中性粒细胞和NK细胞有相似的趋化能力即FliC组、FliCΔ90-97和FliC-L3A组腹腔细胞悬液中的中性粒细胞、NK细胞的比例无差异(图3A和3B),但都明显高于FliCΔ90-97:L3A和对照组(P<0.01)。
表1Bradford法鞭毛素蛋白定量
Tab.1Quantification of flagellin by Bradford method

FliCFliCΔ90-97FliC-L3AFliCΔ90-97:L3AConcentration(mg/ml)2.983.242.954.81

图2 四种重组鞭毛素蛋白激活TLR5和NLRC4通路的生物学活性检测Fig.2 Bioactivity of four recombinant flagellins to activate TLR5 and NLRC4 pathwaysNote: **.P<0.01;***.P<0.001.

图3 重组鞭毛素蛋白对腹腔NK和粒细胞比例的影响Fig.3 Impact of recombinant flagellin on propertion of innate immune cells in peritoneal cavity of miceNote: **.P<0.01.

图4 重组鞭毛素蛋白对小鼠脾脏DC和Treg比例的影响Fig.4 Impact of recombinant flagellin on propertion of splenic DC and Treg in miceNote: *.P<0.05.
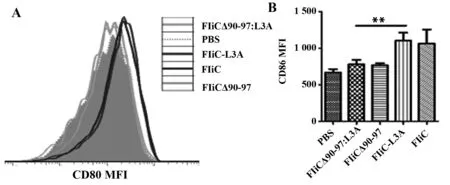
图5 重组鞭毛素蛋白对小鼠脾脏中DC表面CD80和CD86表达的影响Fig.5 Impact of recombinant flagellin on expression of CD80 and CD86 on splenic DC in miceNote: **.P<0.01.
2.3.2对脾脏DC和Treg比例的影响流式分析如图4A所示。结果显示,激活TLR5通路可以增加脾脏中DC和调节性T细胞的比例。FliC-L3A组Treg高于FliC(P<0.05),而FliC和FliCΔ90-97组、FliCΔ90-97:L3A组、对照组相比无统计学差异(P>0.05)(图4A);FliC组和FliC-L3A组DC比例高于FliCΔ90-97组、FliCΔ90-97:L3A组和对照组(P<0.05)(图4B)。
2.3.3对脾脏DC表面共刺激分子CD80和CD86的影响结果显示,激活TLR5使DC表面共刺激分子CD80和CD86表达上调,FliC组和FliC-L3A组CD80(图5A)和CD86(图5B)的平均荧光强度明显高于FliCΔ90-97组和FliCΔ90-97:L3A组(P<0.01),即促进DC成熟主要是通过激活TLR5通路起作用。
3讨论
模式识别受体(Pattern recognition receptors,PRRs)是免疫系统检测入侵病原,启动免疫反应,联系先天免疫和获得性免疫的重要桥梁,主要包括TLRs和NLRs。鞭毛素蛋白具有激活胞外TLR5和胞浆NLRC4两条通路的能力。鞭毛素蛋白诱导炎症因子的表达,趋化炎性相关细胞与其激活TLR5和NLRC4通路密切相关。激活TLR5通路主要产生IL-8、MCP-1、TNF-α、IFN-γ等细胞因子和趋化因子,而NLRC4通路的激活主要产生IL-18和IL-1β,两条通路的激活调节免疫细胞的趋化、成熟和分化。但是这两条通路在激活先天免疫方面相互间的作用如何,尚未见相关研究。因此本研究利用重组的鞭毛素蛋白,来探讨单独或者同时激活TLR5和NLRC4通路对先天免疫细胞的影响。
本研究结果显示,激活TLR5的FliC-L3A组、FliC组和激活NLRC4的FliCΔ90-97诱导中性粒细胞和NK细胞的能力相似。激活DC表面TLR5对DC的成熟起主要作用,单独激活NLRC4通路并不能促进DC的成熟,与之前研究结果一致[11]。文献报道的鞭毛素蛋白的佐剂效应与TLR5和NLRC4通路相关,本研究也揭示了NLRC4通路介导的鞭毛素蛋白的佐剂效应并不是通过对DC的激活而介导的。但对于CD4+CD25+Treg激活TLR5上调其比例,激活NLRC4抵消了单独激活TLR5的效应,FliC组Treg比例低于FliC-L3A(P<0.05)。TLR5和NLRC4通路激活对于Treg活性的影响还需进一步探讨,之前有报道TLR5可以增强Treg抑制活性。
Toll受体不仅在先天免疫防御中起重要作用,Toll受体的差异表达和肿瘤侵袭有关,鞭毛素蛋白激活乳腺癌细胞上的TLR5可以直接抑制肿瘤细胞的增殖[12]。鞭毛素蛋白还有可能通过NLRC4信号通路来参与介导免疫细胞的抗肿瘤效应。肿瘤微环境中肿瘤细胞释放的趋化因子能够募集不同的炎症细胞和免疫细胞。其中Treg细胞的大量募集,导致了肿瘤微环境的免疫抑制状态,抑制了抗肿瘤免疫细胞的功能。在抗肿瘤方面,NK细胞是早期对致病菌和肿瘤产生先天免疫反应的主要效应细胞[13]。它能够通过激活DC,促进其分化而诱导Th1和CTL反应,增强抗肿瘤应答,在抗肿瘤的免疫治疗中发挥重要作用[14]。粒细胞也被认为具有重要的抗肿瘤效应[15]。Tsujimoto等[16]报道了鞭毛素蛋白能够增强NK细胞的杀伤能力,我们的研究也发现了TLR5和NLRC4通路的激活都可以增加NK细胞的比例。另外,鞭毛素蛋白作为重要的免疫免疫佐剂,能够有效的激活机体产生抗原特异性的T细胞应答和抗体应答。提示我们鞭毛素蛋白可能通过增强肿瘤特异性的CD4+T细胞和CD8+T细胞免疫应答、增强NK细胞的杀伤功能而抑制肿瘤生长,另一方面鞭毛素蛋白也可能通过激活DC而减弱机体对肿瘤细胞的免疫耐受。
本研究初步揭示了TLR5和NLRC4通路对先天免疫细胞的影响,为我们进一步利用鞭毛素蛋白进行抗肿瘤免疫治疗提供依据,但是这两条通路在抗肿瘤免疫中的作用仍然需要我们做进一步的研究。
致谢:感谢中国科学院武汉病毒所鄢慧民研究员在实验材料提供方面给予的大力帮助,感谢贵州省人民医院刘水和老师在流式操作上给予的协助。
参考文献:
[1]Kawai T,Akira TS.Toll-like receptors and their crosstalk with other innate receptors in infection and immunity[J].Immunity,2011,34(5):637-650.
[2]Pedra J,Cassel S,Sutterwala F.Sensing pathogens and danger signals by the inflame-masome[J].Current opinion in immunol,2009,21(1):10-16.
[3]Ishii KJ,Koyama S,Nakagawa A,etal.Host innate immune receptors and beyond:making sense of microbial infections[J].Cell Host&Microbe,2008,3(6):352-363.
[4]Zhao Y,Yang J,Shi J,etal.The NLRC4 inflammasome receptors for bacterial flagellin and type III secretion apparatus[J].Nature,2011,477(7366):596-600.
[5]Franchi L,Kamada N,Nakamura Y,etal.NLRC4-driven production of IL-1beta disc-riminates between pathogenic and commensal bacteria and promotes host intestinal defense[J].Nat Immunol,2012,13(5):449-456.
[6]Vijay-Kumar M,Carvalho FA,Aitken JD,etal.TLR5 or NLRC4 is necessary and s-ufficient for promotion of humoral immunity by flagellin[J].Eur J Immunol,2010,40(12):3528-3534.
[7]Li W,Yang J,Zhang E,etal.Activation of NLRC4 downregulates TLR5-mediated antibody immune responses against flagellin[J].Cell Mol Immunol,2015.doi:10.1038/cmi,2015.033.
[8]Hu B,Elinav E,Huber S,etal.Inflammation-induced tumorigenesis in the colon is reg-ulated by caspase-1 and NLRC4[J].Proc Natl Acad Sci USA,2010,107(50):21635-21640.
[9]Leigh ND,Bian G,Ding X,etal.A flagellin-derived toll-like receptor 5 agonist stimulate-s cytotoxic lymphocyte-mediated tumor immunity[J].PLoS One,2014,9(1):e85587.
[10]Yang JY,Zhang E,Liu F,etal.Flagellins of salmonella typhi and non-pathogenic escherichia coli are differentially recognized throughity the NLRC4 pathway in macrophages[J].J Innate Immun,2014,6(1):47-57.
[11]Bates JT,Uematsu S,Akira S,etal.Direct stimulation of tlr5+/+ CD11c+ cells is necessary for the adjuvant activity of flagellin[J].J Immunol,2009,182(12):7539-7547.
[12]Cai Z,Sanchez A,Shi Z,etal.Activation of Toll-like receptor 5 on breast cancer cells by flagellin suppresses cell proliferation and tumor growth[J].Cancer Res,2011,71(7):2466-2475.
[13]Vivier E,Raulet DH,Moretta A,etal.Innate or adaptive immunity? The example of natural killer cells[J].Science,2011,331(6013):44-49.
[14]Wong JL,Mailliard RB,Moschos SJ,etal.Helper activity of NK cells during the dendritic cell-mediated induction of melanoma-specic cytotoxic T cells[J].J Immuno Ther,2011,34(3):270-278.
[15]Mittendorf EA,Alatrash G,Qiao N,etal.Breast cancer cell uptake of the inflammatory mediator neutrophil elastase triggers an anticancer adaptive immune response[J].Cancer Res,2012,72(13):3153-3162.
[16]Tsujimoto H,Uchida T,Efron PA,etal.Flagellin enhances NK cell proliferation and activation directly and through dendritic cell-NK cell interactions[J].J Leukoc Biol,2005,78(4):888-897.
[收稿2015-12-24修回2016-01-12]
(编辑许四平)
Impact of TLR5 and NLRC4 activation on innate immune cells in mice
ZHUO Zhao-Zhen,LI Wei,YUAN Jun.
Department of Immunology,Guizhou Medcial University,Guiyang 550004,China
[Abstract]Objective:To investigate the impact of recombinant flagellin targeting TLR5 and NLRC4 simultaneously or respectively on innate immune cells in mice.Methods: Induction,expression,purification and identification of recombiant FliC,which were FliC(activating both TLR5 and NLRC4);FliCΔ90-97(unable to activate TLR5),FliC-L3A(unable to activate NLRC4),FliCΔ90-97:L3A(unable to activate both TLR5 and NLRC4).The mice were divided into five groups,namely group FliC,FliC-L3A,FliCΔ90-97,FliCΔ90-97:L3A and PBS,which were injected with 100 μl PBS or 10 μg recombinant flagellin intraperitoneally,three mice in each group.12 h later,the mice were executed using dislocation of cervical vertebra and the splenic and peritoneal cells were isolated.The spleen was grinded into single-cell suspension.The proportion of neutrophils,NK cells,DCs and the expression level of CD80 and CD86 on DCs were evaluated with flow cytometry.Results: Group FliC,group FliC-L3A and group FliCΔ90-97 shared the similar proportion of neutrophils in peritoneal cavity(P>0.05),and all of which were significantly higher than group PBS and group FliCΔ90-97(P<0.01),and NK cells also showed the similar trend.Compared with group FliCΔ90-97 and FliCΔ90-97:L3A,the mean fluorescence intensities(MFIs) of CD80 and CD86 in group FliC and FliC-L3A increased significantly(P<0.01).The proportion of Treg in spleen was highest among all groups.Conclusion: Activation of TLR5 and NLRC4 had similar chemotaxis of neutrophils and NK cells.The expression of CD80 and CD86 on DCs were upregulated after stimulation by flagellin and TLR5-dependent.Activation of TLR5,but not NLRC4,increased the proportion of Treg in spleen.
[Key words]Flagellin;TLR5;NLRC4;Innate immune cells;DC;Treg
doi:10.3969/j.issn.1000-484X.2016.06.007
作者简介:卓召振(1987年-),男,在读硕士,检验师,主要从事肿瘤免疫的研究,E-mail:475059537@qq.com。 通讯作者及指导教师:袁军(1970年-),女,博士,教授,主要从事器官移植和肿瘤免疫方面的研究,E-mail:junyuan99430@163.com。
中图分类号R392.1
文献标志码A
文章编号1000-484X(2016)06-0803-05
①本文受贵州省卫计委科学技术基金项目(gzwjkj2015-1-020)、国家高技术研究发展计划(863)子课题(2011AA02A111)和贵州省人民医院博士基金(GZSYBS[2015]11号)资助。
②并列第一作者。
③贵州省人民医院中心实验室,贵阳550002。

