CTNNB1基因在卵巢癌组织中的表达及其相关性
刘海艳 王艳铭 王雨艳 刘丽丽 左中夫
(辽宁医学院附属第一医院妇产科,辽宁 锦州 121000)
·肿瘤·
CTNNB1基因在卵巢癌组织中的表达及其相关性
刘海艳王艳铭王雨艳刘丽丽左中夫
(辽宁医学院附属第一医院妇产科,辽宁锦州121000)
〔摘要〕目的分析CTNNB1在卵巢癌组织中的表达,探讨其与临床特征的关系。方法免疫组织化学方法检测CTNNB1在正常卵巢上皮组织及卵巢癌组织中的表达,分析其与临床特征间的关系;实时聚合酶链反应(PCR)法检测CTNNB1 mRNA的表达;Western印迹法检测CTNNB1蛋白的表达。结果正常的卵巢上皮组织未发现CTNNB1存在。在卵巢上皮性肿瘤组织中,93.3%的卵巢癌组织(42/45)出现了CTNNB1胞质表达。免疫组织化学染色结果显示,CTNNB1主要定位于细胞质,表现为染色后胞质内可见棕褐色的粒状物;CTNNB1在淋巴结转移患者组织中的表达比无淋巴结转移患者增加明显,而不同年龄、病理分期、组织学分化程度间的表达差异不显著;CTNNB1 mRNA和蛋白在卵巢癌组织及卵巢癌细胞株中表现为高表达,与正常的卵巢上皮组织差异显著,其中在细胞株中CAOV3的表达最高。结论CTNNB1在卵巢癌组织及细胞株中均有高表达,且与卵巢癌淋巴结转移关系密切。
〔关键词〕CTNNB1;卵巢癌组织;细胞株
原发性卵巢癌是妇科较为常见恶性肿瘤,其发病机制不清,仍无有效治疗手段。近年来大量文献报道,CTNNB1基因表达增加在肝癌、结肠癌、胃癌、肺癌等肿瘤形成过程中发挥了重要作用〔1~4〕。CTNNB1与肿瘤的发生发展关系密切,在肝癌、结肠癌、胃癌、肺癌等肿瘤组织中均可见CTNNB1蛋白表达增加〔5,6〕。但该基因在卵巢癌发生发展中的作用及分子机制仍不完全清楚。卵巢癌的发生发展及转归与多种因素密切相关,如TMN分期、淋巴结转移、淋巴细胞浸润及细胞分化等〔7〕。本课题拟探讨CTNNB1基因的表达与卵巢癌TMN分期、淋巴结转移、淋巴细胞浸润及细胞分化程度之间的相关性。
1材料与方法
1.1标本与材料组织标本均来我院妇产科,包括10例正常的卵巢上皮组织及45例恶性卵巢上皮性肿瘤。其中恶性肿瘤中,黏液性囊腺癌21例,浆液性囊腺癌10例,透明细胞癌8例,内膜样腺癌6例。年龄61~77岁,平均(69.8±8.6)岁。均来源于初次行探查手术的患者术中切除,排除探查术前接受过放化疗及其他影响实验研究的特殊处理者。正常的卵巢上皮组织均来源于子宫肌瘤或子宫内膜异位症行子宫附件全切者。
1.2方法将每个肿瘤组织等分为二份,其中一份立即放于液氮中冰冻,另一份用4%甲醛溶液固定后石蜡包埋。人卵巢癌细胞株CAOV3,SKOV3,A2780由我院实验室提供。
1.3免疫组织化学方法检测CTNNB1的表达①切片:取石蜡包埋2 d后的标本进行连续切片,切片厚度保持在3 μm。②烤片:将空白切片放置于60℃烤箱中进行烤片,持续3 h,直至组织切片呈现透明。③脱蜡、水化:取二甲苯1、二甲苯2、无水乙醇、95%乙醇、75%乙醇依次对经过烤片后的标本进行脱蜡、水化,分别为15 min,最后用蒸馏水冲洗3 min,共计5次。④孵育:利用新鲜配制3%过氧化氢溶液对其进行室温孵育半小时,消除内源性过氧化物酶活性。磷酸盐缓冲液(PBS)漂洗3 min,共计5次。⑤抗原修复:处理后的标本切片放于枸橼酸缓冲溶中,水浴15 min(95℃),室温下自然冷却,蒸馏水冲洗5次;⑥封闭:10%山羊血清于37℃恒温箱中,封闭15 min,甩去血清,切忌清洗。⑦加液:滴加鼠抗人CTNNB1抗体(溶液配比1∶100)在40℃下过夜,PBS冲洗5 min,总计5次。然后加入二抗(已进行生物素标记),37℃恒温孵育半小时,PBS冲洗3 min,共计5次。后滴加链霉亲和素-生物素复合物(SABC),37℃恒温孵育半小时,PBS冲洗3 min,共计5次。⑧显色:滴加二氨基联苯胺(DAB)液,显色3 min,显微镜下观察,当发现棕黄色颗粒后蒸馏水清洗,停止显色反应,后用HE重复染色15 s后冲洗。⑨封片:常规梯度脱水,待标本干燥后采用中性树胶进行封片,高倍镜下观察。
1.4实时聚合酶链反应(PCR)检测CTNNB1 mRNA基因的表达采用SYBR Green方法检测,反应体系:SYBR Green solution 12 μl;正向引物1 μl;负向引物1 μl;cDNA 2.0 μl;ddH2O 9 μl。共计25 μl。采用Trizol(购自美国GIBCO公司)提取总RNA,RT-PCR按照逆转录及PCR说明进行。引物序列为:CTNNB1:正义-TCCCACTCCTACGGAGAGAA,反义-GAAGGTCGGAAGGAAGG;内参基因β-actin:正义-GACCTGGAGACGAGTGTC,反义-TTCGCTCCACCTGTAAGTA。扩增条件为:95℃ 5 min→94℃ 15 s→60℃ 45s→75℃ 30 s,共计40个循环。实时PCR反应完成后,重复一个循环的溶解曲线反应,以评价扩增的特异性。待测基因CTNNB1的表达水平用2-ΔΔCT的方法进行统计。
1.5Western印迹法检测CTNNB1蛋白的表达采用含10%胎牛血清(FBS)的细胞培养基(DMEM)进行培养。待卵巢癌细胞生长至80%融合时提取总蛋白。总蛋白的浓度采用二喹啉甲酸(BCA)蛋白质定量试剂盒来进行测定。抗原抗体反应后进行显色:取硝酸纤维素(NC)膜置于免疫印迹化学(ECL)发光剂中,反应3 min;暗室内曝光,常规方法定影,并利用 凝胶成像系统进行扫描显色,采用光密度来对蛋白进行表达,蛋白的相对表达=目的蛋白/β-actin。
1.6结果判定由两位医师分别给予双盲阅片,参照肿瘤的阳性细胞面积、染色强度来对结果进行计分。其中肿瘤的阳性细胞面积:阳性细胞面积为0不计分,1%~10% 1分,11%~49% 2分,50%~79% 3分,≥80% 4分;染色强度不表达为0分,弱表达(+)为1分,中度表达()为2分,强表达()为3分。两者计分的乘积为最终的染色分级判断标准。用PBS代替一抗作为阴性对照。
1.7统计学方法采用SPSS18.0统计软件包进行t检验,χ2检验,Pearson相关分析。
2结果
2.1免疫组织化学方法下CTNNB1在卵巢癌中的表达正常的卵巢上皮组织未发现CTNNB1存在。在卵巢上皮性肿瘤组织中,93.3%的卵巢癌组织(42/45)出现了CTNNB1胞质的表达。免疫组织化学染色结果显示,CTNNB1主要定位于细胞质,表现为染色后胞质内可见棕褐色的粒状物。见图1。

图1 CTNNB1 在正常卵巢上皮组织及卵巢癌组织中的表达(400×)
2.2CTNNB1表达与临床病理的关系按年龄、病理分期、组织学分化程度、淋巴结转移情况评分显示,CTNNB1在淋巴结转移患者组织中的表达比无转移患者增加明显(P<0.05),而在患者不同年龄、病理分期、组织学分化程度间的表达差异无统计学意义,提示 CTNNB1的表达与卵巢癌的转移有一定的相关性。见表1。

表1 CTNNB1表达与卵巢癌临床病理特征之间的关系
2.3CTNNB1 mRNA和蛋白在卵巢癌组织表达CTNNB1 mRNA在卵巢癌组织及卵巢癌细胞株CAOV3、SKOV3、A2780中均为高表达,分别为6.1±0.0、5.0±0.1、4.2±0.1、3.5±0.0,明显高于正常卵巢上皮组织(1.4±0.0)(P<0.001)。CTNNB1 蛋白在卵巢癌组织及卵巢癌细胞株CAOV3、SKOV3、A2780中均为高表达,分别为5.4±0.0、3.5±0.1、2.8±0.0、2.6±0.1,明显高于正常卵巢上皮组织(1.1±0.1)(P<0.001)。见图2、图3。
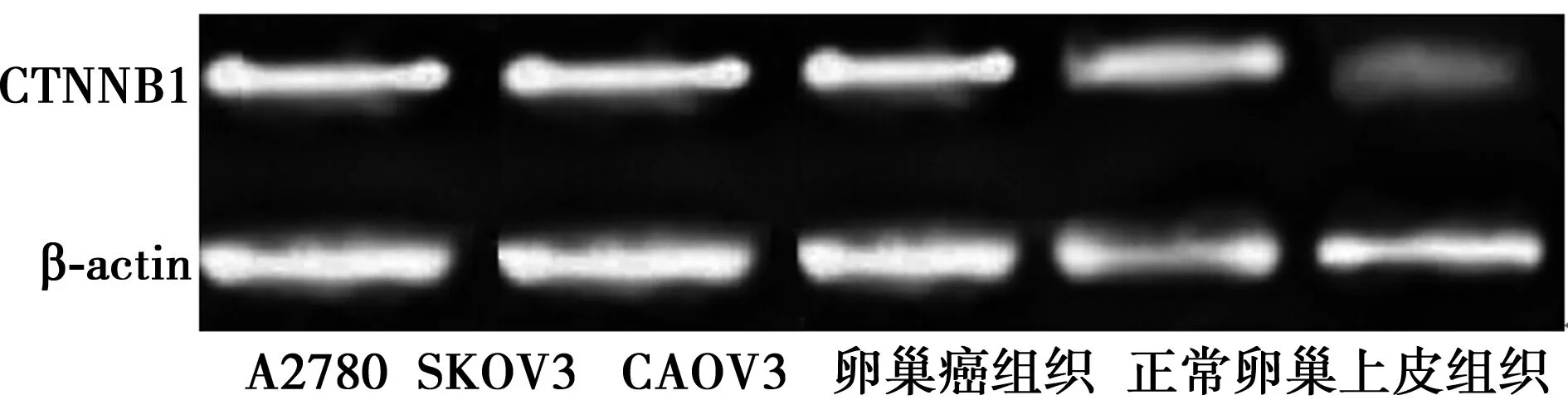
图2 CTNNB1 mRNA在卵巢癌组织中的表达

图3 CTNNB1蛋白在卵巢癌组织中的表达
3讨论
异常的Wnt信号传导 被认为是卵巢癌变过程 的关键〔8~10〕。在激活Wnt通路的过程中,CTNNB1蛋白的稳定至关重要,这为卵巢癌的新治疗提供了有力的靶位。CTNNB1基因也叫β-catenin基因,在癌细胞WNT信号传导通路被激活 ,发挥抑制GSK-3β活性的作用,从而达到稳定CTNNB1蛋白的目的〔11~16〕。Wnt/β-catenin活化通路在人类多种肿瘤中均得到证实,而且研究还显示,Wnt/β-catenin靶基因的活化可使肿瘤细胞发生侵袭和转移、增殖等〔17~20〕。CTNNB1蛋白由于大量集聚在细胞质,能够和T细胞因子/淋巴增强因子(TCF/LEF)结合,转入细胞核,进而激活其下游基因,加速细胞的增殖〔21~23〕。对卵巢癌细胞株的研究显示,CTNNB1在部分细胞株中作为其必需的原癌基因,一旦CTNNB1的活性受限,细胞周期会很快停滞在G1期,细胞开始凋亡〔24~27〕。综上,CTNNB1高表达于卵巢癌中,并且CAOV3是CTNNB1高表达的主要卵巢癌细胞株,推测在后续的研究中可以选择CAOV3作为效应细胞来进一步验证CTNNB1的功能及其在Wnt通路中的变化。
4参考文献
1Burkhalter RJ,Symowicz J,Hudson LG,etal.Integrin regulation of β-catenin signaling in ovarian carcinoma〔J〕.J Biol Chem,2011;286(26):23467-75.
2Feng Y,Sakamoto N,Wu R,etal.Tissue-specific effects of reduced β-catenin expression on adenomatous polyposis coli mutation-instigated tumorigenesis in mouse colon and ovarian epithelium〔J〕.PLoS Genet,2015;11(11):e1005638.
3Maria VB,Rebecca JB,Stack MS.Diverse mechanisms for activation of Wnt signalling in the ovarian tumour microenvironment〔J〕.Biochem J,2011;437(Pt 1):1-12.
4Yoshioka S,Mandy LK,Sophia R,etal.WNT7A regulates tumor growth and progression in ovarian cancer through the WNT/β-catenin pathway〔J〕.Mol Cancer Res,2012;10(3):469-82.
5Basu M,Mukhopadhyay S,Chatterjee U,etal.FGF16 promotes invasive behavior of SKOV-3 ovarian cancer cells through activation of mitogen-activated protein kinase(MAPK)signaling pathway〔J〕.J Biol Chem,2014;289(3):1415-28.
6Lynch HT,Casey MJ,Snyder CL,etal.Hereditary ovarian cancer:molecular genetics,pathology,management and heterogeneity〔J〕.Mol Oncol,2009;3(2):97-137.
7Mao YB,Xu JF,Li ZH,etal.The role of nuclear β-catenin accumulation in the twist 2-induced ovarian cancer EMT〔J〕.PLoS One,2013;8(11):e78200.
8Condello S,Morgan CA,Nagdas S,etal.Beta-Catenin Regulated ALDH1A1 is a target in ovarian cancer spheroids〔J〕.Oncogene,2015;34(18):2297-308.
9Wang H,Wang HY,Makki MS,etal.Overexpression of β-catenin and cyclinD1 predicts a poor prognosis in ovarian serous carcinomas〔J〕.Int J Clin Exp Pathol,2014;7(1):264-71.
10Tanwar PS,Kaneko-Tarui T,Ho-Joon L,etal.PTEN loss and HOXA10 expression are associated with ovarian endometrioid adenocarcinoma differentiation and progression〔J〕.Carcinogenesis,2013;34(4):893-901.
11Rosanò L,Cianfrocca R,Masi S,etal.β-Arrestin links endothelin a receptor to β-catenin signaling to induce ovarian cancer cell invasion and metastasis〔J〕.Proc Natl Acad Sci USA,2009;106(8):2806-11.
12Yan XH,Lyu TJ,Jia N,etal.Huaier aqueous extract inhibits ovarian cancer cell motility via the AKT/GSK3β/β-catenin pathway〔J〕.PLoS One,2013;8(5):e63731.
13Tanwar PS,Zhang LH,Kaneko-Tarui T,etal.Mammalian target of rapamycin is a therapeutic target for murine ovarian endometrioid adenocarcinomas with dysregulated Wnt/β-catenin and PTEN〔J〕.PLoS One,2011;6(6):e20715.
14Thakur R,Mishra DP.Pharmacological modulation of beta-catenin and its applications in cancer therapy〔J〕.J Cell Mol Med,2013;17(4):449-56.
15Chan DW,Mak CSL,Thomas HY,etal.Down-regulation of Sox7 is associated with aberrant activation of Wnt/β-catenin signaling in endometrial cancer〔J〕.Oncotarget,2012;3(12):1546-56.
16Zhang YX,Wang J,Ren ML,etal.Gene therapy of ovarian cancer using IL-21-secreting human umbilical cord mesenchymal stem cells in nude mice〔J〕.J Ovarian Res,2014;7:8.
17Purcell R,Childs M,Maibach R,etal.HGF/c-Met related activation of β-catenin in hepatoblastoma〔J〕.J Exp Clin Cancer Res,2011;30(1):96.
18Baldwin LA,Hoff JT,Lefringhouse J,etal.CD151-α3β1 integrin complexes suppress ovarian tumor growth by repressing slug-mediated EMT and canonical Wnt signaling〔J〕.Oncotarget,2014;5(23):12203-17.
19King ML,Lindberg ME,Stodden GR,etal.WNT7A/β-catenin signaling induces FGF1 and influences sensitivity to niclosamide in ovarian cancer〔J〕.Oncogene,2015;34(26):3452-62.
20Sundram V,Ganju A,Hughes JE,etal.Protein kinase D1 attenuates tumorigenesis in colon cancer by modulating β-catenin/T cell factor activity〔J〕.Oncotarget,2014;5(16):6867-84.
21Mostowska A,Pawlik P,Sajdak S,etal.An analysis of polymorphisms within the wnt signaling pathway in relation to ovarian cancer risk in a polish population〔J〕.Mol Diagn Ther,2014;18(1):85-91.
22Rodriguez N,Yang JZ,Hasselblatt K,etal.Casein kinase Ⅰ epsilon interacts with mitochondrial proteins for the growth and survival of human ovarian cancer cells〔J〕.EMBO Mol Med,2012;4(9):952-63.
23Fung FKC,Chan DW,Vincent WS,etal.Increased expression of PITX2 transcription factor contributes to ovarian cancer progression〔J〕.PLoS One,2012;7(5):e37076.
24Tanwar PS,Commandeur AE,Zhang LH,etal.The Müllerian inhibiting substance type 2 receptor suppresses tumorigenesis in testes with sustained β-catenin signaling〔J〕.Carcinogenesis,2012;33(12):2351-61.
25Nejak-Bowen KN,Satdarshan PS.Beta-catenin signaling,liver regeneration and hepatocellular cancer:sorting the good from the bad〔J〕.Semin Cancer Biol,2011;21(1):44-58.
26Ford CE,Jary E,Sean SI,etal.The Wnt gatekeeper SFRP4 modulates EMT,cell migration and downstream wnt signalling in serous ovarian cancer cells〔J〕.PLoS One,2013;8(1):e54362.
27Kwon M,Lee SJ,Wang YR,etal.Filamin A interacting protein 1-like inhibits WNT signaling and MMP expression to suppress cancer cell invasion and metastasis〔J〕.Int J Cancer,2014;135(1):48-60.
〔2014-12-17修回〕
(编辑苑云杰)
基金项目:辽宁省教育厅科学技术研究项目(No.L2014332)
〔中图分类号〕R737.31
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2675-03;
doi:10.3969/j.issn.1005-9202.2016.11.049
第一作者:刘海艳(1979-),女,硕士,主治医师,主要从事老年病及临床妇产科研究。

