离子液体反应萃取精馏合成乙酸乙酯
揭会民,崔现宝,彭艳枚,李晓兵,徐丽,林瑞榕(天津大学化工学院,化学工程联合国家重点实验室,天津 300072)
离子液体反应萃取精馏合成乙酸乙酯
揭会民,崔现宝,彭艳枚,李晓兵,徐丽,林瑞榕
(天津大学化工学院,化学工程联合国家重点实验室,天津 300072)
摘要:采用离子液体1-磺酸丁基-3-甲基咪唑硫酸氢盐([HSO3bmim][HSO4])和1-丁基-3-甲基咪唑双三氟甲磺酰亚胺盐([BMIM][Tf2N])分别作为催化剂和萃取剂,对乙酸甲酯与乙醇合成乙酸乙酯和甲醇的反应萃取精馏(RED)过程进行了模拟计算。在反应动力学和汽液相平衡分析基础上建立了反应萃取精馏流程,研究了理论板数、回流比、持液量、进料位置、溶剂比(萃取剂进料与原料进料摩尔流量的比值)、催化剂进料流量等参数对反应萃取精馏过程的影响。在优化的操作条件下,甲醇纯度为0.9922,乙酸乙酯纯度为0.9905,乙酸甲酯转化率为0.9922。
关键词:离子液体;反应萃取精馏;乙酸甲酯;甲醇;共沸物;模拟
2015-07-31收到初稿,2015-09-06收到修改稿。
联系人:崔现宝。第一作者:揭会民(1990—),男,硕士研究生。
Received date: 2015-07-31.
引 言
离子液体作为一种绿色溶剂和催化剂近年来受到了很多关注。离子液体具有独特的性质,使其能够运用于很多领域,包括作为有机反应的反应介质[1-2]、化学反应催化剂[3-5]、电化学电解液[6-7]、萃取精馏及萃取过程的萃取剂[8-12]、分析化学试剂[13]等。离子液体几乎可忽略的蒸气压和良好的热稳定性又使其易于与大部分有机物通过简单蒸馏分离,能够实现循环利用,可以节省分离过程的能耗,替代传统工艺中的溶剂。离子液体具有可设计性,可以合成具有催化功能的酸性离子液体,作为化学反应的催化剂[14-17]。
反应萃取精馏(RED)是将反应精馏和萃取精馏集成于同一设备内同时进行的过程。反应萃取精馏适合反应物和产物形成共沸物或近沸物而难以采用反应精馏的反应体系。通过在反应体系中加入萃取剂改变待分离体系的相对挥发度,同时将反应产物及时分离出去,能够使平衡反应获得高转化率和高纯度产品。反应萃取精馏过程结合了反应精馏和萃取精馏各自的优点,降低了设备的投资和能耗,是一种很有前景的分离方法[18]。目前关于反应萃取精馏的报道并不多[18-21]。Jiménez等[20-21]将反应萃取精馏运用于乙酸甲酯和正丁醇的酯交换反应过程,该过程使用酸性离子交换树脂作为酯交换反应的催化剂,以邻二甲苯作为萃取剂。Cai等[18]以离子液体作为催化剂和萃取剂,对乙酸甲酯和正丁醇合成甲醇和乙酸正丁酯的反应萃取精馏过程进行了模拟计算,结果表明通过反应萃取精馏过程可以获得高纯度的甲醇和乙酸正丁酯。
乙酸乙酯(EtOAc)是一种重要的有机溶剂,广泛用于染料、涂料、黏合剂等产品,还可用于生物、制药、食品等行业。乙酸甲酯(MeOAc)作为PVA生产过程中的副产物,在工业上的应用范围很小。将乙酸甲酯与乙醇(EtOH)的酯交换反应运用于反应萃取精馏过程,不仅能得到用途更广泛的乙酸乙酯产品,还会获得高纯度甲醇(MeOH),而甲醇是PVA生产的原料之一。
本研究利用流程模拟软件Aspen Plus模拟计算了乙酸甲酯与乙醇合成乙酸乙酯和甲醇的反应萃取精馏(RED)过程,以离子液体1-磺酸丁基-3-甲基咪唑硫酸氢盐([HSO3bmim][HSO4])为催化剂、1-丁基-3-甲基咪唑双三氟甲磺酰亚胺盐([BMIM][Tf2N])为萃取剂。在反应动力学和汽液相平衡分析基础上建立了反应萃取精馏流程,讨论了理论板数、回流比、持液量、进料位置、溶剂比、催化剂进料流量等参数对离子液体反应萃取精馏过程的影响。
1 反应动力学
乙酸甲酯与乙醇酯交换反应方程式如下

乙酸甲酯与乙醇酯交换反应的离子液体催化剂为[HSO3bmim][HSO4]。Peng等[15]研究了以该离子液体作为催化剂的乙酸甲酯与乙醇的酯交换反应的动力学,反应动力学方程如下

式中,r代表反应速率,V代表反应体系体积,ni为反应体系中组分i的物质的量,vi为反应体系中组分i的化学计量数,ρ是反应混合物密度,ccat是催化剂浓度,αMeoAc、αEtOH、αEtOAc、αMeoH分别是乙酸甲酯、乙醇、乙酸乙酯、甲醇在离子液体反应萃取精馏体系中的活度。

式(1)中正反应速率常数k+和逆反应速率常数可以通过Arrhenius方程计算,表达式如下其中,k0+=4694.8 L1.5·mol−1.5·min−1;k0−=4678.5 L1.5·mol−1.5·min−1;Ea+=38.90 kJ·mol−1;Ea−=39.36 kJ·mol−1。
在后面的反应萃取模拟计算中,反应萃取精馏塔内既有催化剂又有萃取剂,但是萃取剂是惰性组分,不参与反应,而且上述动力学方程的定义是基于不含萃取剂的反应体积,因此萃取剂的加入对于反应速率[式(1)]没有影响。如果反应速率的定义是基于包括萃取剂的反应体积,那么萃取剂会使反应速率降低。但是,这两种方法计算得到的单位时间的反应量是相同的。本研究的模拟计算直接采用式(1)所描述的反应速率,反应体积采用扣除萃取剂的反应体积。
2 汽液平衡
乙酸甲酯与乙醇酯交换反应体系中存在3个共沸体系:甲醇-乙酸甲酯、乙醇-乙酸乙酯和甲醇-乙酸乙酯。本研究利用COSMO-SAC模型[22-23]选出一种能同时打破这3种共沸体系的离子液体萃取剂,具体筛选过程参见李瑞等[24]的研究。筛选结果表明1-丁基-3-甲基咪唑双三氟甲磺酰亚胺盐([BMIM][Tf2N])可以作为萃取剂打破上述3个共沸体系的共沸点。离子液体[BMIM][Tf2N]作用下的甲醇-乙酸甲酯、乙醇-乙酸乙酯、甲醇-乙酸乙酯的汽液平衡相图如图1~图3所示,图1和图3中x′1表示除去离子液体的甲醇的归一化摩尔分数,图2 中x′1表示除去离子液体的乙醇的归一化摩尔分数。从图中可以看出,在这3个共沸体系中分别加入足够量的离子液体[BMIM][Tf2N],它们的共沸点就会消失。汽液平衡数据采用NRTL模型进行回归,得到的NRTL方程参数见表1。

图1 甲醇(1)-乙酸甲酯(2)-[BMIM][Tf2N](3)物系的等压汽液平衡相图(101.3 kPa)[25]Fig.1 Isobaric VLE diagram of methanol (1) - methyl acetate(2) - [BMIM][Tf2N] (3) ternary system at 101.3 kPa ○ x3=0; ■ x3=0.2; ▲ x3=0.4; solid lines, calculated by NRTL model

图2 乙醇(1)-乙酸乙酯(2)-[BMIM][Tf2N](3)物系的等压汽液平衡相图(101.3 kPa)[26]Fig.2 Isobaric VLE diagram of ethanol (1) - ethyl acetate (2) -[BMIM][Tf2N] (3) ternary system at 101.3 kPa ○ x3=0; ■ x3=0.2; ▲ x3=0.3; solid lines, calculated by NRTL model

图3 甲醇(1)-乙酸乙酯(2)-[BMIM][Tf2N](3)物系的等压汽液平衡相图(101.3 kPa)[26]Fig.3 Isobaric VLE diagram of methanol (1)-ethyl acetate (2)-[BMIM][Tf2N] (3) ternary system at 101.3 kPa ○ x3=0; ■ x3=0.2; ▲ x3=0.4; solid lines, calculated by NRTL model
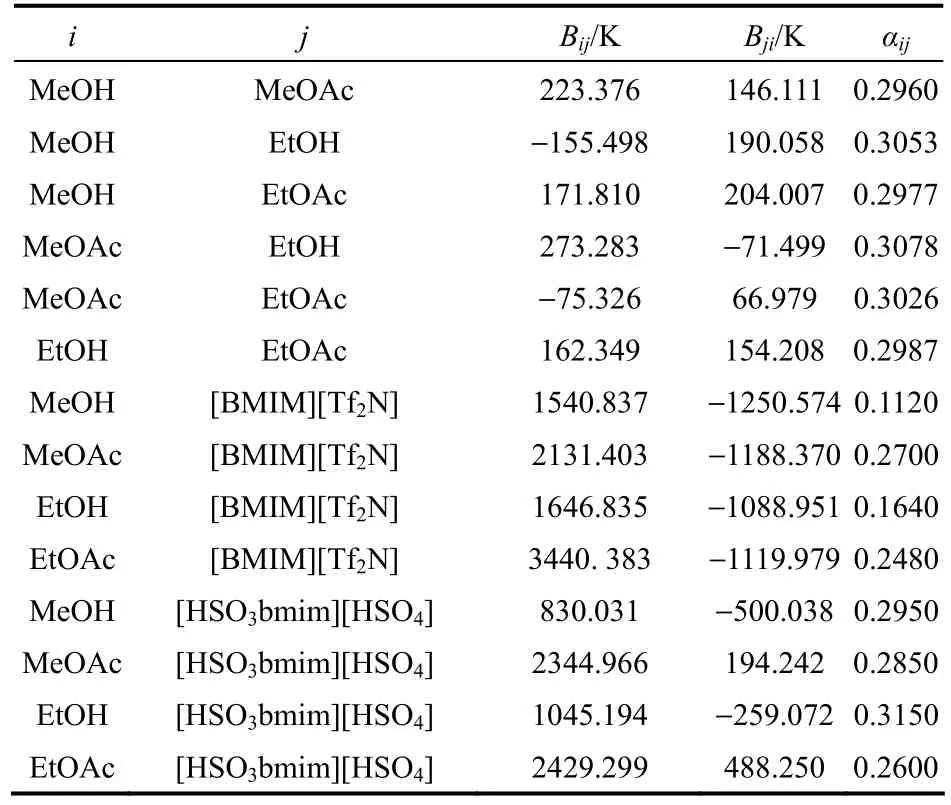
表1 NRTL方程的二元交互作用参数和非随机参数Table 1 Values of binary parameters and non-randomness parameters of NRTL equation
NRTL模型如下
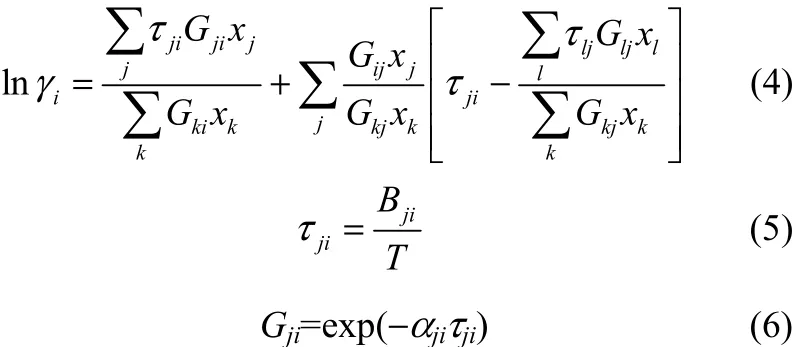
式中,Bji为二元交互作用参数,αji为非随机参数,T为温度,xi为液相组分i的摩尔分数,γi为组分i的活度系数。
3 反应萃取精馏过程模拟
3.1工艺描述
图4是该反应萃取精馏工艺流程图,操作压力为101.3 kPa,其中包含一个离子液体反应萃取精馏塔(T-1)和一个闪蒸罐(T-2)。低沸点反应物乙酸甲酯从靠近塔底进料,高沸点反应物乙醇从塔中部进料,离子液体催化剂和萃取剂混合物从靠近塔顶的位置进料。T-1塔是化学反应和萃取精馏进行的场所,是该流程的关键部分。T-1塔顶部获得轻组分产物甲醇,塔底得到的产物乙酸乙酯和离子液体混合液则进入T-2塔。T-2塔是重组分产物乙酸乙酯和离子液体分离的场所,乙酸乙酯从T-2塔顶部采出,离子液体催化剂和萃取剂混合液则从T-2塔底部采出。

图4 离子液体反应萃取精馏工艺流程Fig.4 Schematic diagram of RED process using ionic liquids as catalyst and entrainer
3.2参比操作条件及模拟计算结果
采用上述工艺流程进行初步模拟计算,得到较为适宜的参比操作条件,后文所述的影响因素分析将以此条件为参照,即改变其中某一个操作条件而保持其他条件不变。参比操作条件及其模拟计算结果见表2。其中第1块理论塔板为冷凝器,最后一块理论塔板为再沸器。
4 离子液体反应萃取精馏的影响因素
4.1理论板数的影响
理论板数是反应萃取精馏塔的一个重要参数,对化学反应过程和分离过程具有一定的影响,理论板数不足达不到分离要求,理论板数过大则会造成设备投资大。图5表示的是理论板数从35增加到55时对产物纯度和乙酸甲酯转化率的影响。从图中可以看出,当理论板数大于50时甲醇和乙酸乙酯纯度以及乙酸甲酯转化率基本保持不变。所以,综合考虑经济因素和分离效果,适宜的理论板数为50。

图5 理论板数对产物纯度和乙酸甲酯转化率的影响Fig.5 Effects of theoretical stages on purities of products and conversion of methyl acetate
4.2回流比的影响
反应萃取精馏塔内化学反应和分离过程是同时进行的,所以回流比对反应萃取精馏过程的影响比对传统精馏过程更为复杂。为了研究回流比对反应萃取精馏的影响,在其他条件与表2中参比条件相同的情况下,采用不同的回流比进行模拟计算。回流比与反应产物纯度及乙酸甲酯转化率的关系如图6所示。传统精馏过程产物纯度会随回流比增大而增大,但在反应萃取精馏过程中存在一个最佳回流比,使产物纯度和反应物转化率达到最大值。这是因为在回流比较小时体系内的反应物与产物无法彻底分离,故产物纯度和反应物转化率较低,回流比增大后产物纯度和反应物转化率都提高,但回流比过大时塔的回流量大,造成萃取剂被稀释,萃取剂的作用减弱,不利于共沸物的分离,导致产物甲醇和乙酸乙酯纯度及乙酸甲酯转化率降低。由图6分析得出最佳回流比为6。

图6 回流比对产物纯度和乙酸甲酯转化率的影响Fig.6 Effects of reflux ratio on purities of products and conversion of methyl acetate
4.3塔板持液量的影响
离子液体反应萃取精馏过程中的酯交换反应是在整个塔内进行的,塔板为化学反应发生的场所。塔板持液量对产物纯度及乙酸甲酯转化率的影响如图7所示。从图中可以看出,随着塔板持液量的增加,产物纯度和乙酸甲酯转化率先增加后趋于稳定。这是因为反应萃取精馏过程同时受反应和分离控制,当塔板持液量少时单位时间内的反应量少,反应过程为整个过程的控制步骤,因此增大持液量会使产物纯度和乙酸甲酯转化率提高;而当持液量足够大时,单位时间内的反应量增大,控制步骤逐渐向分离过程过渡,此时持液量增大对于反应精馏过程影响很小。由图7得出每块塔板的适宜持液量为30 L。

图7 持液量对产物纯度和乙酸甲酯转化率的影响Fig.7 Effects of liquid holdup on purities of products and conversion of methyl acetate
4.4进料位置的影响
本研究讨论两种情况下进料位置的影响:①同时改变乙酸甲酯和乙醇的进料位置,从而改变两者之间的进料间隔塔板数;②固定反应物之间的进料间隔,改变乙酸甲酯和乙醇的进料位置。
针对第1种情况,研究了表3中的7种反应物进料位置对甲醇和乙酸乙酯纯度及乙酸甲酯转化率的影响,结果如图8(a)所示。从图中可以看出,随着进料间隔的增加,甲醇和乙酸乙酯的纯度及乙酸甲酯的转化率都随之增加,适宜的原料进料间隔为20块塔板。

表3 乙醇和乙酸甲酯的进料位置及间隔板数Table 3 Feed tray of ethanol and methyl acetate and feed tray interval

图8 进料间隔及乙酸甲酯进料位置对产物纯度和乙酸甲酯转化率的影响Fig.8 Effects of feed tray interval and feed tray location of methyl acetate on purities of products and conversion of methyl acetate
针对第2种情况,固定乙醇与乙酸甲酯进料间隔为20块塔板,研究了不同的进料位置对产物纯度及乙酸甲酯转化率的影响,结果见图8(b),图中横坐标为乙酸甲酯进料位置,乙醇进料位置应在其上20块塔板。从图中结果可以看出,甲醇和乙酸乙酯纯度及乙酸甲酯转化率随乙酸甲酯进料位置下移而增大,当乙酸甲酯在第38块板进料、乙醇在第18块板进料时,甲醇和乙酸乙酯纯度及乙酸甲酯转化率达到较大值。
4.5溶剂比的影响
溶剂比即离子液体萃取剂的摩尔流量与两个反应物进料的摩尔流量之和的比值。从图9可以看出,随着溶剂比的增加,产物纯度及乙酸甲酯转化率不断增加。这是因为当萃取剂量很少时萃取剂对反应体系内共沸物的作用很弱,难以对共沸物进行分离,故甲醇和乙酸乙酯纯度低;随着塔内萃取剂浓度的升高,萃取剂作用加强,共沸物之间的相对挥发度增大,甲醇和乙酸甲酯纯度增加;但当溶剂比为2.5时,甲醇纯度已经达到0.9905,继续加大萃取剂的量会增加再沸器的热负荷。综合考虑能耗和反应萃取精馏效率,最佳溶剂比为2.5。

图9 溶剂比对产物纯度和乙酸甲酯转化率的影响Fig.9 Effects of entrainer ratio on purities of products and conversion of methyl acetate
4.6催化剂进料流量的影响
催化剂[HSO3bmim][HSO4]进料流量的影响如图10所示。从图中可以看出,甲醇和乙酸乙酯纯度及乙酸甲酯转化率随催化剂进料流量增加而急剧增大,当催化剂进料流量达到1 kmol·h−1后趋于稳定。这是因为当催化剂量较少时单位时间的反应量少,化学反应为控制步骤,随着催化剂进料流量的增加,单位时间的反应量提高,分离过程成为反应萃取精馏过程的控制步骤,因此适宜的催化剂进料流量为1 kmol·h−1。

图10 催化剂进料流量对产物纯度和乙酸甲酯转化率的影响Fig.10 Effects of catalyst flow rate on purities of products and conversion of methyl acetate
4.7优化条件及结果
综合上述各个影响因素的分析对反应萃取精馏过程进行了初步优化,得到了一个优化的操作条件。与参比操作条件相比,甲醇纯度由0.9847提高到0.9922,乙酸乙酯纯度由0.9831提高到0.9905,乙酸甲酯转化率由0.9847提高到0.9922。具体操作条件及计算结果见表4。

表4 优化操作条件和模拟计算结果Table 4 Optimized operating conditions and simulation results
5 结 论
以离子液体作为催化剂和萃取剂对乙酸甲酯和乙醇酯交换反应合成甲醇和乙酸乙酯的反应萃取精馏过程进行模拟计算,结论如下。
(1)采用离子液体[HSO3bmim][HSO4]和[BMIM][Tf2N]分别作为催化剂和萃取剂,利用反应萃取精馏进行乙酸甲酯和乙醇的酯交换反应,能够得到纯度为0.9922的甲醇和纯度为0.9905的乙酸乙酯,乙酸甲酯转化率为0.9922。
(2)研究了理论板数、回流比、持液量、进料位置、溶剂比、催化剂进料流量等参数对反应萃取精馏过程的影响。结果表明,甲醇和乙酸乙酯纯度以及乙酸甲酯转化率随塔板持液量、溶剂比和催化剂含量升高而升高,反应萃取精馏过程存在最佳回流比。
符号说明
Bij——NRTL二元交互作用参数
ccat——催化剂浓度,mol·L−1
Ea+, Ea−——分别为正、逆反应活化能,kJ·mol−1
k+, k−——分别为正、逆反应速率常数,L1.5·mol−1.5·min−1
k0+, k0
−——分别为Arrhenius方程中正、逆反应指前因
子,L1.5·mol−1.5·min−1
ni——反应体系中组分i的量,mol
r ——反应速率,mol·L−1·min−1
T ——温度,K
t ——时间,min
V ——反应体积,L
xi——液相组分i的摩尔分数
α ——活度
αji——非随机参数
γi——组分i的活度系数
v ——化学计量数
ρ ——反应混合物密度,mol·L−1
References
[1] HALLETT J P, WELTON T. Room-temperature ionic liquids: solvents for synthesis and catalysis. 2 [J]. Chemical Reviews, 2011, 111(5): 3508-3576.
[2] WELTON T. Room-temperature ionic liquids. Solvents for synthesis and catalysis [J]. Chemical Reviews, 1999, 99(8): 2071-2084.
[3] CUI X, CAI J, ZHANG Y, et al. Kinetics of transesterification of methyl acetate and n-butanol catalyzed by ionic liquid [J]. Industrial & Engineering Chemistry Research, 2011, 50(20): 11521-11527.
[4] 董超琦, 耿艳楼, 安华良, 等. 磺酸功能化离子液体催化甘油与甲醇醚化反应 [J]. 化工学报, 2013, 64(6): 2086-2091. DOI: 10.3969/j.issn.0438-1157.2013.06.026. DONG C Q, GENG Y L, AN H L, et al. Etherification of glycerol with methanol catalyzed by SO3H-functional ionic liquids [J]. CIESC Journal, 2013, 64(6): 2086-2091. DOI: 10.3969/j.issn.0438-1157. 2013.06.026.
[5] 卢丹, 赵国英, 任保增, 等. 醚基功能化离子液体合成及催化烷基化反应 [J]. 化工学报, 2015, 66(7): 2481-2487. DOI: 10.11949/j. issn. 0438-1157.20150233. LU D, ZHAO G Y, REN B Z, et al. Isobutane alkylation catalyzed by ether functionalized ionic liquids [J]. CIESC Journal, 2015, 66(7): 2481-2487. DOI: 10.11949/j.issn.0438-1157.20150233.
[6] GALIŃSKI M, LEWANDOWSKI A, STĘPNIAK I. Ionic liquids as electrolytes [J]. Electrochimica Acta, 2006, 51(26): 5567-5580.
[7] XU L, CUI X, ZHANG Y, et al. Measurement and correlation of electrical conductivity of ionic liquid [EMIM][DCA] in propylene carbonate and γ-butyrolactone [J]. Electrochimica Acta, 2015, 174: 900-907.
[8] POOLE C F, POOLE S K. Extraction of organic compounds with room temperature ionic liquids [J]. Journal of Chromatography A, 2010, 1217(16): 2268-2286.
[9] LI Q, ZHANG J, LEI Z, et al. Selection of ionic liquids as entrainers for the separation of ethyl acetate and ethanol [J]. Industrial & Engineering Chemistry Research, 2009, 48(19): 9006-9012.
[10] LIU H, CUI X, ZHANG Y, et al. Isobaric vapor-liquid equilibrium of ethanenitrile + water+1,2-ethanediol+1-ethyl-3-methylimidazolium chloride [J]. Fluid Phase Equilibria, 2014, 378: 13-20.
[11] ORCHILLES A V, MIGUEL P J, VERCHER E, et al. Ionic liquids as entrainers in extractive distillation: isobaric vapor-liquid equilibria for acetone plus methanol plus 1-ethyl-3-methylimidazolium trifluoromethanesulfonate [J]. Journal of Chemical and Engineering Data, 2007, 52(1): 141-147.
[12] QUIJADA-MALDONADO E, AELMANS T A M, MEINDERSMA G W, et al. Pilot plant validation of a rate-based extractive distillation model for water-ethanol separation with the ionic liquid [emim][DCA] as solvent [J]. Chemical Engineering Journal, 2013, 223: 287-297.
[13] SUN P, ARMSTRONG D W. Ionic liquids in analytical chemistry [J]. Analytica Chimica Acta, 2010, 661(1): 1-16.
[14] PENG Y, CUI X, ZHANG Y, et al. Kinetic study of transesterification of methyl acetate with ethanol catalyzed by 4-(3-methyl-1-imidazolio)-1-butanesulfonic acid triflate [J]. Applied Catalysis A: General, 2013, 466: 131-136.
[15] PENG Y, CUI X, ZHANG Y, et al. Kinetics of transesterification of methyl acetate and ethanol catalyzed by ionic liquid [J]. International Journal of Chemical Kinetics, 2014, 46(2): 116-125.
[16] YANG Z, CUI X, JIE H, et al. Kinetic study and process simulation of transesterification of methyl acetate and isoamyl alcohol catalyzed by ionic liquid [J]. Industrial & Engineering Chemistry Research, 2015, 54(4): 1204-1215.
[17] YANG Z, CUI X, YU X, et al. Transesterification of methyl acetate with n-butanol catalyzed by single and mixed ionic liquids [J]. Catalysis Letters, 2015, 145(6): 1281-1289.
[18] CAI J, CUI X, YANG Z. Simulation for transesterification of methyl acetate and n-butanol in a reactive and extractive distillation column using ionic liquids as entrainer and catalyst [J]. Chinese Journal of Chemical Engineering, 2011, 19(5): 754-762.
[19] BESTE Y A, EGGERSMANN M, SCHOENMAKERS H. Method for chemical reaction and separation of a mixture in a column: US719797[P]. 2007-05-21.
[20] JIMÉNEZ L, COSTA-LÓPEZ J. The production of butyl acetate and methanol via reactive and extractive distillation(Ⅱ): Process modeling, dynamic simulation, and control strategy [J]. Industrial & Engineering Chemistry Research, 2002, 41(26): 6735-6744.
[21] JIMÉNEZ L, GARVÍN A, COSTA-LÓPEZ J. The production of butyl acetate and methanol via reactive and extractive distillation(Ⅰ): Chemical equilibrium, kinetics, and mass-transfer issues [J]. Industrial & Engineering Chemistry Research, 2002, 41(26): 6663-6669.
[22] LIN S-T, SANDLER S I. A priori phase equilibrium prediction from a segment contribution solvation model [J]. Industrial & Engineering Chemistry Research, 2002, 41(5): 899-913.
[23] HSIEH C-M, SANDLER S I, LIN S-T. Improvements of COSMO-SAC for vapor-liquid and liquid-liquid equilibrium predictions [J]. Fluid Phase Equilibria, 2010, 297(1): 90-97.
[24] 李瑞, 崔现宝, 吴添, 等. 基于COSMO-SAC模型的离子液体萃取剂的选择 [J]. 化工学报, 2013, 64(2): 452-469. DOI: 10.3969/j.issn. 0438-1157.2013.02.008. LI R, CUI X B, WU T, et al. Selection of ionic liquid solvent for liquid-liquid extraction based on COSMO-SAC model [J]. CIESC Journal, 2013, 64(2): 452-469. DOI: 10.3969/j.issn. 0438-1157. 2013.02.008.
[25] 彭艳枚, 崔现宝, 张缨, 等. 甲醇-乙酸甲酯-1-丁基-3-甲基咪唑双三氟甲磺酰亚胺盐的等压汽液平衡 [J]. 化学工业与工程, 2013, 30(6): 27-31. DOI:10.13353/j.issn.1004.9533.2013.06.008. PENG Y M, CUI X B, ZHANG Y, et al. Isobaric vapor-liquid equilibrium for methanol-methyl acetate-1-butyl-3- methylimidazolium bis[(trifluoromethyl) sulfonyl]imide at 101.3 kPa [J]. Chemical Industry and Engineering, 2013, 30(6): 27-31. DOI:10.13353/j.issn. 1004.9533.2013.06.008.
[26] 彭艳枚. 离子液体反应萃取精馏制备甲醇和乙酸乙酯[D]. 天津:天津大学, 2013. PENG Y M. Production of methyl acetate and ethyl acetate by reactive and extractive distillation using ionic liquids as entrainer and catalyst[D]. Tianjin: Tianjin University, 2013.
DOI:10.11949/j.issn.0438-1157. 20151227
中图分类号:TQ 032.4
文献标志码:A
文章编号:0438—1157(2016)02—0606—08
Corresponding author:Prof. CUI Xianbao, cxb@tju.edu.cn
Synthesis of ethyl acetate via reactive and extractive distillation column using ionic liquids as catalyst and entrainer
JIE Huimin, CUI Xianbao, PENG Yanmei, LI Xiaobing, XU Li, LIN Ruirong
(State Key Laboratory of Chemical Engineering (Tianjin University), School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China)
Abstract:Transesterification of methyl acetate with ethanol to produce ethyl acetate and methanol via reactive and extractive distillation (RED) was simulated, using ionic liquids, 1-sulfobutyl-3-methyllimidazolium hydrogensulfate [HSO3bmin][HSO4] and 1-butyl-3-methylimidazolium bis[(trifluoromethyl) sulfonyl]imide ([BMIM][Tf2N], as catalyst and entrainer respectively. Based on the analysis of vapor-liquid equilibrium and reaction kinetics, a reactive and extractive distillation process was developed. The effects of number of theoretical stages, reflux ratio, liquid holdup, feed locations, entrainer ratio (the ratio of solvent mole flowrate to feed mole flowrates) and catalyst flowrate on RED process were investigated. The simulation results indicated that the purities of ethanol and ethyl acetate were 0.9922 and 0.9905 (mole fraction), respectively, and the conversion of methyl acetate was 0.9922 under the optimal operating and structural conditions.
Key words:ionic liquids; reactive and extractive distillation; methyl acetate; methanol; azeotrope; simulation

