微流控制备壳聚糖功能材料研究进展
赵红,徐晓敏,徐建鸿,王涛,骆广生(清华大学化学工程系,化学工程联合国家重点实验室,北京 100084)
综述与专论
微流控制备壳聚糖功能材料研究进展
赵红,徐晓敏,徐建鸿,王涛,骆广生
(清华大学化学工程系,化学工程联合国家重点实验室,北京 100084)
摘要:壳聚糖功能材料由于优异的特性在药物控缓释、水处理、催化等领域显示出许多优势而受到研究者的普遍关注,近年来发展起来的微流控技术为制备结构、尺寸可控的壳聚糖功能材料提供了可靠的新方法。本文综述了微流控技术对于壳聚糖功能材料的形貌调控以及在此基础上的应用研究进展。
关键词:微流控;壳聚糖;结构调控;功能化
2015-06-03收到初稿,2015-07-13收到修改稿。
联系人:徐建鸿。第一作者:赵红(1988—),女,博士研究生。
Received date: 2015-06-03.
引 言
壳聚糖是自然界存在的唯一的碱性多糖,由甲壳素经过脱乙酰作用得到,储量仅次于纤维素。壳聚糖具有优异的物理、化学性能,如无毒,生物相容,生物可降解,价格低廉,分子链上分布着很多活泼的羟基、氨基,具有较强的化学反应能力等。因此,壳聚糖常被制备成微球、微胶囊、纤维等,用于细胞培养、药物可控释放、酶的固定化、催化剂载体、水处理、蛋白质分离等诸多领域[1-3]。
传统的壳聚糖材料制备方法如喷雾干燥法、乳化-固化法、单凝聚法、复凝聚法等,普遍存在着结构单一、能耗大、效率低、液滴粒径分布宽和过程不易控制等不足,而20世纪90年代发展起来的微流控技术可以弥补以上不足。微流控技术可操控微小体积的流体在尺寸为几十到几百微米的微小通道或构件中流动,由于其良好的可设计性、优异的界面控制能力以及传质传热性能,作为一种崭新的材料制备技术平台,目前已在构建微结构精确可控的新型功能材料方面显示出传统技术无法比拟的创造性和优越性[4-6],因此也进一步拓展了壳聚糖材料的实际应用。
本文介绍了近年来利用微流控技术制备壳聚糖功能材料的研究进展,着重介绍了微流控技术所制备得到的不同结构形貌的壳聚糖材料,以及其在不同领域的应用。
1 微流控技术制备壳聚糖功能材料
1.1壳聚糖微球或微胶囊的制备
通过设计不同的微通道结构形式,或对操作条件进行调控,可以制备不同类型的壳聚糖微球。Xu 等[7]将壳聚糖溶解于含有2%(质量)乙酸的水溶液中制成4%(质量)的壳聚糖溶液作为分散相,以含有2%(质量)司班80和30%(质量)三辛胺的正辛醇溶液作为连续相,在图1所示的同轴环管微通道中制备单分散的壳聚糖液滴,利用三辛胺对液滴中乙酸的萃取作用,实现液滴的固化,制备得到相对致密的壳聚糖微球,如图2(a)所示。在此基础上,以2%(质量)的壳聚糖的乙酸水溶液为分散相,以含有2%(质量)司班80的正辛醇溶液作为连续相,含有0.015%(质量) 戊二醛的正辛烷溶液为凝固浴,通过正辛醇对液滴内水的溶剂萃取与氨基和醛基间的化学交联作用相结合对液滴进行固化,仅通过控制液滴在凝固浴中的停留时间,即可实现整体多孔,壳层致密、内部多孔和整体致密3种不同结构微球的一步制备,如图2(b)所示[8]。较之目前制备不同结构壳聚糖微球需对壳聚糖进行不同的改性,缺乏简单统一的制备方法的现状,该方法简化了不同结构壳聚糖微球的制备过程,利于进行实际应用。
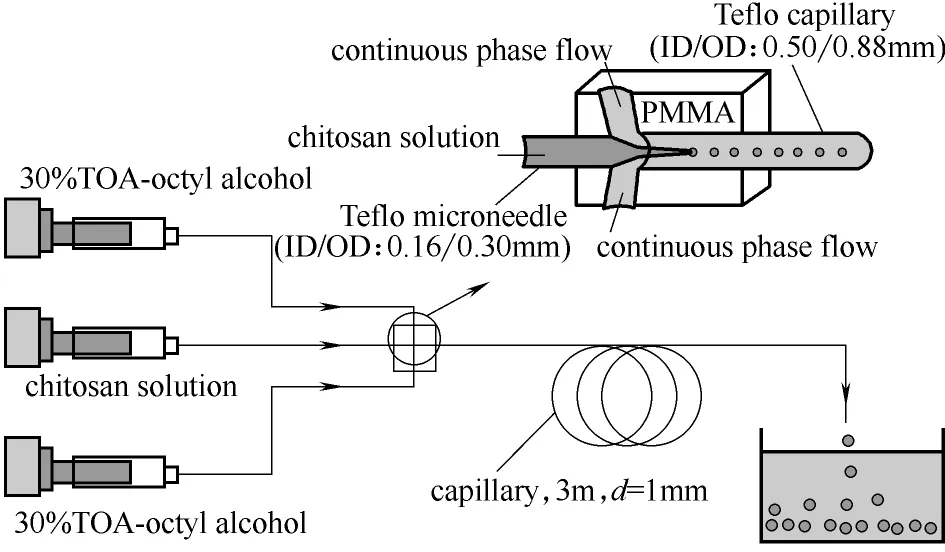
图1 同轴环管型微流控装置[7]Fig.1 Co-axial microfluidic device[7]

图2 壳聚糖微球/微胶囊的形貌Fig.2 Mophology of chitosan microspheres / microcapsules
Liu等[9]利用双重同轴环管型微通道,以2%(质量)水溶性壳聚糖和1.5%(质量) Pluronic F-127水溶液为中间相,同时加入2%(质量)羟乙基纤维素调节体系黏度,以含有2%(质量)对苯二甲醛的大豆油与苯甲酸苄酯1:2(体积比)的混合液为内相,含有8%(质量) PGPR的大豆油为外相,制备油包水包油的双重乳液。所制备得到的乳液放置12 h确保微胶囊得到彻底固化,如图2(c)所示。由于壳聚糖与对苯二甲醛之间的交联反应受pH影响,因此所得到的微胶囊具有pH响应性。在中性环境下保持微胶囊结构,当pH降低至3.1时,由于氨基更易与氢离子结合,导致氨基与醛基之间的双键打开,微胶囊壳层在122 s左右完全溶解,内核释放。该方法为油溶性药物的运载和快速释放提供了很好的基础。
Yang等[10]分别以壳聚糖水溶液和葵花籽油溶液作为分散相和连续相,在同轴环管型微通道中制备单分散的油包水乳液,并由三聚磷酸盐或硫酸盐水溶液进行收集,通过壳聚糖与盐类之间的静电作用实现交联。当含有壳聚糖液滴的葵花籽油进入收集水相时,葵花籽油由于较小的密度而位于水相上方,而由于三相界面张力的作用,壳聚糖液滴在一定程度铺展于油水界面,因此固化后即可得到半球形或圆盘形状,如图2(d)所示。通过调节水相或油相的密度以及界面张力,可以调节半球形的大小。虽然作者并未对半球形壳聚糖微球的应用进行探索,但若能分别对半球形微球的球面和平面进行不同的功能化,制备Janus结构,则有望在催化领域拓展潜在应用。
1.2壳聚糖纤维的制备
Yeh等[11]利用图3(a)中所示的水力学聚焦型微通道,分别以壳聚糖溶液和三聚磷酸钠为分散相和连续相,通过调节两相流量形成层流流动,制备得到了壳聚糖纤维,如图3(b)所示。He等[12]在双重同轴环管型微通道内,以4%(质量)的壳聚糖水溶液为中间相,50%戊二醛的水溶液为外相,20% PEG的水溶液或者有机溶剂苯甲酸苄酯为内相,利用层流流动和苯甲酸苄酯在壳聚糖相中的液滴存在形式,分别制备得到了壳聚糖管状纤维和具有豌豆荚形貌的壳聚糖纤维,如图4所示。不同形貌的壳聚糖纤维的制备,为后续的功能化和应用提供了良好的基础。
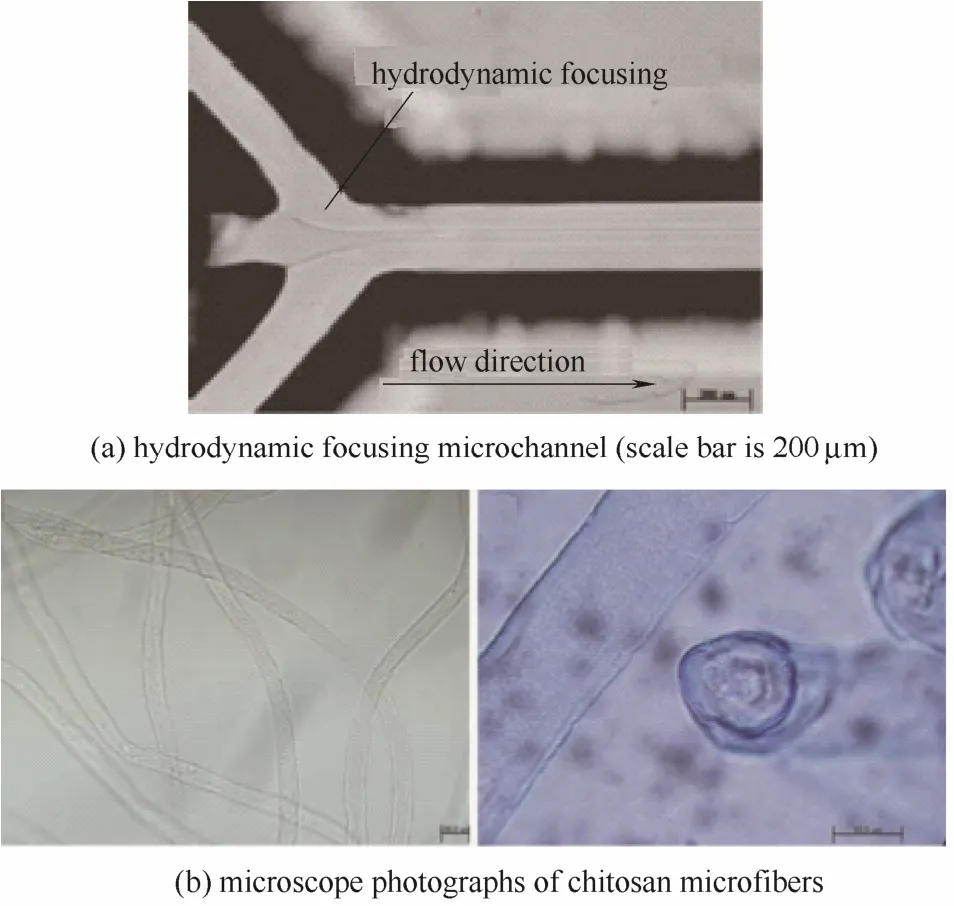
图3 微通道和壳聚糖纤维的显微照片[11]Fig.3 Microscope photographs of microchannel and chitosan microfibers[11]

图4 壳聚糖纤维SEM照片[12]Fig.4 SEM images of chitosan microfibers[12]
1.3壳聚糖膜的制备
Luo等[13]利用壳聚糖在不同pH条件下的溶解性能不同,酸性条件下溶解,中性和碱性环境下不溶,制备得到了半渗透的壳聚糖膜,其原理如图5(a)所示。以HCl调节水溶液pH约为3,将0.5%的壳聚糖溶解于其中,搅拌溶解后作为一股流体,以磷酸盐配制碱性的缓冲溶液,作为另一股流体。两股流体通过不同的形式分别导入到X形微通道中,通过两股流体之间界面的不同,制备得到了不同尺寸的壳聚糖膜,如图5(b)所示。该壳聚糖膜可以透过水溶液,且具有几纳米大小的孔,这一尺寸大小也是抗体的尺寸范围,因此,壳聚糖膜在生化、生物分析、生物传感和细胞培养等领域具有潜在的应用。但微流控装置在对复杂体系、复杂结构的调控和制备方面具有优势,而以其为平台,制备结构相对单一的壳聚糖膜是否具有优势,还有待进一步的探讨。
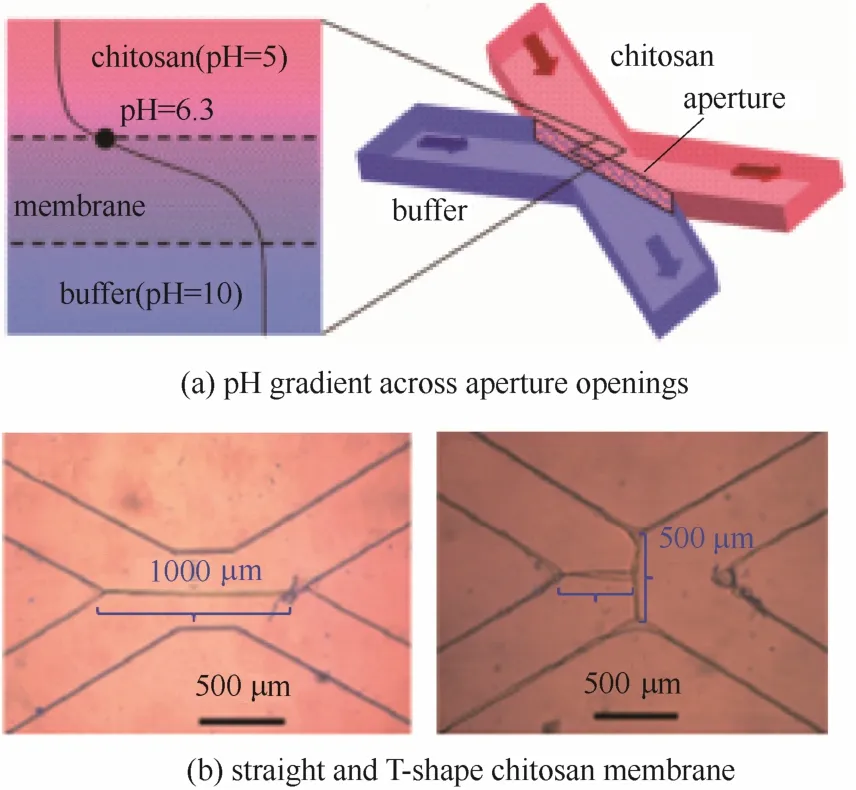
图5 壳聚糖膜的形成[13]Fig.5 Formation of chitosan membrane[13]
2 壳聚糖功能材料的应用
2.1壳聚糖材料在吸附领域的应用
壳聚糖的分子链上含有大量的氨基,因此可以螯合金属离子实现对金属离子的吸附。Zhao等[14]利用壳聚糖溶液和硅溶胶的混合液作为分散相在同轴环管型微通道中制备得到复合型微球,通过控制微球在含有戊二醛的正辛醇溶液中的停留时间,得到了具有不同孔结构和宏观形貌的复合微球,由于该复合微球的海绵状孔结构使得其具有较大的比表面积,因此利用其进行铜离子的吸附,在6 h左右即可达到吸附平衡53 mg·g−1。Xu等[15]为了提高壳聚糖微球对于铜离子的吸附性能,分别在壳聚糖分散相中加入致孔剂PEG或聚丙烯酸,通过增大比表面积或引入协同吸附剂的形式,使得微球的最大吸附容量由33 mg·g−1分别增加到52 mg·g−1和66.3 mg·g−1。He等[16]则通过离子印迹的方式,在分散相壳聚糖溶液中直接加入铅离子,制备带有铅离子印迹的壳聚糖微球,通过EDTA将作为印迹的铅离子洗掉,所得到的壳聚糖微球可以在30 min内实现79.2 mg·g−1的吸附容量。表1中列出了不同的壳聚糖微球对于金属离子的吸附性能比较,通过与非微流控方法制备的壳聚糖-纤维素复合微球以及接枝氨丙基的SBA-15进行比较可以发现,由于大量氨基的存在,壳聚糖基微球具有更优的金属离子吸附性能,而通过微流控技术对微球结构进行精确的调控,可以使其实现更好的吸附性能,且同轴环管型微通道易于进行数目放大,生产规模具有保证,因此壳聚糖基微球在废水处理、有机催化等领域具有良好的应用前景。但是以壳聚糖材料进行金属离子的吸附也存在着不可回避的不足,例如壳聚糖的生物可降解性虽然使得其具有环境友好的优势,但是当用于废水中金属离子去除时,较短的吸附寿命也限制了其应用,此外,也存在成本较高的问题。因此,通过壳聚糖与其他材料的复合,延长壳聚糖的使用寿命,降低材料成本,还有待进一步的研究。
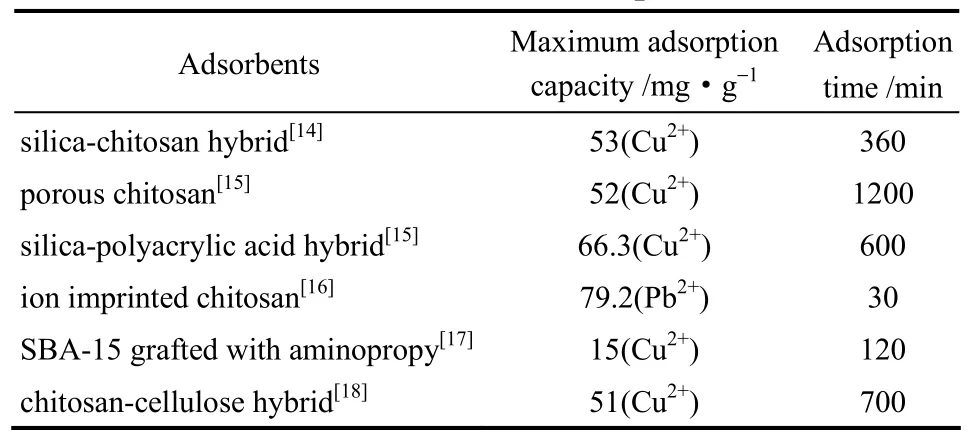
表1 不同壳聚糖微球吸附性能比较Table 1 Comparison of adsorption performance among different chitosan microspheres
2.2壳聚糖材料在催化领域的应用
基于壳聚糖对于金属离子和蛋白质的良好吸附作用,可以利用其负载金属催化剂或酶进行有机或生物催化。Zhao等[19]在双重同轴环管型微通道内,分别以壳聚糖水溶液和硅溶胶作为内部流体和中间流体,以正辛醇为外相流体,制备壳聚糖/硅凝胶核壳型复合微球,该微球具有优异的吸附性能,利用其进行Cu(I)的固定,并催化苄基叠氮和苯乙炔之间的点击反应,实现了在室温下水环境中3 h内99%的转化率,且由于壳聚糖分子上大量还原性基团羟基的存在,减缓了Cu(I)的氧化过程,催化剂循环使用多次后均可保持较高的收率。当由于催化剂被氧化而导致收率下降时,利用抗坏血酸钠对其还原,催化效果恢复。Xu等[20]利用壳聚糖与丙烯酸混合溶液作为分散相,制备单分散液滴后引发丙烯酸聚合以及壳聚糖交联,得到二者的复合微球,并进行葡萄糖异构酶的吸附固定,通过酶活实验发现,固定化葡萄糖异构酶与自由酶相比,具有更高的温度、pH稳定性,且循环使用多次后仍保持较高的酶活。这是因为壳聚糖的生物相容性,使得酶在其中易于暴露活性位点,固定化后,酶的构象被固定,因此具有更好的稳定性,这进一步证明了壳聚糖作为催化剂载体在有机催化和生物催化中的良好应用前景。
2.3壳聚糖材料在药物递送领域的应用
壳聚糖作为生物相容性、生物可降解性良好的材料,在药物递送等生物领域具有重要作用,表2中列出了壳聚糖材料在药物递送领域的研究进展。Lan等[21]在同轴环管型微通道中,以壳聚糖溶液与硅溶胶直接混合作为分散相,以含有三辛胺的正辛醇溶液作为连续相制备壳聚糖-二氧化硅的复合微球,通过凝固浴中油酸含量的调节,使得制备得到的复合微球具有不同的孔结构。由于壳聚糖与二氧化硅之间的协同作用,使得所制备得到的复合微球对于模型药物牛血清蛋白(BSA)具有更好的吸附性能,通过将微球在BSA溶液中浸泡3 d,实现了50 mg·g−1的最大吸附量。Zhao等[8]将BSA直接包埋在制备得到的不同结构的壳聚糖微球中,简化了包覆过程,同时,不同微球对于BSA具有不同的释放速度,使其可以满足不同类型药物的释放要求。Majedi等[22]将壳聚糖进行疏水改性,将其与紫杉醇溶解于酸性水溶液中作为分散相,以pH=7.4的碱性水溶液作为连续相,在水力学聚焦型微通道中形成层流流动,由于疏水改性后的壳聚糖在弱碱性环境下易于进行自组装,因此,在流动过程中,壳聚糖逐渐自组装形成微球,将紫杉醇负载在微球内部。包覆效率随着流速的增大、主体混合的增强而逐渐降低,并在约4 d内具有缓释效果。Yang等[23]在同轴环管型微通道中制备出原位包埋氨苄青霉素的单分散壳聚糖液滴,通过将液滴引入CuSO4水溶液中,利用离子诱导壳聚糖凝胶化,实现了对氨苄青霉素的快速负载。通过控制微球尺寸,得到不同的传质距离,实现了氨苄青霉素从3 h到18 h之间的不同速度的释放。壳聚糖优异的生物相容性、生物可降解性、黏膜黏附性等奠定了其在药物递送领域的优势,微流控技术的引入可以对药物包覆量、释放速度等进行精确的调控。目前壳聚糖已在很多药物中得到了实际应用,为了拓展其应用,对壳聚糖材料的尺寸以及制备过程中引入的其他物质的生物相容性等方面还需要深入优化。
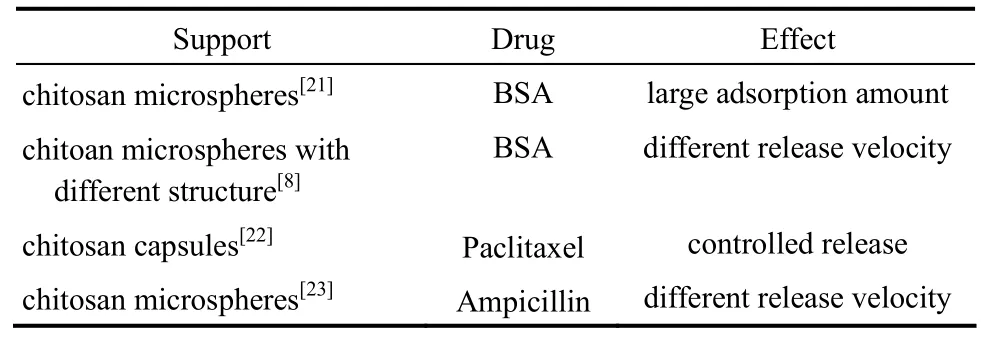
表2 壳聚糖微球在药物递送领域的应用Table 2 Applications in drug delivery of chitosan microspheres
2.4壳聚糖材料在细胞培养领域的应用
壳聚糖良好的生物相容性、机械性和细胞黏附性等,使得其广泛应用于细胞培养、组织工程、DNA纯化等领域。Lee等[24]以壳聚糖为内部流体,三聚磷酸盐为外部流体,制备得到实心的壳聚糖纤维。在壳聚糖纤维上培养HepG2细胞,HepG2细胞会自聚集成为球形,且表现出更高的肝脏特定功能,在肝组织工程领域具有潜在应用。Oh等[25]则在同轴环管型微通道中,以含有纤维细胞的磷酸缓冲溶液作为内部流体,以壳聚糖和明胶的酸性水溶液作为外部流体,通过流量调节形成层流结构,流体后续直接通入三聚磷酸钠的溶液中进行离子交联固化,形成内部直接黏附细胞的壳聚糖-明胶中空纤维,细胞成活率高达92%。在细胞培养液中培养3 d后发现,明胶的加入有利于细胞在管壁的扩散增殖。Lee等[26]则利用壳聚糖与海藻酸钙的混合液为内部流体,以CaCl2的水溶液为外部流体,形成壳聚糖-海藻酸钙的纤维。分别在纤维的壁面和纤维内部培养HepG2细胞,并与仅采用海藻酸钙纤维进行细胞培养进行比较。结果发现,在壳聚糖-海藻酸钙纤维的壁面所培养的细胞会发生自聚集,说明壳聚糖有效地提高了细胞和壁面之间的相互作用。而与在海藻酸钙纤维内部培养的细胞进行比较,在壳聚糖-海藻酸钙纤维内部的细胞具有更高的细胞活性,说明壳聚糖为细胞提供了更适宜的生长环境。这对于壳聚糖实际应用于细胞培养、细胞治疗、组织再生等领域打下了良好的基础。
3 结论与展望
微流控技术的精确可控、操作简易和高度的可重复性等在材料制备领域体现出前所未有的优势。壳聚糖作为生物相容、生物可降解、吸附性能好、成膜性好且来源广泛的材料,在诸多领域具有潜在应用。以微流控技术作为平台,实现对壳聚糖功能材料的可控制备,在传统的技术基础上进一步拓宽和优化了壳聚糖的应用。
然而,目前微流控制备壳聚糖功能材料还处于研究阶段,对于壳聚糖的尺寸、结构、形貌的调控范围还难以完全满足实际应用的需要,且复杂微通道形式下的材料调控制备还存在放大困难的问题,因此,如何在更大的范围内控制壳聚糖材料的尺寸、如何利用简单的微通道结构形式实现壳聚糖材料复杂结构的制备、如何利用壳聚糖与其他材料的复合延长其使用寿命、如何降低制备过程成本以及实现批量化可控制备等问题还有待进一步的研究。
References
[1] AGNIHOTRI S, AMINABHAVI T. Novel interpenetrating network chitosan-poly(ethylene oxide-g-acrylamide) hydrogel microspheres for the controlled release of capecitabine [J]. International Journal of Pharmaceutics, 2006, 324 (2): 103-115.
[2] BAIG R B N, NADAGOUDA M N, VARMA R S. Ruthenium on chitosan: a recyclable heterogeneous catalyst for aqueous hydration of nitriles to amides [J]. Green Chemistry, 2014, 15: 1839-1843.
[3] HAGAN K A, FERRANCE J P, LANDERS J P. Chitosan-coated silica as a solid phase for RNA purification in a microfluidic device [J]. Analytical Chemistry, 2009, 81: 5249-5256.
[4] XU J H, GE X H, CHEN R, et al. Microfluidic preparation and structure evolution of double emulsions with two-phase cores [J]. RSC Advances, 2014, 4 (4): 1900-1906.
[5] XU J H, LI S W, TAN J, et al. Correlations of droplet formation in T-junction microfluidic devices: from squeezing to dripping [J]. Microfluidics and Nanofluidics, 2008, 5 (6): 711-717.
[6] XU J H, LUO G S, LI S W, et al. Shear force induced monodisperse droplet formation in a microfluidic device by controlling wetting properties [J]. Lab on a Chip, 2006, 6 (1): 131-136.
[7] XU J H, LI S W, TOSTADO C, et al. Preparation of monodispersed chitosan microspheres and in situ encapsulation of BSA in a co-axial microfluidic device [J]. Biomed. Microdevices, 2009, 11: 243-249.
[8] XU J H, ZHAO H, LAN W J, et al. A novel microfluidic approach for monodispersed chitosan microspheres with controllable structures [J]. Advanced Healthcare Materials, 2012, 1 (1): 106-111.
[9] LIU L, YANG J P, JU X J, et al. Monodisperse core-shell chitosan microcapsules for pH-responsive burst release of hydrophobic drugs [J]. Soft Matter, 2011, 7 (10): 4821.
[10] YANG C H, HUANG K S, WANG C Y, et al. Microfluidic-assisted synthesis of hemispherical and discoidal chitosan microparticles at an oil/water interface [J]. Electrophoresis, 2012, 33(21): 3173-3180.
[11] YEH C H, LIN P W, LIN Y C. Chitosan microfiber fabrication using a microfluidic chip and its application to cell cultures [J]. Microfluidics and Nanofluidics, 2009, 8(1): 115-121.
[12] HE X H, WANG W, DENG K, et al. Microfluidic fabrication of chitosan microfibers with controllable internals from tubular to peapod-like structures [J]. RSC Advances, 2015, 5: 928-936.
[13] LUO X, BERLIN D L, BETZ J, et al. In situ generation of pH gradients in microfluidic devices for biofabrication of freestanding, semi-permeable chitosan membranes [J]. Lab on a Chip, 2010, 10 (1): 59-65.
[14] ZHAO H, XU J H, LAN W J, et al. Microfluidic production of porous chitosan/silica hybrid microspheres and its Cu(II) adsorption performance [J]. Chemical Engineering Journal, 2013, 229: 82-89.
[15] XU J H, XU X M, ZHAO H, et al. Microfluidic preparation of chitosan microspheres with enhanced adsorption performance of copper(II)[J]. Sensors and Actuators B: Chemical, 2013, 183: 201-210.
[16] LU Y C, HE J, LUO G S. An improved synthesis of chitosan bead for Pb(II) adsorption [J]. Chemical Engineering Journal, 2013, 226: 271-278.
[17] SHAHBAZI A, YOUNESI H, BADIEI H. Functionalized SBA-15 mesoporous silica by melamine-based dendrimer amines for adsorptive characteristics of Pb(II), Cu(II) and Cd(II) heavy metal ions in batch and fixed bed column [J]. Chemical Engineering Journal, 2011, 168: 505-518.
[18] LI N, BAI R. Copper adsorption on chitosan-cellulose hydrogel beads: behaviors and mechanisms [J]. Separation and Purification Technology, 2005, 42: 237-247.
[19] ZHAO H, XU J H, WANG T, et al. A novel microfluidic approach for preparing chitosan-silica core-shell hybrid microspheres with controlled structures and their catalytic performance [J]. Lab on a Chip, 2014, 14 (11): 1901-1906.
[20] XU X M, XU J H, WU H C, et al. Microfluidic preparation of chitosan-poly(acrylic acid) composite microspheres with a porous surface structure [J]. RSC Advances, 2014, 4: 37142-37147.
[21] LAN W J, LI S W, XU J H, et al. One-step synthesis of chitosan-silica hybrid microspheres in a microfluidic device [J]. Biomed. Microdevices, 2010, 12 (6): 1087-1095.
[22] MAJEDI F S, HASANI-SADRABADI M M, EMAMI S H, et al. Microfluidic assisted self-assembly of chitosan based nanoparticles as drug delivery agents [J]. Lab on a Chip, 2013, 13 (2): 204-207.
[23] YANG C H, HUANG K S, CHANG J Y. Manufacturing monodisperse chitosan microparticles containing ampicillin using a microchannel chip [J]. Biomed. Microdevices, 2007, 9(2): 253-259.
[24] LEE K H, SHIN S J, KIM C B, et al. Microfluidic synthesis of pure chitosan microfibers for bio-artificial liver chip [J]. Lab on a Chip, 2010, 10(10): 1328-1334.
[25] OH J, KIM K, WON S W, et al. Microfluidic fabrication of cell adhesive chitosan microtubes [J]. Biomed. Microdevices, 2013, 15(3): 465-472.
[26] LEE B R, LEE K H, KANG E, et al. Microfluidic wet spinning of chitosan-alginate microfibers and encapsulation of HepG2 cells in fibers [J]. Biomicrofluidics, 2011, 5 (2): 22208.
DOI:10.11949/j.issn.0438-1157.20150814
中图分类号:TQ 028.8
文献标志码:A
文章编号:0438—1157(2016)02—0373—06
基金项目:国家自然科学基金项目(21136006,21322604)。
Corresponding author:XU Jianhong, xujianhong@ tsinghua.edu.cn supported by the National Natural Science Foundation of China (21136006, 21322604).
Research progress in microfluidic preparation of chitosan functional materials
ZHAO Hong, XU Xiaomin, XU Jianhong, WANG Tao, LUO Guangsheng
(State Key Laboratory of Chemical Engineering, Department of Chemical Engineering, Tsinghua University, Beijing 100084, China)
Abstract:Much attention has been paid to chitosan functional materials due to their outstanding advantages in drug controlled release, water treatment, catalysis and so on. Recently, microfluidic technology has been developed as the novel and reliable approach for the preparation of chitosan functional materials with controllable structure and size. This paper reviews the preparation and application progress of chitosan functional materials using microfluidic technology in the past decade.
Key words:microfluidic; chitosan; structure control; functionalization

