白藜芦醇抑制血管紧张素Ⅱ诱导大鼠心脏成纤维细胞胶原合成的实验研究
西安市第一医院心内科(西安710002) 陆 艳 郭 萱
白藜芦醇抑制血管紧张素Ⅱ诱导大鼠心脏成纤维细胞胶原合成的实验研究
西安市第一医院心内科(西安710002)陆艳 郭萱
摘要目的:观察白藜芦醇对血管紧张素Ⅱ(AngⅡ)诱导的大鼠心脏成纤维细胞(CFs)胶原合成的影响,并探索可能分子机制。方法:提取新生大鼠CFs,采用免疫荧光法检测CFs纤维粘连蛋白(fibronectin)及α-平滑肌肌动蛋白(α-SMA)表达以鉴定CFs;用100 nM AngⅡ或100 nM AngⅡ加白藜芦醇(20 μM或50 μM)干预后,采用MTT法检测细胞增殖变化;采用Realtime-PCR检测各干预组CFs细胞I型胶原(Collagen I)、III型胶原(Collagen III)及TGF-β1的mRNA表达水平;Western Blotting法检测各干预组CFs、 Collagen I、Collagen III及TGF-β1的蛋白表达变化。结果:AngⅡ干预可显著促进CFs的增殖,而白藜芦醇20 μM和50μM均可呈时间依赖性抑制AngⅡ诱导的CFs增殖;AngⅡ可以促进CFs、Collagen I、Collagen III及TGF-β1的mRNA及蛋白表达水平(P<0.05);而当加入白藜芦醇后,AngⅡ所诱导的上述分子的表达无论在mRNA水平还是蛋白水平均被明显抑制(P<0.05)。结论:白藜芦醇可以抑制AngⅡ诱导的CFs增殖及胶原合成,下调TGF-β1表达可能是白藜芦醇抑制CFs胶原合成的关键机制。
主题词血管紧张素Ⅱ成纤维细胞心肌纤维化高血压@白藜芦醇
长期的高血压可以造成心脏结构重塑,导致心肌纤维化[1]。心肌纤维化病变中,由于重塑的心肌室壁僵硬,顺应性下降,导致心室舒缓功能障碍。此外,过多的间质使心肌细胞分离,使心肌细胞间的电耦联作用减弱,严重影响心脏的收缩功能。因此防治与逆转心肌纤维化已是治疗高血压心脏病的重要目标之一。心脏成纤维细胞(Cardiac fibroblasts,CFs)是构成心肌组织的主要间质细胞,约占心脏细胞总数的60%~70%。目前的研究结果显示,CFs过度活化增殖及细胞外间质(Extracellular matrix,ECM)过度沉积是造成各种心肌纤维化的主要原因[2]。在高血压情况下,机体内的肾素-血管紧张素系统(Rennin-angiotensin system,RAAS)具有高度活性,其中,血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)的水平明显增加。AngⅡ作用于心肌成纤维细胞表面的相应受体,促进转化生长因子-β1(Transforming growth factor-β1,TGF-β1)等细胞因子分泌增加,引起生长因子网络平衡紊乱,进而促进CFs合成大量胶原蛋白,同时抑制胶原的降解,造成胶原在心肌间质的大量沉积,导致心脏结构重塑和心肌细胞纤胞维化[3]。白藜芦醇是一种生物活性很强的天然多酚类物质,主要来源于虎杖、葡萄等植物,可通过降低急性脊髓损伤后的氧化应激水平,减轻脊髓炎症程度而发挥对脊髓的保护作用[4]。近年来的研究表明,白藜芦醇亦可以通过调节脂代谢、抗氧化、清除自由基、舒张血管、抗炎、抗血小板聚集等多种途径发挥心血管保护作用[5]。然而,白藜芦醇是否可以抑制高血压状态下AngⅡ诱导的心肌纤维化,目前鲜有报道。本研究中,我们拟观察白藜芦醇对AngⅡ诱导的CFs增殖及胶原合成的影响,并探索其可能的分子机制。
材料和方法
1材料①实验动物:新生48 h内Wistar大鼠6只由西安交通大学动物实验中心提供。雌雄不限,体重16.10 ±1.02 g。动物质量合格证号:陕医动证08005号。②药物与试剂:白藜芦醇(纯度> 99%)购自美国Sigma公司,用二甲基亚砜(DMSO)将其溶解成50 mmol/L贮存液,置-20℃保存。 DMEM/F12培养基购自北京博奥森公司;胎牛血清为澳大利亚Hyclone公司产品;青霉素、链霉素、AngⅡ均购自美国Sigma公司;Trizol购自美国Invitrogen 公司;逆转录试剂盒及Realtime-PCR试剂盒购自大连宝生物工程(TaKaRa)有限公司;所需引物由上海生物工程技术服务有限公司负责设计合成;RIPA蛋白裂解液购自上海申能博彩生物科技公司;TGF-β1 ELISA试剂盒购自上海轩昊生物公司;兔抗鼠I型胶原(Collagen I)及III型胶原(Collagen III)多克隆抗体购自美国Abcam公司;兔抗鼠TGF-β1、β-actin抗体购自美国Santa公司。
2方法 ①细胞培养:按照参考文献[6]在无菌条件下提取大鼠原代心肌成纤维细胞。具体方法如下:将出生48 h内Wistar大鼠以颈椎牵引法处死后,酒精消毒后在无菌条件下取出乳鼠心室并剪碎成约0.5mm3大小,加入适量0.25%胰蛋白酶并吹打混匀后于37℃消化组织块约30min,血清终止消化,200目筛网过滤。收集细胞悬液,于1000 r/min离心10 min,弃上清,将细胞重悬于含20%胎牛血清(FBS)、100 U/ml青霉素、100μg/ml链霉素的DMEM/F12培养基,接种于25cm2培养瓶中,置入37 ℃,含5%CO2孵箱中培养,每3 d换液1次,细胞生长近融合时传代。用免疫荧光法检测纤维粘连蛋白(fibronectin)及α-平滑肌肌动蛋白(α-SMA)表达,经鉴定证实为CFs后用于后续实验,本实验所用CFs均为2~3代细胞。②细胞分组及干预:在mRNA及蛋白水平检测,细胞处理按以下分组:正常对照组(Normal组):未加干预;100 nM血管紧张素Ⅱ单独干预组(AngⅡ组); 100 nM血管紧张素Ⅱ加20 μM白藜芦醇干预组(AngⅡ+ Res组)。③MTT检测细胞增殖:取对数生长期的CFs细胞制成细胞悬液,以每孔3×103个细胞于96孔板中接种CFs细胞,待细胞贴壁后,加0.1%FBS的DMEM/F12培养基过夜饥饿处理。将饥饿后的CFs分成以下4组:正常对照组(Normal组)、100 nM AngⅡ单独干预组(AngⅡ组)、100 nM AngⅡ加20 μM白藜芦醇干预组(AngⅡ+ 20 μM Res组)及100 nM AngⅡ加50μM白藜芦醇干预组(AngⅡ+ 50μM Res组)干预后继续培养12 h、24 h、48 h。上述干预时间点到底后,每孔加入MTT溶液10 μl(浓度5 mg/ml),继续于培养箱中培养4 h后弃去上清,每孔再加入DMSO溶液200 μl,当出现蓝紫色颗粒结晶并充分溶解后,检测OD(490nm)值。实验重复3次,计算各组细胞平均OD490值。④Realtime-PCR检测相关基因的mRNA表达:干预细胞24 h后按Trizol法提取细胞总RNA。用Taka逆转录试剂盒进行逆转录操作,得到的cDNA用于Realtime-PCR扩增。PCR反应体系为20 μl,其中含有:2 μl逆转录产物(cDNA),上游与下游引物各1 μl,2×SYBY green PCR Master 10 μl,用ddH2O水补足体积至20 μl。PCR反应条件如下:95℃预变性5min;95℃变性30 s,58℃退火30 s,74℃延伸30 min,共40个循环;74℃延伸10 min以终止反应。以GAPDH作为内参照,每组设置3个复孔。Real-time PCR反应完成后,待测基因的表达水平通过∆∆CT计算方法进行定量表达。△△CT =实验组(CT目的基因- CTGAPDH)-对照组(CT目的基因-CTGAPDH)。扩增用目的基因引物见附表。⑤目的蛋白Western blot检测:干预48h后用RIPA细胞裂解液提取细胞总蛋白。获得的样品采用BCA法进行浓度测定。加入上样缓冲液至样品于70℃变性30min。取30 μg各组蛋白样品上样后进行SDS-PAGE电泳。电泳完成后,采用湿转膜法将蛋白转移至PVDF膜;用含10%脱脂奶粉的PBST封闭液室温封闭膜2h,随后将膜用一抗稀释液4℃孵育过夜。次日取出膜用PBS漂洗后加二抗稀释液(1∶5000)将膜室温孵育2 h。以PBS洗膜,膜上覆盖发光液,利用凝胶图像分析系统进行照相。获得的条带密度利用Quantity One v4.61图片分析软件进行定量分析,以GAPDH为内参照,以各组细胞目的蛋白与自身GAPDH灰度值的比值作为目的蛋白的相对含量。⑥细胞免疫荧光实验:将CFs细胞接种至6孔板于37℃含5%CO2的培养箱中常规培养,待细胞长至合适密度,取出培养板,以4%多聚甲醛固定细胞。用含0.5% Triton X-100的PBS溶液孵育细胞5 min后用1%牛血清白蛋白封闭细胞1 h。再用0.5% Triton X-100溶液制备一抗孵育液(fibronectin,1∶200;α-SMA,1∶150)4℃孵育细胞过夜。次日吸出一抗孵育液,用PBS漂洗后加入0.5% Triton X-100溶液配制的荧光二抗溶液,避光条件下室温孵育1 h。孵育结束后用1 μg/ml DAPI稀释液孵育细胞5min,完成上述孵育过程的细胞用PBS漂洗后,于暗室内应用荧光显微镜以合适波长的光进行激发,并照相,获取实验结果。
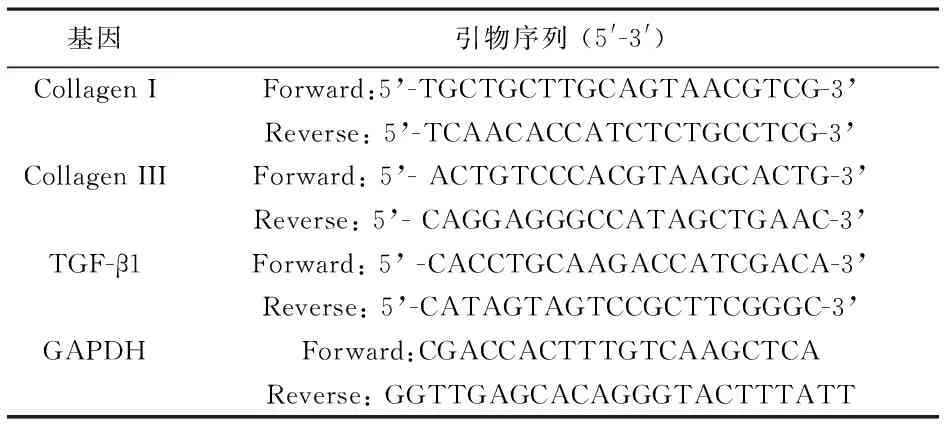
附表 引物设计序列
3统计学方法以上所有实验均至少重复3次。全部实验数据经均应用SPSS 18.0统计软件进行统计分析,计算得到的所有数据以均数±标准差表示,组间比较采用one-way ANOVA方差分析,以α=0.05为显著性检验水准。
结果
1大鼠CFs鉴定提取的细胞置于倒置相差显微镜下观察,细胞呈梭形或多边形,胞质透明,核呈椭圆形,内含2~3个核仁(图1A)。免疫荧光染色显示,提取的细胞呈现fibronectin染色阳性和α-SMA染色阴性(图1D),符合文献所述CFs特征。
2白藜芦醇抑制AngⅡ诱导的大鼠CFs增殖采用MTT法评估白藜芦醇(Res)对AngⅡ诱导的大鼠CFs增殖性的影响。结果如图2所示,加入AngⅡ(100nM)后,培养12h、24h、48h后,CFs细胞的增殖能力明显增强,与正常对照组(Normal组)相比,差异显著(P<0.05)。然而,当加入白藜芦醇(20μM)后,各组细胞的OD490值明显下降(P<0.05),说明白藜芦醇对AngⅡ诱导的CFs增殖有抑制作用。随着白藜芦醇浓度增加,抑制作用越明显,呈现剂量依赖性。这些结果说明,白藜芦醇可以抑制AngⅡ对CFs增殖的促进作用。
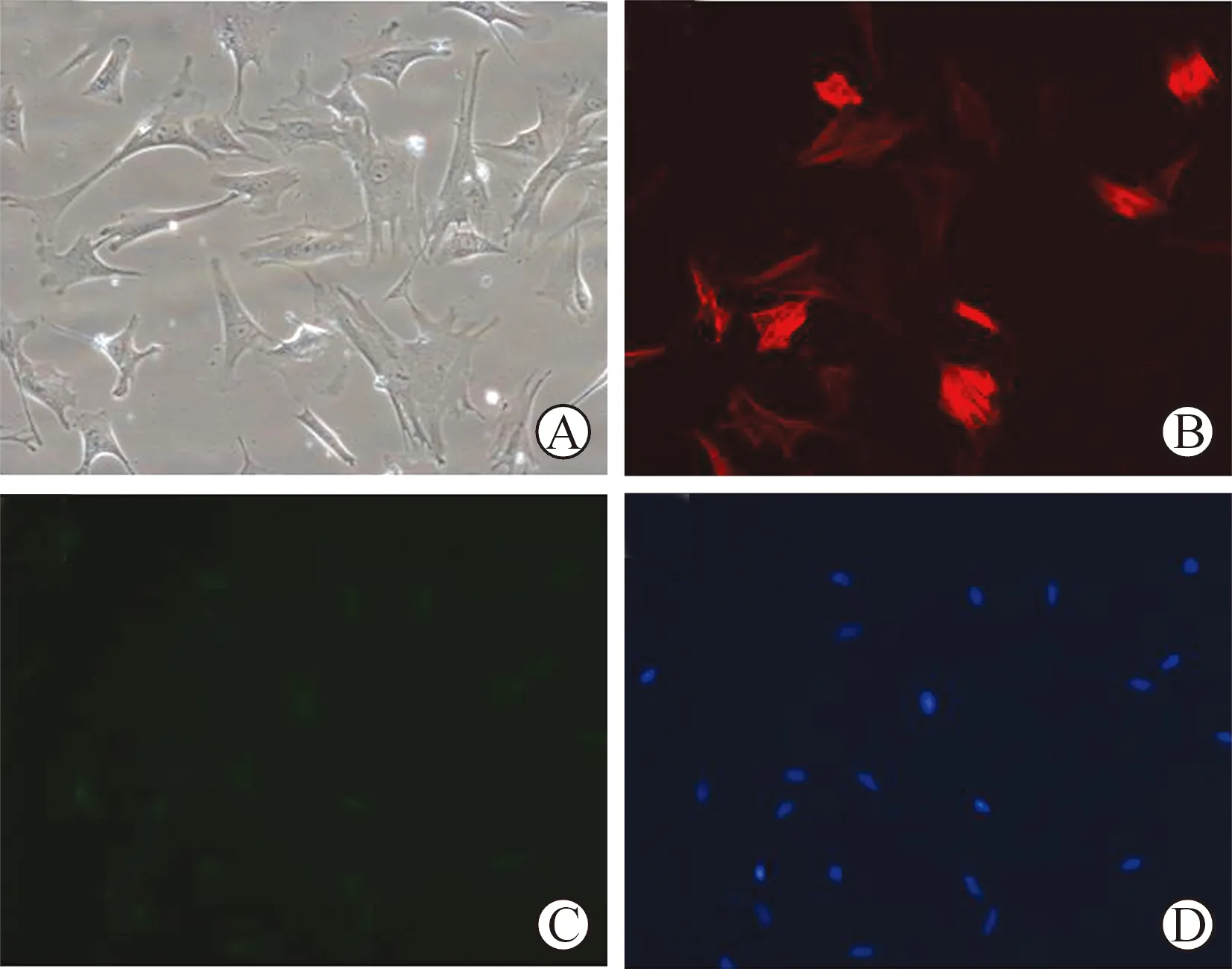
A光学显微镜下,由大鼠心肌组织中提取后第3天的CFs;B 免疫荧光法检测fibronectin表达;C 免疫荧光法检测α-SMA表达;D 免疫荧光DAPI染色
图1原代大鼠CFs的提取与鉴定(×200)
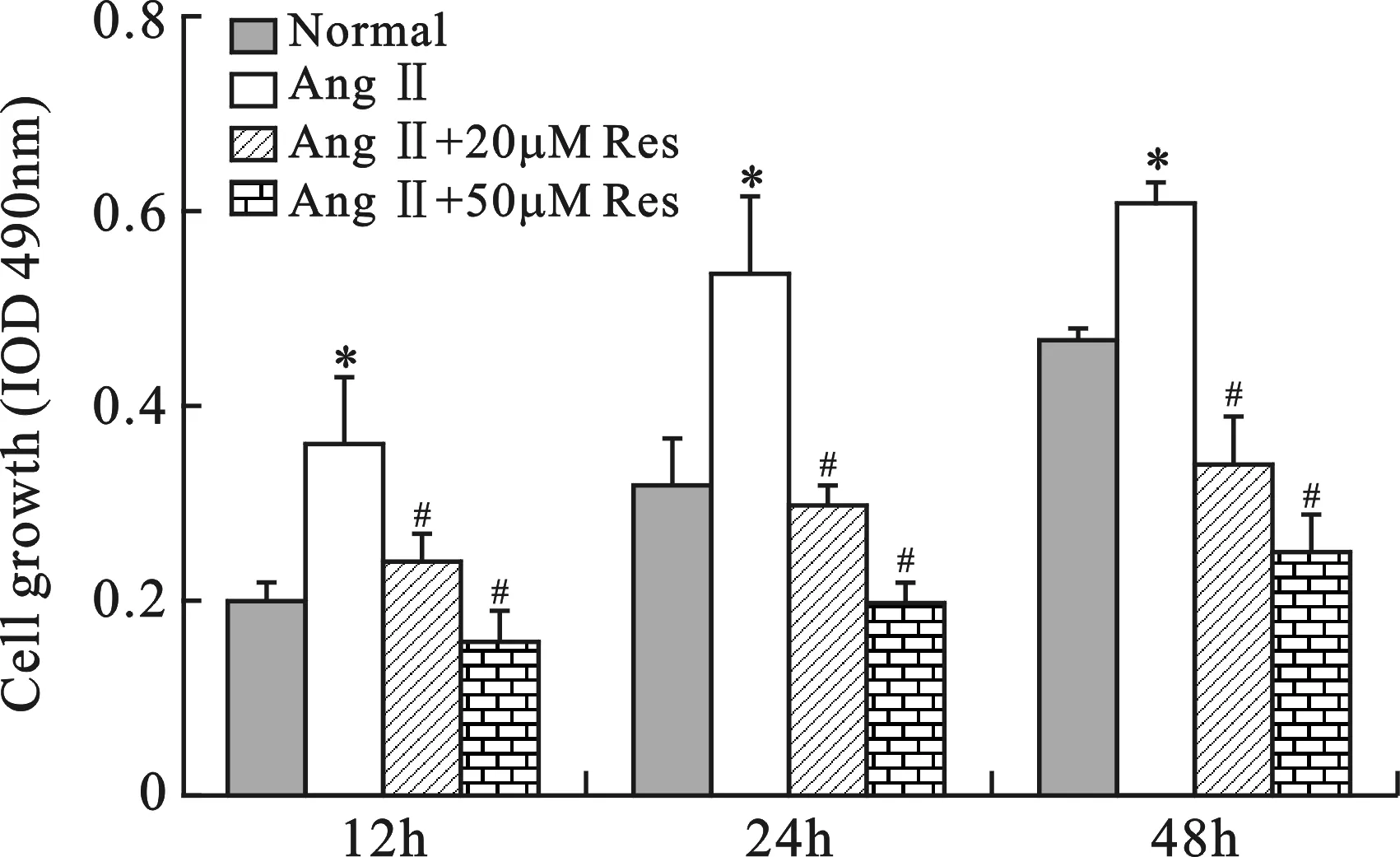
与各时间点Normal组比较, *P<0.05;与各时间点AngⅡ组比较,#P<0.05
图2白藜芦醇对AngⅡ诱导的大鼠CFs增殖的影响
3白藜芦醇抑制AngⅡ诱导的大鼠CFs胶原合成用AngⅡ或AngⅡ加白藜芦醇(AngⅡ+ Res)干预CFs细胞24 h,提取细胞总mRNA,通过Realtime-PCR技术检测I型胶原(Collagen I)及III型胶原(Collagen III)mRNA的表达变化。结果如图3所示,与未干预对照组(Normal)相比,100 nmol/L AngⅡ干预可以显著促进CFs 的I型胶原和III型胶原的mRNA表达水平(P<0.05)。然而,加入白藜芦醇(20 μM)后,I型胶原和III型胶原的mRNA表达水平显著降低,与AngⅡ单独干预组相比,差异有统计学意义(P<0.05)。

与对照组比较,* P<0.05,与AngⅡ组比较,#P<0.05
图3Realtime-PCR检测白藜芦醇对AngⅡ诱导的
大鼠CFs胶原mRNA表达的影响
4白藜芦醇抑制AngⅡ诱导大鼠CFs TGF-β1表达Realtime-PCR技术检测各组细胞TGF-β1的表达水平。结果如图4所示,AngⅡ(100 nmol/L)干预可以增加CFs TGF-β1的mRNA表达水平,与未干预对照组相比差异显著(P<0.05)。
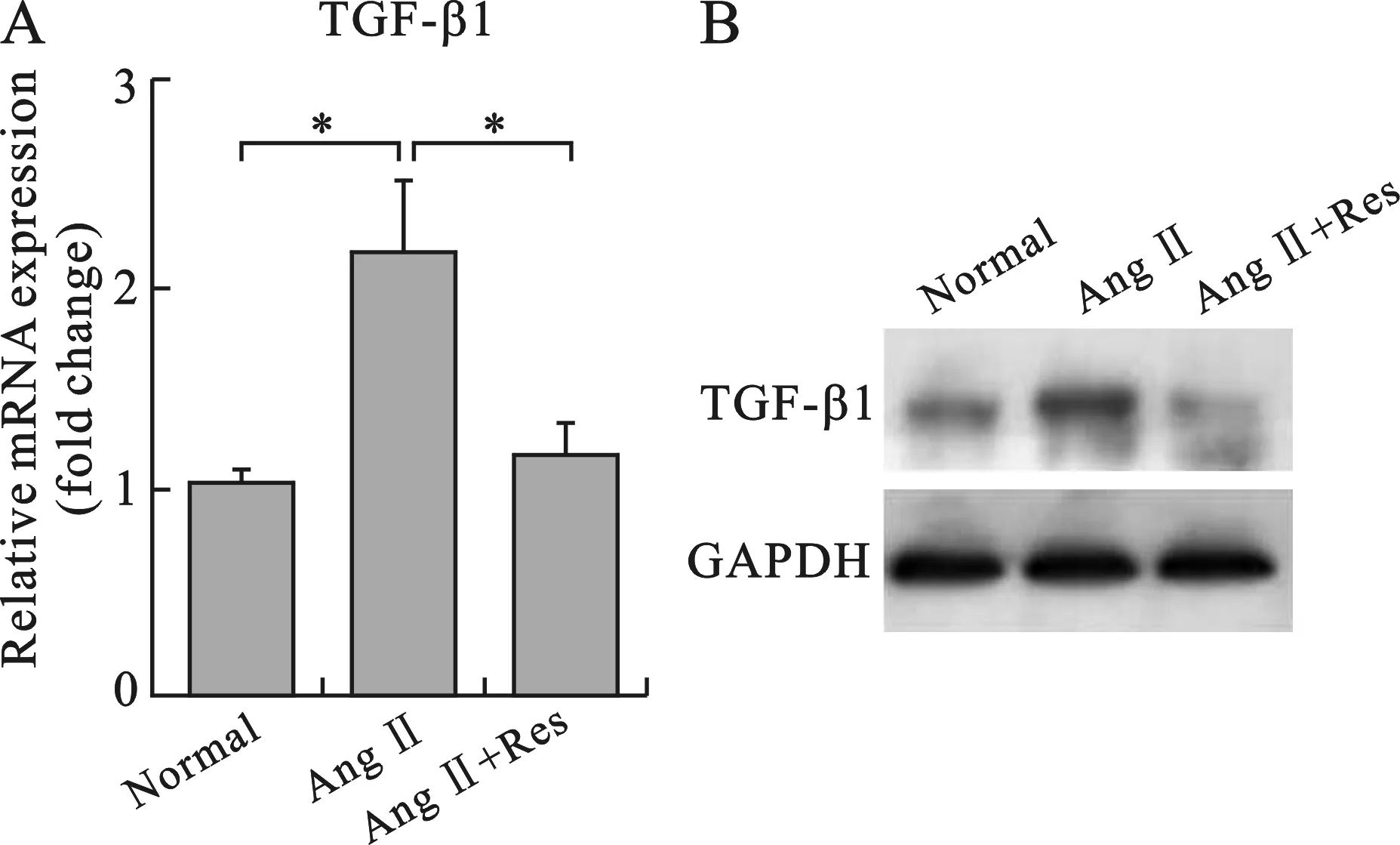
与对照比较,*P<0.05
讨论
正常心肌组织约2/3由非心肌细胞构成。而在非心肌细胞中,CFs占绝大多数。在正常生理情况下,CFs参与心脏ECM的产生,与心脏的发育、结构及功能密切相关。然而,在高血压、心肌炎、风湿性心脏病、慢性心肌缺血等病理情况下,CFs受到损伤因素的刺激发生过度增殖,且ECM合成增加。CFs的过度增殖并产生大量胶原蛋白等ECM成分是导致各种心肌纤维化的主要原因[7]。在高血压性心脏病中,一方面,心肌细胞代偿性增生肥大,另一方面,心肌细胞周围的CFs大量增殖活化,分泌过量的胶原到心肌间隙,且胶原等间质成分降解减少,以上两方面原因造成心肌结构重塑及心肌纤维化,导致心脏的舒张和收缩功能障碍,最终导致心力衰竭。因此,抑制高血压等病理情况下CFs的过度增殖及活化可能是治疗或减缓心脏纤维化的有效治疗策略。
高血压患者体内的激素水平的主要变化体现为RAAS的过度激活。其中,AngⅡ的血浆水平增加是高血压患者RAAS活化的主要标志之一,也是导致高血压患者心脏、肾脏等器官相关并发症的罪魁祸首[8]。越来越多的证据表明,Ang II参与了高血压患者的心肌结构重塑[9]。有资料[10]显示,Ang II可以诱导CFs的增殖,更为重要的是,在Ang II的作用下,CFs的MAPK信号通路发生活化,胞内DNA合成加速,TGF-β1等与组织纤维化密切相关的细胞因子的合成和分泌水平也增加,而纤溶酶原激活物阻滞因子等促进ECM降解的分子产生减少,以上几方面因素共同促进心肌纤维化的发生。
TGF-β1属于转化生长因子-β超家族蛋白成员。TGF-β1已被认为是导致各种器官纤维化的共同细胞因子之一。在各种病理因素刺激下,心肌细胞及CFs长生大量的TGF-β1等细胞因子,并分泌到组织间隙中。TGF-β1通过与CFs表面相应的受体结合,磷酸化激活TGF-β1信号通路下游的Smad2/3,通过影响靶基因的表达最终促进CFs的增殖及活化。抑制CFs的TGF-β1信号通路则可以组织心肌纤维化,改善心肌的舒缓功能。我们的结果显示,白藜芦醇可以抑制CFs的增殖,并减少其胶原蛋白的合成。进一步的研究发现,白藜芦醇可以显著下调CFs促纤维化细胞因子TGF-β1的表达,这可能是其发挥上述作用的重要机制。
总之,白藜芦醇可能通过减少CFs TGF-β1的产生而抑制Ang II诱导的CFs的增殖和胶原合成。在体内实验中,白藜芦醇是否可以抑制高血压所介导的动物心肌纤维化,值得进一步研究。
参考文献
[1]Eschalier R,Rossignol P,Kearney-Schwartz A,etal. Features of cardiac remodeling, associated with blood pressure and fibrosis biomarkers, are frequent in subjects with abdominal obesity[J]. Hypertension,2014,63(4):740-746.
[2]Krenning G,Zeisberg EM,Kalluri R.The origin of fibroblasts and mechanism of cardiac fibrosis[J]. J Cell Physiol,2010,225(3): 631-637.
[3]Cottart CH,Nivet-Antoine V,Beaudeux JL.Review of recent data on the metabolism, biological effects, and toxicity of resveratrol in humans[J]. Mol Nutr Food Res,2014,58(1):7-21.
[4]王广生,王菲,强辉,等. 白藜芦醇抗氧化应激效应对大鼠脊髓损伤组织的保护[J].陕西中医,2011,32(1): 111-113.
[5]Ma F,Li Y,Jia L,etal. Macrophage-stimulated cardiac fibroblast production of IL-6 is essential for TGF beta/
Smad activation and cardiac fibrosis induced by angiotensin II[J]. PLOS ONE,2012,7(5): e35144.
[6]Xu J,Carretero OA,Liao TD,etal. Local angiotensin II aggravates cardiac remodeling in hypertension[J]. Am J Physiol Heart Circ Physiol,2010,299(5):1328-1338.
[7]Leask A. TGFbeta, cardiac fibroblasts, and the fibrotic response[J]. Cardiovasc Res,2007,74(2): 207-212.
[8] Li J, Qu X,Ricardo SD,etal.Nikolic-Paterson, Resveratrol inhibits renal fibrosis in the obstructed kidney: potential role in deacetylation of Smad3, Am. J. Pathol[J].2010,177:1065-1071.
[9] Hamdaoui N,Baudoin-Legros M,Kelly M,etal.Resveratrol rescues cAMP-dependent anionic transport in the cystic fibrosis pancreatic cell line CFPAC1[J]. Br J Pharmacol,2011,163:876-886.
[10]Akgedik R,Akgedik S,Karamanli H,etal.Effect of resveratrol on treatment of bleomycin-induced pulmonary fibrosis in rats[J]. Inflammation,2012,35:1732-1741.
(收稿:2015-12-09)
【中图分类号】R542.23
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.06.006

