小鹅瘟病毒W株的分离与鉴定
苗玉和,陈生雷,刘 全,刘艳霞,夏春雷,舒秀伟
(1.辽宁益康生物股份有限公司,辽宁 辽阳 111000 2.辽宁省动物卫生监测预警中心,辽宁 沈阳 110001)
小鹅瘟病毒W株的分离与鉴定
苗玉和1,陈生雷1,刘 全2,刘艳霞1,夏春雷1,舒秀伟1
(1.辽宁益康生物股份有限公司,辽宁 辽阳 111000 2.辽宁省动物卫生监测预警中心,辽宁 沈阳 110001)
从山东省潍坊某鹅场病死雏鹅的心、肝和脾等组织中分离到一株病毒,通过12日龄鹅胚进行病毒分离,并对分离病毒进行致病性试验、鹅胚中和试验、琼脂扩散试验及分子生物学鉴定等。结果证明,所分离的病毒为小鹅瘟病毒,命名为W株。
小鹅瘟病毒;分离;鉴定
小鹅瘟是由小鹅瘟病毒(Goose plague virus),即鹅细小病毒(Goose parvovirus,GPV)引起,主要侵害20日龄以内小鹅和雏番鸭的一种急性、高度接触性、败血性传染病。该病传染性强、病程短且死亡率高,发病率和死亡率可达90%~100%,在我国各地均有流行,是严重威胁养鹅业健康发展的一种传染病。20世纪50年代,我国学者方定一在江苏扬州首次发现、分离出病原并将其命名为小鹅瘟病毒。
2008年,在山东潍坊一养鹅场发生疑似小鹅瘟的病例。在鹅群起初为零星发病,2 d后在鹅群中大面积流行,发病的雏鹅为3日龄。1 357只雏鹅中发病1 082只,死亡396只,发病率约为79.7%,致死
率为100%。病鹅主要表现精神沉郁,行走缓慢,饮欲和食欲下降,鼻腔和口腔流出无色液体;排白色或淡黄色稀粪,肛门四周沾有稀粪。病鹅离群,渐进性消瘦,发病后1~2 d死亡。濒死期病鹅饮食废绝,呼吸困难,口、鼻流出无色液体,扭头,倒地抽搐而死。病死鹅心肌及冠状脂肪有针尖状出血点,十二指肠弥漫性出血,肠腔膨大,肠壁变薄;盲肠有香肠样栓;肾肿胀,呈黑红色,表面有针尖状出血点。采集病死鹅的心、肝、脾等组织,进行小鹅瘟病毒的分离,并进行了各项鉴定和检验。
1 材料与方法
1.1 材料
1.1.1 病料 5日龄病死鹅心、肝、脾组织。
1.1.2 鹅胚和雏鹅 购自辽宁省豁鹅原种场,所选用的鹅场未注射过小鹅瘟疫苗,未发生过小鹅瘟,血清及卵黄抗体经小鹅瘟琼扩抗体效价测定为阴性。
1.1.3 小鹅瘟阳性血清 由南京农业大学惠赠,其琼扩效价为1:16。
1.1.4 阳性血清 新城疫、鸭病毒性肝炎、番鸭细小病毒、鸭瘟病毒等阳性血清,购自中国兽医药品监察所和福建省农业科学院。
1.1.5 培养基 普通琼脂平板、巧克力琼脂平板、麦康凯琼脂平板、厌氧内汤,均为辽宁益康生物股份有限公司制备。
1.1.6 试剂 DNA提取试剂盒购自天根生化科技(北京)有限公司、2.5 mmol/L dNTP、Marker2000均购自TaKaRa公司;其他试剂均为国产分析纯。
1.1.7 引物 根据GenBank上公布的鹅细小病毒B株全基因序列,针对GPV的VP3的保守基因设计了1对引物,引物序列为:
GPV-F:5´-GTGCCGATGGAGTGGGTAATGC-3´
GPV-R:5´-ATGGTGCCTTCCGTAGCCGAG-3´
扩增片段长度为436 bp。引物合成均由英潍捷基(上海)贸易有限公司完成。
1.2 方法
1.2.1 细菌分离 以无菌操作从发病雏鹅的肝、脾、肾取样接种于普通琼脂平板、巧克力琼脂平板、麦康凯琼脂平板,分别于37℃ CO2培养箱和37℃恒温箱中培养72 h,观察培养结果。同时取病死雏鹅的心血、肝脏触片,革兰氏染色,镜检。
1.2.2 病毒分离 无菌采取发病雏鹅的脑、肝、脾、肾等器官,用生理盐水制成1:5悬液,反复冻融3次,以2 500 r/min离心10 min,上清液加1 000 IU/mL青链霉素,37℃作用30 min,用0.22 μm滤膜过滤除菌,-20℃结冻保存备用。
1.2.2.1 鹅胚增殖病毒 取12日龄易感鹅胚10枚,每枚尿囊腔内接种0.3 mL过滤病毒液,接种后置37℃孵化箱孵化,每日照胚2次,观察216 h,72 h以前死亡的胚胎弃掉,72 h以后死亡的胚胎取出置2~8℃冷却4~24 h,无菌收取尿囊液,同时观察胚体病变,尿囊液作无菌检验和病毒含量测定。合格后-20℃保存备用。将分离的病毒命名为W株。
1.2.2.2 毒力 将收获的鹅胚病毒液用生理盐水进行1:100稀释,皮下注射5日龄易感雏鹅各10只,每只1.0 mL,设10只为对照组,皮下注射生理盐水1.0 mL,同条件下隔离饲养,观察10 d,记录雏鹅死亡情况。
1.2.3 特异性鉴定
1.2.3.1 琼脂扩散试验 常规方法制备琼脂板,中央孔加入处理好的鹅胚尿囊液,周围孔依次加小鹅瘟阳性血清、新城疫阳性血清、鸭病毒性肝炎阳性血清、番鸭细小病毒阳性血清、鸭瘟阳性血清和健康鹅血清。置湿盒中37℃观察24~48 h,记录结果。
1.2.3.2 中和试验 将鹅胚尿囊液毒分别加入5倍的新城疫病毒阳性血清、鸭瘟病毒阳性血清、小鹅瘟阳性血清、鸭病毒性肝炎阳性血清、番鸭细小病毒阳性血清混合均匀后,置37℃中和1 h,尿囊腔内接种12日龄鹅胚各10枚,每胚0.3 mL,观察216 h,记录鹅胚死亡情况。
1.2.4 分子生物学鉴定 取收获的W株鹅胚尿囊液进行病毒DNA的提取,以提取得DNA为模板进行PCR反应,反应体系为:Taq酶0.13 μL,10×PCR Buffer(含MgCl2)2.5 μL,2.5 mmol/L dNTP 2 μL,上游引物和下游引物分别1 μL,小鹅瘟病毒DNA 5 μL,ddH2O 13.37 μL。反应程序:95℃预变性3 min;95℃变性30 s,58℃退火30 s,72℃延伸30 s,进行30个循环;72℃延伸10 min。反应结束后取产物进行1.0%琼脂糖凝胶电泳鉴定。
取鉴定阳性的PCR产物送宝生物(大连)公司进行测序,测序结果采用DNASTAR软件进行分析。
2 结果与分析
2.1 细菌培养 将病死鹅心血、肝脏涂片、染色、镜检未观察到细菌;病料在普通琼脂平板、巧克力琼脂平板、麦康凯琼脂平板上培养3 d,均无细菌生长。
2.2 病毒增殖 将过滤的病毒组织悬液接种鹅胚,在接种后72~192 h,鹅胚19/20死亡。48 h死亡的1枚弃掉不计,剩余19枚死亡鹅胚分别收取尿囊液并剖检胚体,观察病变。剖检胚体尿囊膜增厚;头部和两胁皮下水肿;死亡胚体充血和出血,尤其在翅尖、两蹊、喙旁、颈部等处均有严重的出血点;胚肝充血,呈黄褐色;心脏和小脑出血,收获的E1代尿囊液病毒含量为105.12ELD50/0.3 mL。
2.3 雏鹅接种试验 将E1病毒液接种5日龄雏鹅,在接种后第2天开始发病,7 d内死亡9只。发病雏鹅精神萎顿,食欲减退,直至废绝,鼻腔有黏液,排出绿色混有气泡粪便;剖检注射后2 d死亡雏鹅,仅见肠黏膜严重充、出血,肝、脾微肿;注射后第5天死亡雏鹅,小肠黏膜脱落,凝固,剖开回盲部见有灰白色栓子,质地坚硬,将肠腔堵塞;胆囊膨大充满胆汁,肝脏呈黄色,心冠状脂肪有针尖大小点状出血。耐过雏鹅生长缓慢,发育不良;对照组雏鹅健康,未出现临床症状。雏鹅死亡结果见表2。

表1 鹅胚死亡结果Table1 The results of goose embryo death
从表2结果可以看出,分离的小鹅瘟病毒鹅胚尿囊液E1代病毒注射5日龄雏鹅9/10死亡,对照组10/10健活。
2.4 病毒鉴定

表2 鹅胚尿囊液接种雏鹅死亡情况Table2 The results of inoculation of goose embryo allantoic fluid of goslings death
2.4.1 在琼脂扩散试验中,待检病毒抗原与小鹅瘟阳性血清间出现清晰白色沉淀线,而与新城疫阳性血清、鸭病毒性肝炎阳性血清、番鸭细小病毒阳性血清、鸭瘟病毒阳性血清和健康鹅血清均未出现沉淀线。
2.4.2 分离的小鹅瘟病毒与各阳性血清中和后接种鹅胚,结果见表3。
从表3结果可以看出,鹅胚尿囊液毒可被小鹅瘟阳性血清中和,但不能被新城疫阳性血清、鸭瘟病毒阳性血清、鸭肝炎病毒阳性血清、番鸭细小病毒阳性血清中和。
2.5 分子生物学鉴定 根据GenBank上公布的鹅细小病毒B株全基因序列,针对GPV的VP3的保守基因设计了1对引物GPV-F/GPV-R经PCR扩增后得到436 bp目的片段,结果见图1。测序结果通过NCBI BLAST后,与小鹅瘟病毒序列比对,该分离病毒与国内GDa株,SH株同源性为100%,与国外分离株B株同源性为95%。进一步确定该病毒株为鹅细小病毒毒株。
3 讨论与小结
3.1 采用山东潍坊某鹅场发病鹅病料接种12日龄鹅胚,经雏鹅回归试验、琼脂扩散试验、鹅胚中和试验,结果显示,该病毒能引起雏鹅发病,能被小鹅瘟病毒阳性血清中和,不被新城疫病毒、鸭瘟病毒、鸭肝炎病毒和番鸭细小病毒等抗血清中和。证明该分离病毒为小鹅瘟病毒,鹅胚尿囊液病毒含量为105.12ELD50/0.3 mL。
3.2 通过PCR检测、基因测序与分析,所分离的病毒基因序列与GenBank上公布的鹅细小病毒基因序列比对,基因同源性达95%以上。证明该分离株为小鹅瘟病毒,将其命名为W株。
3.3 对小鹅瘟的预防主要是采用疫苗进行免疫,目前广泛使用的是小鹅瘟鹅胚化活疫苗,然而,随着预防接种的母鹅越来越多,鹅胚化疫苗株不断通过和适应于母鹅而增强毒力,同时由于水禽免疫的复杂性,母鹅的免疫效果十分不理想,雏鹅产生的母源抗体有限,不能有效抵抗小鹅瘟病毒的感染,初生雏鹅往往需要采用抗体制剂进行预防和治疗。小鹅瘟病毒W株的分离鉴定,为进一步研制针小鹅瘟的抗体制剂、疫苗等工作奠定了基础。
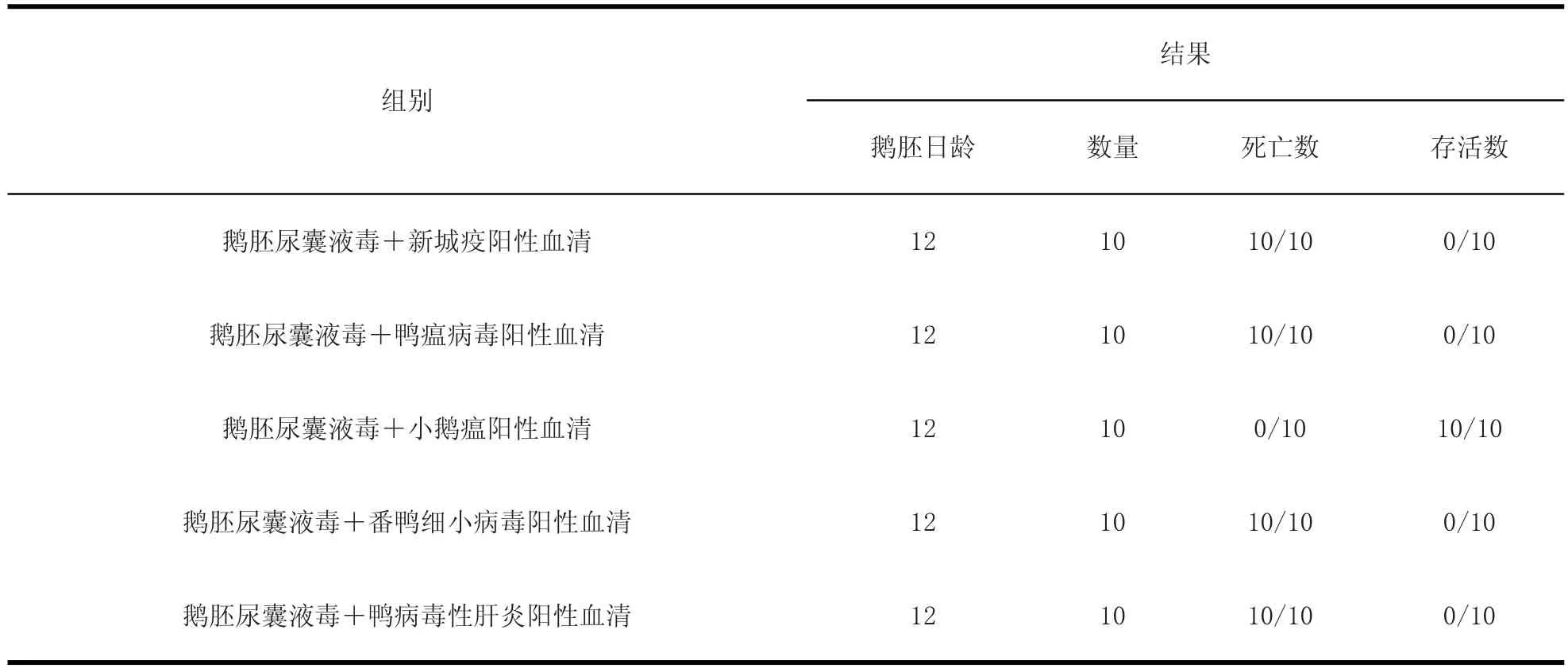
表3 中和试验结果Table3 The results of neutralization test
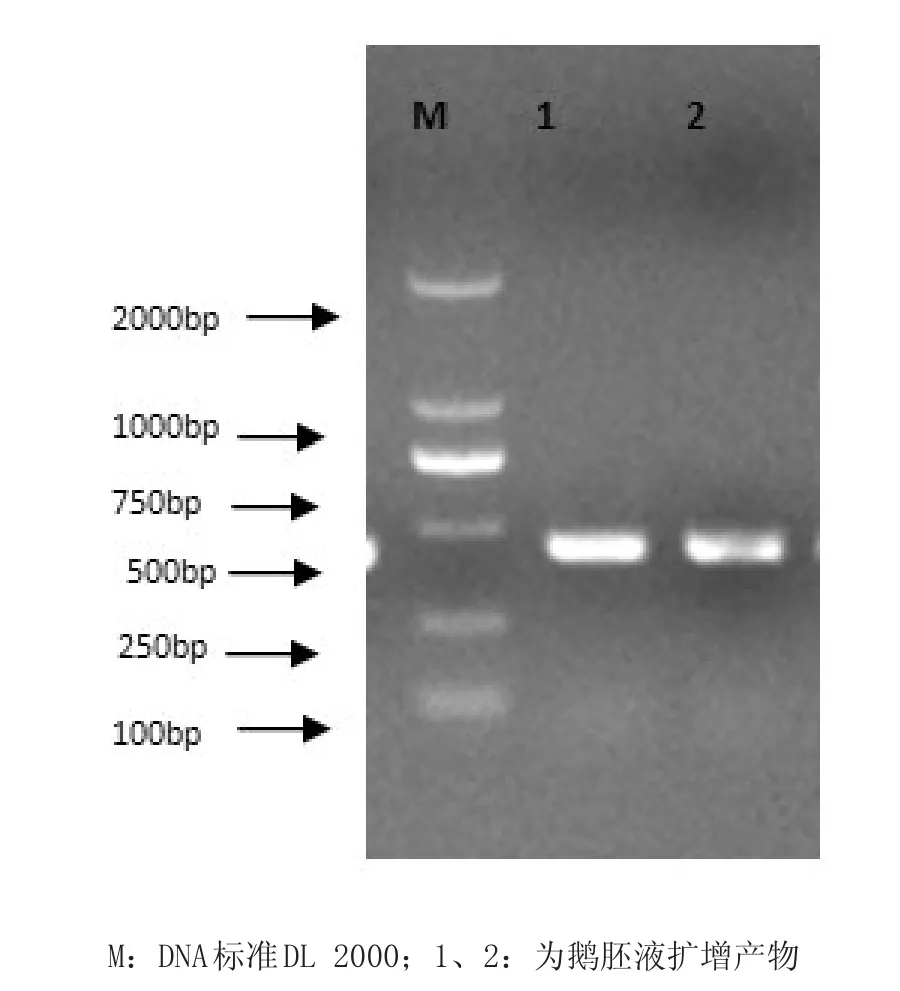
图1 病毒液PCR扩增结果Fig.1 PCR amplification results of Virus
[1]方定一.小鹅瘟的介绍[J].中国兽医杂志,1962,8:19-20.
[2]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:1165-1168.
[3]李桂霞,刘胜旺,孔宪刚,等.鹅细小病毒HG5/82株的分离鉴定及生物学特性的研究[J].中国预防兽医学报,2005,27(3):196-201.
[4]周瑞进,布日额,韩先杰,等.鹅细小病毒免疫血清的制备及其应用[J].中国兽医科技,2004,12(34):63-66.
[5]布日额,王君伟,吴金花,等.GPV野毒株鉴定及其致病力试验[J].中国家禽,2003,16(25):8-10.
[6]吴金花.鹅细小病毒的PCR诊断[J].黑龙江畜牧兽医,2004,12:41-42.
[7]方定一.周阳生.小鹅瘟病原体及其特异防治的研究[J].中国农业科学,1981(4):1-8.
Isolation and identification of Gosling Plague virus W strain
Miao Yuhe1,Chen Shenglei1,Liu Quan2,Liu Yanxia1, Xia Chunlei1,Shu Xiuwei1
(1.Liaoning Yikang Blological Corporation Limited,Liaoning Liaoyang 111000; 2.Liaoning Province animal health monitoring and early warning center,Liaoning Shenyang 110001)
A virus was isolated from goose heart,liver and spleen tissues by 12 day old goose embryo.The virus was identificated by Pathogenicity test,neutralization test,agar diffusion test and molecular biology.The results show that the isolated virus was gosling plague virus, named W strain.
Gosling Plague virus;Isolation;Identification
S852.65
:B
:1672-9692(2016)09-0006-05
2016-08-09
苗玉和(1966-),男,博士,研究方向为兽医免疫学,研究员,副总经理,主要负责兽用生物制品技术研究开发和质量检验管理等工作。

