多倍体植物抗逆性研究进展
魏 望,施富超,王东玮,彭 丽,2,葛 刚,孙宝腾
(1南昌大学 生命科学学院,南昌 330031;2威士达医疗设备(上海)有限公司,南昌 330031)
多倍体植物抗逆性研究进展
魏望1,施富超1,王东玮1,彭丽1,2,葛刚1,孙宝腾1
(1南昌大学 生命科学学院,南昌 330031;2威士达医疗设备(上海)有限公司,南昌 330031)
摘要:许多逆境能诱导多倍体植物发生,并可能作为筛选压力推动多倍体的形成。多倍体植物具有细胞、器官巨大化的特点,但株型不一定巨大化。在几种主要逆境条件下(如低温、高温、干旱、盐碱、病害等),多倍体植物抗逆性往往增强。多倍体植物主要通过调整细胞大小和结构、调节生物膜系统、提高渗透调节物质含量、增强抗氧化系统活性、增加基因表达和通过表观遗传变化来增强抗逆性,但也有研究显示多倍体植物的抗逆性降低。多倍体植物的抗逆性还需要更深入和细致研究,才能阐明抗逆机理。该文对近年来国内外有关多倍体植物的形成、特征、抗逆性表现及其调控机制等方面的研究进展进行综述。
关键词:多倍体植物;逆境;抗逆性机理
多倍体是指含有3套或3套以上完整染色体组的生物体,在自然界中广泛存在,约70%的被子植物在其进化史中曾发生过一次或多次多倍化过程。植物体多倍化后往往会发生各种各样的生物学特性变化,使得多倍体具有器官巨大、可孕性低、有机合成速率增加、抗逆性增强等特性。人们对于多倍体的研究多集中在探究其起源和发生途径、诱导方法、鉴定方法等方面,而近年来随着全球气候变化,多种逆境胁迫同时存在于作物的生长季,对作物产量造成了严重影响,如何提高植物抗逆性亟待解决。实践研究表明,多倍体植物抗逆性往往较二倍体增强,例如小麦[1]、大豆[2]、刺槐[3]等植物的多倍体均具有比未加倍的物种更强的抗逆性。人们开始对多倍体植物抗逆性增强这一现象进行了广泛而深入的研究,并已逐渐从外部形态研究转变为细胞水平和分子水平研究。目前国内外没有文章对多倍体植物抗逆性进行综述,本文综合了近几年来的相关文献,从逆境诱导多倍化的发生谈起,继而介绍了多倍体植物在几种主要逆境中的抗性研究现状,并分别从形态结构、生理生化、基因表达等不同层面对多倍体植物的抗性机理进行了阐述,为多倍体植物抗逆性的进一步研究提供参考,并为多倍体育种及其生产应用提供理论依据。
1逆境胁迫促进多倍体植物的发生
自然界中多倍体植物产生的诱导因子往往是异常的环境条件,如极端温度(冷、热刺激)、水分胁迫(干旱和洪涝)、养分胁迫、辐射等。这些环境因子均能诱发植物体产生不减数配子,从而形成多倍体。研究表明,低温会导致第二次减数分裂末期细胞核内原料保证系统异常,从而影响染色体的分离,导致不减数配子的形成[4]。低温处理芸薹属植物的不减数配子形成率为23%,较正常植株显著提高[5];二倍体富利亚薯在低温胁迫下产生不减数配子的频率更是高达90%。高温会引起第二次减数分裂时纺锤丝的定位,也会导致不减数配子的生成。如Pécrix等[6]研究发现,蔷薇经36 ℃高温处理后,2n配子的形成率升高为24.5%; Wang等[7]发现,经高温处理后,杨树产生2n雄配子的频率甚至大于80%。2n配子的产生和产量也明显受干旱、日照长度、肥料等影响[8]。这些研究结果表明,逆境胁迫是植物多倍化的动力,能够提高多倍体的发生概率,促进多倍体的形成。
另一方面,多倍体还可能是逆境胁迫下自然选择的结果,是对不良环境的适应。北极圈是世界上植物多倍化比例最高的地区,多倍体在严峻的环境中往往具有更大的竞争力,常迅速占领由冰川融化而形成的新生境[9]。代吉莉属植物在低营养环境中的多倍体数比高营养环境中高了7倍[10]。可见,在逆境中,多倍体的生存竞争力往往强于二倍体,导致在高纬度、高海拔地带或其他极端环境中,多倍体植物比二倍体植物数量更多、分布更广,逆境可能成为一种筛选压力而对多倍体的形成产生积极作用。
由此可见,植物多倍体的产生易受环境因素的影响,逆境是多倍体形成的原因。同时,植物多倍体是逆境胁迫下自然选择的结果,其长期生长在恶劣环境当中,抗逆性自然强于二倍体,能够适应多样化的极端环境条件,两者相互关联,密不可分。
2多倍体植物在几种主要逆境胁迫下抗性增强
研究发现,多倍体植物往往表现出对逆境有较强的抗性。比如在低温、高温、干旱、盐胁迫、病害等逆境下,多倍体具有更强的竞争力和生存能力,我们选择了具有代表性的一些文献简要列于表1。
首先,绝大多数植物多倍体的耐低温胁迫能力均强于二倍体。颜志明等[11]对扬花萝卜进行低温胁迫处理,发现四倍体萝卜较二倍体在叶片和肉质根形态上表现出巨大性,优质高产,且耐寒能力强于二倍体。Deng等[12]通过观察烟草在低温胁迫下的气孔行为和抗氧化情况发现,八倍体植株的活性氧积累比四倍体少,抗氧化酶活性更强,认为八倍体植株抗寒能力更强。王园园[13]研究表明,在低温胁迫下,四倍体杂交兰叶片中渗透调节物质含量和保护酶活性均较高,其对低温的耐性强于二倍体杂交兰。马跃等[14]研究结果显示,4 ℃低温处理后,四倍体不结球白菜的净光合速率、气孔导度和蒸腾速率均高于二倍体,两者冻害指数差异显著,同源四倍体不结球白菜表现出综合耐寒高产特性。Nejadsadeghi[15]研究发现,经不同低温处理后,六倍体小麦的电导率、过氧化氢含量、丙二醛含量均低于四倍体,而抗氧化保护酶活性和脯氨酸等保护物质的含量则显著提高,可见高倍性的小麦具有更强的抗寒性。由以上研究可见,多倍体植物抗寒性明显强于二倍体植株。
其次,多倍体植物也对高温胁迫具有更强的抗性。徐伟钰等[16]研究高温胁迫下二倍体和四倍体萝卜生长时发现,在高温胁迫下,四倍体的电解质渗透率、MDA 含量均低于二倍体,而其可溶性蛋白及总叶绿素含量均高于二倍体,说明四倍体萝卜从生理和生化角度均表现出了明显的耐热性状,抗性强于二倍体。李军[17]通过检测高温胁迫下不同倍性的加拿大一枝黄花的各项生理指标发现,四倍体和六倍体具有较低的H2O2、脯氨酸积累,但具有较高的抗氧化酶Cu/Zn-SOD活性,表明多倍体加拿大一枝黄花具有较强的活性氧清除机制,对高温胁迫的耐受性明显高于二倍体。王园园[18]研究发现,杂交兰在高温处理后,二倍体叶片失水变黄且叶尖叶缘焦枯,而四倍体颜色变暗,略显失水,仅叶尖焦枯,四倍体膜损伤程度、渗透调节物质含量等生理生化特性也表现出抗热性。刘慧吉等[19]通过多倍体育种手段选育出了耐热的四倍体白菜,发现耐热品种的株高、叶片重、叶柄重及单株重皆超过二倍体亲本,具有耐热、优质的特性。由此说明,多倍体植物一般具有更强的抗高温能力,且多倍体育种已经成为提高植物耐热性的一种有效途径。第三,多倍体植物在干旱的生态坏境中生存力更强、分布更广,具有较强的抗旱能力。Maherali等[20]研究发现在水分胁迫下,多年生草本植物柳兰(Chamaenerionangustifolium)四倍体具有更高的木质部水力传导系数,表现出更强的抗旱能力。黄金艳等[21]通过一系列生理指标测定,发现干旱胁迫下四倍体薄皮甜瓜株高胁迫指数、茎径胁迫指数、干物质胁迫指数均显著高于二倍体,而其叶片中自由水含量和水分饱和亏则明显低于二倍体,证明四倍体薄皮甜瓜在苗期抗旱性比二倍体强。Manzaneda等[22]发现,干旱胁迫下二穗短柄草四倍体能维持更高的光合作用效率和气孔导度,更强的杂合性及遗传变异性使其更具可塑性,能适应多样化的环境。Xu等[23]通过测定一系列生理指标以及进行转录组测序分析,研究干旱胁迫对不同倍性泡桐的影响,发现四倍体泡桐的抗氧化酶活性、叶绿素含量等指标均高于二倍体,且与抗旱性有关的一些基因也呈现出积极的调控作用。由以上研究不难看出,多倍体植物在抗旱方面有更大的优势。
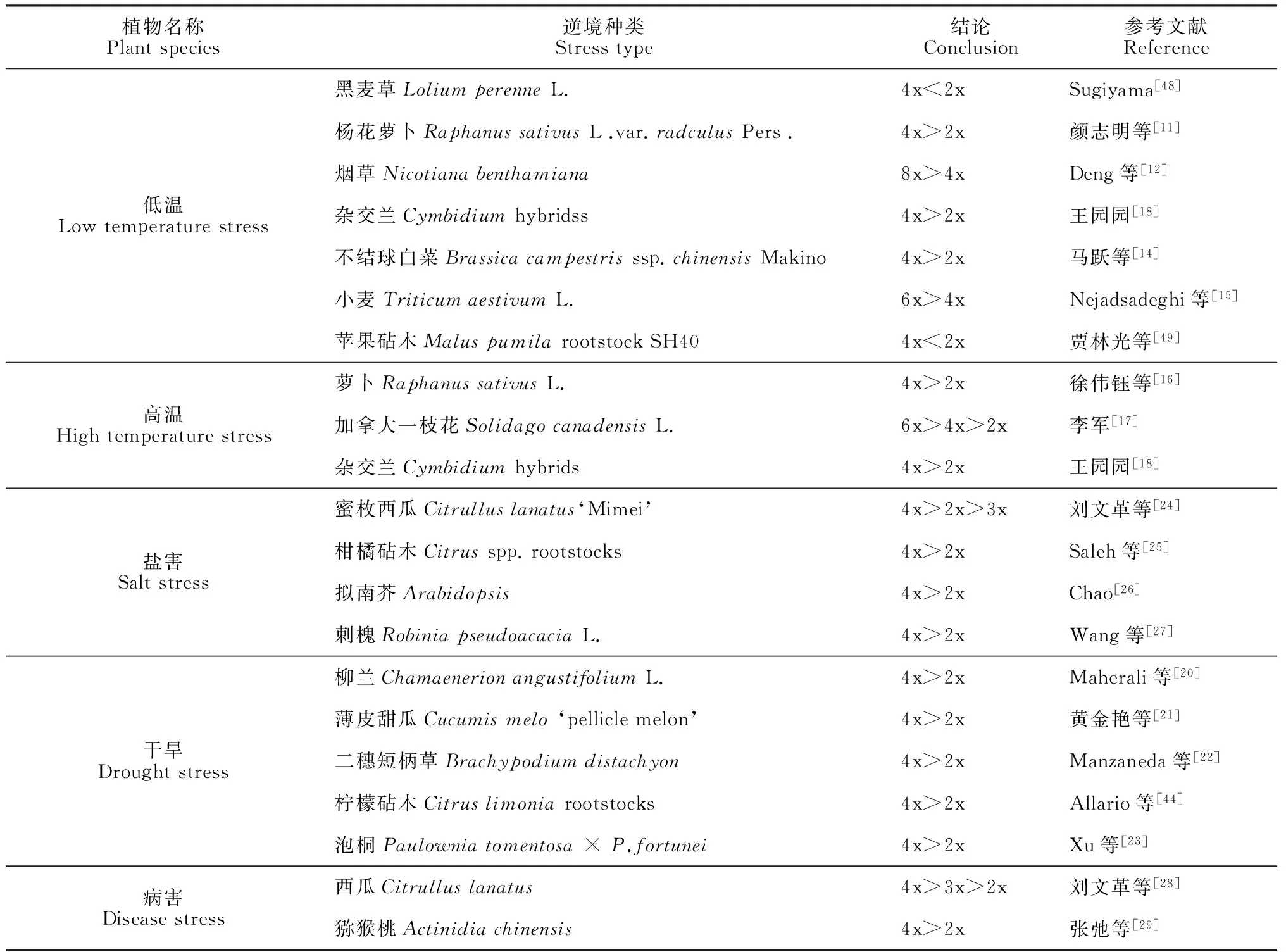
表1 在几种主要逆境胁迫下不同倍性植物的抗性强弱比较
注:2x、3x、4x、6x、8x分别代表二倍体、三倍体、四倍体、六倍体、八倍体
Note:2x,3x,4x,6x and 8x represent the diploid, triploid, tetraploid, hexaploid and octoploid, respectively
第四,多倍体植物抗盐性的集中深入研究发现,多倍体在盐渍化土壤中往往具有更强的生存能力。刘文革等[24]用NaCl琼脂固定法对不同倍性蜜枚西瓜在不同浓度NaCl胁迫下发芽种子成苗率、下胚轴长、根长、侧根数等进行比较,当NaCl浓度在90 mmol/L以上时,四倍体耐盐性明显比二倍体强。Saleh[25]研究不同倍性柑橘属果树抗盐性时发现,在盐胁迫下二倍体果树的生长速率没有明显变化,四倍体果树生长速率反而增加,且四倍体叶片中氯离子积累速率慢于二倍体,表明四倍体的耐盐性强于二倍体。Chao[26]等报道,经200 mmol/L NaCl处理后,拟南芥多倍体可以通过根系吸收更多钾离子,提高叶片钾钠比来增强对盐胁迫的抵抗能力。Wang等[27]对不同倍性刺槐进行500 mmol/L NaCl处理,比较两者外部形态、超微结构、生理生化特征以及蛋白质组学特性,发现四倍体在植株生长速率、叶片离子含量、氧化损伤程度及超微结构上均呈现出比二倍体更积极的抗逆表现。这些研究显示多倍体植物的抗盐性明显提高。
另外, 病害是影响植物生长,使得作物产量降低的重要危害因子,病害胁迫下,多倍体植物同样比二倍体具有更强的抗性。刘文革等[28]通过对18个同基因型不同染色体倍性西瓜品种的苗期枯萎病抗性进行接种鉴定,发现同基因型的二倍体植株最先进入发病期,而同源四倍体和同源三倍体对枯萎病的抗性优于二倍体。张弛[29]利用离体叶片滴接法,对二倍体及诱导所获得的10个株系的四倍体红阳猕猴桃组培苗叶片进行了溃疡病侵染鉴定,结果表明二倍体植株在接种后3 d内感病,而四倍体植株中有8个株系的植株在接种5 d后感病,另外两个四倍体株系未见褐色病斑,没有感病,这可以初步证明此两个株系的四倍体组培苗抗病性增强。可见,多倍体植物与二倍体相比,抗病性有了较大提高。
3多倍体植物抗性增强机理
研究表明,大多数多倍体植物的抗逆性较二倍体明显提高,因此,探究多倍体抗逆机理,找出抗逆性增强的根本原因和相关机制,对多倍体抗性育种有重大意义。迄今,研究人员已从细胞水平、生理生化水平、分子水平对多倍体植物抗逆增强机理进行了广泛的探索。
3.1多倍体植物通过调整细胞大小和结构以增强抗逆性
多倍体植物最普遍的效应是细胞体积增大,最具代表性的是花粉和表皮细胞,特别是气孔的保卫细胞,多倍体与二倍体的区别非常明显。多倍体的气孔密度减小、保卫细胞的长、宽增加。而气孔是植物与外界进行气体交换的通道,气孔导度直接影响植物的光合作用和蒸腾作用,进而影响植株的生态适应性及对逆境的抗性。据马跃等[30]研究,四倍体“寒富”苹果气孔保卫细胞不论长度还是宽度均显著高于二倍体,气孔密度降低了58.7%,而田间试验证明其抗病性明显增强(图1)。此外,多倍体植物还可通过调整细胞排列来抵御不良环境,如经盐胁迫处理后,二倍体刺槐海绵组织出现纤维化,结构不完整,间隙增大,栅栏组织明显缩短,所占比例减小,而四倍体排列则更为紧密,海绵细胞变小,层次多,是植物受到盐伤害的一种结构上的有利表现,有助于提高植物对逆境的适应能力[31]。另外,在逆境胁迫下,不同倍性植物的叶绿体、线粒体等超微结构变化也不一致。经0 ℃低温处理后,二倍体绿玉树试管苗的叶绿体变成圆球状,叶绿体内基粒和基粒片层结构紊乱,淀粉粒解体,线粒体溶解;而四倍体小苗,叶绿体、线粒体结构稍有紊乱,但结构仍基本保持完整[32]。这说明多倍体植物在低温胁迫下能保持叶绿体、线粒体的结构完整性,使得植物能维持正常的光合作用和其他生理活动,从而提高抗逆性。
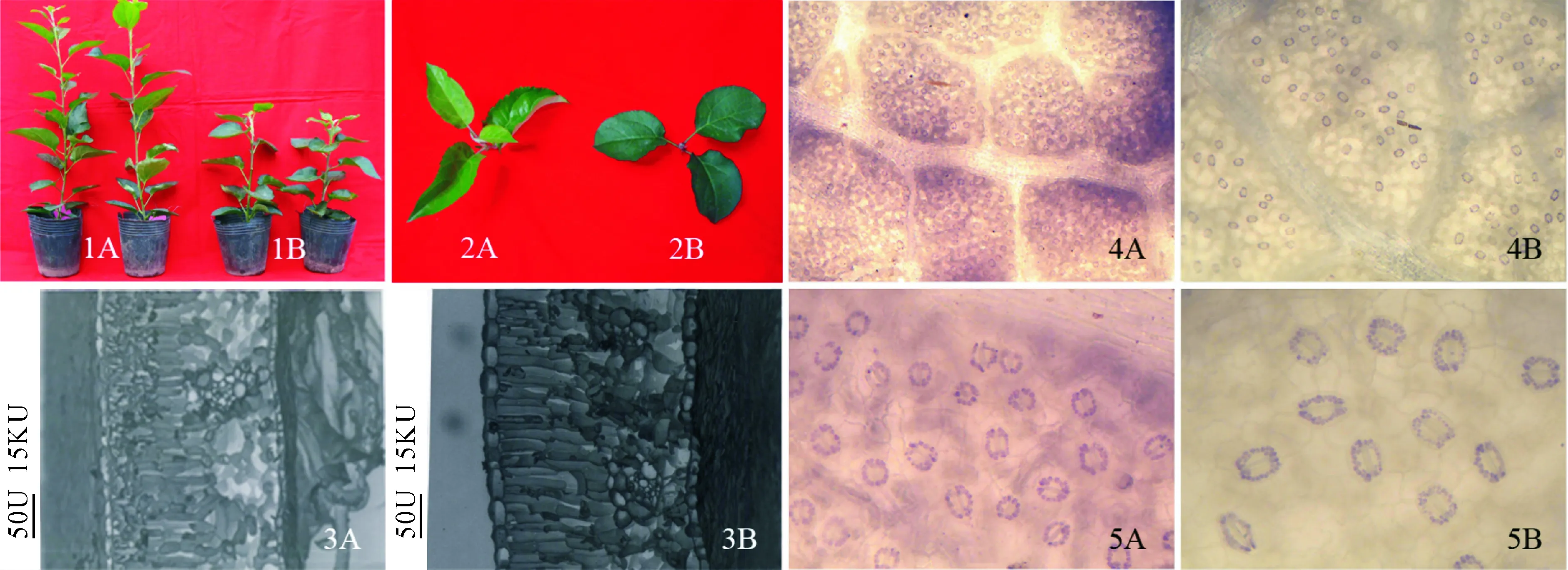
1.植株;2.叶片;3.叶肉组织结构;4、5.气孔;A、B分别表示二倍体和四倍体。图1 不同倍性‘寒富’苹果形态比较[30]1. The whole plant; 2. The leaves; 3. The mesophyll tissue; 4,5. The stomata; A and B are diploid and tetraploid plant, respectively.Fig.1 The morphology of diploid and autotetraploid ‘Hanfu’ apple[30]
多倍体植物器官的巨大性并不一定引起整个植株的增大,有些甚至会相反。多倍体植株往往细胞分裂速度慢、栅栏组织厚度与海绵组织厚度比值高,使得品种表现出趋于矮化的趋势。许多农作物的多倍体植株都出现茎杆变短变粗的现象,而这种矮壮现象正好增强了植株的抗倒伏能力。
3.2多倍体植物通过生理生化特征变化来增强抗逆性
研究表明,多倍体植物体内的含水量、渗透压、呼吸作用、蒸腾作用、光合作用、叶绿素的含量、各种酶的含量和活性等生理生化特性与二倍体相比都发生了明显改变。而正是这些特征的变化使得多倍体具有更强的逆境调节能力及适应性。
3.2.1调节生物膜系统外界环境对植物的胁迫首先在膜系统中有体现,往往先引起膜透性的改变。李培旺等[32]比较二、四倍体绿玉树小苗的抗寒性发现,四倍体植株的细胞膜电解质相对外渗率明显小于二倍体,受损伤小,抗寒性强。Nejadsadeghi[15]发现,经-5 ℃低温处理后,不同倍性小麦的电导率均呈上升趋势,但六倍体小麦的电导率始终低于四倍体。经盐胁迫处理10 d后,二倍体刺槐的电导率上升了3倍左右,而四倍体却能达到基本保持不变[27]。另外,在逆境胁迫下,细胞膜会遭受氧化损伤,产生高活性的脂质过氧化物丙二醛(MDA),并会进一步对膜系统进行毒害,其含量也可以反映逆境下细胞膜的稳定性。孟华兵[33]在比较白菜型油菜二倍体和四倍体抗镉胁迫能力的实验中发现,用100 μmol/L的镉处理20 d后,二倍体叶片中的MDA积累量是同时期四倍体的2.8倍,表明二倍体受到的膜脂过氧化伤害要比四倍体严重得多,抗逆性弱。周珊珊等[34]研究表明在低温和高温胁迫下,大花蕙兰类原球茎三倍体、四倍体的MDA含量均显著低于二倍体。由此可以看出,在逆境胁迫下多倍体植株产生的膜伤害物质显著低于二倍体,细胞膜系统受损伤程度低。因此,多倍体抗逆性的增强是由于其具有更强的细胞膜保护能力。
3.2.2调节细胞渗透调节系统渗透调节是植物适应干旱、盐渍和低温胁迫的重要机制之一。植物在逆境胁迫下细胞内会积累脯氨酸、可溶性糖、可溶性蛋白、K+、Na+等渗透调节物质,从而来保持植物细胞水势的平衡。
首先,脯氨酸是一种小分子的渗透物质,能加强逆境条件下蛋白质的水合作用,有利于植物细胞结构和功能的维持;并具有解氨毒和保护质膜完整性的作用,植物在受到逆境胁迫时都能积累高水平的脯氨酸。研究表明,低温胁迫下,二倍体和四倍体不结球白菜脯氨酸含量呈先升后降的单峰曲线,且四倍体植株能在遭遇低温后积累更多的脯氨酸,使其受到的伤害作用小,抗寒性增强[35]。魏跃等[36]发现,经高温处理后,二、四倍体矮牵牛的游离脯氨酸含量均呈现从高到低再到高的变化趋势,且四倍体脯氨酸含量始终都高于二倍体,这表明四倍体胞质渗透调节能力更强。Dong[37]的研究结果也表明,在干旱胁迫下泡桐的脯氨酸含量不断升高,且四倍体脯氨酸的相对含量高于二倍体,这个结论可以作为四倍体泡桐的抗旱性优于相应二倍体的佐证。
同时,可溶性蛋白作为一种亲水性胶体,亲水性很强,可提高细胞的保水能力。逆境下,可溶性蛋白含量的增加,使细胞的保水能力加强,降低植物的冰点,以此来提高植物的抗逆性。颜志明等[11]对二倍体扬花萝卜及其同源四倍体萝卜的生长和品质特性及幼苗在低温胁迫下的生理生化特性进行比较研究,结果表明四倍体幼苗的可溶性蛋白含量大幅度提高且高于二倍体,耐寒能力强于二倍体。在低温胁迫过程中,四倍体杂交兰株系T1和T2可溶性蛋白质含量增幅分别显著比二倍体高2.4和2.5倍,具有更强的抗逆性,环境适应性较强[13]。
其次,可溶性糖也是植物主要保护物质之一,能增加细胞液的渗透压,加强细胞吸水、保水能力,起冰冻保护剂作用;糖还可提供能源与代谢底物,诱导其他与抗性有关的生理生化过程,如脂肪的合成,有利于提高抗逆性。马跃等[14]研究表明,在低温胁迫下四倍体不结球白菜的可溶性糖较二倍体增加了17%。在水分胁迫下,二倍体和同源四倍体薄皮甜瓜可溶糖含量明显增加,分别比对照增加了36.63%和9.82%,四倍体叶片相对可溶性糖含量变化幅度极显著高于二倍体,说明四倍体薄皮甜瓜对水分胁迫比较敏感,促进保卫细胞内的淀粉迅速转化为可溶性糖,使渗透势下降,可以从外界继续吸水,维持细胞膨压,保证生理生化过程的正常进行[21]。
另外,Na+、K+在植物正常的生命活动中起着很重要的作用。正常生长的植物细胞内K+/ Na+比值比较高,是植物正常代谢进行的前提。逆境胁迫下,细胞内的正常的离子动态平衡被打破,K+/ Na+比值受盐胁迫影响较大,因此,K+/ Na+比值就被作为衡量植物抗逆性的重要指标。Chao等[26]的研究表明,用200 mmol/L NaCl处理拟南芥后,3个品种的四倍体存活率均显著高于二倍体,四倍体叶片中K+含量较二倍体显著升高,而Na+降低,K+/ Na+是二倍体的3倍,说明四倍体可以通过聚集K+、抑制Na+的吸收,升高K+/ Na+比来调整细胞渗透平衡,从而增强植株耐盐性。朱红菊[38]研究也发现,在高浓度盐胁迫下,不同倍性西瓜叶片K+/ Na+比值表现为4x>3x>2x,而植物受伤害程度表现为2x>3x>4x,说明在盐胁迫下四倍体西瓜中K+对Na+的竞争力强于二倍体,能通过提升K+/ Na+降低渗透势,使植物水势降低,使其能从水势变低的土壤中继续吸收水分,从而维持体内水分平衡及各种生理生化过程的正常进行。
综上可知,在逆境下多倍体植物会通过大量积累脯氨酸、可溶性蛋白、可溶性糖、无机离子等渗透调节物质来降低细胞的水势,增强细胞的吸水和保水能力,以维持细胞的正常膨压和功能,同时渗透调节物质还具有保护细胞中蛋白质、蛋白复合物和膜结构免遭降解或破坏的作用,从而使细胞维持正常的生理活动,在一定程度上维持植株的正常生长,缓解胁迫对细胞产生进一步的伤害,进而提高植物的抗逆性。
3.2.3调节抗氧化系统植物处于逆境条件下时,活性氧(ROS)大量积累,植物体通过活性氧清除系统,降低活性氧对膜脂的攻击能力以及对其它大分子生命物质的伤害。ROS的清除机制主要有抗氧化酶促清除系统和非酶促清除系统。
抗氧化酶促清除系统包括超氧化物岐化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)等,它们能有效清除植物体内的活性氧,使植物免受活性氧的伤害。抗氧化酶的活性越高,植物抗逆性往往越强。四倍体蒲公英根、叶、花序中SOD活性平均增加 29%,POD活性平均增加 45%,CAT活性平均增加 40%,表明四倍体植株比二倍体具有更强的生长优势和抗逆性[39]。薯蓣属多倍体在高温胁迫处理过程中,其POD、CAT活性较二倍体明显增强,表明四倍体比二倍体有更强的抵抗外界环境造成植物氧化损伤的能力[40]。盐胁迫下四倍体刺槐的相关抗氧化酶活性普遍高于二倍体,能够迅速有效清除盐胁迫过程中体内产生的活性氧,更好地保护膜系统的完整性,进而保证植物的光合作用正常进行,证明四倍体刺槐具有较强的抗盐性[3]。
活性氧的非酶促清除系统包括AsA、GSH、维生素E和类胡萝卜素等抗氧化物质,它们都具有清除活性氧的功能,共同维持着细胞内活性氧产生和清除代谢的平衡。张艺笑[40]研究结果显示,盾叶薯蓣二倍体和四倍体中的AsA浓度分别在高温处理的第3天或第5天开始下降,而GSH浓度随高温处理时间的延长呈下降趋势,但四倍体幼苗的AsA和GSH浓度在高温处理的各个阶段均显著高于二倍体,说明高温胁迫下四倍体植株具有更高的清除活性氧的能力。另外,四倍体辣椒AsA量比二倍体增加15%~70%;油菜二倍体受到盐胁迫处理的第2天后其GSH含量逐渐降低,而四倍体却能维持较高的GSH的水平,所以能够消耗更多的过氧化氢,保护叶片的过氧化反应[33]。
可见,在逆境胁迫条件下,多倍体植物可以通过提高各种抗氧化酶活性和抗氧化物质含量来抵御不良环境。在两种抗氧化系统的协同作用下,有效遏制了 ROS 水平的升高,保持细胞内活性氧的平衡,保护细胞膜的完整性,减少细胞遭受的氧化损伤,从而使多倍体植物的抗逆性得以提高。
3.3多倍体植物通过基因表达变化和表观遗传变化来增强抗逆性
随着分子生物学技术和细胞遗传学技术(如分子标记、原位杂交、高通量测序技术)的飞速提升,人们对多倍体抗逆性的研究逐渐由生理生化特征变化转变为基因表达变化和表观遗传变化等分子层面的探索。多倍体中的基因沉默、基因表达的调节以及导致的基因亚功能化和新功能化有遗传和表观遗传两方面的原因,两者相互关联、共同作用,调节多倍体植物在逆境胁迫下的适应能力。
3.3.1多倍体植物在逆境胁迫中基因表达变化无论多倍体植物在逆境胁迫下外部形态和生理生化指标如何变化,归根结底是因为分子水平发生了改变。尤其是染色体加倍后的基因的剂量效应对多倍体抗性变化影响极大。在多倍体基因组中,有些重复基因虽然在功能上不发生改变,但是由于基因剂量效应,其在表达量上往往会发生显著变化。这些重复基因有时会增加和集中次生代谢物质和起防御作用的化学物质,这种增量表达在某些情况下或在生长发育的某个阶段对增强多倍体个体的适应性可能是有利的[14]。Dong等[41]研究发现,陆地棉异源四倍体中60对同源基因的表达模式受5种非生物逆境胁迫的影响,70%的基因都在至少一种胁迫处理中表现出受诱导的表达量变化,说明基因的表达量变化是多倍体植物适应环境并最终形成稳定物种的分子机制之一。基因IiCPK1与植物抗逆性有关,冷胁迫后的四倍体菘蓝中IiCPK1的表达水平高于二倍体,使四倍体菘蓝具有较高的生活力和长势以及较强的抗性[42]。低温胁迫下四倍体不结球白菜P8中CBF3、COR15和ZAT10基因表达量均显著高于二倍体P9,基因表达量的提高导致保护酶活性、渗透物质含量及叶绿体抗寒性的提高,从而维持四倍体低温下的光合能力,使其表现单株质量和小区产量等显著高于二倍体的优良农艺性状,四倍体相较于二倍体对低温环境表现出更强的适应能力及高产潜力[14]。随着高通量测序技术的发展,研究者开始从研究多倍体植物单个基因与抗逆性的关系转向对全基因组进行整体分析。Tan等[43]通过转录组测序对资阳香橙二倍体和四倍体的差异基因进行GO富集分析,发现这些差异基因所涉及的代谢通路与植物抗旱、耐盐等过程密切相关(图2)。Allario等[44]利用基因芯片技术对柠檬砧木的二倍体及四倍体进行抗旱能力进行比较,发现四倍体柠檬砧木可增加其根部中ABA合成途径的相关调控基因的表达量,来远程调控ABA信号途径以便响应干旱胁迫,使其抗旱性增强。除此之外,多倍体植物产生优势的内在原因还可能与基因的遮盖作用或上位效应、重复基因的显性与超显性作用、等位基因间的互作、非等位基因的互作等过程有关。当植物染色体组加倍后,其细胞核与细胞质的比例关系发生变化,各染色体在减数分裂过程中有可能发生不均衡分配、基因的剂量效应和基因的互作效应等都会打破原有的生理生化功能的平衡,致使植株发生一系列变化,因而增加了植物体的适应性变异,为植物抵御不良环境奠定了物质基础[45]。
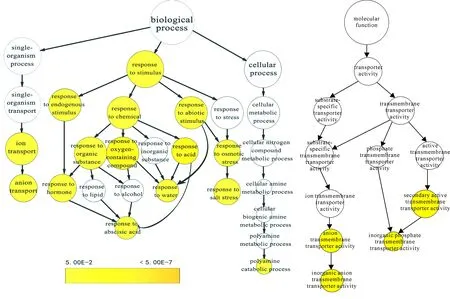
彩色注释代表显著富集的功能,彩色长条显示显著性程度;active transmembrane transporter activity.主动跨膜转运载体活性;anion transmembrane transporter activity. 阴离子跨膜转运载体活性;anion transport. 阴离子转运;biological process. 生物过程;cellular amine metabolic process. 细胞胺代谢过程;cellular biogenic amine metabolic process. 细胞生物内源胺代谢过程;cellular metabolic process. 细胞代谢过程;cellular nitrogen compound metabolic process. 细胞含氮化合物代谢过程;cellular process. 细胞过程;inorganic anion transmembrane transporter activity. 无机阴离子跨膜转运载体活性;inorganic phosphate transmembrane transporter activity. 无机磷酸盐跨膜转运载体活性;ion transmembrane transporter activity. 离子跨膜转运载体活性;ion transport. 离子转运;molecular function. 分子功能;phosphate transmembrane transporter activity. 磷酸盐跨膜转运载体活性;polyamine catabolic process. 多胺分解代谢过程;polyamine metabolic process. 多胺代谢过程;response to abiotic stimulus. 非生物刺激响应;response to abscisic acid. 脱落酸响应;response to acid. 酸响应;response to alcohol. 乙醇响应;response to chemical. 化学响应;response to endogenous stimulus. 内源性刺激响应;response to hormone. 激素响应;response to inorganic substance. 无机物响应;response to lipid. 脂质响应;response to organic substance. 有机物质响应;response to osmotic stress. 渗透胁迫响应;response to oxygen-containing compound. 含氧化合物响应;response to salt stress. 盐胁迫响应;response to stimulus. 刺激响应;response to stress. 胁迫响应;response to water. 水分响应;secondary active transmembrane transporter activity. 次级主动跨膜转运载体活性;single-organism process. 单生物过程;single-organism transport. 单生物转运;substrate-specific transmembrane transporter activity. 底物特异性跨膜转运载体活性;substrate-specific transporter activity. 底物特异性转运载体活性;transmembrane transporter activity. 跨膜转运载体活性;transporter activity. 转运活性;图2 资阳香橙二倍体和四倍体差异基因的GO富集分析[43]The colored nodes represent the significantly over-represented GO terms. The colored bar shows the significance.Fig. 2 Significantly enriched GO categories in DEGs between 2x and 4x Ziyang Xiangcheng[43].
3.3.2多倍体植物在逆境胁迫中的表观遗传变化与经典的遗传机制相比,表观遗传的调控在多倍体抗逆的过程中起着更为广泛而深远的作用,表观调控的机制包括DNA甲基化、组蛋白修饰、转座子激活、RNA干扰等。表观遗传调控由于其可恢复性,为多倍体的进化提供了一个十分有效和具弹性的机制来适应环境。其中,DNA甲基化是表观遗传修饰的主要方式,在植物的生长、发育及基因表达调控等过程中发挥着重要作用。DNA甲基化像RNA表达一样具有时空效应,控制着一些基因的表达与沉默,植物在逆境条件下一些抗性基因的表达与沉默极有可能与DNA甲基化的模式有很大的关系,近年来对植物逆境的表观遗传学方面的研究已经成为一个很重要的热点。有研究认为植物DNA甲基化状态与植物所处的不同生长环境有很大的关系,逆境胁迫下的甲基化多态性分析和多倍体的甲基化多态性分析已有相关报道。朱红菊[46]的研究发现不同倍性西瓜幼苗甲基化水平受NaCl 胁迫影响严重,随着盐浓度的增加,西瓜幼苗基因组 DNA 全甲基化率、半甲基化率、总甲基化率都随之降低,同一NaCl浓度处理下甲基化率表现为2x>4x>3x;与此同时,超甲基化比率升高,并且其变化幅度是 4x>3x>2x。说明DNA的去甲基化和超甲基化比率与西瓜幼苗的耐盐能力相关,在 NaCl 胁迫时植株会通过降低 DNA 的去甲基化比率和升高超甲基化比率来响应 NaCl 胁迫。孟华兵[47]的研究表明,镉处理四倍体油菜甲基化水平增高量大于二倍体,说明了其在镉胁迫环境中通过增加甲基化整体水平来抵御镉的胁迫反应。重金属胁迫导致DNA甲基化水平的上升,可能是对基因组进行保护,防止DNA在镉胁迫下被内切酶切割和多拷贝转座,四倍体在这方面可能更具有优势。可见,在逆境胁迫下,多倍体植物可以通过甲基化和去甲基化作用沉默和诱导某些抗性基因的表达,从而触发一系列抗性机制和通路,使植物更好地适应环境。
4多倍体植物抗性也可能降低
虽然研究发现,多倍体在许多逆境条件下抗性会增强,但是还有些研究认为多倍体的抗逆性反而降低了。关于多倍体抗性降低的报道不多,对于抗性机理有所提及,但研究的不够深入。如Sugiyama[48]比较黑麦草二倍体和同源四倍体之间的竞争力及抗寒能力发现,经低温处理后,四倍体芽冠的再生能力不如二倍体,对低温的耐受程度明显更低。贾林光等[49]的研究也发现四倍体苹果的半致死温度比二倍体高,无论抗寒锻炼前期还是后期,四倍体的可溶性蛋白质、可溶性糖和脯氨酸含量均极显著低于二倍体,苹果矮化砧木染色体加倍后抗寒性降低。刘文革等[24]报道,不同倍性西瓜之间的成苗率、下胚轴长、根长、侧根数等指标有明显差异,且四倍体(M4X)可耐受150 mmol/L浓度的盐分,二倍体(M2X)可耐受120 mmol/L浓度的盐分,三倍体(M3X)可耐受90 mmol/L浓度的盐分,耐盐性为M4X>M2X>M3X,三倍体的耐盐程度较差可能与其种子发育不良有关。邹兴建等[50]在研究干旱胁迫下不同倍性水稻的生理差异及 ABA 相关基因表达比较时发现,二倍体水稻对干旱胁迫的适应能力最强,三倍体次之,单倍体水稻最弱,这可能是因为三倍体及单倍体的染色体不成对,导致部分基因沉默或者过量表达,引起抗逆体系的不协调,导致其抗逆能力下降。多倍体植物抗逆性降低的研究证据还不多,其机理还不清楚,可能没有普遍性,但最终结论还需要更多实验证据证明。
5展望
植物经过多倍化后往往表现出比亲本二倍体更强的抗寒、抗旱、抗盐碱能力,因此人们已经将多倍体育种视为提高植物抗逆性的有效手段,并且在农业生产中的应用已有报道。国内外许多学者从细胞水平、基因水平和生理生化水平等不同层面对多倍体植物抗逆性增强的机制进行了探究。但是多倍体植物抗逆性是由诸多方面影响控制的,多倍体植物与其抗逆性之间的关系仍有许多不明之处,并且还有多倍体植物抗逆性降低的实验证据,因此还需要深入研究才能阐述清楚。目前该领域在以下两个方面研究还不够深入透彻,今后有待进一步探究:(1)多倍体植物抗逆性增强的机制在基因水平上的研究甚少,特别是由于多倍化导致的基因拷贝数的增加和表观遗传改变还需深入探讨,比如多倍体在逆境胁迫下DNA甲基化水平的变化模式还知之甚少。(2)多倍体植物抗性降低机制研究的很少,但这点非常重要,只有探究清楚其中原因,才能知道如何有效地培育出抗性强的多倍体品种。比如,亲本的选择对诱导培育抗性强的多倍体品种就很关键,这方面的研究今后需要加强。
参考文献:
[1]YANG C W, ZHAO L, ZHANG H K,etal. Evolution of physiological responses to salt stress in hexaploid wheat[J].ProceedingsoftheNationalAcademyofSciencesUSA, 2014, 111(32): 1 1882-1 1887.
[2]COATE J E, POWELL A F, OWENS T G,etal. Transgressive physiological and transcriptomic responses to light stress in allopolyploidGlycinedolichocarpa(Leguminosae)[J].Heredity, 2013, 110(2): 160-170.
[3]孟凡娟,庞洪影,王建中,等.NaCl和Na2SO4胁迫下两种刺槐叶肉细胞叶绿体起微结构[J].生态学报,2011,31(3):734-741.
MENG F G, PANG H Y, WANG J Z,etal. The ultrastructure of chloroplast in mesophyll cell on two robinias under NaCl and Na2SO4stress[J].ActaEcologicaSinica, 2011,31(3):734-741.
[4]YOUNIS A,HWANG Y J, LIM K B. Exploitation of induced 2n-gametes for plant breeding[J].PlantCellRep, 2014, 33(2): 215-223.
[5]MASON A S,NELSON M N,YAN G J,etal. A. Production of viable male unreduced gametes inBrassicainterspecific hybrids is genotype specific and stimulated by cold temperatures[J].BMCPlantBiology, 2011, 11: 103.
[6]PECRIX Y, RALLO G, FOLZER H,etal. Polyploidization mechanisms: temperature environment can induce diploid gamete formation inRosasp.[J].JournalofExperimentalBotany, 2011, 62(10): 3 587-3 597.
[7]WANG J, LI D L, KANG X Y. Induction of unreduced megaspores with high temperature during megasporogenesis inPopulus[J].AnnalsofForestScience, 2012, 69(1): 59-67.
[8]VEILLEUX, RICHARD. Diploid and polyploid gametes in crop plants: mechanisms of formation and utilization in plant breeding[J].PlantBreedingReview, 2011, 3: 253-288.
[9]BROCHMANN C, BRYSTUNG A.K,ALSOS I G,etal,ELVEN R. Polyploidy in arctic plants[J].BiologicalJournaloftheLinneanSociety, 2004, 82: 521-536.
[10]GRANT V. Cytogenetics of the hybridGiliamillefoliata×achilleacfolia. I. variations in meiosis and polyploidy rate as affected by nutritional and genetic conditions[J].Chromosoma, 1952, 5: 372-390.
[11]颜志明, 张蜀宁, 汤伟华, 等. 二倍体和四倍体扬花萝卜的品质特性及抗寒性比较研究[J]. 西北植物学报, 2007, 27(7): 1 405-1 410.
YAN Z M, ZHANG S N, TANG W H,etal. Growth , quality and cold tolerance of diploid and tetraploid yanghua Radish[J].ActaBot.Boreal.-Occident.Sin., 2007, 27(7): 1 405-1 410.
[12]DENG B L, DU W C, LIU C L,etal. Antioxidant response to drought, cold and nutrient stress in two ploidy levels of tobacco plants: low resource requirement confers polytolerance in polyploids[J].PlantGrowthRegul., 2012, 66: 37-47.
[13]王园园, 叶志琴, 刘容, 等. 二倍体和四倍体杂交兰幼苗对低温胁迫的生理响应差异分析[J]. 植物资源与环境学报, 2014, 23(4): 68-74.
WANG Y Y, YE Z Q, LIU R,etal. Analysis on difference in physiological response of diploid and tetraploid ofCymbidiumhybrid seedling to low temperature stress[J].JournalofPlantResourcesandEnvironment, 2014, 23(4): 68-74.
[14]马跃, 王雅美, 张蜀宁, 等. 二、四倍体不结球白菜抗寒基因表达及生理生长特性[J]. 南京农业大学学报, 2014, 37(5): 41-46.
MA Y, WANG Y M, ZHANG S N,etal. Expression of cold-related genes and physiological characteristics of the diploid and teraploid non-heading Chinese cabbage[J].JournalofNanjingAgriculturalUniversity, 2014, 37(5): 41-46.
[15]NEJADSADEGHI L, MAALI-AMIRI R, ZEINALI H, RAMEZANPOUR S, SADEGHZADE B. Comparative analysis of physio-biochemical responses to cold stress in tetraploid and hexaploid wheat[J].CellBiochemBiophys, 2014, 70: 399-408。
[16]徐伟钰, 张蜀宁, 张杰, 张振超, 侯喜林. 高温胁迫对二倍体和四倍体萝卜生长和膜伤害的影响[J]. 南京农业大学学报, 2006, 29(4): 43-47.
XU W Y, ZHANG S N, ZHANG J,etal. Effects of heat stress on growth and membrane damage of diploid and tetrapliodRaphanussativusL.[J].JournalofNanjingAgriculturalUniversity, 2006, 29(4): 43-47.
[17]李军. 多倍化在加拿大一枝黄花(SolidagocanadensisL.)的入侵中的生态学意义[D]. 南京: 南京农业大学, 2011.
[18]王园园, 尹翠翠, 王广东. 高温胁迫对二倍体和四倍体杂交兰相关生理生化特征的影响[J]. 西北植物学报, 2013, 33(4): 735-740.
WANG Y Y, YIN C C, WANG G D. Related physiological and biochemical characteristic of diploid and tetraploidCymbidiumhybrids under high temperature stress[J].ActaBot.Boreal.-Occident.Sin., 2013, 33(4): 735-740.
[19]刘慧吉, 张蜀宁, 王华. 青梗、优质、抗热同源四倍体白菜杂交新品种暑优1号的选育[J]. 南京农业大学学报, 2002, 25(3): 22-26.
LIU H J, ZHANG S N, WANG H. Breeding an autotetraploid hybrid non-heading Chinese cabbage cultivar Shuyou No.1 with green stalk ,high quality and heat-resistance[J].JournalofNanjingAgriculturalUniversity, 2002, 25(3): 22-26.
[20]MAHERALI H, WALDEN A E, HUSBAND B C. Genome duplication and the evolution of physiological responses to water stress[J].NewPhytologist, 2009, 184: 721-731.
[21]黄金艳, 付金娥, 覃斯华, 等. 水分胁迫对二、四倍体薄皮甜瓜苗期生理生化特性的影响[J]. 安徽农业科学, 2011, 39(11): 6305-6307,6355.
HUANG J Y, FU J E, TAN S H,etal. Effect of water stress on the physiological and biochemical characteristics of diploid and tetraploid pellicle melon[J].JournalofAnhuiAgri.Sci., 2011, 39(11): 6 305-6 307,6 355.
[22]MANZANEDA A J, REY P J, BASTIDA J M,etal. Environmental aridity is associated with cytotype segregation and polyploidy occurrence inBrachypodiumdistachyon(Poaceae)[J].NewPhytol, 2012, 193(3): 797-805.
[23]XU E K, FAN G Q, NIU S Y,etal. Transcriptome-wide profiling and expression analysis of diploid and autotetraploidPaulowniatomentosa×Paulowniafortuneiunder drought stress[J].PLOSOne, 2014,18: 9(11):e113313.
[24]刘文革, 阎志红, 张红梅, 等. 不同倍性西瓜发芽种子成苗过程中的耐盐性研究[J]. 中国西瓜甜瓜, 2002(3): 1-2.
LIU W G, YAN Z H, ZHANG H M,etal. Research on the salt tolerance of different ploidy watermelon seed in germination[J].ChinaWangtermelonandMelon, 2002,(3): 1-2.
[25]SALEH B, ALLARIO T, DAMBIER D,etal. Tetraploid citrus rootstocks are more tolerant to salt stress than diploid[J].ComptesRendusBiologies, 2008, 331: 703-710.
[26]CHAO D Y, DIKES B,LUO H B,etal. Polyploids exhibit higher potassium uptake and salinity tolerance inArabidopsis[J].Science, 2013, 341(6 146): 658-659.
[27]WANG ZH M, WANG M Y, LIU L K,etal. Physiological and proteomic responses of diploid and tetraploid black locust (RobiniapseudoacaciaL.) subjected to salt stress[J].InternationalJournalofMolecularSciences, 2013, 14: 20 299-20 325.
[28]刘文革, 阎志红, 赵胜杰, 等. 不同染色体倍性西瓜对枯萎病的抗性研究[J]. 长江蔬菜, 2008,(18): 19-20.
LIU W G, YAN Z H, ZHAO S J,etal. Study on resistance to fusarium wilt in different polyploidy of watermelons[J].JournalofChangjiangVegetables, 2008,(18): 19-20.
[29]张弛. 红阳猕猴桃四倍体诱导及其抗溃疡病特性初探[D]. 重庆: 西南大学, 2011.
[30]马跃, 张蕾, 李元源, 等. ‘寒富’苹果二倍体及其同源四倍体叶片超微结构和叶绿素荧光参数特征[J]. 西北植物学报, 2012, 32(3): 477-483.
MA Y, ZHANG L, LI Y Y,etal. Characteristics of micro-structures and chlorophyll fluorescence parameters of diploid and autotetraploid ‘Hanfu’ apple leaves[J].ActaBot.Boreal.-Occident.Sin., 2012, 32(3): 477-483.
[31]孟凡娟, 王秋玉, 王建中, 等. 四倍体刺槐的抗盐性[J]. 植物生态学报, 2008, 32(3): 654-663.
MENG F J, WANG Q Y, WANG J Z,etal. Salt resistance of tetraploidRobiniapseudoacacia[J].JournalofPlantEcology, 2008, 32(3): 654-663.
[32]李培旺, 李昌珠, 周朴华, 等. 绿玉树多倍体诱导及其抗寒性研究[J]. 湖南林业科技, 2004, 31(5): 7-9.
LI P W, LI C Z, ZHOU P H,etal. Polyploid induce and the cold-resistant characteristics of the induced polyploid plantlets forEuphorbiatirucalli(L.)[J].HunanForestryScience&Technology, 2004, 31(5): 7-9.
[33]孟华兵. 白菜型油菜同源四倍体与二倍体之间盐和镉胁迫耐性的差异及其分子机理[D]. 杭州: 浙江大学, 2010.
[34]周珊珊, 谢利, 王辰辉, 等. 环境胁迫对不同倍性大花蕙兰类原球茎增殖和分化的影响[J]. 植物生理学报, 2015, 51(8): 1 265-1 272.
ZHOU S S, XIE L, WANG C H,etal. Effects of environmental stress on proliferation and differentiation of protocorm-like bodies of different ploidyCymbidiumhybridum[J].PlantPhysiologyJournal, 2015, 51(8): 1265-1272.
[35]张蜀宁, 张振超, 张红亮, 等. 低温胁迫对不同倍性不结球白菜生长及生理生化特征影响[J]. 西北植物学报, 2008, 28(1): 109-112.
ZHANG S N, ZHANG Z C, ZHANG H L,etal. Growth, physiological and biochemical characteristics of non-heading Chinese cabbage under low temperature stress[J].ActaBot.Boreal.-Occident.Sin., 2008, 28(1): 109-112.
[36]魏跃, 李振陆, 陈啸寅, 等. 二、四倍体矮牵牛农艺性状与耐热性比较研究[J]. 福建农业学报, 2010, 25(2): 187-191.
WEI Y, LI Z L, CHEN X Y,etal. Agronomic traits and heat tolerance of diploid and tetraploid petunia[J].FujianJournalofAgriculturalSciences, 2010, 25(2): 187-191.
[37]DONG Y P, FAN G Q, ZHAO Z L,etal. Compatible solute, transporter protein, transcription factor, and hormone-related gene expression provides an indicatorof drought stress inPaulowniafortunei[J].FunctIntegrGenomics, 2014,14: 479-491.
[38]朱红菊, 刘文革, 赵胜杰, 等. NaCl胁迫对不同倍性西瓜幼苗K+、Na+和Ca2+质量分数的影响[J]. 西北农业学报, 2014, 23(3): 151-158.
ZHU H J, LIU W G, ZHAO S J,etal. Effects of NaCl stress on mass fractions of Na+, K+and Ca2+in different ploidy watermelon seedlings[J].ActaAgriculturaeBoreali-OccidentalisSinica, 2014, 23(3): 151-185.
[39]田永生, 赵晓明. 蒲公英二倍体与四倍体的几个生理指标比较[J]. 中国农学通报, 2007, 23(6): 345-348.
TIAN Y S, ZHAO X M. Comparison of several physiological indexes in diploid and tetraploid plant ofT.mongolicumHand[J].ChineseAgriculturalScienceBulletin, 2007, 23(6): 345-348.
[40]ZHANG Y X, HU C G, YAO J L. Tetraploidization of diploidDioscorearesults in activation of the antioxidant defense system and increased heat tolerance[J].JournalofPlantPhysiology, 2010, 167(2): 88-94.
[41]DONG S W, ADAMS K L. Differential contributions to the transcriptome of duplicated genes in response to abiotic stresses in natural and synthetic polyploids[J].NewPhytologist, 2011, 190: 1 045-1 057.
[42]PAN X Z, XIAO Y, WANG Z N,etal. Tetraploids Isatis indigotica are more responsive and adaptable to stresses than the diploid progenitor based on changes in expression patterns of a cold inducibleIiCPK1[J].CellularandMolecularBiology, 2008, 63(4): 535-541.
[43]TAN F Q, HONG T, LIANG W J,etal. Comparative metabolic and transcriptional analysis of a doubled diploid citrus rootstock (C.junoscv.Ziyangxiangcheng) suggests its potential value for stress resistance improvement[J].BMCPlantBiology, 2015, 15(1):1-14.
[44]ALLARIO T, BRUMOS J, COLMENERO-FLORES J M,etal. Tetraploid Rangpur lime rootstock increases drought tolerance via enhanced constitutive root abscisic acid production[J].PlantCellEnvironment, 2013, 36: 856-868.
[45]刘文革. 不同染色体倍性西瓜(Citrulluslanatus)的遗传变异和抗逆机理研究[D]. 陕西杨陵: 西北农林科技大学, 2003.
[46]朱红菊, 刘文革, 赵胜杰, 等. NaCl胁迫下二倍体和同源四倍体西瓜苗DNA甲基化差异分析[J]. 中国农业科学, 2014, 47(20): 4 045-4 055.
ZHU H J, LIU W G, ZHAO S J,etal. Comparison between tetraploid watermelon(Citrulluslanatus) and its diploid progenitor of DNA methylation under NaCl stress[J].ScientiaAgriculturaSinica, 2014, 47(20): 4 045-4 055.
[47]孟华兵, 杜雪, 姜宇晓, 等.镉胁迫下二倍体和同源四倍体油菜DNA甲基化差异分析. 核农学报, 2010, 24(6): 1 297-1 304.
MENG H B, DU X, JIANG X Y,etal.Comparison between tetraploid turnip(Brassicarapa) and its diploid progenitor of DNA methylation under cadmium stress[J].JournalofNuclearAgriculturalSciences, 2010, 24(6): 1 297-1 304.
[48]SUGIYAMA S. Differentiation in competitive ability and cold tolerance between diploid and tetraploid cultivars inLoliumperenne[J].Euphytica, 1998, 103: 55-59.
[49]贾林光, 王红宁, 邵建柱, 等. 二倍体、四倍体苹果矮化砧木SH40抗寒性的比较研究[J]. 河北农业大学学报, 2015, 38(4): 62-65.
JIA L G, WANG H N, SHAO J Z,etal. Comparison of cold resistance between the diploid and tetraploid apple dwarf rootstock SH40[J].JournalofAgriculturalUniversityofHebei, 2015, 38(4): 62-65.
[50]邹兴建. 研究干旱胁迫下不同倍性水稻的生理差异及 ABA 相关基因表达比较[D]. 成都:四川农业大学, 2010.
(编辑:裴阿卫)
Research Progress on Stress Resistance in Polyploidy Plants
WEI Wang1, SHI Fuchao1, WANG Dongwei1, PENG Li1,2, GE Gang1, SUN Baoteng1*
(1 School of Life Sciences, Nanchang University, Nanchang 330031, China; 2 Vastec Medical (Shanghai) Limited Company, Nanchang 330031, China)
Abstract:Many researchers found that stress environment induced the formation of polyploidy plant. Simultaneously, it might be the stress that acted as a key factor to select polyploidy plants to survive in that rigid environment. The size of cells and organs in polyploidy plants were always larger, but not of the size of the whole plant. Polyploidy plants had increased resistance in some major stress environments such as low temperature, high temperature, drought, salinity and pathogenic stress. The elevated resistance to stress was achieved due to changing the cell dimension and structure, changing the membrane system, enhancing the osmotic substances, elevating the activity of antioxidative system, altering the gene expressing and epigenetic changes. However, there were also researchers showed that the stress resistance of polyploidy plants was shrunk down. We could not illustrate the mechanism of stress resistance of polyploidy plants unless do more detailed studies. This article presents a review on the formation and characteristics of polyploidy plants and its response and regulation mechanisms under stress conditions.
Key words:polyploidy plants; stress environment; resistance mechanism
文章编号:1000-4025(2016)04-0846-11
doi:10.7606/j.issn.1000-4025.2016.04.0846
收稿日期:2015-12-29;修改稿收到日期:2016-04-03
基金项目:国家自然科学基金(31160297/C130407);江西省研究生创新专项资金(YC2015-S026)
作者简介:魏望(1992-),女,硕士研究生,主要从事植物生理学研究。E-mail:632466784@qq.com *通信作者:孙宝腾,副教授,硕士生导师,主要从事植物逆境生理研究。E-mail:sbt72@163.com
中图分类号:Q945.78;Q343.2+44
文献标志码:A

