壳聚糖改性及其在造纸白水中的抑菌应用研究
张 明 杨仁党 李知函 杨 飞
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
·抑菌剂·
壳聚糖改性及其在造纸白水中的抑菌应用研究
张 明 杨仁党 李知函 杨 飞
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
壳聚糖经冰醋酸溶解、氢氧化钠碱性润胀和冷冻预处理后,利用有机溶剂对壳聚糖置换脱水,再与2,3-环氧丙基三甲基氯化铵(ETA)制备不同取代度的壳聚糖季铵盐;利用制备的壳聚糖季铵盐作为抑菌剂对造纸厂白水中常见的细菌(如大肠杆菌和金黄色葡萄球菌等)进行抑菌实验,并与常用抑菌剂进行比较,且将其与常用抑菌剂异噻唑啉酮复配,进行大肠杆菌和金黄色葡萄糖球菌抑菌效果实验。实验结果表明,通过用异丙醇对壳聚糖置换脱水,与空白样相比壳聚糖季铵盐得率提高14.3个百分点,产物得率最高可达到60.3%;从实际抑菌效果及生产成本考虑,最佳底物反应比例是n(壳聚糖)∶n(ETA)=1∶6;壳聚糖季铵盐也是一种广谱抑菌剂,在异噻唑啉酮中加入用量20%的壳聚糖季铵盐,具有最好的复配抑菌性能。
壳聚糖季铵盐;异丙醇;造纸白水;抑菌效果;复配
(*E-mail: 1020742122@qq.com)
造纸白水中含有纤维素、半纤维素、木素以及施胶剂、改性淀粉等,这为微生物的生长繁殖提供了丰富的营养[1],且封闭白水体系的温度也适合微生物的生长繁殖[2]。这会导致浆料中腐浆的产生,进而引起管道堵塞和设备腐蚀,降低生产效率;同时腐浆还会造成孔眼、暗斑等纸病[3]。为解决因造纸生产过程中微生物生长而引起的各种问题,提高产品质量,实现连续高效清洁生产,必须使用抑菌剂对白水系统中的微生物进行抑菌、杀菌控制[4]。目前用在造纸白水中的抑菌剂主要有氧系、氯系、溴系,但大多数在毒性、可降解性及环保方面难满足造纸工业的生产要求[5]。
壳聚糖作为一种来源丰富的生物质资源,具有良好的生物相容性、无毒性、生物降解性和广谱的抗菌抑菌等性能,其在新型抑菌材料制备、造纸白水处理等方面有着广阔的应用前景[6-9]。但壳聚糖存在分子间与分子内氢键,结晶度较高,在水中不溶解。为提高壳聚糖的水溶性,以进一步改善其对造纸白水中微生物的抑菌效果,需对天然的壳聚糖进行化学改性[10]。由于壳聚糖分子链上含有氨基、伯羟基和仲羟基等反应性官能团,可以对壳聚糖进行改性以提高其溶解和抑菌效果[11]。
本研究以无毒、绿色、环保为理念,对壳聚糖进行改性,合成一种抑菌剂——壳聚糖季铵盐,分析置换脱水剂乙醇、异丙醇对合成工艺的影响、壳聚糖季铵盐的抑菌效果和机理,以及复配抑菌剂对白水微生物的抑菌效果。
1 实 验
1.1 实验原料
壳聚糖(CTS,脱乙酰度90.61%,相对分子质量1.0×105);2,3-环氧丙基三甲基氯化铵(ETA);大肠杆菌(ATCC8739)、金黄色葡萄球菌(ATCC-6538)、绿脓杆菌(ATCC9027)、黑曲霉菌(ATCC-16404)和枯草杆菌(ATCC6633)。
1.2 化学药品
置换脱水剂:乙醇,异丙醇。
常用抑菌剂:异噻唑啉酮,吡啶硫酮锌,十六烷基三甲基氯化铵。
1.3 实验仪器
高速分散机、反应釜、电子分析天平、EVO18型扫描电子显微镜(SEM)、空气摇床、压力蒸汽灭菌锅、无菌操作台、生化培养箱。
1.4 壳聚糖季铵盐的制备
将总质量为1.00 kg壳聚糖分多次溶于体积分数为2%的醋酸溶液中,在高速分散机中完全溶解后滴加质量分数40%的NaOH溶液,调节壳聚糖溶液的pH值到10左右,使壳聚糖完全析出,在-18℃冷冻条件下放置24 h后解冻,用水洗涤至中性。最后,用一定体积的乙醇或异丙醇分批次加入到壳聚糖中进行洗涤,置换出壳聚糖中的水。
将预处理过的壳聚糖转移到30 L反应釜中,加入异丙醇搅拌分散成浆状,并按一定比例分多次加入ETA,反应条件如表1所示。反应结束后,冷却到室温。真空减压抽滤,用质量分数75%的乙醇洗涤(重复处理3次),干燥得壳聚糖季铵盐粗产品,将壳聚糖季铵盐粗产品置于冷冻干燥器中干燥,得壳聚糖季铵盐精制品。

表1 壳聚糖季铵盐的制备工艺条件
1.5 壳聚糖季铵盐取代度的测定
称取0.6 g(精确至0.001 g)壳聚糖季铵盐精制品于250 mL锥形瓶中,加入100 mL蒸馏水使其充分溶解,加入5 g/L的铬酸钾溶液2 mL,用0.05 mol/L的硝酸银标准溶液滴定至砖红色沉淀刚出现即为滴定终点。另取一锥形瓶加入100 mL蒸馏水作空白对照实验。每组实验做3次,取平均值。取代度用式(1)计算。
(1)
式中,DS为取代度;V1为蒸馏水消耗AgNO3标准溶液体积,mL;V2为试样消耗AgNO3标准溶液体积,mL;c为AgNO3标准溶液浓度,mol/L;314为壳聚糖季铵盐的摩尔质量,g/mol;m为壳聚糖季铵盐的质量,g。
1.6 壳聚糖季铵盐抑菌性能检测及分析
1.6.1 菌种的活化与计数
制备150 mL液体培养基,灭菌后将冷藏保存的菌种加入到液体培养基中,置于38℃空气摇床中培养12 h,使细菌浓度约为108cfu/mL。然后把各菌液分别稀释至102、104、106、108倍,对活菌进行计数。
1.6.2 抑菌实验
将不同取代度的壳聚糖季铵盐精制品、异噻唑啉酮、吡啶硫酮锌、十六烷基三甲基氯化铵分别配成浓度为100、250、500、750、1000 mg/L溶液。准确移取0.1 mL菌液均匀地涂在培养基上,再往培养基上加入0.1 mL不同浓度的溶液,将溶液涂匀,每个浓度制备3个平行样。另设置空白对照组,涂菌,以等量无菌水代替上述溶液,处理完后将培养皿放到37℃生化培养箱中培养24 h。统计菌落个数,计算各抑菌剂的在不同浓度下的抑菌率。抑菌率用式(2)计算。
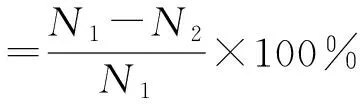
(2)
式中,N1为未经抑菌剂处理的空白样培养基上的菌落数,N2为经抑菌剂处理后培养基上菌落数。
1.6.3 扫描电子显微镜分析
将25 mL 1000 mg/L壳聚糖季铵盐配制成一定浓度的溶液加入到装有25 mL一定稀释度菌液的试管中,设置空白组,摇床上38℃振荡处理4 h,然后吸取适量液体滴加到铝箔上,自然风干。最后对铝箔表面进行喷金处理,置于EVO 18型扫描电镜下,放大不同倍数进行观察。
1.7 与异噻唑啉酮复配进行抑菌效果检测
在一定量的异噻唑啉酮中分别加入0、10%、20%、30%、40%壳聚糖季铵盐进行复配,再把复配抑菌剂配成100、250、500、750、1000 mg/L共5个浓度,按1.6.2步骤对大肠杆菌、金黄色葡萄球菌做抑菌实验。
2 结果与讨论
2.1 置换脱水剂对反应的影响
采用等量异丙醇和乙醇对经过预处理的壳聚糖置换脱水,然后与ETA在一定反应温度和时间下进行反应,最后得到的产物呈淡黄色,产物得率、取代度如表2所示。由表2可知,壳聚糖未经脱水时,产物得率为46.0%,取代度为0.62,而经异丙醇处理后,产物得率能达到60.3%,取代度达到0.86,得率提高14.3个百分点,取代度提高0.24。故对壳聚糖进行置换脱水能明显提高产物的得率和取代度。出现这种现象主要是由于反应体系的水会使醚化剂水解且产物溶于水后体系黏度会增大,颗粒会聚集在一起,阻碍传热传质,不利于亲和取代反应,降低反应效率,从而降低产物得率和取代度。另外,在实验过程中发现,当壳聚糖在反应前未经脱水处理时,最后所得的壳聚糖季铵盐呈淡黄色黏稠状,产物黏度很大,不易从反应釜中取出,而壳聚糖经脱水处理后再与ETA反应,所得产物呈淡黄色颗粒状,黏度很小,易从反应釜中取出。故对壳聚糖进行脱水处理,一方面能提高产物得率,另一方面也使产物方便取出,可提高生产效率。
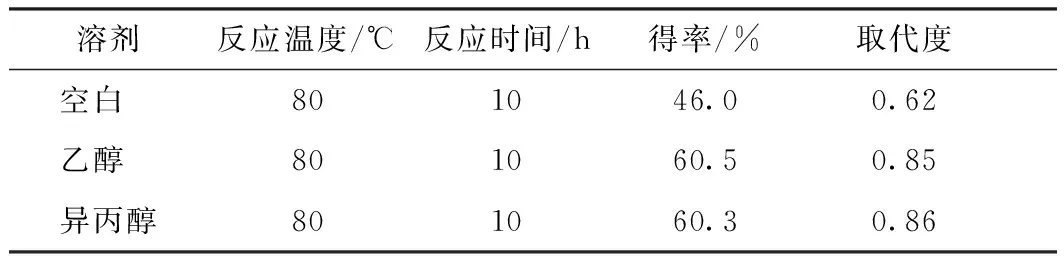
表2 置换脱水剂对产物得率和取代度的影响
从表2可以看出,采用乙醇和异丙醇对壳聚糖进行脱水处理都能显著提高产物得率和取代度,且采用乙醇脱水和异丙醇脱水的产物得率、取代度都相当。但采用乙醇脱水时,脱水后的壳聚糖里残留有大量乙醇,而乙醇的沸点为78.3℃,当反应温度高于78.3℃时,在反应过程中乙醇会挥发出来,存在安全隐患,故反应温度应低于78.3℃。异丙醇的沸点为82.5℃,当反应温度高于78.3℃而低于82.5℃时,异丙醇不会挥发出来,故反应温度可高于78.3℃。在一定温度范围内,由于产物的得率、取代度会随着温度的升高而提高[12],因此反应温度越接近82.5℃,产物的得率、取代度就会越高,故采用异丙醇比采用乙醇的效果好。另一方面,由于反应物是在异丙醇作为溶剂下进行反应的,为了方便溶剂的蒸馏回用,采用异丙醇作为置换脱水剂。
2.2 反应物摩尔比对抑菌效果的影响
图1和图2分别为反应物摩尔比[n(壳聚糖)∶n(ETA)]对大肠杆菌和金黄色葡萄球菌抑菌率的影响。从图1、图2可以看出,壳聚糖季铵盐对大肠杆菌与金黄色葡萄球菌的抑菌率随反应物摩尔比的增加而增加,而当ETA用量达到壳聚糖的6倍以后,抑菌率增加不再明显。这是由于壳聚糖季铵盐的抑菌效果与壳聚糖季铵盐的取代度有关,取代度越高,单位质量的壳聚糖季铵盐含有越多的正电荷,可能就越容易吸附在带负电的细胞壁上,破坏细胞的正常生理活动,使细菌死亡。表3为反应物摩尔比对壳聚糖季铵盐取代度的影响。由表3可知,壳聚糖季铵盐的取代度随反应物摩尔比的增加而增加,这是因为壳聚糖不溶于异丙醇,壳聚糖与ETA接触几率随ETA用量的增加而增加,有利于亲核反应[12];但当ETA用量达到壳聚糖的6倍时,壳聚糖上可供取代的基团有限,且随着反应的进行,空间位阻也会增加,取代反应不易进行,故继续增加ETA用量,产物的取代度变化不大;另外,从表3中也可看出采用有机溶剂对壳聚糖进行置换脱水,与空白样相比取代度提高的相当明显,其中采用异丙醇对壳聚糖置换脱水,取代度提高最明显。当n(壳聚糖)∶n(ETA)=1∶6,且采用异丙醇对壳聚糖脱水时,从实际抑菌效果及生产成本考虑,可使企业获得最大效益。

图1 反应物摩尔比对大肠杆菌抑菌率的影响

图2 反应物摩尔比对金黄色葡萄球菌抑菌率的影响

置换脱水剂取代度n(壳聚糖)∶n(ETA)1∶21∶41∶61∶81∶10空白 0.340.500.620.630.64乙醇 0.380.680.790.810.82异丙醇0.410.710.860.860.88
另外,从图1、图2也可以发现,壳聚糖季铵盐对两种菌的抑菌效果随浓度的增加而提高,但壳聚糖季铵盐在各浓度下对金黄色葡萄球菌的抑菌效果要比对大肠杆菌的效果差,这主要是由于金黄色葡萄球菌是典型的革兰氏阳性菌,细胞壁较厚,约20~80 nm,肽聚糖含量丰富,有15~50层。大肠杆菌是革兰氏阴性菌,细胞壁厚度约10 nm,仅2~3层肽聚糖[13]。带正电的壳聚糖季铵盐吸附在带负电的细胞壁上[14],而细胞壁越薄,壳聚糖季铵盐可能越易进入细胞内部,其生长所需的平衡也越易遭到破坏,最后细胞可能会发生凹陷而死亡。因此壳聚糖季铵盐对大肠杆菌的抑菌效果要比对金黄色葡萄糖球菌的好。
2.3 壳聚糖季铵盐的抑菌机理分析

图3 壳聚糖季铵盐处理大肠杆菌前后的SEM照片
利用壳聚糖季铵盐对白水中常见的大肠杆菌和金黄色葡萄球菌进行处理,在SEM下进行观察,结果如图3、图4所示。从图3可以看出大肠杆菌呈杆状,在未经处理时,细胞表面光滑,而经处理后,细胞表面发生凹陷。从图4可以看出金黄色葡萄球菌呈球状,未经处理时,细胞表面光滑,而经处理后细胞也发生凹陷。这主要是由于壳聚糖季铵盐带正电,吸附带负电的大肠杆菌和金黄色葡萄球菌的细胞壁[14],在菌体细胞壁表面形成一层膜,菌体细胞膜的通透性会发生改变,使细胞膜丧失选择透过性。这样细胞内部一些重要的离子如钠离子、钾离子会泄漏出去,离子的流失会影响细胞内外渗透压,这破坏了原有的平衡,细胞发生破裂,使得细胞的原生质如蛋白质、水等渗出,菌体表面发生凹陷,最后死亡。另外,小分子的壳聚糖季铵盐可能会通过细胞膜进入细胞体内,吸附带有阴离子的细胞质,并与其发生絮凝作用扰乱细胞正常生理活动,细胞发生破裂,菌体凹陷而死去。

图4 壳聚糖季铵盐处理金黄色葡萄球菌前后的SEM照片
2.4 壳聚糖季铵盐与常见抑菌剂的对比

图5 不同抑菌剂对大肠杆菌的抑菌率
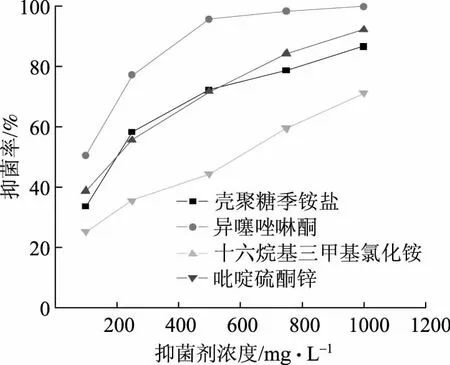
图6 不同抑菌剂对金黄色葡萄球菌的抑菌率
将壳聚糖季铵盐与造纸行业常用的异噻唑啉酮、吡啶硫酮锌、十六烷基三甲基氯化铵3种抑菌剂进行抑菌性能对比,结果如图5和图6所示。通过对比分析可知,壳聚糖季铵盐的抑菌效果与异噻唑啉酮的抑菌效果相差较大,但其与吡啶硫酮锌相比,具有很大的优势。从图5、图6也可以发现,随着抑菌剂浓度的增加,壳聚糖季铵盐对两种菌的抑菌曲线与十六烷基三甲基氯化铵的抑菌曲线分别在一定浓度出现交点,且两条曲线间的距离相差不大,抑菌率最大差值不到5%,可以认为两种抑菌剂的抑菌效果基本相当。但是,十六烷基三甲基氯化铵对水生生物有极高毒性,长期使用会对水体环境产生不良影响[15],故不适宜用于处理造纸白水。而壳聚糖季铵盐是一种环保抑菌剂,其对微生物有良好的抑菌效果,可用于处理造纸白水中的微生物。
2.5 壳聚糖季铵盐的广谱性分析
造纸白水中常见的微生物除大肠杆菌、金黄色葡萄球菌以外,主要还有黑曲霉菌、绿脓杆菌、枯草杆菌等[16],因此检测壳聚糖季铵盐对黑曲霉菌、绿脓杆菌、枯草杆菌的抑菌效果结果见图7。从图7可知,壳聚糖季铵盐对黑曲霉菌、枯草杆菌、绿脓杆菌均有显著的抑菌效果,且抑菌效果随浓度的增加而提高。再结合图5、图6可知壳聚糖季铵盐对白水中常见的5种微生物均有显著的抑菌效果,可以认为壳聚糖季铵盐是一种广谱抑菌剂。
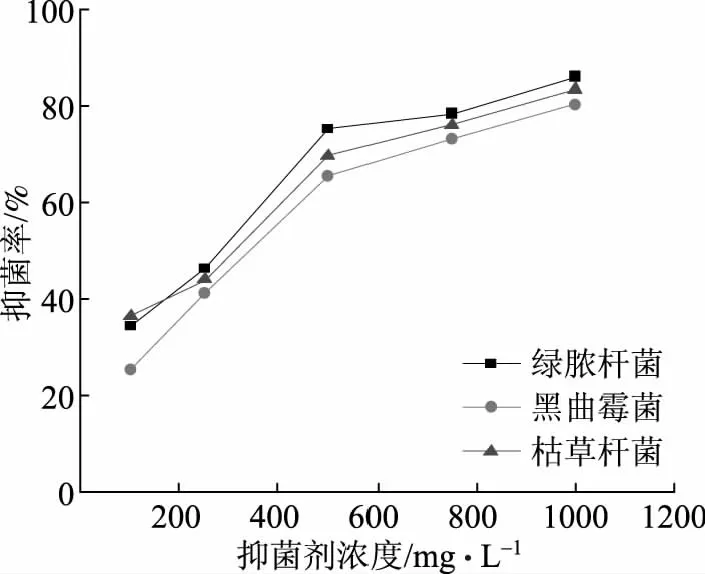
图7 壳聚糖季铵盐对绿脓杆菌、黑曲霉菌、枯草杆菌的抑菌率
2.6 壳聚糖季铵盐与异噻唑啉酮复配的抑菌效果
异噻唑啉酮是造纸企业处理白水微生物常用的抑菌剂,异噻唑啉酮抑菌是依靠杂环上的S—N键活性部位与蛋白质的半胱氨酸上的巯基形成二硫键,从而使蛋白质失活,达到抑菌的目的[17]。而壳聚糖季铵盐的抑菌作用主要是改变细胞膜的通透性,最后使细胞发生凹陷达到抑菌的目的。由于两种抑菌剂的抑菌机理不同,实验对其进行复配,以期在抑菌效果上相互补充。
把壳聚糖季铵盐与异噻唑啉酮进行复配,然后处理大肠杆菌与金黄色葡萄球菌,抑菌效果如表4、表5所示。从表4和表5可知,在相同用量时,两种抑菌剂复配后的抑菌效果明显好于异噻唑啉酮单一使用时的效果。当抑菌剂浓度为100、250、500 mg/L时,随着壳聚糖季铵盐用量的增加,复配抑菌剂对两种菌的抑菌效果提高,但是当壳聚糖季铵盐用量大于20%时,抑菌率下降,因此从实际抑菌效果考虑可选取在异噻唑啉酮中加入用量20%壳聚糖季铵盐。另外,在工业上如果长期使用单一抑菌剂也会使微生物产生抗药性,将两种抑菌剂复配使用,能有效避免这一问题[18]。
因此,把壳聚糖季铵盐与异噻唑啉酮进行复配,不仅能提高抑菌效果,同时也能有效缓解白水微生物对单一抑菌剂产生耐药性的问题。

表4 复配抑菌剂对大肠杆菌的抑菌率
注 壳聚糖季铵盐用量均相对于异噻唑啉酮,以下同。

表5 复配抑菌剂对金黄色葡萄球菌的抑菌率
3 结 论
(1)采用异丙醇和乙醇对壳聚糖置换脱水都能显著提高壳聚糖季铵盐得率和取代度,但使用异丙醇时的取代度和得率更高,得率能达到60.3%、取代度达到0.86,与空白样相比得率提高14.3个百分点、取代度提高0.24。
(2)壳聚糖季铵盐的抑菌机理是带正电的壳聚糖季铵盐吸附在带负电的细胞壁表面,改变细胞膜的通透性,同时相对分子质量小的壳聚糖季铵盐也会进入细胞内部,破坏细胞正常生长所需的各种平衡,细胞发生凹陷,菌体死亡。
(3)不同反应物摩尔比生产的壳聚糖季铵盐产品对大肠杆菌、金黄色葡萄球菌均有抑菌效果。从实际抑菌效果及生产成本考虑,最佳n(壳聚糖)∶n(ETA)=1∶6,此条件下生产的壳聚糖季铵盐对黑曲霉菌、绿脓杆菌、枯草杆菌也都具有很好的抑菌效果,是一种广谱抑菌剂,可用于处理造纸白水中的微生物;其抑菌效果比异噻唑啉酮的低,但比吡啶硫酮锌的高,与十六烷基三甲基氯化铵的效果相当。
(4)壳聚糖季铵盐与异噻唑啉酮复配后,能提高处理白水微生物的效果,从实际抑菌效果考虑,在异噻唑啉酮中加入用量20%壳聚糖季铵盐最好,同时也能有效缓解白水微生物对单一抑菌剂产生耐药性的问题。
[1] MO Li-huan, CHEN Ke-fu, CHEN Zu-xin. The summary of biocide used in papermaking industry[J]. Paper Chemicals, 2004, 16(2): 7.
莫立焕, 陈克复, 陈祖鑫. 杀菌防腐剂在造纸工业中的应用概述[J]. 造纸化学品, 2004, 16(2): 7.
[2] YANG Ren-dang, CHEN Ke-fu, CHEN Xue-zhi, et al. Biocides: Solve the Microbial Contaminant Problems in Papermaking Process[J]. China Pulp & Paper, 2002, 21(2): 49.
杨仁党, 陈克复, 陈学志, 等. 应用杀菌剂解决造纸过程中的微生物污染[J]. 中国造纸, 2002, 21(2): 49.
[3] Linda R, Robertson, XIONG Kun. Microbial Contamination Causes Papermaking Problems[J]. China Pulp & Paper, 2000, 19(2): 51.
Linda R, Robertson, 熊 坤. 造纸过程中由微生物污染所造成的问题及其解决措施[J]. 中国造纸, 2000, 19(2): 51.
[4] HUANG Xiao-mo, MAI Ai-ping, LI Jing, et al. Effectiveness of two non-oxidative microbicides in microbial contamination control of papermaking white water[J]. Paper Chemicals, 2007, 19(4): 30.
黄小茉, 麦霭平, 李 静, 等. 2种非氧化型杀菌剂在造纸白水中的应用效果[J]. 造纸化学品, 2007, 19(4): 30.
[5] HUANG Liang-hui, YANG Ren-dang, YANG Fei, et al. Novel Cationic Biocides of Quaternary Ammonium Salt Applied in Microbial Contamination Control of Papermaking White Water[J]. China Pulp & Paper, 2009, 28(2): 36.
黄良辉, 杨仁党, 杨 飞, 等. 新型阳离子季铵盐杀菌剂在造纸白水中的应用[J]. 中国造纸, 2009, 28(2): 36.
[6] Dina Raafat, Hans-Georg Shal. Chitosan and its antimicrobial potential-A critical literature survey[J]. Microbial Biotechnology, 2009, 2: 186.
[7] ZHANG Mei-yun, GUO Hui-ping. Preparation of Quaternary Ammonium Salt of Chitosan and Its Application in Antibacterial Paper[J]. China Pulp & Paper, 2008, 27(2): 14.
张美云, 郭慧萍. 壳聚糖季铵盐的制备及其在抗菌纸中的应用[J]. 中国造纸, 2008, 27(2): 14.
[8] Timofeeva L, Kleshcheva N. Antimicrobial polymers mechanism of action,factors of activity and applications[J]. Appl. Microbiol. Biotechno., 2011, 89: 475.
[9] HU Fang, LI Xu-ying, ZENG Xu. Preparation of Chitosan-montmorillonite Coated Antibacterial and Its Properties[J]. China Pulp & Paper, 2015, 34(6): 1.
胡 芳, 李旭英, 曾 旭. 壳聚糖-蒙脱土复合抗菌涂布纸的制备及性能研究[J]. 中国造纸, 2015, 34(6): 1.
[10] ZHOU Jing-run, XIN Mei-hua, LI Ming-chun. Research progress of preparation of chitosan quatemary salts and its applicaion[J]. Chemical Industry and Engineering Progress, 2008, 27(5): 679.
周景润, 辛梅华, 李明春. 壳聚糖季铵盐的制备及其应用研究进展[J]. 化工进展, 2008, 27(5): 679.
[11] CAI Zhao-sheng, SONG Zhan-qian, YANG Chun-sheng, et al. Research progress in preparation of chitosan quatemary salts and their application[J]. Biomass Chemical Engineering, 2009, 43(1): 28.
蔡照胜, 宋湛谦, 杨春生. 壳聚糖季铵盐的制备与应用研究进展[J]. 生物质化学工程, 2009, 43(1): 28.
[12] WEN Wen-zhong, LAN Yi-jun, LIN Ping, et al. Study on the preparation of quaternary ammonium salt of chitosan by open-loop method of derivatives[J]. Flavour Fragrance Cosmetics, 2012(1): 42.
温文忠, 蓝艺珺, 林 萍, 等. 环氧衍生物开环法制备壳聚糖季铵盐的工艺研究[J]. 香料香精化妆品, 2012(1): 42.
[13] ZHOU De-qing. Microbiology Tutorial[M]. Beijing: Higher Education Press, 2001.
周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 2001.
[14] Chung Y C, Chen C Y.Antibacterial characteristics and activity of acid-soluble chitosan[J]. Bioresource Technology, 2008, 99(8): 2806.
[15] XU Yin, GE Fei, TAO Neng-guo, et al. Growth inhibition and mechanism of cetyltrimethyl ammonium chloride on Chlorella vulgaris[J]. Environmental Science, 2009, 30(6): 1767.许 银, 葛 飞, 陶能国, 等. 十六烷基三甲基氯化铵抑制小球藻生长的效应及作用机制[J]. 环境科学, 2009, 30(6): 1767.
[16] LUO Ling-zhi, WANG Jian-hua, QIU Zhen-quan, et al. Microbiological Control in Papermaking Systems[J]. China Pulp & Paper, 2013, 32(6): 64.
罗灵芝, 王建华, 邱振权. 造纸系统中的微生物控制[J]. 中国造纸, 2013, 32(6): 64.
[17] WANG Jin-tao. Studies on the bacteriostatic activity of isothiazolone derivatives[D]. Dalian: Dalian University of Technology, 2013.
王金涛. 异噻唑啉酮衍生物的抑菌活性研究[D]. 大连: 大连理工大学, 2013.
[18] WANG Chun-hua, XIE Xiao-bao, ZENG Chun-yan, et al. The developments microbial resistance to industrial antiseptics and disinfectants[J]. Microbiology China, 2007, 34(4): 791.

(责任编辑:常 青)
Application of Modified Chitosan as Bacteriostatic Agent in White Water
ZHANG Ming*YANG Ren-dang LI Zhi-han YANG Fei
(StateKeyLabofPulpandPaperEngineering,SouthChinaUniversityofTechnology,Guangzhou,GuangdongProvince, 510640)
Natural chitosan (CTS) was first dissolved in acetic acid and fully swelled up with sodium hydroxide, then dehydrated by organic solvents. Subsequently the quatemary ammonium chitosan (QCS) with different substitution degrees were synthesized by the reaction of chitosan 2,3-epoxypropyl trimethyl ammonium chloride(ETA) in different ratio. Two strains including Gram negativeE.coliand Gram positiveS.aureuswere selected for antibacterial tests because they are commonly found in papermaking white water. The antibacterial activities of QCS, isothiazolinone and their mixture were also investigated. Result indicated that isopropyl alcohol was better than ethyl alcohol using for dehydration, the yield of dehydrating chitosan with isopropyl alcohol reached to 60.3%, and 14.3 percentage points higher than the control sample. From the point of view of actual bacteriostatic effect and the production costs, the bestn(CTS)∶n(ETA)was 1∶6. Chitosan quaternary ammonium salt was a broad-spectrum antibacterial agent, the best bacteriostatic performance was achieved by adding 20% quaternary ammonium salt of chitosan to isothiazolinone.
quaternary ammonium salt of chitosan; isopropyl alcohol; papermaking white water; bacteriostatic effect; compounding
张 明先生,在读硕士研究生;研究方向:植物资源综合利用新技术。
2015-10-20(修改稿)
“十二五”国家科技支撑计划项目(2013BAC01B03)。
TS727+.2
A DOI:10.11980/j.issn.0254- 508X.2016.04.004

