宫颈癌和子宫内膜癌诊疗中盆腔淋巴结状态的检测及意义
邓丽慧,符淳
宫颈癌和子宫内膜癌诊疗中盆腔淋巴结状态的检测及意义
邓丽慧,符淳△
【摘要】淋巴结转移作为宫颈癌和子宫内膜癌的主要转移途径,是影响其预后的重要因素。在治疗前和治疗过程中如何检测和评估这2种恶性肿瘤的盆腔淋巴结状态仍处于初步探索阶段。目前检测淋巴结状态的方法有超声检查、计算机断层扫描、磁共振成像(MRI)、正电子发射计算机断层显像(PET-CT)和前哨淋巴结活检定位等。不同检查方法的原理不同,其敏感度、特异度和准确度等方面各有优劣。随着影像学技术及显像生物制剂的发展,淋巴结状态检测已由单纯形态学向功能学转变。彩色多普勒超声、弥散加权成像及PET-CT等均在传统影像学技术上进一步提高了敏感度和特异度,其中PET-CT和功能性MRI在检测的敏感度、特异度和准确度等方面尤其具有优势;显像生物制剂通过不断发展,已逐渐细化为针对淋巴结内肿瘤细胞代谢、血管和淋巴回流等三方面的特异性淋巴造影剂。
【关键词】淋巴结;宫颈肿瘤;子宫内膜肿瘤;超声检查;磁共振成像;正电子发射断层显像术;前哨淋巴结活组织检查
作者单位:410011长沙,中南大学湘雅二医院妇产科
△审校者
(J Int Obstet Gynecol,2016,43:151-155)
宫颈癌和子宫内膜癌是两种最常见的妇科恶性肿瘤,严重威胁广大妇女的生命健康。在术前对患者病情进行准确评估,是制定适宜治疗策略的前提和基础。淋巴结转移作为宫颈癌和子宫内膜癌的主要转移途径,是影响患者生存率、肿瘤复发等预后的重要因素,也是将盆腔淋巴结清扫术列入早期宫颈癌和具有高危因素的子宫内膜癌的常规手术的理由。掌握淋巴结诊疗中的状态有助于更好地评估患者的预后、评价治疗效果及指导医生为患者制定更好的治疗方案。然而,在治疗前和治疗过程中如何检测和评估这2种恶性肿瘤的盆腔淋巴结状态仍处于初步探索中。近年随着影像学技术及显像生物制剂的发展,该项研究得以进展。本文将临床常用检查方法进行介绍与比较,并将近年取得的发展成果及未来发展方向进行阐述。
1 盆腔淋巴结分布特点及淋巴结转移的意义
盆腔淋巴结分为髂外、髂内、髂总淋巴结。髂外淋巴结一般与髂外动静脉伴行;髂内淋巴结常与髂内动静脉各分支伴行,包括闭孔、臀上、臀下、骶侧和内脏(包括宫旁、输尿管和宫颈旁)等淋巴结;髂总淋巴管基本是髂外淋巴结的直接延续,同时接受髂内淋巴结的淋巴引流输出,最后回流入腹主动脉旁淋巴结[1]。
淋巴结转移作为宫颈癌和子宫内膜癌的主要转移途径,是影响患者肿瘤复发和生存率的独立危险因子。Chen等[2]报道的609例宫颈癌患者中,阴性淋巴结数为10个和25个的5年生存率分别为62.8% 和80.5%;在10个<阴性淋巴结数<25个的患者中,按阳性淋巴结率0%、0%~5%、5%~20%、>20%分为4组,各组5年生存率分别为77.8%、0%(病例数为2)、3.2%、0%;阴性淋巴结数>25个的患者中,按阳性淋巴结率0%、0%~5%、5%~20%、>20%分为4组,各组5年生存率分别为87.6%、25%、4.5%、0%。Narayan等[3]对243例子宫内膜癌患者[临床分期国际妇产科联盟(FIGO)Ⅰ~ⅢC期,病理类型包括内膜样腺癌、浆液性癌和透明细胞癌等]的复发进行了多元分析,发现淋巴管血管局部转移的风险比为4.9,淋巴结阳性的风险比更高达8.8。以上2项研究证明了阳性淋巴结不仅使患者生存率减低,还增加了肿瘤复发的风险。
2 检测方法
淋巴结体积小,位置不定,尤其是主动脉旁和髂淋巴结等非外周淋巴结位置深,给临床检测带来难度。近年多种淋巴结检测方法得以发展。
2.1超声检查(ultrasonography)超声波以光点形式组成切面的超声波图像能直观显示脏器的大小、形态及内部结构。有研究对104例ⅠA2~ⅡB期宫颈癌患者术前施行二、三维超声检查发现,无论是主观评价还是客观评价均不能很好地预测淋巴结转移[4]。Sawicki等[5]对90例子宫内膜癌患者施行经腹、经阴道的二维超声波检查,在15例经病理证实的淋巴结转移患者中仅检测到5例,其敏感度、特异度、阳性预测值和阴性预测值分别为33.3%、100%、100%和88.2%,超声检查尽管特异度高,但敏感度低限制其应用。当超声应用多普勒效应探测淋巴结内部血流情况时,良性淋巴结的血流模式为中流(门血管分布),恶性淋巴结为周缘流(外周血管分布)或混合性血管分布,并且转移性淋巴结的阻力指数、搏动指数等客观指标均高于良性淋巴结,提高了辨别良恶性淋巴结的能力,但由于淋巴结检测率仍未提高,并且小淋巴结内血流情况检测困难,多普勒超声并没有显著提高检测敏感度[6]。
2.2计算机断层扫描(computer tomography,CT)CT通过灰阶影像对比分布图和CT值来显示淋巴结的直径和形状。当淋巴结受肿瘤细胞侵犯后CT值可能发生改变,CT图像上因淋巴结中央坏死伴边缘强化呈现出的信号不均性是淋巴结转移的特征性表现。Tsili等[7]比较了14例宫颈癌患者的CT结果与术后病理检查结果发现,CT检测转移性淋巴结的准确率为89%,并且所有假阴性的淋巴结短径均<1cm。Ryo等[8]报道了CT检测子宫内膜癌盆腔淋巴结转移的敏感度及特异度为38%和100%(其中非正常淋巴结直径的截断值设定>5 mm)。由此可见,CT检测2种肿瘤淋巴结状态的敏感度较低,特异度较高,并且淋巴结直径截断值影响其敏感度和特异度。
2.3磁共振成像(magnetic resonance imaging,MRI)Zhang等[9]比较了宫颈癌患者的MRI图像和病理结果,发现MRI检测转移性淋巴结的敏感度、特异度和准确度分别为27.78%、85.98%和77.6%(该研究将短径超过10 mm的淋巴结视为非正常),提示传统MRI在检测淋巴结方面并无优越性。近年MRI功能性成像受到关注。一项研究显示MRI增强扫描识别子宫内膜癌转移性淋巴结的敏感度、特异度、准确度、阳性预测值和阴性预测值分别为45.0%、91.2%、85.6%、40.9%和92.4%[10],其检测转移性淋巴结能力显著提高。弥散加权成像(diffusion weighted imaging,DWI)通过平均表观弥散系数(apparent diffusion coefficient,ADC)来反映组织内水分子弥散和毛细血管微循环情况,转移性淋巴结内肿瘤细胞及新生血管排布密集,水分子运动受到限制,故而ADC值较良性淋巴结小[11]。张洁等[12]研究发现,转移性淋巴结与非转移性淋巴结的短径、长径、短径/长径、最小ADC值及平均ADC值比较差异均有统计学意义,其中平均ADC值优于其他诊断条件,当将平均ADC值为759.0×10-6mm2/s作为截断值时,DWI鉴别良恶性淋巴结的敏感度、特异度分别为95.2%、92.1%。因此,功能性MRI使得MRI不再单一关注淋巴结的大小形态,显著提高了其鉴别淋巴结状态的能力。
2.4正电子发射计算机断层显像(positron-emission tomography/computer tomography,PET/CT)PET/CT由PET提供病灶详尽的功能与代谢分子信息,CT提供病灶的精确解剖定位。在以18氟-脱氧葡萄糖(fluorine-18-fluorodeoxyglucose,18F-FDG)为显像剂的PET/CT图像上,肿瘤组织18F-FDG的标准化摄取值(standardized uptake value,SUV)与正常组织相比明显升高,转移性淋巴结亦是如此。Sironi等[13]比较了47例ⅠA或ⅠB期宫颈癌患者的PET/CT图像与病理结果,发现若淋巴结直径>5 mm时,其检测淋巴结转移的敏感度进一步提高至100%。另有研究通过Meta分析发现PET/CT应用于子宫内膜癌患者时,转移淋巴结检测的整体敏感度、特异度、阳性似然比及阴性似然比分别为63.0%、94.7%、10.465 和0.399,准确度为89.5%,高阳性纵然比肯定了PET/CT阳性发现的可靠性[14]。
为了对上述CT、MRI、PET/CT 3种影像学方法进行比较,Choi等[15]从768篇文献中筛选出41篇合格文献并进行Meta分析,结果显示,若以患者为观察对象,PET或PET/CT的敏感度和特异度均显著高于CT和MRI;若以淋巴结为观察对象,CT、PET或PET/CT的敏感度高于MRI,而MRI、PET或PET/CT的特异度高于CT,见表1。
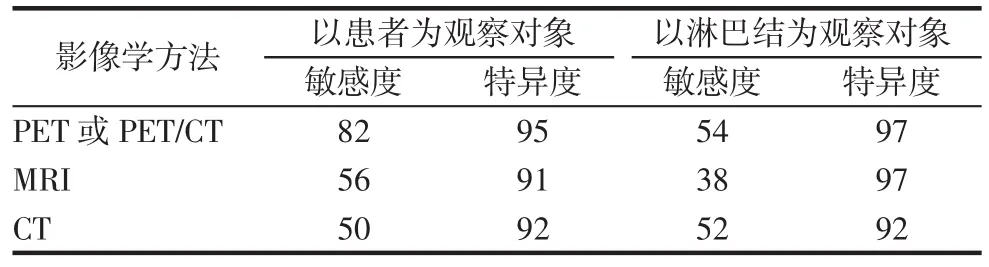
表1 不同影像学方法检测转移性淋巴结敏感度和特异度的比较 (%)
2.5前哨淋巴结定位(sentinel lymph node mapping)前哨淋巴结是肿瘤转移最先受累的淋巴结,可帮助判断盆腔淋巴结状态,指导术中处理和术后治疗。一项Meta分析发现宫颈癌的前哨淋巴结活检术的总阳性率为89.2%,汇总敏感度90%,这种检测率和敏感度还与示踪剂及术前是否进行新辅助化疗有关[16]。Raimond等[17]通过多中心回顾性研究发现,前哨淋巴结活检术与传统淋巴结切除术相比,早期子宫内膜癌淋巴结转移率提高了3倍,并且很大部分为肿瘤微转移。以上例子证明前哨淋巴结定位检测转移性淋巴结的敏感度较高,但其有创性限制其只能术中应用,且不可重复,该技术在宫颈癌和子宫内膜癌中的应用,有望在获得同样的诊断信息和预后信息的同时,降低淋巴水肿等不良反应的风险。
3 影像学检测内容和显像剂
淋巴结的大小(直径)和形状是大多数影像学检测内容。肿瘤细胞在淋巴结内大量增殖,是淋巴结肿大及形状改变的常见原因,但临床上反应性淋巴结肿大并不少见。此外,正常大小的淋巴结同样可能存在微转移,因此单纯依靠形态学来判断淋巴结状态是不够的。有研究发现转移性和非转移性淋巴结的体积范围有很大一部分重叠,相当一部分的转移性淋巴结直径<1 cm[7,18],这是传统CT、MRI检查敏感度低的重要原因之一。
近年淋巴结的功能成像日益受到关注。超声波应用多普勒效应探测淋巴结内部血流情况;DWI通过ADC值来反映淋巴结内水分子弥散和毛细血管微循环情况;PET/CT提供淋巴结细胞的代谢情况,以帮助辨别淋巴结良恶性。淋巴结的特异性显像技术也逐步受到重视,淋巴造影剂分为针对淋巴结内肿瘤细胞代谢、血管和淋巴回流等三方面的特异检测。
3.1检测肿瘤细胞代谢PET-CT常用的2种显影剂18F-FDG和11C-胆碱,其显像原理为转移性淋巴结内肿瘤细胞膜磷脂合成增加,葡萄糖载体增加,细胞内磷酸化酶活性增高,故与正常组织相比,转移性淋巴结摄取更多的脱氧葡萄糖以供代谢所需,摄取更多的胆碱作为磷脂合成底物。
3.2检测血管造影剂用于显示淋巴结内的血管及血管形成情况。Mumprecht等[19]在黑色素瘤小鼠模型上施行了2种PET检查,一种使用了常见的18FFDG显影剂,一种使用了124I标记的淋巴结血管内皮透明质酸受体-1抗体,结果发现后者能显示更多转移性淋巴结,但血管形成同样可以发生在炎症细胞中。新生血管形成既是肿瘤转移的前提和基础,也被用于评价抗肿瘤治疗效果,但尚未有将其应用于宫颈癌、子宫内膜癌患者PET/CT检查的报道,可作为今后研究方向之一。
3.3检测淋巴回流造影剂使盆腔淋巴回流可视化,易于确定前哨淋巴结的位置,其显像剂主要分为肉眼可识别的生物活性染料和需相应设备的放射性核素。术前向宫颈癌患者宫颈注射纳米碳后,在腹腔镜下定位前哨淋巴结的敏感度、准确度和阴性预测值分别为80.0%、100.0%和100.0%[20]。有研究对28例宫颈癌患者皮内注射欧乃影后行MRI检查发现,所有患者的各组淋巴结及淋巴回流均清晰显示,定位前哨淋巴结的敏感度、特异度和阴性预测值分别为83.3%、100%和95.7%[21]。
4 盆腔淋巴结状态的检测意义
4.1疗效评价根据实体瘤的治疗效果评价标准,CT、MRI和PET/CT在临床上用于检测宫颈癌和子宫内膜癌患者疗效。影像学检测的主要内容包括肿瘤大小、病灶信号特点和是否有相邻组织侵犯等。肿瘤复发或残留在MRI上常表现为T1图像上等信号和T2图像上高信号(与周围肌肉组织比较);PET/CT上表现为病灶部位的脱氧葡萄糖和胆碱的摄取率显著高于周围正常组织。PET/CT较MRI更能反映肿瘤治疗中的体积变化程度[22]。多项研究显示PET/CT在检测上述2种肿瘤复发方面,其敏感度、特异度均较高,在临床上也是患者治疗后跟踪随访的重要手段之一[23-24]。近年有研究发现宫颈癌复发患者中,局限于原发宫颈病灶的概率仅34.5%,其余65.5%复发病灶位于宫颈外[25];而子宫内膜癌复发的典型及非典型部位包括阴道、淋巴结、附件、腹膜、肺、中枢神经系统和肌肉骨骼等[26]。因此仅关注原发病灶易造成“假阴性”,关注治疗前后淋巴结状态可作为判断疗效的补充手段之一,但目前相关研究很少。
4.2治疗决策盆腔淋巴结清扫术已列入早期宫颈癌和具有高危因素的子宫内膜癌的常规手术中。但近年有研究发现某些子宫内膜癌患者的淋巴结转移率并不高[27],并且淋巴结切除数与患者生存率、无复发生存期无显著关系[28];而盆腔淋巴结清扫使得手术范围扩大、时间延长、出血增多和感染概率增加,并会增加术后淋巴囊肿等不利因素的发生。如在356例开腹的盆腔及腹主动脉旁淋巴结清扫术的妇科肿瘤(宫颈癌、子宫内膜癌、卵巢肿瘤)患者中,术后下肢淋巴水肿率为21.8%,证实了旋髂淋巴结的清除与其发生正相关[29];在385例低风险子宫内膜癌患者的前瞻性研究中证实,淋巴结切除术提高了患者并发症的发生率且没有带来显著的医疗效益[30]。这些研究结果的发现促使人们去寻求创伤更小、效益更好的个体化治疗方案,前哨淋巴结活检术应运而生,并成为近年的研究热点,但目前尚缺乏可靠的临床依据,在应用于临床,尤其是子宫内膜浆乳癌、腺鳞癌等高危类型时,专家尚保持审慎态度。
5 结语
淋巴结转移作为宫颈癌和子宫内膜癌的主要转移途径,是影响其预后的重要因素之一。随着影像学技术及显像生物制剂的发展,淋巴结状态检测已由单纯形态学向功能学转变,在敏感度、特异度和准确度等方面得到提升,PET/CT和功能性MRI成像在淋巴结检测方面具有优势。在宫颈癌和子宫内膜癌的诊治过程中,如何更加有效评估淋巴结的状态,更加准确地反映治疗过程中淋巴结的变化,是未来淋巴结检测手段发展的方向。
参考文献
[1]冯兰兰,张建平.女性盆腔淋巴结的分布特点及其临床意义[J].国际妇产科学杂志,2012,39(3):265-267.
[2]Chen Y,Zhang L,Tian J,et al. Combining the negative lymph nodes count with the ratio of positive and removed lymph nodes can better predict the postoperative survival in cervical cancer patients[J]. Cancer Cell Int,2013,13(1):6.
[3]Narayan K,Khaw P,Bernshaw D,et al. Prognostic significance of lymphovascular space invasion and nodal involvement in intermediate- and high-risk endometrial cancer patients treated with curative intent using surgery and adjuvant radiotherapy[J]. Int J Gynecol Cancer,2012,22(2):260-266.
[4]Pálsdóttir K,Fischerova D,Franchi D,et al. Preoperative prediction of lymph node metastasis and deep stromal invasion in women with invasive cervical cancer:prospective multicenter study using 2D and 3D ultrasound[J]. Ultrasound Obstet Gynecol,2015,45(4):470-475.
[5]Sawicki W,Spiewankiewicz B,Stelmachów J,et al. The value of ultrasonography in preoperative assessment of selected prognostic factorsinendometrialcancer[J].Eur JGynaecol Oncol,2003,24(3/4):293-298.
[6]Cui XW,Jenssen C,Saftoiu A,et al. New ultrasound techniques for lymph node evaluation[J]. World J Gastroenterol,2013,19 (30):4850-4860.
[7]Tsili AC,Tsangou V,Koliopoulos G,et al. Early -stage cervical carcinoma:the role of multidetector CT in correlation with histopathological findings[J]. J Obstet Gynaecol,2013,33(8):882-887.
[8]Ryo E,Yasugi T,Mizutani K,et al. Diagnostic usefulness of intraoperative ultrasonography in avoiding unnecessary para-aortic lymphadenectomyin women with endometrial carcinoma[J]. Int J Gynecol Cancer,2011,21(5):859-863.
[9]Zhang W,Zhang J,Yang J,et al. The role of magnetic resonance imaging in pretreatment evaluation of early-stage cervical cancer[J]. Int J Gynecol Cancer,2014,24(7):1292-1298.
[10]Teng F,Zhang YF,Wang YM,et al. Contrast -enhanced MRI in preoperative assessment of myometrial and cervical invasion,and lymph nodemetastasis:diagnostic value and error analysis in endometria carcinoma[J]. Acta Obstet Gynecol Scand,2015,94(3):266-273.
[11]Zhang F,Zhu L,Huang X,et al. Differentiation of reactive and tumor metastatic lymph nodes with diffusion-weighted and SPIO-enhanced MRI[J]. Mol Imaging Bio,2013,15(1):40-47.
[12]张洁,任翠,薛华丹,等.弥散加权成像对宫颈癌淋巴结转移的诊断价值[J].中国医学科学院学报,2014,36(1):73-78.
[13]Sironi S,Buda A,Picchio M,et al. Lymph node metastasis in patients with clinical early-stage cervical cancer:detection with integrated FDGPET/CT[J]. Radiology,2006,238(1):272-279.
[14]Chang MC,Chen JH,Liang JA,et al. 18F-FDG PET or PET/CT for detection of metastatic lymph nodes in patients with endometrial cancer:asystematicreviewand meta-analysis[J]. Eur J Radiol,2012,81(11):3511-3517.
[15]Choi HJ,Ju W,Myung SK,et al. Diagnostic performance of computer tomography,magnetic resonance imaging,and positron emission tomography or positron emission tomography/computer tomography for detection of metastatic lymph nodes in patients with cervical cancer:meta-analysis[J]. Cancer Sci,2010,101(6):1471-1479.
[16]Kadkhodayan S,Hasanzadeh M,Treglia G,et al. Sentinel node biopsy for lymph noda staging of uterine cervix cancer:a systematicreview and meta-analysis of the pertinent literature[J]. Eur J Surg Oncol,2015,41(1):1-20.
[17]Raimond E,Ballester M,Hudry D,et al. Impact of sentinel lymph node biopsy on the therapeutic management of early -stage endometrial cancer:Results of a retrospective multicenter study[J]. Gynecol Oncol,2014,133(3):506-511.
[18]Osarogiagbon RU,Ramirez RA,Wang CG,et al. Size and histologic characteristics of lymph node material retrieved from tissue discarded after routine pathologic examination of lung cancer resection specimens[J]. Ann Diagn Pathol,2014,18(3):136-139.
[19]Mumprecht V,Honer M,Vigl B,et al. In vivo imaging of inflammation- and tumor-induced lymph node lymphangiogenesis by immuno-positron emission tomography[J]. Cancer Res,2010,70 (21):8842-8851.
[20]刘开江,吕欣炜,刘青,等.纳米炭在腹腔镜下宫颈癌前哨淋巴结检测中的应用[J].中国医学科学院学报,2013,35(2):150-154.
[21]Hong Y,Xiang L,Hu Y,et al. Interstitial magnetic resonance lymphography is an effective diagnostic tool for the detection of lymph nodemetastases in patients with cervical cancer[J]. BMC Cancer,2012,12:360.
[22]Lee JE,Huh SJ,Nam H,et al. Early response of patients undergoing concurrent chemoradiotherapy for cervica cancer:a comparison of PET/CT and MRI[J]. Ann Nucl Med,2013,27(1):37-45.
[23]Meads C,Auguste P,Davenport C,et al. Positron emission tomography/computerised tomography imaging in detecting and managing recurrent cervical cancer:systematic review of evidence,elicitation of subjective probabilities and economic modelling[J]. Health Technol Assess,2013,17(12):1-323.
[24]Musto A,Grassetto G,Marzola MC,et al. Role of 18F-FDG PET/CT in the carcinoma of the uterus:a review of literature[J]. Yonsei Med J,2014,55(6):1467-1472.
[25]Babar S,Rockall A,Goode A,et al. Magnetic resonance imaging appearances of recurrent cervical carcinoma[J]. Int J Gynecol Cancer,2007,17(3):637-645.
[26]Kurra V,Krajewski KM,Jagannathan J,et al. Typical and atypical metastatic sites of recurrent endometrial carcinoma[J]. Cancer Imaging,2013,13(1):113-122.
[27]Odagiri T,Watari H,Kato T,et al. Distribution of lymph node metastasis sites in endometrial cancer undergoing systematic pelvic and para-aortic lymphadenectomy:a proposal of optimal lymphadenectomy for future clinical trials[J]. Ann Surg Oncol,2014,21(8):2755-2761.
[28]Linkov F,Edwards RP,Althouse A,et al. Obesity,lymphadenectomy and survival outcomes in intermediate to high -risk,early -stage endometrial cancer patients[J]. Future Oncol,2015,11(4):607-615.
[29]Hareyama H,Hada K,Goto K,et al. Prevalence,classification,and risk factors for postoperative lower extremity lymphedema in women with gynecologic malignancies:a retrospective study[J]. Int J Gynecol Cancer,2015,25(4):751-757.
[30]Dowdy SC,Borah BJ,Bakkum -Gamez JN,et al. Prospective assessment of survival,morbidity,and cost associated with lymphadenectomy in low-risk endometrial cancer[J]. Gynecol Oncol,2012,127(1):5-10.
[本文编辑秦娟]
The Detection and Significance of Pelvic Lymph Node Status in Diagnosis and Treatment of Cervical Cancer and Endometrial Carcinoma
DENG Li-hui,FU Chun. Department of Obstetrics and Gynecology,The Second Xiangya Hospital of Central South University,Changsha 410011,China
【Abstract】Lymph node metastasis as the main route of metastasis of cervical cancer and endometrial cancer,and is an important factor affecting the prognosis of cervical cancer and endometrial cancer. The way how to detect and evaluate the lymph node status before and during the therapy has still been in the preliminary exploration. Current methods of detecting lymph node status are ultrasonography,computer tomography,magnetic resonance imaging(MRI),positron emission tomography/computer tomography(PET-CT)and localization by sentinel lymph node biopsy etc. Different methods create images in different ways and have different sensitivity,specificity and accuracy. With the development of radiological technology and the imaging agents,the detection levels of lymph node status have been developed from simple morphology to function. Color Doppler ultrasonography,diffusion-weighted imaging,PET-CT. etc are more sensitive and specific when compared with traditional methods. Among them,PET-CT and functional MRI imaging have advantages in the detection of sensitivity,specificity and accuracy. Imaging agents are subdivided into three kinds of agents detecting tumor cell metabolism,vessel and lymphatic drainage through development.
【Keywords】Lymph nodes;Uterine cervical neoplasms;Endometrial neoplasms;Ultrasonography;Magnetic resonance imaging;Positron-emission tomography;Sentinel lymph node biopsy
基金项目:湖南省科技计划项目(2015SK20212)
通信作者:符淳,E-mail:csxyfc@sina.com
Corresponding author:FU Chun,E-mail:csxyfc@sina.com
收稿日期:(2015-09-15)

