APC基因的DNA甲基化与卵巢癌关系荟萃分析
闫冰冰,李力
APC基因的DNA甲基化与卵巢癌关系荟萃分析
闫冰冰,李力
【摘要】目的:进一步探讨结肠腺瘤性息肉病基因(APC基因)的失活在卵巢癌的发生、发展中的作用。方法:搜索PubMed、EMBase、Web of Science及CNKI数据库中2000年1月1日—2014年12月31日有关APC基因甲基化与卵巢上皮癌相关的文献,纳入研究均为包含病例组及对照组的随机对照试验。纳入文献采用纽卡斯尔-渥太华量表(NOS)评价标准。使用Stata 11.0软件进行OR值、异质性及发表性偏倚的相关的统计学分析。结果:共纳入9篇文献,其中包括641例卵巢癌患者和377例对照者。总病例组与总对照组的APC基因甲基化发生率差异有统计学意义(OR= 6.19,95%CI:4.08~9.41,P=0.000);卵巢癌组织与正常组织的APC基因甲基化发生率差异有统计学意义(OR=5.88,95% CI:3.66~9.45,P=0.000);卵巢癌组织与良性卵巢肿瘤组织的APC基因甲基化发生率差异有统计学意义(OR=6.99,95% CI:3.12~15.64,P=0.000)。结论:APC基因甲基化可能与卵巢癌有关。
【关键词】卵巢肿瘤;基因,APC;DNA甲基化;Meta分析
作者单位:530021南宁,广西医科大学附属肿瘤医院妇科
(J Int Obstet Gynecol,2016,43:169-173)
卵巢癌死亡率居妇科恶性肿瘤之首,严重威胁妇女健康。约1.5%的妇女患有卵巢恶性肿瘤,并且大多数患者诊断时均已至晚期。肿瘤抑制基因启动子的高甲基化会导致基因沉默,这一表观遗传学改变是卵巢癌的重要调节机制,且在卵巢癌的早期阶段就已经发生表观遗传学改变。目前已经有研究在肿瘤组织中检测到结肠腺瘤性息肉病基因(APC基因)的甲基化改变,并且证实该基因的甲基化改变与肿瘤的临床行为有关。APC基因是公认的肿瘤抑制基因,定位于人类染色体5q21上,长约900 kb,由15个外显子组成,编码由2 843个氨基酸组成的、分子质量为300 ku的蛋白质[1]。其编码的APC蛋白通过Wnt信号转导通路参与调解细胞分化、增殖、迁移等过程,从而具有多功能抑制肿瘤的作用[2]。目前研究发现,APC基因作为抑癌基因较少发生突变,引起该基因功能缺失的机制包括杂合性丢失和启动子甲基化,其中启动子甲基化引起的基因沉默是该基因表达下调的主要原因。有研究表明,卵巢癌细胞系中检测到APC基因过量甲基化。这些研究表明,APC基因启动子的甲基化可能在卵巢癌的发生、发展中有非常重要的作用。有研究报道在肿瘤组织及非肿瘤组织中APC基因甲基化状态不同。然而,目前已有的报道都是基于小样本的研究,且结果不尽相同。因此,我们基于以往的研究进行关于APC基因甲基化与卵巢癌关系的Meta分析。
1 资料与方法
1.1一般资料以卵巢(ovarian OR ovary)AND癌症或恶性肿瘤(cancer OR carcinoma OR tumor)AND APC基因甲基化(APC methylation)为关键词检索PubMed、EMBase、Web of Science、CNKI,搜索文献范围2000年1月1日—2014年12 月31日。搜索研究仅限于人类。没有语言限制。
1.2文献纳入标准①探讨卵巢癌及APC基因甲基化与卵巢癌关系的文献;②病例对照试验或者一个研究中包含病例组及对照组;③报道病例组及对照组APC基因甲基化与非甲基化病例数的文献;④样本仅限于组织样本。首先根据最初的纳入标准,从初始搜索研究的标题和摘要进行评估,然后搜索文章的全文进行评估。如果一项研究被发表多次,则将最全最新的研究纳入Meta分析中。最后,共纳入9篇文献[3-11],其中包括641例病例及377例对照。病例组的癌组织来自于卵巢癌患者,对照组的组织来自于健康人或者无卵巢癌患者的正常卵巢组织或者是卵巢良性肿瘤患者的卵巢肿瘤组织。纳入文献的基本特征见表1。
1.3数据提取以及文献质量评估从文献中提取以下信息:第一作者,发表时间,研究人群国家或地区,样本数量,病例组及对照组的平均年龄,对照组的情况,病例组及对照组的病例数,甲基化的检测方法。并由两位评审员根据在线纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)软件(http:// www.ohri.ca/programs/clinical_epidemiology/oxford.asp)对所纳入的文献进行质量评估。
1.4统计学方法采用I2检验分析各个研究之间的异质性,当I2>50%时,说明各研究之间异质性显著,选用随机效应模型;当I2≤50%时,纳入文献异质性不显著,则选用固定效应模型对文献数据进行分析。应用Stata 11.0软件对数据进行分析处理,采用OR值及其95%置信区间(95%CI)作为结局变量进行汇总分析。采用Begg’s检测评价发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1文献筛选流程最初筛选出164篇文献,去除了其中50篇重复文献后,进一步评审剩余的114篇文献,依照这些文献的标题和摘要,84篇文献被排除,其中包括25篇综述,5篇细胞系文章,6篇毕业论文,40篇不相关文献,8篇不包含全部版本信息。最后阅读全文,8篇没有对照组的文献及13篇没有基因甲基化数据的文献被排除,最后纳入9篇文献。见图1。
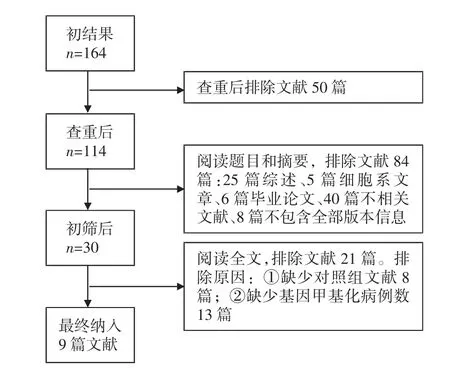
图1 文献筛选流程图
2.2NOS评价结果NOS通过对研究人群选择、病例组与对照组可比性、暴露因素的测量三方面进行质量评分,共9个项目,每个项目1分,满分为9分。6分以上为高质量文献。根据NOS,所纳入文献均符合质量要求,见表2。

表1 纳入文献的基本特征
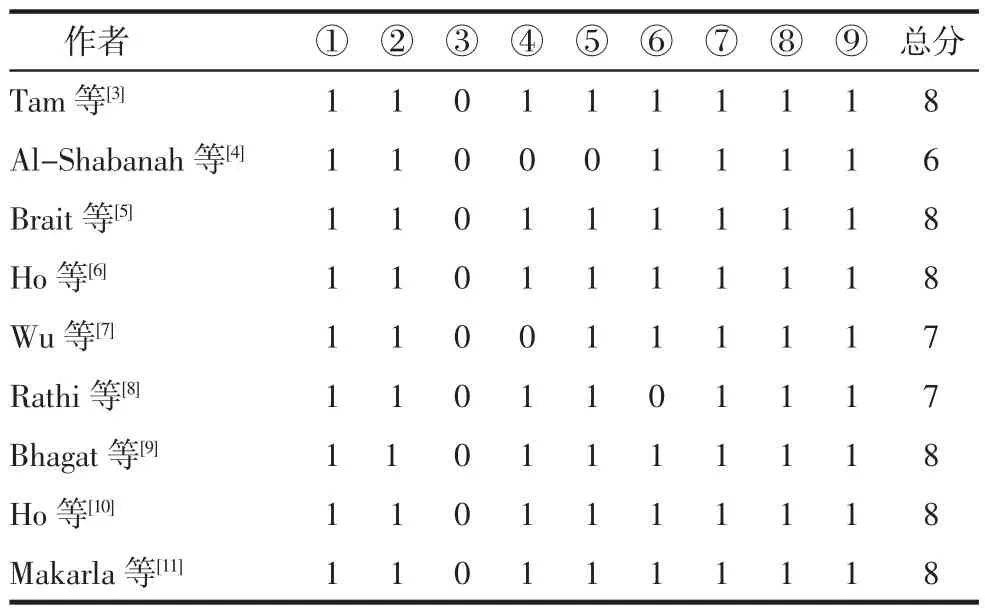
表2 纳入文献的质量评分 (分)
2.3APC基因甲基化和卵巢癌的关系Meta分析结果
2.3.1总病例组和总对照组中APC基因甲基化比较对纳入的9篇文献中病例组和对照组的APC基因甲基化发生率进行比较,共有卵巢癌患者641例,对照组377例。其中有227例(35.41%)肿瘤组织和35例(9.28%)对照发生甲基化。由于各研究之间不存在明显的异质性(I2=8.2%,P>0.1),故采用固定效应模型进行Meta分析。结果显示,病例组与对照组的APC基因甲基化发生率差异有统计学意义(OR=6.19,95%CI:4.08~9.41,P=0.000)。见图2。
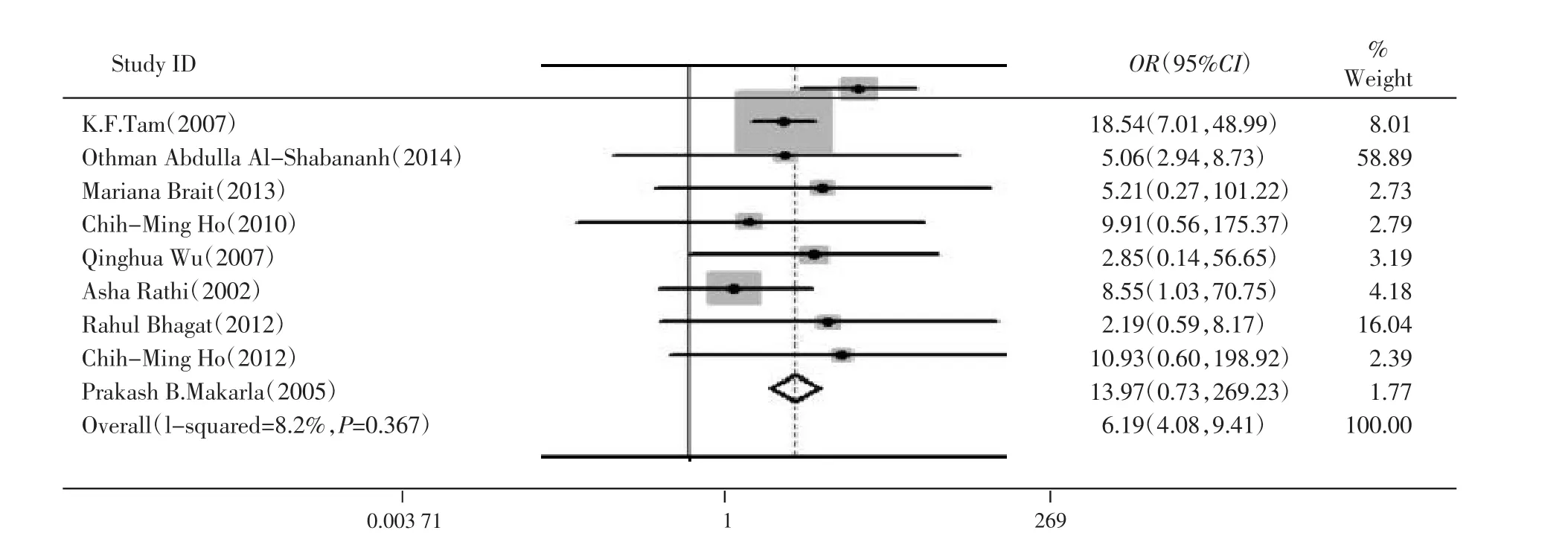
图2 总病例组及总对照组APC基因甲基化的Meta分析结果森林图
2.3.2卵巢癌组织与正常组织的APC基因甲基化比较有6篇文献对正常组织和卵巢癌组织中APC基因甲基化发生率进行了比较,共有卵巢癌患者485例,对照组277例。其中有190例(39.18%)卵巢癌组织和25例(9.03%)正常组织发生甲基化。由于各研究之间不存在明显的异质性(I2=0,P>0.1),故采用固定效应模型进行Meta分析。结果显示,卵巢癌组织与正常组织的APC基因甲基化发生率差异有统计学意义(OR=5.88,95%CI:3.66~9.45,P=0.000)。见图3。
2.3.3卵巢癌组织与良性卵巢肿瘤组织的APC基因甲基化比较5篇文献对卵巢癌组织与良性卵巢肿瘤组织中APC基因启动子甲基化的发生率进行比较,共有卵巢癌患者308例,良性卵巢肿瘤患者100例。其中有129例(41.88%)卵巢癌组织和8例(8.00%)良性卵巢肿瘤组织发生甲基化。由于各研究之间不存在明显的异质性(I2=30.0%,P>0.1),故采用固定效应模型进行Meta分析。结果显示,卵巢癌组织与良性卵巢肿瘤组织的APC基因甲基化发生率差异有统计学意义(OR=6.99,95%CI:3.12~15.64,P=0.000)。见图4。
2.3.4发表偏倚本研究对总病例组和总对照组APC基因甲基化比较纳入的9篇文献、肿瘤组织和正常组织APC基因甲基化比较纳入的6篇文献以及肿瘤组织和良性卵巢肿瘤组织APC基因甲基化纳入的5篇文献分别进行Begg’s检测,绘制漏斗图,显示本研究的发表偏倚非常小(均P>0.05)。见图5~7。
3 讨论
卵巢癌是女性生殖系统常见的三大恶性肿瘤之一,其发病率居第3位,病死率却居首位,其中以上皮性卵巢癌为主。上皮性卵巢癌早期无明显临床症状和体征,不易被发现,绝大部分患者以腹水症状就诊,发现时已是晚期。尽管目前手术联合术后化疗广泛应用于临床,但预后仍较差[12]。因此,对卵巢癌发病机制的研究具有重要的意义。卵巢癌的发病机制目前尚未明确,多种途径可能都参与了卵巢癌的发生、发展,其中DNA甲基化被认为是卵巢癌发生的重要作用机制。
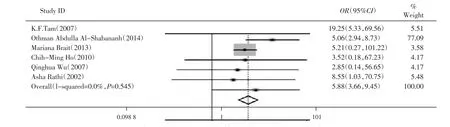
图3 卵巢癌组织及正常组织中APC基因甲基化Meta分析结果的森林图

图4 卵巢癌组织及良性卵巢肿瘤组织中APC基因甲基化Meta分析结果的森林图
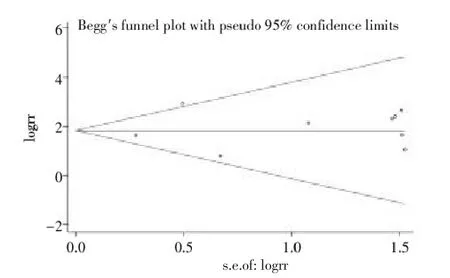
图5 总病例组和总对照组APC基因甲基化比较纳入的9篇文献发表偏倚分析漏斗图
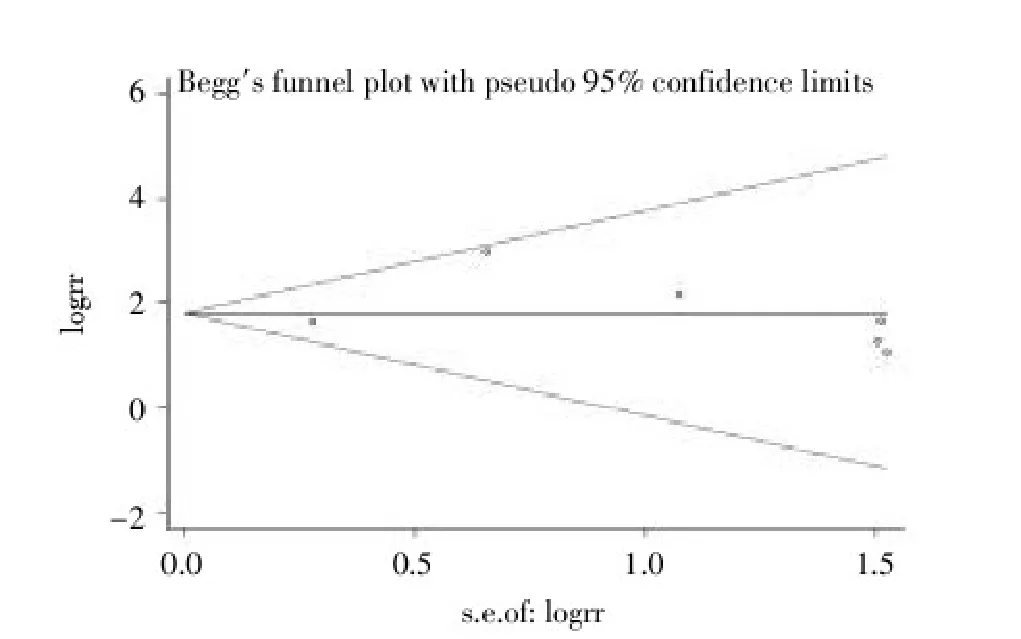
图6 卵巢癌组织与正常组织APC基因甲基化比较纳入的6篇文献发表偏倚分析漏斗图
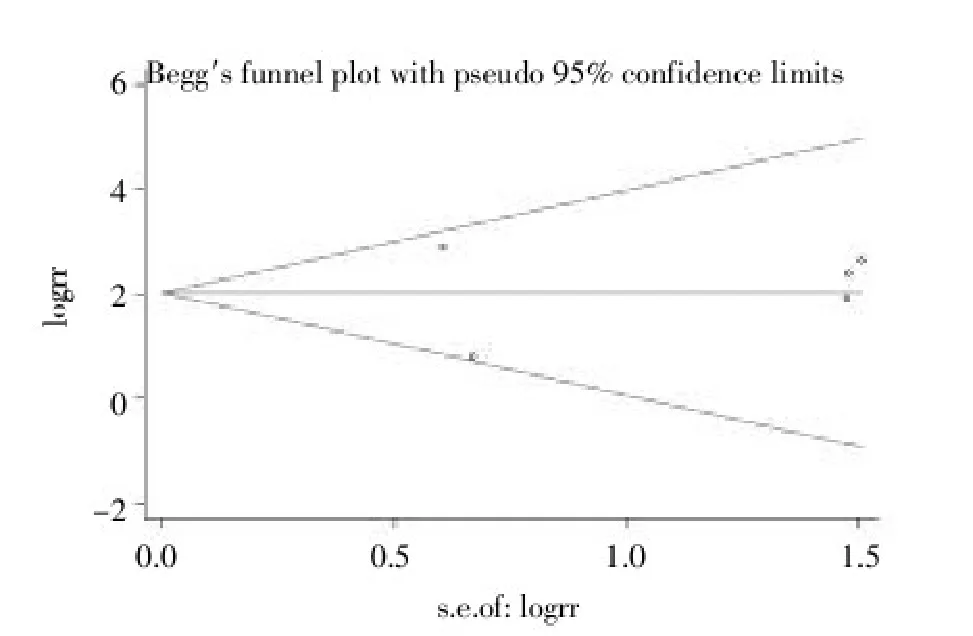
图7 卵巢癌组织与良性卵巢肿瘤组织APC基因甲基化纳入的5篇文献发表偏倚分析漏斗图
APC基因是Herrera于1986年在格德纳综合征患者中发现的[1]。该基因通过参与调解细胞分化、增殖、记忆及迁移等过程而具有多功能抑制肿瘤作用[2]。APC基因的异常是导致家族性结肠腺瘤样息肉发生癌变的关键因素[13]。在结肠癌、胃癌、乳腺癌、子宫内膜癌等肿瘤组织中也已发现APC基因的表达缺失,而且与这些恶性肿瘤的发生、发展、浸润、转移密切相关。APC基因可以通过基因突变及基因启动子甲基化失活,而基因启动子甲基化是导致该基因失活的主要原因。
本研究综合已有的APC基因甲基化与卵巢癌关系的相关文献,纳入9篇文献,共641例病例及377例对照。病例组APC基因的甲基化水平明显高于对照组。卵巢癌病例组发生APC基因甲基化的可能性是对照组的6.19倍,卵巢癌组织发生APC基因甲基化的可能性是正常组织的5.88倍,是良性卵巢肿瘤组织的6.99倍。这提示APC基因甲基化与卵巢癌的发生可能存在密切关系。
Meta分析本质上属于观察性研究,收集文献及在对文献进行统计分析的过程中,必然存在偏倚,偏倚对Meta分析结果的真实性和可靠性有很大的影响,但是可以通过纳入高质量文献及敏感度分析等方法,尽量降低这些偏倚带来的影响。本研究最终只有9篇文献入选,对这些文献通过忽略任何一篇文献的方式进行敏感度分析,发现没有单独的文献影响总OR值,并且通过对发表性偏倚分析后提示发表偏倚较小,结论较可靠。
本研究也存在一些局限。本研究通过筛选后最终只有9篇文章被纳入,纳入文献较少,无法对APC基因甲基化是否在不同类型的卵巢癌中存在差别及是否与肿瘤的转移和分期有关进行研究。
有相关研究提示APC基因的甲基化与多种肿瘤的发生密切相关。本研究综合以往相关研究进行Meta分析,进一步为APC基因甲基化对卵巢癌发生的可能存在密切关系提供了依据,为将来从基因水平诊断和治疗卵巢癌提供了丰富的理论基础。
总之,APC基因甲基化与卵巢癌的发生、发展密切相关,对临床卵巢癌的诊断和靶向治疗有临床指导意义。随着甲基化技术的进步和检测水平的提高,Meta分析将对此做出更准确的评价,以便指导临床运用。
参考文献
[1]Jarrett CR,Blancato J,Cao T,et al. Human APC2 localization and allelic imbalance[J]. Cancer Res,2001,61(21):7978-7984.
[2]van Noort M,Meeldijk J,van der Zee R,et al. Wnt signaling controls the phosphorylation status of beta -catenin[J]. J Biol Chem,2002,277(20):17901-17905.
[3]Tam KF,Liu VW,Liu SS,et al. Methylation profile in benign,borderline and malignant ovarian tumors[J]. J Cancer Res Clin Oncol,2007,133(5):331-341.
[4]Al -Shabanah OA,Hafez MM,Hassan ZK,et al. Methylation of SFRPs and APC genes in ovarian cancer infected with high risk human papillomavirus[J]. Asian Pac J Cancer Prev,2014,15(6):2719-2725.
[5]Brait M,Maldonado L,Noordhuis MG,et al. Association of promoter methylation of VGF and PGP9.5 with ovarian cancer progression[J]. PLoS One,2013,8(9):e70878.
[6]Ho CM,Lai HC,Huang SH,et al. Promoter methylation of sFRP5 in patients with ovarian clear cell adenocarcinoma[J]. Eur J Clin Invest,2010,40(4):310-318.
[7]Wu Q,Lothe RA,Ahlquist T,et al. DNA methylation profiling of ovarian carcinomas and their in vitro models identifies HOXA9,HOXB5,SCGB3A1,and CRABP1 as novel targets[J]. Mol Cancer,2007,6:45.
[8]Rathi A,Virmani AK,Schorge JO,et al. Methylation profiles of sporadic ovarian tumors and nonmalignant ovaries from high -risk women[J]. Clin Cancer Res,2002,8(11):3324-3331.
[9]Bhagat R,Chadaga S,Premalata CS,et al. Aberrant promoter methylation of the RASSF1A and APC genes in epithelial ovarian carcinoma development[J]. Cell Oncol(Dordr),2012,35(6):473-479.
[10]Ho CM,Huang CJ,Huang CY,et al. Promoter methylation status of HIN -1 associated with outcomes of ovarian clear cell adenocarcinoma[J]. Mol Cancer,2012,11:53.
[11]Makarla PB,Saboorian MH,Ashfaq R,et al. Promoter hypermethylation profile of ovarian epithelial neoplasms[J]. Clin Cancer Res,2005,11(15):5365-5369.
[12]Marsden DE,Friedlander M,Hacker NF. Current management of epithelial ovarian carcinoma:a review[J]. Semin Surg Oncol,2000,19(1):11-19.
[13]Tamura G,Maesawa C,Suzuki Y,et al. Primary gastric carcinoma cells frequently lose heterozygosity at the APC and MCC genetic loci [J]. Jpn J Cancer Res,1993,84(10):1015-1018.
[本文编辑王昕]
A Meta-analysis of DNA-Methylated Gene APC and Ovarian Cancer
YAN Bing-bing,LI Li. Department of Gynecology,Affiliated Tumor Hospital,Guangxi Medical University,Nanning 530021,China
【Abstract】Objective:To investigate the role of APC gene inactivation in the occurrence and development of ovarian cancer. Methods:Databases such as PubMed,EMBase,Web of Science,and CNKI data were searched. Related literatures were published from January 1,2000 to December 31,2014. Only randomized controlled trials were included. The quality of the included studies were assessed by Newcastle-Ottawa Scale(NOS). Stata 11.0 software was used for statistical analysis such as OR value,heterogeneity and publication bias. Results:Nine studies,with 641 ovarian cancer patients and 377 controls were included in the Meta-analysis. Statistical results shows that the pooled odds ratio was 6.19(95%CI:4.08-9.41,P=0.000)in the case group versus the control group under fix effects model. The pooled odds ratio was 5.88(95%CI:3.662-9.450,P=0.000)in the cancer group versus the normal group under fix effects model. The pooled odds ratio was 6.99(95%CI:3.12-15.64,P=0.000)in the cancer group versus the benign tumor group under fix effects model. Conclusions:This analysis suggests that APC gene methylation had an association with ovarian cancer.
【Keywords】Ovarian neoplasms;Genes,APC;DNA methylation;Meta-analysis
基金项目:教育部高校博士学科点专项基金(20124503110003);广西科学研究与技术开发计划项目(桂科攻1140003A-34)
通信作者:李力,E-mail:lili@gxmu.edu.cn
Corresponding author:LI Li,E-mail:lili@gxmu.edu.cn
收稿日期:(2015-09-21)

