亚低温联合硫辛酸对重型颅脑创伤的疗效观察
龚 立,王静予,孔令军,许乐宜,邱锋,费智敏
上海中医药大学附属曙光医院(上海200021)
亚低温联合硫辛酸对重型颅脑创伤的疗效观察
龚立,王静予,孔令军,许乐宜,邱锋,费智敏
上海中医药大学附属曙光医院(上海200021)
摘要:目的观察亚低温联合硫辛酸针剂对重型颅脑创伤(STBI)病人的疗效。方法将58例STBI病人随机分为治疗组(29例)与对照组(29例)。在西医常规治疗下给予治疗组亚低温环境联合硫辛酸针剂,对照组给予亚低温治疗。比较两组的死亡率、多器官功能障碍(MODS)发生率,以及不同时间格拉斯哥昏迷量表(GCS)评分变化。结果治疗组病人死亡人数、MODS发生率均低于对照组;与治疗前比较,两组病人炎症因子指标在复温后24 h,复温后5 d以及2个月后均显著好转。亚低温联用硫辛酸组在复温后5 d以及治疗两月后GCS均明显优于对照组。结论亚低温与硫辛酸针剂联合治疗对STBI病人均有疗效。
关键词:重型颅脑创伤;亚低温;硫辛酸针剂;格拉斯高昏迷量表;
重型颅脑创伤(severe traumatic brain injury, STBI)是指脑外伤后格拉斯哥昏迷量表(Glasgow coma scale,GCS)得分均不高于8分;有明显神经系统阳性体征;体温、呼吸、血压、脉搏有明显改变。主要包括广泛颅骨骨折、广泛脑挫裂伤及脑干损伤或颅内血肿[1]。随着我国轻便型交通工具的快速增加,STBI发病率、致残率呈现上升趋势,其并发症多,预后差,加重了病人家庭与社会经济负担[2]。STBI后的多种病理生理改变,尤其是全身炎症反应综合征和多器官功能障碍等严重并发症的发生与炎性细胞因子的大量分泌有关。通过干扰细胞因子表达水平治疗STBI的方法研究,已经成为医学界关注的热点话题[3]。近期研究发现33 ℃~35 ℃亚低温治疗能降低STBI病人病死率,具有促进STBI神经功能恢复作用[4-6,8]。硫辛酸是一种线粒体辅酶,能够清除加速老化因素与致病自由基[7]。本研究分析亚低温联合硫辛酸对STBI病人细胞因子表达水平的影响,探讨此联合疗法对STBI病人的临床疗效及相关机制。
1 资料与方法
1.1临床资料选择我院神经外科2012年8月-2014年8月收治的重型颅脑创伤病人58例为观察对象,其中多发性脑挫裂伤29例,外伤性蛛网膜下腔出血21例,广泛性脑肿胀12例,弥漫性轴索损伤8例,急性硬膜外、硬膜下血肿18例,实质内多发性、混合性血肿18例,原发性脑干损伤2例。男34例,女24例,年龄17岁~65岁(47.8岁±6.3岁)。将病人随机分为两组。治疗组29例,男18例,女11例;年龄18岁~63岁(46.2岁±4.2岁);GCS评分(6.27±1.33)分。对照组29例,男16例,女13例;年龄17岁~65岁(48.8岁±3.2岁);GCS评分(6.38±1.07)分。两组性别、年龄分析、GCS评分比较无统计学意义(P>0.05),具有可比性。
1.2纳入标准STBI病人符合以下标准:①均为颅脑外伤病人;②GCS得分均不高于8分;③所有病人于发生创伤到入院时间;④年龄在15岁~65岁;⑤所有病人属于硬膜外血肿、硬膜下血肿或脑挫裂伤等病理类型,无颅外其他脏器严重损伤。⑥病人或其家属均知情同意,并签署知情同意书。
1.3排除标准①瞳孔散大、脑疝晚期以及开放性颅脑损伤病人;②持续性休克,经治疗无好转者;③发生创伤前具有严重精神疾;④头颅CT阴性而持续昏迷者;⑤严重的心肺疾病者;⑥具有遗传性或传染性疾病,如皮肤病、性病等;⑦哺乳期或妊娠期妇女。
1.4研究方法所有病人入院后按照诊疗常规给予常规对症治疗并进行GCS评分,其治疗主要有药物治疗和手术治疗两种,治疗原则为抗炎,止血,抑酸,补充电解质,维持酸碱平衡,营养脑神经,保护脑组织等。并且根据临床情况给予入院即刻或术后脑室外引流,降低颅内压,一般引流2 h后行亚低温治疗。
治疗组病人给予亚低温联合硫辛酸针剂(国药准字H20055869,亚宝药业太原制药有限公司)治疗。采用亚低温治疗仪,设定温度和湿度水平,体温调节毯持续降低体温,将病人体温维持在34 ℃,通过脑脊液引流管监测至颅内压降至180 mmH2O(1 mmH2O=0.009 8 kPa)以下维持24 h给予自然复温,同时配合给予硫辛酸针剂静脉输注,将600 mg硫辛酸加入250 mL生理盐水注射液中,避光静脉输注,输注时间>60 min,每日1次,持续2周。对照组病人单纯给予亚低温治疗,治疗时间与治疗组相同。
1.5指标评测临床疗效评测指标:伤后2个月对两组病人进行死亡人数、多器官功能障碍(multiple organ failures,MODS)发生率以及格拉斯哥量表预后评分(Glasgow outcome scale, GOS)进行评价。观察白介素-6(IL-6)、白介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)指标水平。
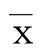
2结果
2.1两组临床疗效评价在治疗期间以及其后的随访中,治疗组有1例死亡,对照组有6例死亡;治疗2个月后治疗组并发MODS者4例,对照组11例;2个月后治疗组GCS评分与对照组比较差异有统计学意义。详见表1。
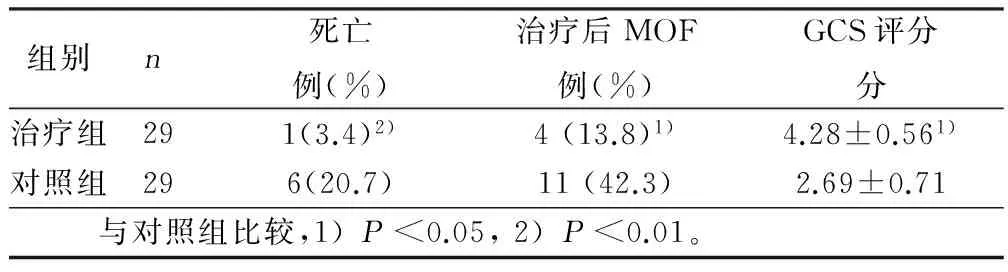
表1 两组临床疗效评价
2.2两组病人脑脊液中细胞因子含量比较与治疗前比较,两组病人的炎症因子指标在复温后24 h,治疗后5 d以及2个月后比较差异有统计学意义。亚低温联合硫辛酸治疗组在复温后5 d以及治疗2个月后与对照组比较差异有统计学意义。详见表2。
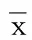
表2 两组病人治疗前后脑脊液中细胞因子含量比较(±s)
3讨论
亚低温治疗STBI已经有较长历史,方法最早记载于17世纪60年代,亚低温治疗方法无论对因由因而导致的损伤还是对由外因而导致的损伤,均具有快速保护脑组织,促进病人康复的功效。低温环境下的脑组织氧代谢缓慢,对脑组织具有保护作用[9],国内外临床治疗常将亚低温与依达拉奉针剂合用加强其清除急性脑损伤后产生的氧自由基,保护脑组织,疗效仍不理想[10-12]。我国STBI的发生率较高,因治疗不当而导致的死亡人数占各因素导致死亡总人数的2%[13-15],因此寻求一种更为有效的STBI治疗方法成为目前神经外科的一个重要课题。
本研究通过单用亚低温以及亚低温联合硫辛酸针剂治疗STBI,病人临床症状均明显改善,且联合治疗疗效较单用亚低温治疗临床更有效。对比两组病人不同时间点脑脊液中IL-6和IL-8含量得出,亚低温合并硫辛酸针剂以及单用亚低温均可降低IL-6和IL-8的异常表达量,且两者联合降低速度更快,具有快速调节作用,促进病人在短时间内将IL-6和IL-8恢复到正常水平。IL-6作为颅脑创伤后首先高表达的因子,能够加重病人的颅脑损伤程度。研究发现,对颅脑创伤病人给予IL-6受体阻滞剂可减缓颅脑损伤程度,为治疗提供更多的时间[16-17];Scanzano等[18-19]指出,IL-8在机体中可发挥趋化因子作用,当其表达受到抑制时,发生在机体中的一系列炎症反应将会受到不同程度的影响。因此其可作为颅脑损伤程度的生化指标以及疗效评价指标。
亚低温疗法通过降低耗氧量达到避免脑组织内PH值降低。Suehiro等[20]和Li等[21]研究报道亚低温疗法对脑中自由基生成具有抑制作用,可降低内源性毒性物质对脑细胞的损害。硫辛酸作为广谱强效抗氧化剂对于糖尿病周围神经病变有明确疗效,能够有效改善神经传导功能[22],可抑制脂质过氧化,清除自由基和活性氧,再生其他内源抗氧化剂、增加神经细胞Na+-K+-ATP酶活性及保护血管内皮功能等,不仅发挥抗氧化作用,其本身亦是神经营养成分。近期研究表明硫辛酸具有修复突触,抑制脑内炎症反应,减少神经元的丢失,保护线粒体功能[23-24]。目前研究者应用于延缓帕金森进展,改善认知障碍,提高认知储备能力,治疗中风以及用于血管性痴呆的防治[25-26]。
通过观察单用亚低温与亚低温联合硫辛酸STBI病人在不同时间点脑脊液中TNF-α表达量的研究发现亚低温治疗前,两组病人TNF-α表达量均处于较高水平,无论是否联合使用硫辛酸,亚低温治疗24 h后以及其他观察时间点炎性因子的表达均下降。该结果表明亚低温或硫辛酸可达到将TNF-α表达量恢复正常的作用,但给予亚低温联合硫辛酸治疗的病人可更快速恢复TNF-α表达量。该原因可能与亚低温与硫辛酸具有减缓组织受损的作用有关。
综上所述,亚低温联合硫辛酸对STBI病人具有治疗效果,调节创伤后IL-6、IL-8、TNF-α异常表达量,降低颅内压,减少脑组织耗氧量,对病人康复具有重要意义。本研究首次将硫辛酸针剂用于STBI的治疗,样本量偏少,如果能够在国内进行大样本的临床观察,为硫辛酸治疗STBI提供一定临床依据。
参考文献:
[1]赵明亮,杨细平,田竺,等. 亚低温联合依达拉奉对重型颅脑创伤患者脑脊液肿瘤坏死因子-α及白细胞介素-6表达的影响[J].中国中西医结合急救杂志,2014,5(4): 256-261.
[2]宋奎勤,张景荣,孙冲,等.重型颅脑损伤59例死亡原因分析[J].中国临床神经科学,2001,9(1):76-77.
[3]杨旺明,叶泽兵,饶先伟,等. 亚低温联合依达拉奉对急性缺血性脑卒中患者神经功能的影响[J]. 中国实用神经疾病杂志, 2014, 8(12): 40-42.
[4]陈建松,陈衔城.亚低温脑保护机制研究的进展[J].中国临床神经科学,1999,7(3):185-187.
[5]石磊,夏玲洋,戴晓莉,等.依达拉奉联合亚低温治疗急性重型颅脑损伤疗效观察[J].中国药物经济学,2014,5(8):223-224.
[6]梁建锋.依达拉奉联合亚低温治疗急性重型颅脑损伤的疗效[J].中国处方 药,2014,12(8):56-56.
[7]Jin HY,Lee KA,Wuj Z,et al.The neuroprotective benefit from pioglitazone (PIO) addition on the alpha lipoic acid (ALA)-based treatment in experimental diabetic rats[J].Endocrine, 2014,47(3):772-782
[8]李季林,盛罗平,陈仁辉,等.597例住院颅脑损伤患者流行病学调查[J].中华全科医学,2014,12(12):1986-1989.
[9] Idris Z,Zenian MS,Muzaimi M,et al.Better Glasgow outcome score,cerebral perfusion pressure and focal brain oxygenation in severely traumatized brain following direct regional brain hypothermia therapy:a prospective randomized study[J]. Asian J Neurosurg,2014,9(3):115-123.
[10]禹书宝,朱青峰,王凤伟,等.依达拉奉联合亚低温治疗急性重型颅脑损伤疗效观察[J].临床合理用药杂志, 2013,6(31): 62-63.
[11]李焰,刘凤丽,田艳霞,等.依达拉奉对脑缺血再灌注损伤后p-ERKI/2表达的影响[J].天津医药, 2010, 38(4): 310-312.
[12]彭小莲.头颅局部亚低温联合依达拉奉注射液治疗脑出血的临床疗效与安全性 [J]. 中国医药指南, 2012, 23(27): 31-33.
[13]俞磊,况建国,夏亮.4018例颅脑创伤住院患者流行病学特征分析[J].江西医学院学报,2009,49(5):120-122.
[14]喻安孝,李毅,刘慧芝.颅脑损伤致死的法医学分析[J].重庆医学,2013,42(27):3326-3327.
[15]Alexandre H, Marcelo F, Rodrigo D,et al.Role of hormonal levels on hospital mortality for male patients with severe traumatic brain injury[J].Brain Inj,2014,28(10):1262-1269 .
[16]赵冉冉,徐晓臣,徐飞,等.天然抗氧化剂α-硫辛酸对血管性痴呆大鼠线粒体的 保护作用[J].山西医科大学学报,2014,45(12):1136-1139.
[17]ÜsküdarTeke H, Gündüz E, Akay OM, et al. Are the high serum interleukin-6 and vascular endothelial growth factor levels useful prognostic markers in aggressive non-hodgkin lymphoma patients[J].Turk J Haematol,2015,32(1):21-28.
[18]Yaoita T,Sasaki Y, Yokozawa J, et al. Treatment with Anti-Interleukin-6 Receptor Antibody Ameliorates Intestinal Polyposis in Apc(Min/+) Mice under High-Fat Diet Conditions[J]. Tohoku J Exp Med,2015,235(2):127-134.
[19]Scanzano A,Schembri L,Rasini E,et al.Adrenergic modulation of migration, CD11b {JP3and CD18 expression, ROS and interleukin-8 production by human polymorphonuclearleukocytes[J]. Inflamm Res,2015,64(2):127-135.
[20]Suehiro E,Koizumi H,Fujiyama Y,et al. Recent advances and future directions of hypothermia therapy for traumatic brain injury[J]. Neurol Med Chir (Tokyo),2014,54(11):863-869.
[21]Li P,Yang C.Moderate hypothermia treatment in adult patients with severe traumatic brain injury: a meta-analysis[J]. Brain Inj, 2014,28(8):1036-1041.
[22]徐春生,洪怡瑜.硫辛酸对糖尿病周围神经病变患者神经传导功能的影响[J].中国实用神经疾病杂志,2014,17(8):72-73.
[23]Choi KH, Park MS, Kim HS, et al. Alpha-lipoic acid treatment is neurorestorative and promotes functional recovery after stroke in rats[J]. Mol Brain,2015,8(1):9.
[24]Zhao RR, Xu F, Xu XC, et al. Effects of alpha-lipoic acid on spatial learning and memory,oxidative stress, and central cholinergic system in a rat model of vascular dementia[J]. NeurosciLett, 2015(587):113-119.
[25]李艳花,和青,尉杰忠,等.硫辛酸对LPS诱导的帕金森病小鼠黑质多巴胺能神经元损伤的影响[J].中国病理生理杂志,2015,31(2):201-206.
[26]Isgren A, Jakobsson J, Pålsson E,et al.Increased cerebrospinal fluid interleukin-8 in bipolar disorder patients associated with lithium and antipsychotic treatment[J]. Brain Behav Immun,2015,1(43):198-204.
(本文编辑薛妮)
基金项目:上海市高级中西医结合人才培养项目(No.ZYSNXD012-RC-ZXY001)
通讯作者:费智敏, E-mail: tommyfei@126.com
中图分类号:R541.6R289.5
文献标识码:B
doi:10.3969/j.issn.1672-1349.2016.08.038
文章编号:1672-1349(2016)08-0907-03
(收稿日期:2015-11-05)
·神经科疾病临床观察/研究·

