高盐饮食所致高血压前期大鼠的中枢调控机制
史国娟,康玉明,杨志明
1.山西医科大学第二医院(太原 030001);2.西安交通大学医学部基础医学院
高盐饮食所致高血压前期大鼠的中枢调控机制
史国娟1,康玉明2,杨志明1
1.山西医科大学第二医院(太原 030001);2.西安交通大学医学部基础医学院
摘要:目的观察不同含盐量饲料对SD大鼠高血压前期下丘脑室旁核神经激素的影响,并探讨其机制。方法选取体重160 g±5 g雄性SPF级SD大鼠30只,随机分为3组:8%NaCl饮食组、4%NaCl饮食组、0.3% NaCl饮食组 (正常饮食组),严格按各组别NaCl浓度制作大鼠饲料喂养。同时采用大鼠尾动脉无创血压测量系统监测血压,平均动脉压达高血压前期血压值水平后称重,麻醉后处死动物。采用蛋白免疫印迹法检测3组大鼠下丘脑室旁核p-Ikkβ及白细胞介素-1β(IL-1β)表达水平,DHE法原位检测下丘脑室旁核氧化应激水平。 结果8%NaCl组和4%NaCl组平均动脉压高于正常饮食喂养组(P<0.05),8%NaCl组平均动脉压高于4%NaCl组(P<0.05)。8%NaCl组和4%NaCl组下丘脑室旁核p-Ikkβ、IL-1β及活性氧簇表达均高于正常饮食组(P<0.05),8%NaCl组下丘脑室旁核p-Ikkβ、IL-1β及活性氧簇表达高于4%NaCl组(P<0.05)。结论高盐饮食可使高血压前期大鼠炎性细胞因子、活性氧簇表达增多,核转录因子(NF-κB)激活。不同含盐量导致上述因素变化量不同。
关键词:高血压前期;高盐饮食;下丘脑室旁核;核转录因子;白细胞介素-1β
高血压的病因包括遗传因素和环境因素。其中,高盐膳食已被大量流行病学调查证实为高血压患病的重要危险因素。目前认为,长期限盐有助于预防或减缓高血压的发生发展,世界卫生组织建议每日食盐量不超过6 g。高盐摄入除引起水钠潴留外,也显著影响血压调控其他环节,如促发炎症、氧化应激、增强交感神经系统活性和激活肾素-血管紧张素系统、损害血管内皮功能等。现代研究认为高血压时下丘脑室旁核(paravent ricular nucleus of hypothalamus,PVN)神经激素类物质,如肾素-血管紧张素系统(renin-angiotensin system,RAS)组分、活性氧簇(reactive oxygen species,ROS)、炎性细胞因子(proinflammatory cytokines,PIC)表达增多且与核转录因子(NF-κB)的激活相关[1]。Leeneen等[2]发现高盐饮食可使盐敏感性大鼠下丘脑室旁核区细胞间质Na+浓度增高,RAS组分和活性氧簇增多,肾交感神经兴奋增强,血压升高,但导致中枢内这些体液因子变化的因素尚未明确。那么对于不能确定为盐敏感性或尚未达到临床高血压的正常人群,高盐饮食是否也引起了中枢神经激素改变有待研究。
1材料与方法
1.1动物分组及模型制备选取体重160 g±5 g雄性SPF级SD大鼠(7周龄)30只,随机分为3组:8%NaCl饮食组、4%NaCl饮食组、0.3%NaCl饮食组(正常饮食组),严格按各组别NaCl浓度制作大鼠饲料,恒温恒湿,自然光照下喂养。采用大鼠尾动脉无创血压测量系统监测血压,8%NaCl饮食组和含4%NaCl饮食组SD大鼠平均动脉压达高血压前期水平后说明造模成功。称重,麻醉后处死动物。
1.2无创血压测量将清醒大鼠放入无创血压保温箱中调至38 ℃,依次将阻断器、传感器套于大鼠尾部,盖上棕色盖,当基线处出现大鼠脉搏时将箱体温度调至34 ℃,待大鼠安静后开始给大鼠尾部加压,当阻断器开始放气减压至脉搏出现,此出现脉搏处记录为收缩压,继续减压会出现一个波峰,在波峰处则记录为舒张压,再继续减压,可记录大鼠平均动脉压。连续测3次,取其平均值作为一个测量值,每周测1次,记录血压变化规律。
1.3标本采集大鼠经戊巴比妥钠(50 mg/kg)腹腔注射麻醉后开胸暴露心脏,用注射针头刺入其左心室
尖部到达升主动脉后用止血钳固定,剪开右心耳,灌入1%多聚甲醛150 mL,待右心耳流出无色透明液体后再缓慢灌入4%多聚甲醛约400 mL直至其肝脏、四肢、头颈部变硬,将头剪下,用咬骨钳咬开颅骨,仔细剥离完整的脑组织,于4%多聚甲醛中后固定,置于4 ℃冰箱内保存或行冰冻切片。用于免疫印迹的脑组织不需经多聚甲醛固定,直接取材冻存。
1.4Western Blot检测PVN中p-Ikkβ及白细胞介素-1β(IL-1β)水平①选取各组大鼠脑中PVN区域的组织放入5 μLEP管中,用酒精消毒过的眼科剪刀将组织剪碎后放置于冰上,超声细胞破碎仪进行破碎后用微量检测仪定量蛋白质的浓度,然后据不同的浓度对样本进行变性处理;②制胶,加入电泳缓冲液,加样后电泳;③转膜后用5%小牛血清封闭1 h;④加入一抗,4 ℃孵育过夜;⑤加入二抗,37 ℃条件下孵育2 h;⑥滴加现配的化学发光底物,显影成像;⑦图像分析和统计学处理,所拍胶片用NIH Image software软件分别计算各自曝光条带的面积和灰度的乘积,并计算出各指标对应曝光条带所得乘积与β-actin 条带所得乘积的比值。
1.5DHE染色原位检测PVN氧化应激将冰冻切片取出复温后用磷酸盐缓冲液(PBS,pH 7.4)冲洗3次,每次3 min;避光稀释DHE原液后滴加至切片上,37 ℃下孵育30 min;PBS液冲洗3次,每次3 min;荧光封片剂封片后在荧光显微镜下观察,并用图像分析系统进行分析。

2结果
2.1不同含盐量饲料喂养对SD大鼠平均动脉压的影响与正常饮食组比较,8%NaCl组和4%NaCl组平均动脉压升高(P<0.05),8%NaCl组平均动脉压高于4%NaCl组(P<0.05)。6周时监测平均动脉压,正常饮食组平均动脉压为(100±4) mmHg,而8%NaCl组和4%NaCl组平均动脉压分别为(132±6)mmHg和(124±5)mmHg,表示高盐饮食组大鼠均达到高血压前期血压水平,造模成功。详见图1。
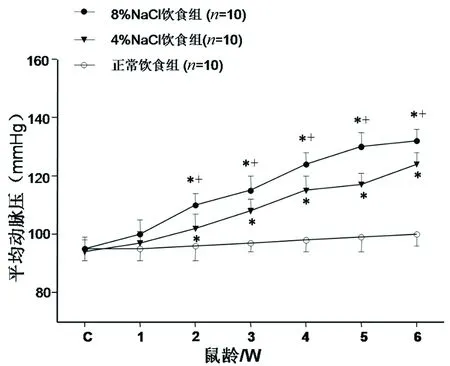
注:C为初始平均动脉压。与正常饮食组比较,*P<0.05;与4% NaCl组比较,+P<0.05。
图1不同含盐量饲料组血压监测
2.2Western Blot法检测下丘脑室旁核IL-1β含量用Western Blot法在蛋白水平半定量检测下丘脑室旁核IL-1β表达水平,灰度分析蛋白条带后进行统计学分析,结果显示8%NaCl组和4%NaCl组下丘脑室旁核IL-1β表达均高于正常饮食组(P<0.05),8% NaCl组下丘脑室旁核IL-1β表达高于4% NaCl组(P<0.05)。详见图2。
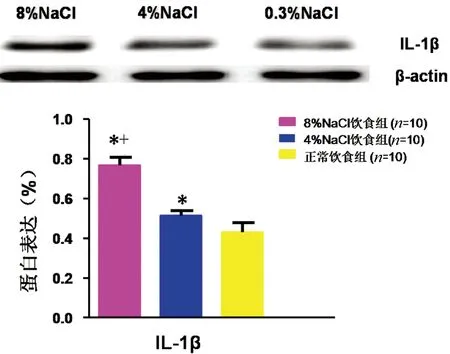
注:与正常饮食组比较,*P<0.05;与4%NaCl组比较,+P<0.05。
图2下丘脑室旁核IL-1β表达
2.3Western Blot法检测下丘脑室旁核p-Ikkβ含量8%NaCl组和4%NaCl组下丘脑室旁核p-Ikkβ表达均高于正常饮食组P<0.05,8%NaCl组下丘脑室旁核p-Ikkβ表达高于4%NaCl组(P<0.05)。详见图3。
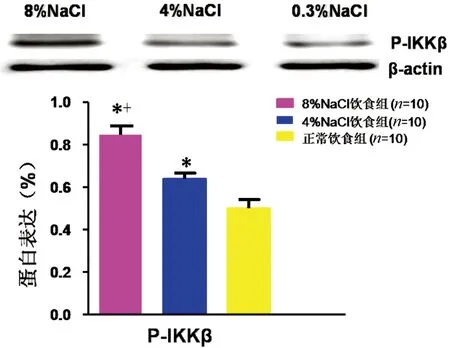
注:与正常饮食组比较,*P<0.05;与4%NaCl组比较,+P<0.05。
图3下丘脑室旁核p-Ikkβ含量
2.4DHE法测PVN氧化应激水平8%NaCl组和4% NaCl组下丘脑室旁核过氧化物表达均高于正常饮食组(P<0.05),8%NaCl组下丘脑室旁核过氧化物表达高于4%NaCl组(P<0.05)。详见图4。
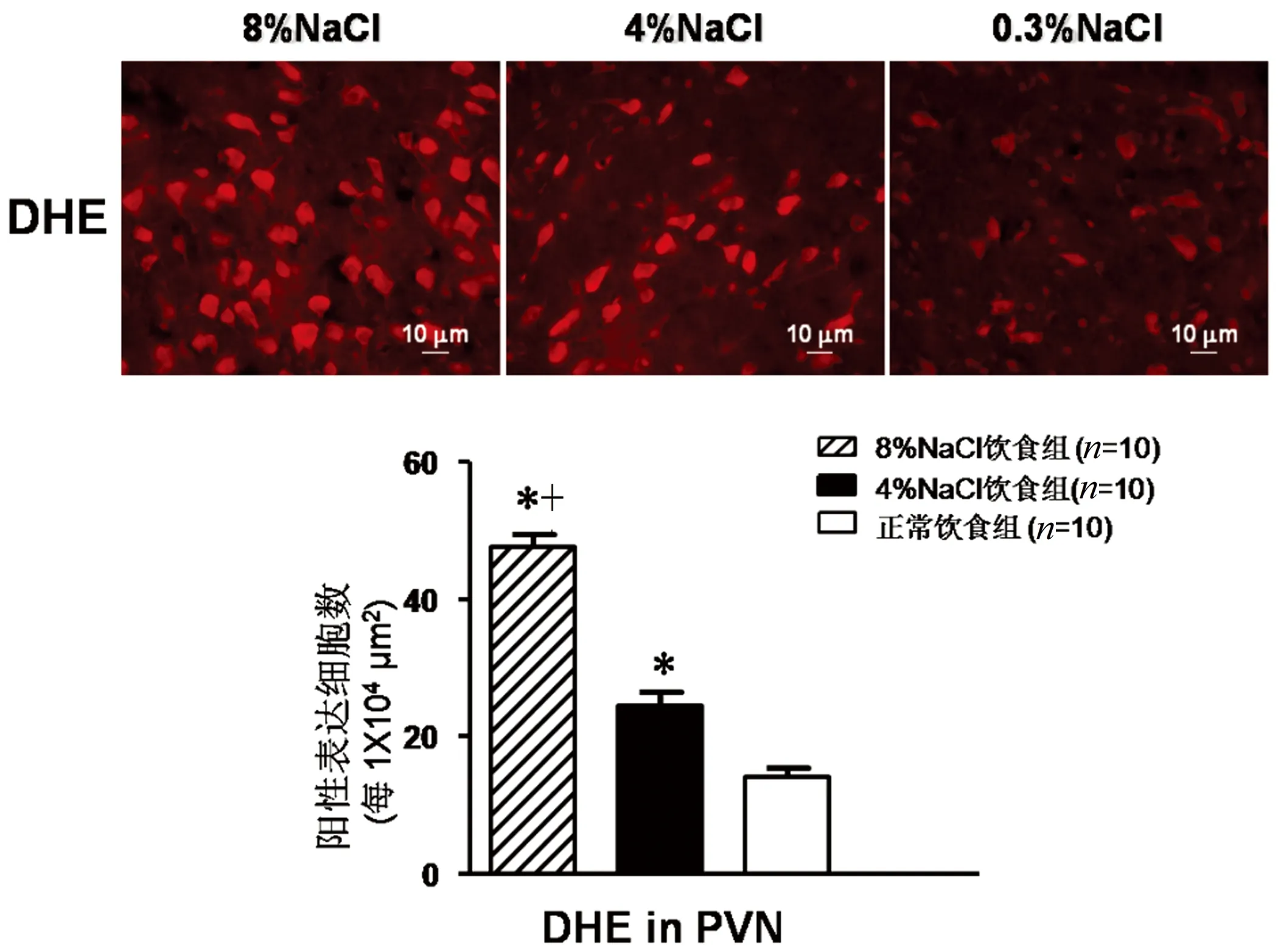
注:与正常饮食组比较,*P<0.05;与4%NaCl组比较,+P<0.05。
图4下丘脑室旁核DHE表达
3讨论
高血压前期是血压介于高血压和正常血压之间的一种中间状态,相当于我国高血压划分中的正常高值,是临床高血压和一系列与血压增高相关的心血管事件的前期[3]。高盐摄入是高血压的重要易患因素,由于其没有达到临床高血压或没有出现高血压相关症状而缺乏重视。一系列限盐实验均证实高度或中度限制盐摄入量均能降低正常人或高血压病人的收缩压和舒张压[4-5]。研究高盐对于高血压前期的影响及其机制意义重大。
下丘脑室旁核位于第三脑室下丘脑部的上端两侧,在维持心血管活动中起着关键作用。以往的研究发现,PVN区域存在完整的肾素-血管紧张素系统、活性氧簇等活性物质,并发现高血压时中枢也有免疫细胞参与,炎性细胞因子表达增多[6]。最近研究提示下丘脑室旁核细胞对高盐饮食导致的盐敏感性高血压起着重要的调节作用,发现高盐饮食可使盐敏感性大鼠PVN区细胞间质Na+浓度增高,RAS组分和活性氧簇增多,肾交感兴奋增强,血压升高[2]。
大量研究证明,NF-κB 在高血压中发挥重要作用。NF-κB 是1986年在B细胞内发现具有调节基因转录的关键因子之一,在机体炎症免疫、心血管疾病的发生发展中起着重要作用。静息状态时,细胞内的NF-κB二聚体与IκB蛋白结合于胞浆中,细胞接受外来刺激后,NF-κB二聚体与IκB蛋白解聚,从细胞浆转移到细胞核,暴露核定位信号,发挥转录调节作用。研究证实,功能性的NF-κB几乎出现在神经系统所有类型的细胞,血管紧张素Ⅱ(AngⅡ)、PIC和ROS能够有效的激活多种细胞类型的NF-κB,NF-κB调控的靶基因产物多为炎症反应介质,如炎性细胞因子[7]。有关心力衰竭大鼠中枢机制研究表明,心力衰竭时PVN区域NF-κB激活,并促进了PVN区RAS组分、ROS及PIC的产生[1,8]。对经外周静脉泵入AngⅡ造成高血压大鼠模型的研究发现,高血压时PVN区域NF-κB激活[9]。针对高盐饮食诱导的高血压前期大鼠,本实验观察到8%NaCl组与4%NaCl组大鼠PVN区p-Ikkβ表达增多,说明高盐可以使高血压前期大鼠PVN区域NF-κB激活。
本实验发现高盐饮食导致的高血压前期大鼠PVN区炎性细胞因子(IL-1β)表达增多。IL-1是体内炎性细胞因子级联反应的始动因子,IL-1β是其主要活性形式[10]。同时实验检测了3组大鼠PVN区ROS水平,发现高盐饮食组PVN区ROS水平明显高于正常饮食对照组,说明高盐饮食可使高血压前期大鼠PVN区氧化应激水平提高,与Leeneen等[2]人的实验结果一致。说明炎症反应与氧化应激在高盐致高血压前期已经存在。NF-κB的研究结果推测高盐饮食致高血压前期大鼠PVN区炎性细胞因子与活性氧簇表达增多,进而激活了PVN区域NF-κB,产生了更多的NF-κB调控的靶基因产物,如IL-1β,其详细相互关系及作用机制尚有待今后进一步研究。
比较8%NaCl组和4%NaCl组SD大鼠PVN区p-Ikkβ、IL-1β及ROS表达水平,8%NaCl组均高于4%NaCl组,且差异有统计学意义。说明高血压前期大鼠PVN区神经激素的变化与环境因素中高盐的摄入量相关。这一结论解释了人群研究发现的血压升高与盐摄入量呈剂量-效应关系[11],说明高度限盐或中度限盐有益于高血压的防治。本实验初步揭示高盐饮食在高血压前期对PVN神经激素的影响,证实了饮食含盐量与机体平均动脉压的关系,为预防或减缓高血压提供理论依据。
参考文献:
[1]Yu XJ,Suo YP,Qi J,et al.Interaction between AT1 receptor and NF-κB in hypothalamic paraventricular nucleus contributes to oxidative stress and sympathoexcitation by modulating neurotransmitters in heart failure[J]. Cardiovascular Toxicology,2013,13(4): 381-390.
[2]Gabor A,Leenen FH.Mechanisms mediating sodium-induced pressor responses in the PVN of Dahl rats[J].Am J Physiol Regul Integr Comp Physiol,2011,301(5):R1338-R1349.
[3]Svetkey LP.Management of Prehypertension[J].Hypertension,2005,45(6):1056-1061.
[4]刘治全,牟建军.盐与高血压[M].北京:北京医科大学中国协和医科大学联合出版社,1997:.
[5]刘治全,牟建军.高血压病诊断治疗学[M].北京:中国协和医科大学联合出版社,2006.
[6]Kishi T,Hirooka Y,Kimura Y,et al.Increased reactive oxygen species in rostral ventrolateral medulla contribute to neural mechanisms of hypertension in stroke-prone spontaneously hypertensive rats[J].Circulation,2004,109(19):2357-2362.
[7]Guijarro C,Egido J.Transcription factor-kappa B (NF- kappa B) and renal disease[J].Kidney-Int,2001,59(2):415-424.
[8]Kang YM,Ma Y,Elks C,et al.Cross-talk between cytokines and renin angiotensin in hypothalamic paraventricular nucleus in heart failure: role of nuclear factor-kappa B[J].Cardiovasc Res,2013,79(4):671-678.
[9]Kang YM,Ma Y,Zheng JP,et al.Brain nuclear factor-kappa B activation contributes to neurohumoral excitation in angiotensin Ⅱ-induced hypertension[J].Cardiovascular Research,2009,82: 503-512.
[10]Agarwal D,Welsch MA,Keller JN,et al.Chronic exercise modulates RAS components and improves balance between pro- and anti-inflammatory cytokines in the brain of SHR[J].Basic Res Cardiol,2011,106: 1069-1085.
[11]Versari D,Daghini E,Virdis A,et al.Endothelium-dependent contractions and endothelial dysfunction in human hypertension[J].British Journal of Pharmacology,2009,157(4):527-536.
(本文编辑薛妮)
The Central Mechanism of Prehypertensive Rats Induced by High-Salt Intake
Shi Guojuan,Kang Yuming,Yang Zhiming
The Second Hospital,Shanxi Medical University,Taiyuan 030001,Shanxi,China
Abstract:Objective In this study, we conducted to assess the effect of high-salt diet on the neurohormone in hypothalamic paraventricular nucleus(PVN) and mean arterial pressure so as to explore the central mechanism of prehypertension.MethodsThirty Sprague-Dawley rats with baseline body weights between 155 and 165 grams fed with a normal salt diet(0.3% NaCl) or a high salt (4% NaCl) diet or a higher salt (8% NaCl) diet.Arterial pressure was determined every week by a tail-cuff occlusion and their recording system.After the mean arterial pressure of high-salt groups accord with prehypertension, all the rats were decapitated while were under anesthesia.We performed western blot or DHE to detect the expression of p-Ikkβ, interleukin(IL)-1β and reactive oxygen species(ROS) in PVN of the rats.ResultsHigh-salt diet resulted in higher mean arterial pressure compared with control rats.The arterial pressure of high-salt diet and medicated group had a reduction of 21.65 mmHg compared with control group.RSNA values elicited by Tan IIA administration was 67.97% of control group.Expression of IL-1β,p-Ikkβ and ROS in PVN of high-salt diet group was higher than that in control group.ConclusionThese observations from this study suggest that proinflammatory cytokines(PIC) and ROS are associated with NF-kB within PVN in high-salt diet induced prehypertension.The higher salinity had more effect on neurohormone in PVN of prehypertensive rats than the lower salinity.
Key words:prehypertension; high-salt intake; hypothalamic paraventricular nucleus; proinflammatory cytokines; reactive oxygen species
通讯作者:杨志明,E-mail:Zhimingyang800@sina.com
中图分类号:R544.1R255.3
文献标识码:A
doi:10.3969/j.issn.1672-1349.2016.08.010
文章编号:1672-1349(2016)08-0829-04
Corresponding Author:Yang Zhiming
(收稿日期:2015-08-08)

