基质金属蛋白酶-2及Bax在人脑胶质瘤中的表达及意义
杨立军
(承德医学院附属医院神经外科,河北承德 067000)
基质金属蛋白酶-2及Bax在人脑胶质瘤中的表达及意义
杨立军
(承德医学院附属医院神经外科,河北承德 067000)
[摘要]目的观察人脑组织中基质金属蛋白酶-2(MMP-2)和Bax的表达,并探讨二者的临床应用价值。方法收集该院人脑胶质瘤患者脑组织标本50例及脑创伤内减压术中切除的脑组织标本20例,采用Western blot和免疫组织化学染色法测定脑组织中MMP-2和Bax的表达,并探讨二者在胶质瘤中的相关性。结果MMP-2在胶质瘤脑组织中的表达高于正常脑组织(P<0.05),在胶质瘤Ⅰ~Ⅱ,Ⅲ~Ⅳ级中的阳性表达率分别为26.92%,70.83%(P<0.05);Bax在脑胶质瘤中的表达量低于正常脑组织,但差异无统计学意义(P>0.05),在胶质瘤Ⅰ~Ⅱ,Ⅲ~Ⅳ级中的阳性表达率分别为76.95%、25.0%(P<0.05)。且人脑胶质瘤中MMP-2和Bax的表达呈负相关(r=-0.587,P<0.01)。结论Bax蛋白表达在脑胶质瘤发生发展中起着抑制作用,且与MMP-2蛋白呈负相关,二者联合检测可为胶质瘤的诊断提供判断指标。
[关键词]人脑胶质瘤;基质金属蛋白酶;Bax
胶质瘤(glioma)是人颅内最常见的恶性肿瘤,占据颅脑肿瘤的35%~60%左右,呈侵袭性生长,其手术切除复发率高,预后差[1-2]。尽管随着神经外科手术治疗、基因治疗、免疫治疗及各种化疗放疗技术的发展,胶质瘤仍不能被完全治愈,其预后生存期不到1年[3]。胶质瘤细胞无限制的恶性增殖是导致机体恶病质的主要原因,而迁移、侵袭则是胶质瘤细胞发生远处转移的基础,是引起病情恶化的主要因素,因此探讨针对胶质瘤侵袭性生长相关蛋白在胶质瘤中的表达具有重要意义[4]。Bax是目前公认的参与细胞凋亡调控作用的最常见抑癌蛋白,是线粒体膜上的一种促凋亡蛋白,在多种肿瘤中低表达,且与多种肿瘤的发生发展密切相关,而与胶质瘤的关系报道较少[5]。同时金属基质蛋白酶(MMP)通过对细胞外基质(ECM)的降解可促进癌细胞对周围组织的浸润,MMP-2能降解血管基底膜和细胞外基质中的Ⅳ型胶原成分,使肿瘤细胞突破结构屏障,与肿瘤内血管生成、侵袭、转移相关。因此本研究应用Western blot和免疫组织化学链霉素抗生物素蛋白-过氧化物酶连接染色法(SP)测定人脑胶质瘤脑组织中MMP-2和Bax的表达,探讨二者与人脑胶质瘤恶性程度的相关性,为人脑胶质瘤的临床治疗和预后提供判断指标。
1资料与方法
1.1材料收集本院外科手术切除的脑胶质瘤组织标本50例,其中男29例,女21例,平均年龄35岁,按WHO 2000年神经系统肿瘤分类标准,50例标本分为Ⅰ级11例,Ⅱ级15例,Ⅲ级9例,Ⅳ级15例。另取20例脑创伤内减压术中切除的脑组织标本作为正常对照。肿瘤组织均经活组织病理诊断证实,均为单一肿瘤,无并发肝、肾疾病,均经医院伦理委员会同意。
1.2主要试剂兔抗人MMP-2,Bax单克隆抗体购自Epitomics公司,SP法免疫组织化学试剂盒购自武汉博士德生物技术有限公司。辣根过氧化物酶标记的羊抗兔IgG二抗,ECL超敏发光试剂盒,BCA试剂盒,RIPA裂解液购自碧云天生物研究所。
1.3Western blot测定脑组织中MMP-2和Bax的表达RIPA裂解液裂解组织并收获蛋白。根据BCA试剂盒对蛋白浓度进行测定。蛋白样品上样,十二烷基硫酸钠(SDS)凝胶电泳2~3 h,湿法转膜30~50 min。一抗孵育,4 ℃过夜,磷酸盐缓冲液(PBS)漂洗3次,每次5 min;二抗室温孵育1~2 h。漂洗3次,每次5 min,滴加ECL曝光液,在凝胶成像系统中曝光。用“Quantity One”软件对各抗体条带灰度值进行统计。
1.4免疫组织化学染色法测定脑组织中MMP-2和Bax的表达10%甲醛溶液固定组织,石蜡包埋,切片,抗原修复,室温冷却30 min,PBS冲洗2次,一抗室温孵育,PBS冲洗2次,二抗(1∶100)37 ℃孵育,PS洗涤2次,DAB溶液显色后冲洗、复染、脱水、透明、树胶封片。以PBS液代替一抗作为阴性对照。
1.5结果判断MMP-2和Bax蛋白染色阳性主要定位于细胞质,采用半定量计分法判定,高倍镜下随机选择10个视野,分别计算500个肿瘤细胞。切片中阳性细胞小于5%为0分,6%~25%为1分,>25%~50%为2分,>50%~75%为3分,≥75%为4分;染色深度以无阳性细胞为0分,淡黄色为1分,黄色为2分,棕黄色或棕褐色为3分,免疫反应的总得分为阳性细胞百分率与免疫染色强度总得分的乘积。
1.6统计学处理采用SPSS17.0统计学软件进行分析,Western blot结果采用t检验,免疫组织化学染色法结果采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1免疫组织化学染色检测MMP-2和Bax在脑胶质瘤脑组织和正常脑组织中的表达MMP-2在正常脑组织中不表达,在人脑胶质瘤中阳性表达率为64.0%,差异具有统计学意义(P<0.01);Bax在正常脑组织中及人脑胶质瘤中阳性表达率分别为60.0%及54.0%,差异不具有统计学意义(P>0.05),见表1,图1、图2。
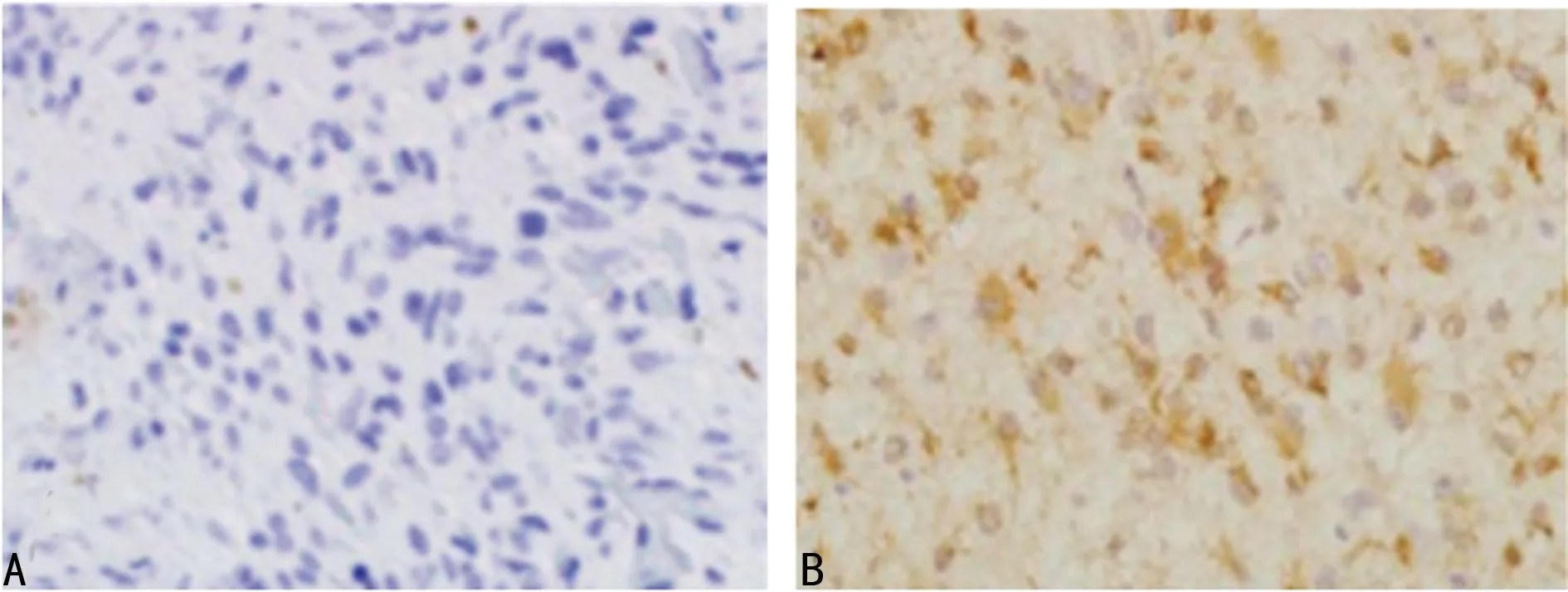
A:正常脑组织,B:脑胶质瘤脑组织。
图1MMP-2在脑胶质瘤脑组织和正常脑组织中的表达(×200)
2.2Western blot检测MMP-2和Bax在脑胶质瘤脑组织和正常脑组织中的表达MMP-2在正常脑组织中和脑胶质瘤脑组织中蛋白灰度值分别为(0.09±0.00)及(1.58±0.31),差异具有统计学意义(P<0.01),见表2、图3。Bax在正常脑组织中和脑胶质瘤脑组织中蛋白灰度值分别为(2.34±0.29)及(2.19±0.29),差异无统计学意义(P>0.05),见表2、图4。

A:正常脑组织,B:脑胶质瘤脑组织。
图2Bax在脑胶质瘤脑组织和正常脑组织中的表达(×200)

表1 MMP-2和Bax在脑胶质瘤脑组织和正常脑组织中的表达[n(%)]
**:P<0.01,与正常脑组织比较。
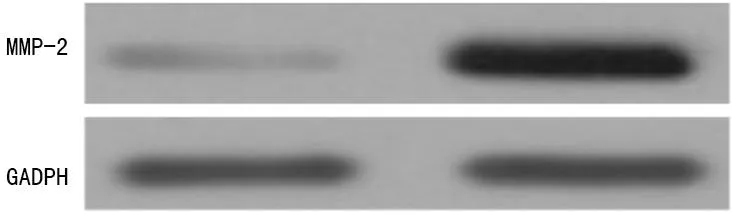
图3 Western blot检测MMP-2在脑胶质瘤脑组织和正常脑组织中的表达

图4 Western blot检测Bax在脑胶质瘤脑组织和正常脑组织中的表达

表2 MMP-2和Bax在脑胶质瘤脑组织和正常脑组织中表达的相对值
**:P<0.01,与正常脑组织比较。
2.3免疫组化检测MMP-2和Bax在各种类型脑组织中的表达MMP-2在Ⅰ~Ⅱ,Ⅲ~Ⅳ级胶质瘤中的阳性率分别为26.92%,70.83%;Bax在Ⅰ~Ⅱ,Ⅲ~Ⅳ级胶质瘤中的阳性率分别为76.95%,25.0%,差异均具有统计学意义(P<0.01),见图5、图6、表3。推测Bax在胶质瘤中起抑制作用,MMP-2在胶质瘤起促进作用。
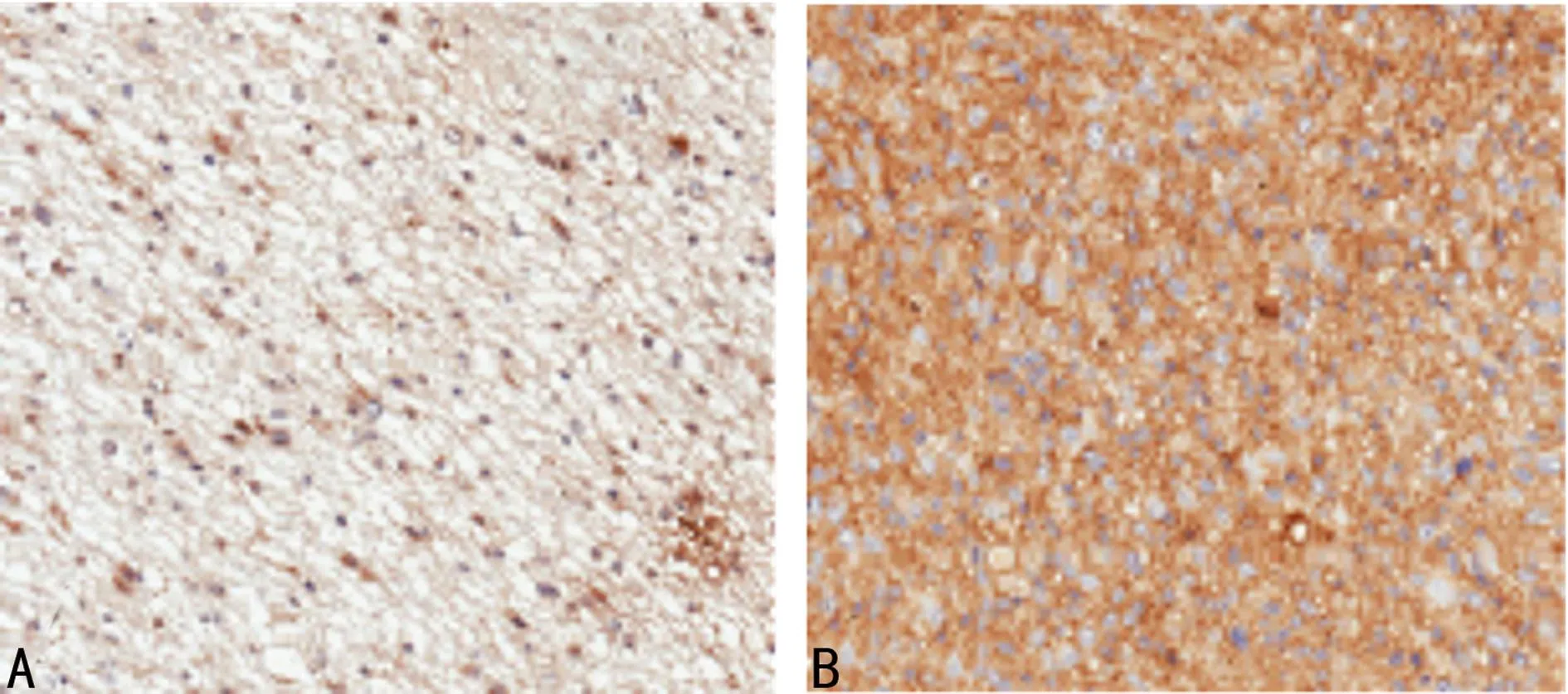
A:Ⅰ~Ⅱ级脑胶质瘤组织,B:Ⅲ~Ⅳ脑胶质瘤组织。
图5免疫组化检测MMP-2在不同级别胶质瘤脑组织中的表达(×100)
2.4MMP-2和Bax表达的相关性经Pearson相关性分析,人脑胶质瘤脑组织中MMP-2和Bax表达呈负相关(r=-0.587,P<0.01)。

A:Ⅰ~Ⅱ级脑胶质瘤组织,B:Ⅲ~Ⅳ脑胶质瘤组织(×200)。
图6免疫组化检测Bax在不同级别胶质瘤脑组织中的表达

表3 免疫组化检测MMP-2和Bax在各种类型脑组织中的表达[n(%)]
**:P<0.01,与Ⅰ~Ⅱ级脑胶质瘤组织比较。
3讨论
胶质细胞瘤是起源于神经胶质细胞的肿瘤,是颅内最常见的恶性肿瘤。在胶质瘤的发生发展过程中,胶质瘤细胞的正常凋亡过程被抑制,导致胶质瘤细胞持续不断地进行分裂与增殖。同时已有研究证实在肿瘤中检测细胞凋亡相关基因的表达可成为肿瘤诊断和预后判断的有效手段[6]。其中Bcl-2家族是被研究得最多的一类细胞凋亡相关基因。Bax是Bcl-2家族中促凋亡基因,当细胞内Bcl-2表达过多,与Bax形成二聚体,使胶质瘤细胞凋亡趋势减弱,打破了细胞增殖与凋亡的平衡,使细胞数目不断增加,从而表现出生长优势,成为胶质瘤形成的重要基础。因而探讨Bax在胶质瘤中的表达具有重要意义,所以本试验通过Western blot和免疫组化检测发现Bax在人脑胶质瘤脑组织中表达低于正常组织,虽差异无统计学意义,但有一定趋势。而与Bax在其他肿瘤中的低表达具有显著性差异不同,可能是由于检测的样本不同,组织来源不同,样本的年龄、性别差异有关。林英等[7]的研究显示:在Ⅰ~Ⅱ、Ⅲ~Ⅳ级人胶质瘤中,Bax的表达阳性细胞率逐渐下降。本实验也验证了此观点,但随着病理分级的提高,其表达量也逐渐下降。说明随着胶质瘤病理级别的升高,Bax表达量下降,Bax含量能一定程度上反映胶质瘤的恶性程度。同时进一步结合已报道文献:在组织特异性启动子和缺氧诱导元件的调控下Bax的过表达是针对胶质瘤的有效基因治疗手段[8]。Tra-8 抗人DR2单抗联合Bax过表达能显著抑制体外胶质瘤细胞生长及体内U251细胞移植瘤的生长[9]。说明胶质瘤中Bax的过表达能显著诱导胶质瘤凋亡。进一步腺病毒转染Bax到D54 MG胶质瘤细胞中,发现联合化疗能显著抑制胶质瘤细胞的增殖及克隆生长[10]。说明胶质瘤中Bax的过表达能提高化疗的敏感性,进一步刺激胶质瘤细胞凋亡。从而说明Bax在胶质瘤中起抑制作用,当其过表达有可能可以提高化疗的敏感性或直接抑制胶质瘤的增殖。
胶质瘤的侵袭性是胶质瘤远处转移的基础,可以使胶质瘤边界模糊,给手术带来困难,是患者肿瘤复发,治疗困难,预后欠佳的主要原因。在胶质瘤侵袭过程中,瘤细胞与细胞外基质表面受体结合后诱导宿主细胞产生MMPs,局部降解细胞外基质,肿瘤细胞通过缺失的细胞外基质向周围组织浸润,产生肿瘤的侵袭和转移。其中MMP-2不仅可以降解细胞外基质中的明胶Ⅳ型胶原等,有利于胶质瘤细胞沿着受损的基底膜向周围浸润,还可以通过新生毛细血管促进胶质瘤的侵袭及转移,是恶性胶质瘤浸润和侵袭的标志。因而探讨MMP-2在胶质瘤中的表达具有重要意义,所以本试验通过Western blot和免疫组化检测发现MMP-2在人脑胶质瘤中表达高于正常组织,与吴红芳等[11],Sun等[12]的研究结果一致,说明MMP-2与胶质瘤的发生有关。本文研究中亦发现Ⅲ~Ⅳ级人脑胶质瘤脑组织中MMP-2显著高于Ⅰ~Ⅱ级,且其差异均有统计学意义,与陈广等[13],Kong等[14]的试验结果一致:MMP-2蛋白及mRNA在Ⅲ~Ⅳ级中的表达高于Ⅰ~Ⅱ级,与胶质瘤的恶性程度及进展呈正相关。说明MMP-2跟人脑胶质瘤病理分级有一定关系。同时Kesanakurti等[15]的研究证实具有侵袭性的胶质瘤细胞分泌大量的MMP-2,其侵袭能力,胶质瘤恶性程度与MMP-2的表达量呈正相关。且有研究证实通过siRNA干扰MMP-2的表达,能显著抑制胶质瘤细胞的侵袭能力[16]。从而说明MMP-2在胶质瘤的发生发展中起促进作用,并与胶质瘤的高侵袭能力密切相关,抑制MMP-2表达可能一定程度上遏制胶质瘤的侵袭程度。
同时在本研究中,经Pearson相关性分析,人胶质瘤脑组织中MMP-2和Bax表达负相关,结合已报道的Bax及MMP-2启动子共转染到人肝癌细胞SNU475中,可显著促进癌细胞凋亡并抑制癌细胞侵袭[17]。推测出使Bax过表达及MMP-2低表达并转染到体外胶质瘤细胞株中可一定程度上遏制胶质瘤的增殖及侵袭。
综上所述,Bax在人脑胶质瘤中起抑制作用,MMP-2在人脑胶质瘤中起促进作用,二者都是判断胶质瘤恶性程度,病理分级的有效指标,联合检测或靶向治疗可一定程度上改善胶质瘤的恶性程度。
参考文献
[1]Schwartz K,Chang HT,Nikolai M,et al.Treatment of glioma patients with ketogenic diets:report of two cases treated with an IRB-approved energy-restricted ketogenic diet protocol and review of the literature[J].Cancer Metab,2015,3(1):1-10.
[2]Madany M,Thomas TM,Edwards L,et al.Immunobiology and immunotherapeutic targeting of glioma stem cells [J].Adv Exp Med Biol,2015(853):139-166.
[3]Cao JX,Zhang XY,Liu JL,et al.Clinical efficacy of tumor antigen-pulsed DC treatment for high-grade glioma patients:evidence from a meta-analysis[J].PLoS One,2014,9(9):e107173.
[4]Chistiakov DA,Chekhonin VP.Extracellular vesicles shed by glioma cells:pathogenic role and clinical value[J].Tumour Biol,2014,35(9):8425-8438.
[5]蔡雯,崔颖,张婷婷,等.Survivin、Bax蛋白在喉病变组织中的表达及临床意义[J].重庆医学,2011,40(20):1988-1990,1994.
[6]Yigit S,Demir L,Tarhan MO,et al.The clinicopathological significance of Bax and Bcl-2 protein expression with tumor infiltrating lymphocytes in ovarian carcinoma[J].Neoplasma,2012,59(5):475-485.
[7]林英,郝卓芳,黄世章,等.Bcl-2和bax蛋白在人脑胶质瘤中的表达及其与恶性程度的关系[J].广州医学院学报,2005,33(4):21-23.
[8]Huang JW,Gao J,Lv X,et al.Target gene therapy of glioma:overexpression of BAX gene under the control of both tissue-specific promoter and hypoxia-inducible element[J].Acta Biochim Biophys Sin (Shanghai),2010,42(4):274-280.
[9]Kaliberov S,Stackhouse MA,Kaliberova L,et al.Enhanced apoptosis following treatment with TRA-8 anti-human Dr5 monoclonal antibody and overexpression of exogenous Bax in human glioma cells[J].Gene Ther,2004,11(8):658-667.
[10]Arafat WO,Buchsbaum DJ,Gómez-Navarro J,et al.An adenovirus encoding proapoptotic Bax synergistically radiosensitizes malignant glioma[J].Int J Radiat Oncol Biol Phys,2003,55(4):1037-1050.
[11]吴红芳,符宝敏.血管生成素-2与基质金属蛋白酶-2在脑胶质瘤中的表达及意义[J].中国实用神经疾病杂志,2014,17(6):77-79.
[12]Sun ZF,Wang L,Gu F,et al.Expression of Notch1,MMP-2 and MMP-9 and their significance in glioma patients[J].Zhonghua Zhong Liu Za Zhi,2012,34(1):26-30.
[13]陈广,邱虹,于向东,等.MMP-2蛋白及mRNA在人脑胶质瘤中的表达及意义[J].药物生物技术,2013,20(2):163-166.
[14]Kong LF,Li Q,Wang LF,et al.The value and correlation between PRL-3 expression and matrix metalloproteinase activity and expression in human gliomas[J].Neuropathology,2007,27(6):516-521.
[15]Kesanakurti D,Chetty C,Rajasekhar MD,et al.Functional cooperativity by direct interaction between PAK4 and MMP-2 in the regulation of anoikis resistance,migration and invasion in glioma[J].Cell Death Dis,2012(3):e445.
[16]Badiga AV,Chetty C,Kesanakurti D,et al.MMP-2 siRNA inhibits radiation-enhanced invasiveness in glioma cells[J].PLoS One,2011,6(6):e20614.
[17]Seo E,Kim S,Jho EH.Induction of cancer cell-specific death via MMP-2 promoter-dependent Bax expression[J].BMB Rep,2009,42(4):217-222.
doi:·经验交流·10.3969/j.issn.1671-8348.2016.08.023
作者简介:杨立军(1968-),学士,副主任医师,主要从事颅内肿瘤研究。
[中图分类号]R739.4
[文献标识码]B
[文章编号]1671-8348(2016)08-1074-04
(收稿日期:2015-09-30修回日期:2015-11-26)

