丝素蛋白生物材料对细胞行为的影响
胡豆豆,杨明英,朱良均
(浙江大学应用生物资源研究所,浙江杭州310058)
丝素蛋白生物材料对细胞行为的影响
胡豆豆,杨明英,朱良均
(浙江大学应用生物资源研究所,浙江杭州310058)
摘要:生物材料的相容性一直是组织工程和再生医学领域的重要议题。组织细胞能对外界环境作出不同的响应,但只有在天然生长环境中(细胞外基质)细胞才能发挥其正常的功能。因此构建基于丝素蛋白的仿生生物材料是处理生物相容性的可行途径之一。本文介绍了细胞与细胞外基质相互作用的机理,总结了近年来丝素来源的生物材料影响细胞黏附、迁移、增殖和分化等行为的因素,包括材料的化学成分、拓扑结构(纤维尺寸、支架孔径和表面特性)以及力学特性,并在此基础上讨论了存在的问题及今后的发展方向,为设计新一代的生物材料提供参考和借鉴。
关键词:丝素蛋白;相容性;细胞行为;相互作用
丝素蛋白(silk fibroin,SF)是构成茧丝的主要成分,它赋予茧丝独一无二的理化特性。凭借一系列优异的生物特性,丝素蛋白逐渐成为组织工程研究领域所青睐的天然生物原料之一。组织工程是运用细胞生物学和工程学的方法,设计和构建适合生物活体组织生长的生物材料,以达到修复或重建组织器官的结构和功能[1]。在这个过程中,生物材料与组织细胞的相互作用显得尤为重要,因此生物相容性是评价生物材料优良与否的重要指标。近年来生物相容性的研究主要集中在细胞尺度上的细胞相容性。得益于研究手段和技术的提高,细胞相容性从早期简单的评价细胞毒理学和细胞数目、形态[2~3]逐步深入到细胞代谢、信号传导、基因表达产物等[4~6]分子水平的分析。在生物体内细胞外基质(extracellular matrix,ECM)为细胞的黏附、迁移、生长和分化提供了良好的环境,目前一些研究者试图从模拟细胞外基质的角度出发来构建组织工程的生物材料。由于细胞外基质成分和结构的复杂性,在丝素中复合其它天然成分——如胶原[7]、壳聚糖[8]、透明质酸[9]等——已成为一种普遍的研究手段。
组织工程的发展对细胞相容性研究提出了越来越高的要求,人们对生物材料与细胞的相互作用越来越重视,希望能从本质上揭示其互作的分子机理,为设计和构建能促进和指导组织修复和再生的生物材料提供理论依据。因此,本文介绍细胞外基质基质与细胞间的作用并综述基于丝素蛋白的生物材料的物化属性对细胞行为的影响。
1 基质与细胞作用的分子基础
1.1参与基质—细胞作用的成分
细胞外基质是由细胞分泌到细胞外间质中的生物大分子构成的复杂网络结构,支持、连接组织结构和调节细胞的生理活动。按功能细胞外基质的组成可分为三大类:①糖胺聚糖(glycosaminoglycan,GAG),由重复二糖单位构成的无分枝长链多糖,在结缔组织中发挥多种功能。硫酸乙酰肝素、硫酸软骨素和透明质酸是三种主要的类型;②结构蛋白,如胶原蛋白和弹性蛋白,它们为细胞外基质提供一定的强度和韧性;③黏着蛋白,包括纤粘连蛋白(fibronectin,FN)和层粘连蛋白(laminin,LN),它们均为糖蛋白,是影响细胞黏附和分化的重要因子[10~11]。
细胞黏附分子是位于细胞膜上的一类跨膜糖蛋白,以受体—配体结合的形式发挥作用。它们的特异性结合使细胞和细胞间、细胞和基质间或细胞—基质—细胞间发生黏附,参与细胞的识别、活化和信号转导、增值分化、伸展与迁移,是免疫应答、炎症反应、凝血、肿瘤转移以及创伤愈合等一系列重要生理和病理过程的分子基础。根据其结构特点黏附分子可分为整合素家族、选择素家族、免疫球蛋白超家族和钙黏蛋白家族等[11]。其中,整合素家族是在组织工程研究中报道得最广泛的黏附分子。
1.2细胞在基质上的黏附
细胞与基质的黏附可分为非特异性黏附和特异性黏附。
非特异性黏附的基本模型是DLVO理论[12],主要涉及细胞与基质表面的静电作用和范德华力。当细胞接近基质表面时,潜在的自由能降低,表明长程静电相互作用(排斥力)和长程范德华力的相互作用(吸引力)达到平衡。由于第二最小值的影响,细胞在基质表面附着并不紧密,只有当细胞克服势能垒进入第一最小值,才能与表面紧密黏附。
特异性黏附主要涉及由细胞黏附分子介导的与细胞外基质中黏着蛋白的受体—配体反应。以整合素为例,当整合素与基质外配体结合后,在Rho-A小分子GTP酶的刺激下黏着斑开始形成。黏着斑是一种几平方微米的的扁平而伸长的连接结构,通常位于细胞外周[13]。黏着斑在细胞质端结合有衔接蛋白(桩蛋白、距蛋白、黏着斑蛋白、α辅肌动蛋白和张力蛋白),衔接蛋白与肌动蛋白丝网络相连,并结合一些信号传递蛋白(图1)。黏着斑的形成是细胞外基质与细胞相互作用的基础,也是影响细胞后续功能的前提条件。
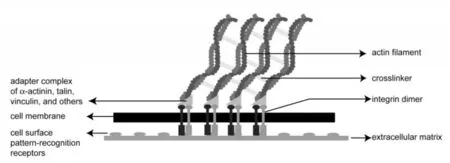
图1 黏着斑示意图[14]Figure 1 A schematic showing how the cell adheres to the substrate
1.3由信号通路介导的细胞行为
由整合素介导的黏着斑的形成使细胞外基质与细胞骨架建立了联系。整合素不仅具有黏合作用,更重要的是它起着受体和信号转换器的作用,可将信息双向跨膜传输。整合素活化引起一系列信号通路的激活,如Wnt信号、NO信号、维甲酸信号和蛋白激酶C信号(PKC),这些信号通路引起细胞核内转录因子活性的增强或减弱,从而调控基因的特异性表达,细胞代谢活性随之发生变化进而影响细胞的命运,如黏附、迁移、分化或凋亡[15]。
2 丝素材料理化特性对细胞行为的影响
在生物体内,组织细胞生活在细胞外基质的微环境中,细胞外基质时刻与细胞进行着物质和信息的交流,这种交流是细胞发挥功能的基础。基于细胞生活的天然环境,仿生材料的设计——如模拟细胞外基质的成分和结构构建的生物材料——很可能是解决组织工程和再生医学领域中某些问题的最具前景的手段之一。大量前期研究表明[2,3,16~20],基于丝素蛋白的仿生生物材料能够很好的行使天然细胞外基质的某些功能,如促进细胞生长、引导细胞迁移、分化等。然而,这类仿生生物材料的哪些特性能够进细胞应答、以及如何促进细胞应答?现阶段对这个问题的研究已经逐渐成熟并取得了一定的进展,将影响细胞生物学行为的材料因素可归纳为以下三个方面。
2.1化学成分
细胞外基质主要由纤维网架和凝胶基质构成。纤维网架由胶原蛋白和弹性蛋白构成,凝胶基质包括氨基聚糖和蛋白聚糖。由于丝素蛋白与胶原蛋白在氨基酸组成上的互补以及壳聚糖(chitosan,CS)与氨基聚糖结构的相似性,常选择胶原、丝素、壳聚糖等作为模拟细胞外基质成分的原料。
相比于家蚕丝素蛋白,柞蚕丝素蛋白来源的生物材料能更好的促进细胞在材料上的黏附,原因在于柞蚕丝素蛋白特有的RGD三肽序列(Arg-Gly-Asp)是一种细胞外基质与细胞沟通的信号分子,能与细胞膜上的整合素特异性结合,引起整合素介导的信号通路开放,从而增强细胞在基质上的黏附。Patra等[6]将从印度柞蚕丝腺中提取的丝素溶于1%的SDS(十二烷基硫酸钠)水溶液,经冷冻干燥制备出多孔3D支架,同时以家蚕丝素蛋白制备的3D支架以及明胶、纤粘连蛋白基质作为对照。将三日龄的Sprague-Dawley大鼠心肌细胞接种于4种基质上。通过研究心肌细胞在基质上的黏附情况、代谢活性和细胞间作用发现,6 h后心肌细胞在柞蚕丝素组的黏附数量和在纤粘连蛋白组的数量大致相当,显著高于明胶组和家蚕丝素组。说明心肌细胞在柞蚕丝素支架上的黏附和扩散比家蚕丝素支架要更快。同时观察到间隙连接蛋白connexin 43在柞蚕丝素组和纤粘连蛋白组的含量显著高于家蚕丝素组和明胶组,并且柞蚕丝素组和纤粘连蛋白组的心肌细胞形成了成熟的肌节。表明柞蚕丝素能够促进心肌细胞肌节的成熟和排列,肌节的生成在细胞形成组织过程中的关键因素。作者通过四肽RGDS(Arg-Gly-Asp-Ser)培养的实验证明造成心肌细胞在不同基质上的表现是由于柞蚕丝素和纤粘连蛋白中都含有RGD序列的缘故。因此,柞蚕丝素蛋白为构建组织工程生物材料提供了新的选择。
为了结合不同天然材料各自的优点,研究人员常对其进行复合。用于研究基质—细胞反应的天然材料一般是胶原、丝素、壳聚糖和明胶等。Wang等[21]用双模板诱导共组装法制备了混有羟基磷灰石的胶原/丝素支架,以胶原或丝素的单一支架作为比较。将鼠骨髓间充质干细胞(BMSCs)接种于支架上,体外成骨诱导培养。发现在三组支架材料上均观察到了干细胞的分化且双模板组细胞数量显著高于单一模板组,但特定的骨形成指示分子如碱性磷酸酶(ALP)和与骨形成相关的特定蛋白如骨钙素、骨连接蛋白的含量在双模板组和单模板组没有显著差异;在体内试验中,双模板组和单模板组都能促进新骨的形成,但形成新骨的百分比双模板组显著高于单模板组。在另一项研究中,Lai等[22]将人骨髓间充质干细胞(hMSCs)种植于由丝素/壳聚糖纳米纤维膜状支架上进行培养,并与单一材料的支架做了比较。研究表明单一丝素纳米纤维支架主要负责促进细胞增殖,而单一壳聚糖支架主要负责促进细胞分化,复合支架在保持促进细胞分化的基础上不影响对细胞的增殖效果。从这些研究可以看到,基于丝素的复合生物材料在对细胞行为影响的效果上要优于单一材料。近来,Altman等[23]通过在丝素—壳聚糖支架上种植人脂肪源性间充质干细胞(ASCs),观察到在基质—细胞界面干细胞形成了起支持和黏附作用的微绒毛和板状伪足,表明丝素—壳聚糖支架和人脂肪源性间充质干细胞的有良好的相互作用。
在天然细胞外基质中还存在着一些对细胞生长发育起调节作用的刺激因子,如骨形态发生蛋白(BMP)[24]。使用化学手段将这些生物因子共价结合到丝素材料上也能提高细胞在材料上的表现。
2.2拓扑结构
除了基质的化学成分,基质的拓扑结构如纤维尺寸、支架孔径、表面特性和微观结构等也会影响细胞的黏附、增殖和分化等功能。
2.2.1纤维尺寸
Min等[25]研究人口腔黏膜上皮细胞(NHOK)在三种不同形式的丝素基质——纺布(微米纤维)、无纺布(纳米纤维)和膜——上的响应。细胞黏附实验发现上皮细胞在无纺布和膜上的初始黏附活性要高于纺布。但造成这种差异的原因当时还不明确,作者只是推测可能与基质的β-折叠含量或纤维直径有关。钱巧芬[26]制备了5同不同晶型结构的丝素共混膜培养小鼠成纤维细胞(L929),没有发现丝素晶型结构对细胞的影响。Gupta等[27]通过比较人脂肪源性间充质干细胞(hASCs)和人脐静脉内皮细胞(HU-VEC)在微米级丝素壳聚糖纤维基质和纳米级丝素壳聚糖纤维基质上的生长发现,纳米纤维基质比微米纤维基质更能促进两种细胞的黏附。认为这是由于纳米纤维具有更大的比表面积能够提供细胞更多的锚固位点造成的。因此他们的研究证实了纤维尺寸是影响细胞行为的因素之一。
在了解纳米纤维能促进细胞活动的基础上,人们试图从分子水平上揭示基质—细胞黏附的机制。Bondar等[28]深入探寻了纳米和微米丝素基质对人脐静脉内皮细胞(HUVEC)和生长内皮细胞(OEC)的影响,实时定量PCR发现两种细胞的β-1整合素受体蛋白表达量在纳米基质中显著高于微米基质。进一步实验发现在纳米基质中细胞与基质间形成了明显的黏着斑结构。
2.2.2支架孔径
合适的支架孔径和孔隙率能为细胞生长迁移提供理想的表面和贯通孔道。前期研究表明适合细胞生长的最小孔径为100 μm左右[29]。Bhardwaj等[8]制备出孔径分布在100~155 μm的丝素壳聚糖支架培养猫科动物成纤维细胞(AH927),发现细胞在支架上生长良好。在随后的研究中,Bhardwaj等[4]又详细调查了丝素壳聚糖3D支架(128 μm)对鼠骨髓间充质干细胞(rMSCs)的影响,以纯柞蚕丝素支架(145 μm)和家蚕丝素支架(81 μm)作为比较。发现丝素壳聚糖支架和柞蚕丝素支架对细胞的黏附性能、增殖性能以及与软骨形成相关的外基质基因(Ⅱ型胶原、aggrecan和软骨形成转录因子sox-9)的表达水平表现相当,显著高于家蚕丝素支架。表明除支架的化学成分外,较大的孔径能提高软骨生成的潜力。
2.2.3表面特性
表面粗糙程度的不同会在体内诱发不同的免疫反应。机体对外部植入材料的免疫应答取决于表面拓扑结构而非化学成分[30]。光滑的表面诱导严重的炎症反应,而粗糙的表面能降低先天免疫反应的程度[6]。Diener等[31]研究了不同材料表面特性对MG-63成骨细胞形成黏着斑的大小、数量和动态的影响,发现粗糙表面的黏着斑数量要少于光滑表面。他们认为材料表面是通过影响黏着斑从而决定细胞的行为。
2.3力学特性
细胞生活的外基质在不同的组织其硬度差距悬殊,软组织如大脑的弹性模量约为1 KPa,肌肉约为10 KPa,而硬组织如骨可达100 KPa[32]。有证据表明,黏附在基质上的细胞会对基质施加收缩力,从而导致细胞骨架产生拉伸应力。有趣的是这种应力和细胞外基质之间的关系会影响细胞的行为,如迁移、增殖、分化和凋亡[33]。Engler等[32]将人骨髓间充质干细胞(hMSCs)培养在高、中、低三种不同硬度的聚丙烯酰胺凝胶上,最初小而圆的细胞分别在三种凝胶上发育成多边形、纺锤形和分枝形的形状。最近,Wen等[34]为了排除基质孔隙对细胞分化的影响,制备了不同孔径相同硬度的聚丙烯酰胺凝胶,在分化因子存在的情况下培养骨髓间充质干细胞(MSCs)和脂肪源性间充质干细胞(ASCs),发现孔隙不影响细胞分化;在相同孔径不同硬度的基质上,软凝胶能促进脂肪生成,硬凝胶能促进骨生成。同年,Chaudhuri等[5]巧妙的混合海藻酸钠和重构基底膜制备了硬度可控且不影响成分和构造的基质,以观察基质硬度是如何影响乳腺上皮细胞形成腺泡组织。他们发现在没有足够层粘连蛋白的情况下,增加基质硬度导致细胞不能形成半桥粒结构(形成正常腺泡组织的细胞连接)。说明细胞外基质硬度和基质中的配体蛋白共同调节半桥粒的生成,而半桥粒的形成是由β4整合素引起的Rac1和P13K信号通路引发的。
研究细胞外基质硬度对细胞行为的影响一个最主要的障碍是制备以硬度为单一变量的基质。而使用天然外基质材料如胶原则不能准确控制硬度,使用合成材料如聚丙烯酰胺则缺少与细胞表面特异作用的配体蛋白。因此,制备出硬度可控的丝素生物材料是研究的关键。Amornsudthiwat等[35]利用氧等离子蚀刻技术构建了不同硬度的丝素膜,接种小鼠成纤维细胞(L929)观察细胞行为,发现细胞在硬度大的丝素膜上迁移快。他们认为这是由丝素膜硬度引起的。但是,硬度大的丝素膜表面粗糙程度高。所以不能完全解释细胞迁移率变化的问题。
3 展望
由于技术方法的进步,如应用原子力显微镜评价表面拓扑结构[35]、测定材料的力学性能[5];通过免疫荧光染色观察基质—细胞作用的关键蛋白[28]等。这些技术使得我们能更深刻的认识基质材料与细胞的相互作用。虽然目前已经取得了一些成绩,但还是有许多问题需要加以解决。多数试验仅研究了在体外基于丝素的生物材料对细胞的影响,侧重点主要集中在细胞的行为上。而生物材料发挥作用的场所是在生物体内,因此这些材料是否可以应用在组织工程修复还需要进一步体内试验的证明。另外,就材料的力学性能对细胞行为的影响方面,主要使用的材料还是无机合成材料,生物材料较少。究其原因,主要在于目前要想制备出力学性能单一变化的生物材料还有一定困难。随着这些问题的解决,人们有望通过控制生物材料的化学成分、拓扑结构和力学性能来调控体内细胞的行为,从而达到修复组织损伤的目的。
参考文献
[1]周长忍.生物材料学[M].北京:中国医药科技出版社,2004:288.
[2]Minoura N,Aiba S I,Higuchi M,et al. Attachment and growth of fibroblast cells on silk fibroin[J]. Biochem. Biophys. Res. Commun. 1995,208(2):511~516.
[3]Gotoh Y,Tsukada M,Minoura N,et al. Synthesis of poly (ethylene glycol)-silk fibroin conjugates and surface interaction between L- 929 cells and the conjugates[J]. Biomaterials. 1997,18(3):267~271.
[4]Bhardwaj N,Kundu S C. Chondrogenic differentiation of rat MSCs on porous scaffolds of silk fibroin/chitosan blends[J]. Biomaterials. 2012,33(10):2848~2857.
[5]Chaudhuri O,Koshy S T,Branco da Cunha C,et al. Extracellular matrix stiffness and composition jointly regulate the induction of malignant phenotypes in mammary epithelium[J]. Nature materials. 2014,13(10):970~978.
[6]Patra C,Talukdar S,Novoyatleva T,et al. Silk protein fibroin from Antheraea mylitta for cardiac tissue engineering[J]. Biomaterials. 2012,33(9):2673~2680.
[7]Maghdouri- White Y,Bowlin G L,Lemmon C A,et al. Mammary epithelial cell adhesion,viability,and infiltration on blended or coated silk fibroin- collagen type I electrospun scaffolds[J]. Mater. Sci. Eng.,C. 2014,43:37~44.
[8]Bhardwaj N,Kundu S C. Silk fibroin protein and chitosan polyelectrolyte complex porous scaffolds for tissue engineering applications[J]. Carbohydr. Polym. 2011,85 (2):325~333.
[9]Garcia-Fuentes M,Meinel A J,Hilbe M,et al. Silk fibroin/hyaluronan scaffolds for human mesenchymal stem cell culture in tissue engineering[J]. Biomaterials. 2009,30(28):5068~5076.
[10]Kuraitis D,Giordano C,Ruel M,et al. Exploiting extracellular matrix-stem cell interactions:A review of natural materials for therapeutic muscle regeneration[J]. Biomaterials. 2012,33(2):428~443.
[11]熊党生.生物材料与组织工程[M].北京:科学出版社,2010:242.
[12]Temenoff J S,Mikos A G.生物材料:生物学与材料科学的交叉[M].北京:科学出版社,2009.
[13]Geiger B,Bershadsky A,Pankov R,et al. Transmembrane extracellular matrix-cytoskeleton crosstalk[J]. Nature Reviews Molecular Cell Biology. 2001,2(11):793~805.
[14]Ananthakrishnan R,Ehrlicher A. The forces behind cell movement[J]. Int. J. Biol. Sci. 2007,3(5):303~317.
[15]Gao Y,Liu S,Huang J,et al. The ECM-cell interaction of cartilage extracellular matrix on chondrocytes[J]. Biomed Res. Int. 2014.
[16]Unger R E,Wolf M,Peters K,et al. Growth of human cells on a non-woven silk fibroin net:A potential for use in tissue engineering[J]. Biomaterials. 2004,25(6):1069~1075.
[17]Mauney J R,Nguyen T,Gillen K,et al. Engineering adipose- like tissue in vitro and in vivo utilizing human bone marrow and adipose- derived mesenchymal stem cells with silk fibroin 3D scaffolds[J]. Biomaterials. 2007,28(35):5280~5290.
[18]Jin H J,Chen J S,Karageorgiou V,et al. Human bone marrow stromal cell responses on electrospun silk fibroin mats[J]. Biomaterials. 2004,25(6):1039~1047.
[19]Chiarini A,Petrini P,Bozzini S,et al. Silk fibroin/poly (carbonate)-urethane as a substrate for cell growth:In vitro interactions with human cells[J]. Biomaterials. 2003,24(5):789~799.
[20]Yang Y,Ding F,Wu H,et al. Development and evaluation of silk fibroin-based nerve grafts used for peripheral nerve regeneration[J]. Biomaterials. 2007,28(36):5526~5535.
[21]Wang J,Yang Q,Mao C,et al. Osteogenic differentiation of bone marrow mesenchymal stem cells on the collagen/ silk fibroin bi-template-induced biomimetic bone substitutes[J]. Journal of Biomedical Materials Research Part A. 2012,100A(11):2929~2938.
[22]Lai GJ,Shalumon K T,Chen SH,et al. Composite chitosan/silk fibroin nanofibers for modulation of osteogenic differentiation and proliferation of human mesenchymal stem cells[J]. Carbohydr. Polym. 2014,111:288~297.
[23]Altman A M,Gupta V,Rios C N,et al. Adhesion,migration and mechanics of human adipose- tissue- derived stem cells on silk fibroin-chitosan matrix[J]. Acta Biomater. 2010,6(4):1388~1397.
[24]Karageorgiou V,Meinel L,Hofmann S,et al. Bone morphogenetic protein-2 decorated silk fibroin films induce osteogenic differentiation of human bone marrow stromal cells[J]. J. Biomed. Mater. Res. A. 2004,71A(3):528~537.
[25]Min B M,Jeong L,Nam Y S,et al. Formation of silk fibroin matrices with different texture and its cellular response to normal human keratinocytes[J]. Int. J. Biol. Macromol. 2004,34(5):281~288.
[26]钱巧芬.不同结构的丝素蛋白材料与细胞相互作用研究[D].苏州:苏州大学,2013.
[27]Gupta V,Davis G,Gordon A,et al. Endothelial and stem cell interactions on dielectrophoretically aligned fibrous silk fibroin-chitosan scaffolds[J]. J. Biomed. Mater. Res. A. 2010,94A(2):515~523.
[28]Bondar B,Fuchs S,Motta A,et al. Functionality of endothelial cells on silk fibroin nets:Comparative study of micro- and nanometricfibresize[J]. Biomaterials. 2008,29 (5):561~572.
[29]Karageorgiou V,Kaplan D. Porosity of 3D biomaterial scaffolds and osteogenesis[J]. Biomaterials. 2005,26 (27):5474~5491.
[30]Ratner B D,Bryant S J. Biomaterials:Where we have been and where we are going[J]. Annu. Rev. Biomed. Eng. 2004,6:41~75.
[31]Diener A,Nebe B,Luthen F,et al. Control of focal adhesion dynamics by material surface characteristics[J]. Biomaterials. 2005,26(4):383~392.
[32]Engler A J,Sen S,Sweeney H L,et al. Matrix elasticity directs stem cell lineage specification[J]. Cell. 2006,126 (4):677~689.
[33]Guilak F,Cohen D M,Estes B T,et al. Control of stem cell fate by physical interactions with the extracellular matrix[J]. Cell Stem Cell. 2009,5(1):17~26.
[34]Wen J H,Vincent L G,Fuhrmann A,et al. Interplay of matrix stiffness and protein tethering in stem cell differentiation[J]. Nature materials. 2014,13(10):979~987.
[35]Amornsudthiwat P,Damrongsakkul S. Oxygen plasma etching of silk fibroin alters surface stiffness:A cell-substrate interaction study[J]. Plasma Processes and Polymers. 2014,11(8):763~776.
Influence of Silk Fibroin-based Biomaterials on Cell Behaviors
HU Dou-dou,YANG Ming-yin,ZHU Liang-jun
(Research Institute of Applied Bioresource,ZhejiangUniversity,Hangzhou 310058,China)
Abstract:Compatibility between biomaterials and organismhasis an important topic in the field of tissueengineering and regenerative medicine. Tissue cells respond differently to environments,while they function well only in the natural microenvironment where they live(extracellular matrix,ECM). It is a logical way to study biocompatibility by constructing silk fibroin(SF)- based biomimetic biomaterials. This review introduced the mechanism of interaction between cells and ECM,and summarized the effects of SF-based biomaterials on cell adhesion,migration,proliferation and differentiation in recent years,including chemical composition of biomaterials,topology(fiber size,scaffold pore size and surface characteristics),and mechanical properties. Moreover,on this basis existingproblems and future perspectives in this field were addressed to provide reference for the design of the next generation of biomaterials.
Key words:silk fibroin;compatibility;cell behaviors;interaction
中图分类号:S886
文献标识码:A
文章编号:0258-4069[2016]01-006-06
基金项目:国家自然科学基金项目(21172194);现代农业产业技术体系建设专项(CARS-22);国家高科技研究发展计划“863”项目(2013AA102507-1)
作者简介:胡豆豆(1988-),男,湖北仙桃人,博士研究生。主要从事蚕业理化性质及开发研究。E-mail:kevinhdd@163.com
通信作者:朱良均,男,教授,博士生导师。E-mail:ljzhu@zju.edu.cn

