Ca2+对CdTe量子点复合丝素蛋白凝胶的影响
宋国龙,赵雪芹,孔祥东
(浙江理工大学,生命科学学院,浙江杭州310018)
Ca2+对CdTe量子点复合丝素蛋白凝胶的影响
宋国龙,赵雪芹,孔祥东
(浙江理工大学,生命科学学院,浙江杭州310018)
摘要:本实验利用LiBr法溶解丝素并制备其蛋白凝胶,基于CdTe量子点(quantum dots,QDs)本身固有的优良光学性能,通过荧光分光光度计分别测定不加Ca2+时和加入不同浓度的Ca2+时,CdTe量子点与丝素蛋白凝胶复合过程中荧光强度的变化,该实验结果证明CdTe量子点与丝素蛋白凝胶的复合需要Ca2+的介导,并且在一定范围内二者结合强度与Ca2+的加入量呈正相关性。
关键词:CdTe量子点;丝素蛋白凝胶;钙离子;荧光复合物
量子点(quantum dots,QDs)是一种纳米尺寸的准零维团簇粒径在1~10 nm之间,由于QDs三个维度的尺寸都在100 nm以下,电子和空穴均被量子限域,造成QDs能带由连续能级结构变成分离的能级结构,从而表现出与块体材料完全不同的光学特性,如激发波长范围宽、发射波长范围窄且对称、量子产率高、荧光寿命长、光学性能稳定等。随着量子点水相合成法的不断改进,所合成量子点的荧光产率不断升高,1993年Rajh等[1]第一次实现了在水相中直接合成巯基甘油修饰的CdTe QDs。Guo等[2]合成的巯基乙酸包覆的CdTe QDs,荧光量子产率高达50%。Rogach等[3]合成经巯基乙酸(Thioglycolic acid,TGA)修饰的CdTe QDs,其荧光量子产率提高到60%。于是,量子点作为离子探针和生物探针在离子检测与生物成像方面的应用得到了进一步的发展。Isarov等[4]对QDs与金属离子相互作用的机理进行了研究,Cu2+能够猝灭CdS QDs,推测其猝灭机理可能是是Cu2+在QDs的表面,被还原为Cu+,产生的Cu+又引起QDs导带的电子与价带发生空穴重组,从而使QDs的荧光猝灭。QDs作为荧光探针标记生物体系的构思最初是由Alivisatos等[5]提出的,基于QDs荧光的猝灭与恢复,可以将QDs用于生物成分如胰蛋白酶[6]、淋巴细胞[7]等的标记与成像。
丝素蛋白是从蚕丝中提取的天然高分子纤维蛋白,具有良好的机械性能和理化性质,如良好的柔韧性和抗拉伸强度、透气透湿性、缓释性[8]等,并且经过不同处理可以得到不同的形态,如纤维、溶液、粉体、膜[9]以及凝胶[10]等。丝素蛋白溶液可以通过改变浓度[11]、pH值[12]或物理超声功率[13]等条件转变为凝胶状态以及加速丝素蛋白凝胶化的进程。本实验用Li-Br法制备丝素蛋白水溶液,在经过透析浓缩得到丝素蛋白凝胶。将制备的CdTe QDs分别与丝素蛋白凝胶混合,经过物理超声、离心处理之后,再用荧光分光光度计分别测定CdTe QDs/丝素蛋白凝胶复合物上清与沉淀物的荧光强度来研究CdTe QDs与丝素蛋白凝胶复合过程。CdTe QDs具有优异的荧光性能,其对细胞的毒性依赖于它的用量[14],与丝素蛋白凝胶复合之后也会降低CdTe QDs的毒性[15]。同时,丝素蛋白是一种天然的生物材料,广泛用于骨组织修复[16,17]和药物运输[18,19],具有良好的生物相容性。通过研究CdTe QDs与丝素蛋白凝胶的复合,可以整合二者的优势,得到性能更好、应用更广泛的复合材料。
1 材料与方法
1.1材料
醋酸镉二水合物,亚碲酸钾,硼氢化钠,巯基乙酸,氢氧化钠,氯化钙,碳酸钠,溴化锂购于上海Aladdin试剂公司。浓盐酸购于华东医药股份有限公司。去离子水由Milipore纯水仪制备。
1.2方法
1.2.1CdTe QDs的制备[20]
量取浓度为4 mM的醋酸镉溶液50 mL置于圆底烧瓶中,并用1 M NaOH溶液调节pH在10.5~11.0之间并进行持续搅拌,反应5 min;加入18 μL TGA,并用NaOH溶液调节pH在10.5~11.0之间,反应5 min;量取浓度为0.8 mM的K2TeO3溶液50 mL以及80 mg NaBH4加入体系之中,维持pH在10.5~11.0之间,持续反应5 min;将圆底烧瓶置于油浴锅中,调节温度为120℃进行冷凝回流反应,每隔15 min进行取样保存;用无水乙醇离心洗涤至上清液在紫外灯下无荧光,分离出沉淀,将沉淀放入冻干机内冷冻干燥后,保存待用。
1.2.2丝素蛋白凝胶的制备[21]
用0.5 wt%Na2CO3水溶液精练茧层2次,每次30 min,精练温度98℃,浴比为1∶100。
精练后用蒸馏水充分洗净,自然干燥,得到丝素蛋白纤维。用9.3 M的LiBr溶液溶解丝素蛋白纤维,溶解温度为60℃,浴比为1∶5,将混合溶液置于磁力搅拌器上溶解6 h。将溶解后的得到的溶液经过纱布过滤之后,灌入透析袋(截留分子量12000~14000)中,在流水中透析3 d。取出透析袋放在支架上用小风扇过夜风吹浓缩得到丝素蛋白凝胶。
1.2.3CdTe QDs/丝素蛋白复合物的制备
本实验所用的CdTe QDs在冷凝回流时间45 min后,经过F-4500荧光分光光度计的三维扫描测得该CdTe QDs的最大激发波长为362 nm,最大发射波长为530 nm。
取500 μL 2 mg/mL丝素蛋白凝胶,加入100 μL 2 mM CdTe QDs;超声处理30 min,然后10 000 rpm离心3 min,收集上清,重悬沉降物,再离心两次同时收集上清,最后加入500 μL去离子水重悬沉淀物,利用荧光分光光度计检测三次离心的上清以及最后的沉淀物重悬液的荧光强度。
取500 μL 2 mg/mL丝素蛋白凝胶,加入50 μL 2 mM CdTe QDs;然后向每只离心管中各加入50 μL不同浓度的Ca2+:浓度梯度为1 mM、10 mM、100 mM。超声处理30 min,然后10000 rpm离心3 min,收集离心的上清并且用去离子水重悬沉淀物。利用F-4500荧光分光光度计检测上清以及最后的沉淀物重悬液的荧光强度。
2 结果与分析
2.1不含Ca2+时,丝素蛋白凝胶与CdTe QDs的复合过程的荧光光谱图
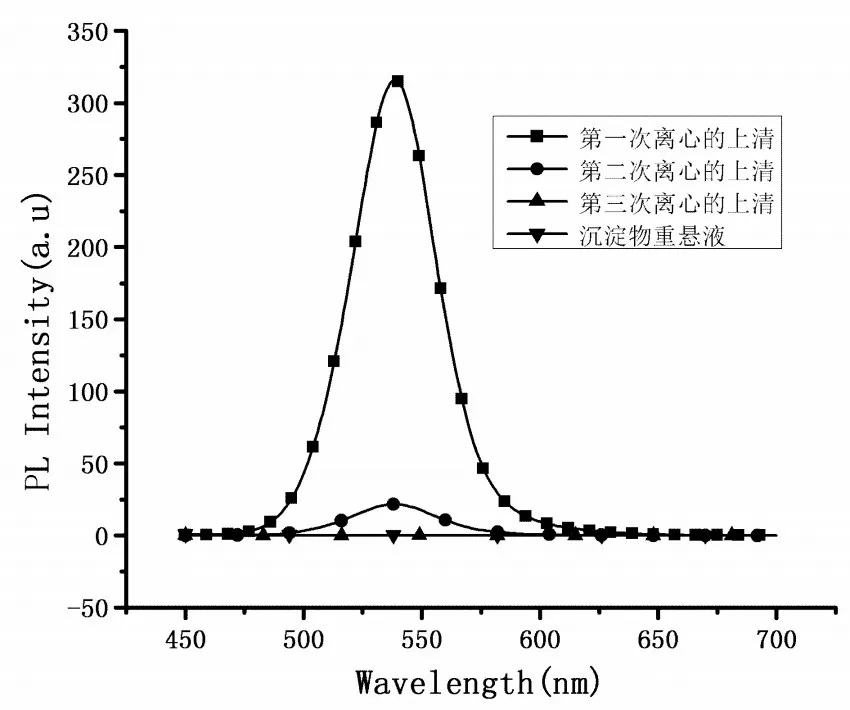
图1 CdTe QDs与丝素蛋白凝胶复合过程的荧光光谱图Figure 1 Fluorescence spectrum of the recombination process of CdTe QDs and SF gel
凝胶复合过程的荧光强度变化情况如图1所示。由图1可知,CdTe QDs与丝素蛋白凝胶复合过程中三次离心收集的上清以及最后沉降物的重悬液,经过荧光分光光度计检测它们的荧光强度分别为319.4,20.4,0,0。从该荧光光谱图可以看出,前两次离心所得上清的荧光强度从319.4急剧衰减至20.4,说明溶液中的CdTe QDs绝大部分都没有与丝素蛋白凝胶结合,而是游离在上清之中;经过第三次离心,沉淀物的荧光强度降低至0,这说明CdTe QDs不能与丝素蛋白凝胶复合,至少是不能稳定的结合在一起。
2.2加入不同浓度的Ca2 +后,丝素蛋白凝胶与CdTe QDs的复合过程的荧光光谱图
加入不同浓度的Ca2+之后,CdTe QDs与丝素蛋白凝胶的复合过程上清的荧光强度变化如图2所示。由图2可知,CdTe QDs与丝素蛋白凝胶的混合体系中,不加入Ca2+时以及加入三种不同浓度的Ca2+后,利用荧光分光光度计检测它们的离心所得上清的荧光强度分别为166.5,162.3,10.65,0,混合体系上清中荧光强度的变化情况与加入Ca2+的浓度高低呈现负相关性。加入Ca2+后,其可以介导CdTe QDs与丝素蛋白凝胶形成复合物,该复合物随离心作用而与上清液分离。Ca2+能够介导CdTe QDs与丝素蛋白凝胶之间的结合,并且在一定范围内Ca2+的加入量与二者结合强度呈正相关性。
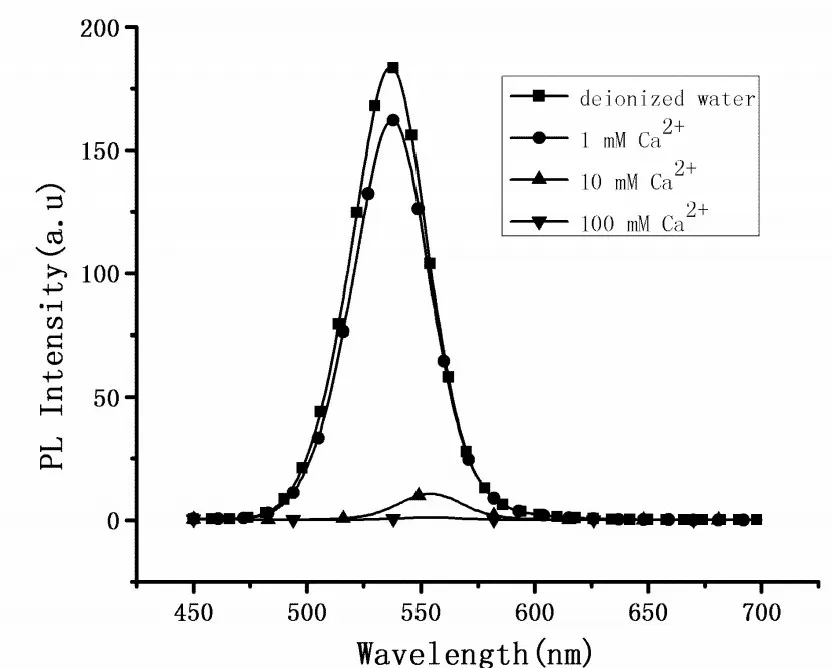
图2 加入不同浓度的Ca2+之后CdTe QDs与丝素蛋白凝胶的复合过程上清的荧光光谱图Figure 2 Fluorescence spectrum of supernate in the recombination process of CdTe QDs and SF gel with different concentration Ca2+solution

图3 加入不同浓度的Ca2+之后CdTe QDs与丝素蛋白凝胶复合过程中沉淀物重悬后的荧光光谱图Figure 3 Fluorescence intensity of resuspending precipitate in the recombination process of CdTe QDs and SF gel
加入不同浓度的Ca2+之后,CdTe QDs与丝素蛋白凝胶复合过程中沉降物重悬后的荧光强度变化情况如图3所示。CdTe QDs与丝素蛋白凝胶混合体系中加入三种不同浓度的Ca2+后得到的沉淀物重悬液经过荧光分光光度计检测它们的荧光强度分别为33.95,1.85,0。从该荧光光谱图可以看出,沉淀物重悬液中CdTe QDs荧光强度的变化由强到弱,该变化趋势与加入Ca2+浓度的变化呈现正相关性。该实验结果与CdTe QDs和丝素蛋白凝胶复合过程上清中所检测到的荧光强度变化情况一致,排除了实验过程中CdTe QDs荧光强度淬灭因素的干扰,从两个方面确定了CdTe QDs和丝素蛋白凝胶的复合过程需要Ca2+的介导。其原因推测是CdTe QDs经过巯基乙酸修饰,表面带有负电荷,丝素蛋白也呈现负电性,加入Ca2+之后打破了CdTe QDs与丝素蛋白凝胶之间的电荷斥力的壁垒,架起了二者复合的桥梁。
3 结论
本实验研究了CdTe QDs与丝素蛋白凝胶的复合过程以及Ca2+浓度对该过程的影响作用。结果表明:CdTe QDs与丝素蛋白凝胶的复合需要Ca2+的介导,否则二者无法结合;CdTe QDs与丝素蛋白凝胶的结合强度与加入Ca2+的浓度有关,Ca2+浓度越高,二者的复合程度越好。随着Ca2+浓度的提高,CdTe QDs与丝素蛋白凝胶之间的结合程度加强。该实验解决了CdTe QDs与丝素蛋白凝胶之间不能复合的问题,CdTe QDs与丝素蛋白凝胶的复合可以整合二者的优势,有利于进一步拓展丝素蛋白凝胶在药物载体、防伪标记等方面的应用。
参考文献
[1]Rajh T,Micic O I,Nozik A J. Synthesis and characterization of surface- modified colloidal Cadmium Telluride quantum dots[J]. Journal of Physical Chemistry,1993,97 (46):11999~12003.
[2]Guo J,Yang W,Wang C. Systematic study of the photoluminescence dependence of thiol-capped CdTe nanocrystals on the reaction conditions[J]. Journal of Physical Chemistry B,2005,109(37):17467~17473.
[3]Rogach A L,Franzl T,Klar TA,et al. Aqueous synthesis of thiol-capped CdTe nanocrystals:State-of-the-art[J]. Journal of Physical Chemistry C,2007,111(40):14628~14637.
[4]Isarov A V,Chrysochoos J. Optical and photochemical properties of nonstoichiometric Cadmium Sulfide nanoparticles:Surface modification with Copper(ii)ions[J]. Langmuir,1997,13(12):3142~3149.
[5]Bruchez M,Moronne M,Gin P,et al. Semiconductor nanocrystals as fluorescent biological labels[J]. Science,1998,281(5385):2013~2016.
[6]Zhang H,Sun P,Liu C,et al. L-cysteine capped CdTe-CdS Core-shell quantum dots:Preparation,characterization and immuno- labeling of HeLa cells[J]. Luminescene,2011,26(2):86~92.
[7]Dong W,Ge X,Wang M,et al. Labeling of BSA and imaging of mouse T-lymphocyte as well as mouse spleen tissue by L-glutathione capped CdTe quantum dots[J]. Luminescence,2010,25(1):55~60.
[8]Khalid A,Mitropoulos A N,Marelli B,et al. Doxorubicin loaded nanodiamond-silk spheres for fluorescence tracking and controlled drug release[J]. Biomedical Optics Express,2015,7(1):132~147.
[9]Wang Y,Kim H J,Vunjak-Novakovic G,et al. Stem cellbased tissue engineering with silk biomaterials[J]. Biomaterials,2006,27(36):6064~6082.
[10]Kundu B,Rajkhowa R,Kundu S C,et al. Silk fibroin biomaterials for tissue regenerations[J]. Advanced Drug Delivery Reviews,2013,65(4):457~470.
[11]Motta A,Migliaresi C,Faccioni F,et al. Fibroin hydrogels for biomedical applications:preparation,characterization and in vitro cell culture studies[J]. Journal of Biomaterials Science- Polymer Edition,2004,15(7):851~864.
[12]Guziewicz N,Best A,Perez-Ramirez B,et al. Lyophilized silk fibroin hydrogels for the sustained local delivery of therapeutic monoclonal antibodies[J]. Biomaterials,2011,32(10):2642~2650.
[13]Wu X,Hou J,Li M,et al. Sodium dodecyl sulfate-induced rapid gelation of silk fibroin[J]. Acta Biomaterialia,2012,8(6):2185~2192.
[14]Sun Y Y,Hu M,Fan C H,et al. The cytotoxicity of CdTe quantum dots and the relative contributions from released cadmium ions and nanoparticle properties[J]. Biomaterials,2010,31(18):4829~4834.
[15]Soenen S J,Demeester J,Smedt S C D,et al. The cytotoxic effects of polymer-coated quantum dots and restrictions for live cell applications[J]. Biomaterials,2012,33 (19):4882~4888.
[16]Kasoju N,Bora U. Silk Fibroin in Tissue Engineering[J]. Advanced Healthcare Materials,2012,1(4):393~412.
[17]Mottaghitalab F,Hosseinkhani H,Shokrgozar M A,et al. Silk as a potential candidate for bone tissue engineering [J]. Journal of Controlled Release,2015,215:112~128.
[18]Germershaus O,Werner V,Kutscher M,et al. Deciphering the mechanism of protein interaction with silk fibroin for drug delivery systems[J]. Biomaterials,2014,35(10):3427~3434.
[19]Esther W,Merkle H P,Lorenz M. Silk fibroin as a vehicle for drug delivery applications.[J]. Journal of Controlled Release,2010,150(2):128~41.
[20]Wu S L,Dou J,Zhang J and Zhang S F. A simple and economical one- pot method to synthesize high- quality water soluble CdTe QDs[J]. Journal of Materials Chemistry,2012,22(29):14573~14578.
[21]Cho H J and Um I C. The effect of dissolution condition on the yield,molecular weight,and wet- and electro-spinnability of regenerated silk fibroins prepared by LiBr aqueous solution[J]. International Journal of Industrial Entomology,2010,20(2):99~105.
Effect of Ca2+on Recombination of CdTe QDs and Silk Fibroin Gel
SONG Guo-long,ZHAO Xue-qin,KONG Xiang-dong
(College of Life Sciences,Zhejiang Sci-Tech University,Hangzhou 310018,China)
Abstract:In this research,silk fibroin(SF)gel is prepared by silk fibroin dissolved in LiBr solution. We take advantage of quantum dots(QDs)itself inherent outstanding optical properties to determine the fluorescence intensity change of the recombination process of CdTe(Cadmium Telluride)QDs and SF gel by fluorescence spectrophotometer,without Ca2+and with different concentration Ca2+solution,respectively. This research proved that the recombination of CdTe QDs and SF gel is mediated by Ca2+,and showed a positive correlation with the addition of Ca2+in a certain range.
Key words:CdTe quantum dots;silk fibroin gel;calcium ion;fluorescence complex
中图分类号:S886
文献标识码:A
文章编号:0258-4069[2016]01-016-04
基金项目:国家自然科学基金(51272236);浙江理工大学521人才培养计划(1610032521302)
作者简介:宋国龙(1989-),男,硕士,主要从事生物材料与药物载体方面的研究。E-mail:sgl19890325@163.com
通信作者:孔祥东,男,博士,教授。E-mail:kongxiangdong@gmail.com

