不同品种牛乳脂质的共聚焦拉曼光谱指纹图谱
罗 洁,王紫薇,宋君红,庞瑞鹏,任发政*
1. 中国农业大学教育部功能乳品重点实验室,北京 100083 2. 畜产品北京高等学校工程研究中心,北京 100083 3. 食品质量与安全北京实验室,北京 100083 4. 秦皇岛出入境检验检疫局,河北 秦皇岛 066000
不同品种牛乳脂质的共聚焦拉曼光谱指纹图谱
罗 洁1,王紫薇2,宋君红3,庞瑞鹏4,任发政1*
1. 中国农业大学教育部功能乳品重点实验室,北京 100083 2. 畜产品北京高等学校工程研究中心,北京 100083 3. 食品质量与安全北京实验室,北京 100083 4. 秦皇岛出入境检验检疫局,河北 秦皇岛 066000
不同品种的乳脂肪球的组成成分不同,从而导致脂肪在乳中的存在形式和最终的乳品品质存在差异。利用拉曼光谱测定黑白花牛乳、水牛乳及牦牛乳中脂质球的脂质和脂肪酸成分,比较不同品种牛乳的脂质组成差异。结果显示,牦牛乳的2 885/2 850 cm-1比值较高,表明牦牛乳脂质球趋于形成结晶态脂肪球膜包裹流动态内核的结构。与黑白花牛乳相比,牦牛和水牛乳的1 655/1 443 cm-1比值较高,表明黑白花牛乳的脂肪酸不饱和程度低于其他两种牛乳;水牛乳小脂肪球的脂肪酸不饱和度高于牦牛乳,大脂肪球的则低于牦牛乳。综上可知,用牦牛乳分离而得的稀奶油较其他牛乳难熔化,搅拌耗时更长,但形成的黄油更柔软;而水牛乳由于脂肪球较大,适用于奶油的加工和脂肪球膜的分离。
乳脂肪;品种;共聚焦拉曼光谱;脂质成分
引 言
乳脂肪是构成牛奶营养、质构和风味特性的重要物质基础,对乳品品质有着至关重要的影响。乳中约含有3%~5%的脂肪,以粒径为0.2~15 μm不等的液滴状或球状形式分布于乳中[1]。乳脂肪中含有70%为饱和脂肪酸,25%单不饱和脂肪酸以及5%多不饱和脂肪酸[2]。不同脂肪酸的种类和比例影响乳的理化性质及加工特性,进而影响乳制品的品质。在干酪制作中,乳脂肪酸的组成影响牛乳的凝固特性[3]。此外,在酸乳等乳制品中,游离脂肪酸是乳风味物质如甲基酮、醇类、内酯等的前体物质,因此是产品风味的重要贡献者[4]。
乳脂肪酸的组成及其含量受多种因素影响,其中奶牛品种的影响尤为显著[5]。研究表明,不同品种牛乳脂肪酸含量差异显著,单(多)不饱和脂肪酸的种类和比例也存在明显差异,其中短链脂肪酸含量差异不大,中长链脂肪酸含量变化差异显著,而长链脂肪酸含量差异极为显著[6]。黑白花牛乳的总产量位居世界第一,是消费量最大的牛乳。我国的水牛头数占世界第二位,同时南方的湿热气候也适于水牛业生产,因此对水牛乳的加工利用具有广阔的开发前景;而在高寒缺氧地区,人类的饮奶、肉、运输又大部分依赖于牦牛。因此,近年来,水牛乳和牦牛乳的成分组成成为研究热点。有研究表明,牦牛乳中饱和脂肪酸/不饱和脂肪酸比值较低,且共轭亚油酸等功能性脂肪酸含量尤其丰富,因此牦牛乳的营养价值相对其他牛乳更高。水牛乳的乳脂含量高、脂肪球粒径大,因此特别适合用于制作黄油、奶油和优质干酪的生产,具有特殊的加工价值[6]。然而,针对牦牛乳和水牛乳脂质组成的系统研究尚未阐明。
目前用于测定乳脂质组成的方法有很多[7],包括色谱技术,如气相色谱和液相色谱[8]。这些方法包含提取和分离步骤,非常的耗时耗材,不适合大量样品的同步实时观测。近年来,拉曼光谱被应用至食品分析中,并已成功应用于测定无水乳脂肪的固体脂肪含量和牛乳脂肪的共轭亚油酸测定中[9]。拉曼光谱的优越性在于不需要任何化学标记手段就可以实现对静态样品的快速检测。单个脂肪球分子能在天然状态下被固定,保持其天然构型,同时获得单个分子的拉曼光谱信号。然而,现有应用拉曼光谱分析不同品种牛乳脂肪球成分差异的研究较为缺乏。
利用共聚焦拉曼光谱对黑白花牛乳、水牛乳和牦牛乳中天然脂肪球的脂质化学成分进行测定。通过了解不同品种奶牛的牛乳脂肪球的物化特性,能在制作对产品品质及加工性能有特殊需求的乳制品时,为原料乳的选择提供理论依据。
1 实验部分
1.1 样品制备
新鲜牛乳取自北京三元食品股份有限公司专用原料乳(春山农场),水牛乳取自云南大理州云南皇氏来思尔乳业有限公司;牦牛乳取自甘南藏族自治州合作市卡加道乡牧场。所有牛乳取后存于4 ℃备用。
1.2 动态光散射测定
贝克曼Coulter LS230激光衍射粒度分析仪(贝克曼库尔特,美国)配有4 mW氦/氖激光器在波长633 nm输出,应用动态光散射的原理测定牛奶样品中脂肪球的平均粒径。通过实验可得到散射光强(I)的自相关函数g2(τ,q)
从表2中可以看出,每组数据中所包含的粗差数量并不多,对平均值的影响比较微弱,各组数据的数量不同是因为实际观测时间长短不同,同一距离处的一组数据可以看作重复性观测。
g2(τ,q)≡〈I(τ,q)I(0,q)〉/〈I(0,q)〉

式中Γ为反映散射光频移程度的线宽,由线宽可得到平移扩散系数D
D=Γ/q2
依据Stokes-Einstein公式,即可得到溶液中高分子的流体力学半径Rh
Rh=kBT/(6πη0D)
式中,kB为波尔兹曼常数,T为绝对温度,η0为溶剂粘度,D为平移扩散系数。在25 ℃时,水的折射率为1.333,粘度为1.002 MPa·s。样品在含100 mL水的测定装置中稀释,当浓度达到8%时开始测定。在粒度分布中平均容量直径
其中ni为脂肪球在一个直径数量级di的个数。多分散指数
1.3 共聚焦拉曼光谱
不同品种的天然脂肪球的脂质成分根据Gallier等的方法进行改进后用共聚焦拉曼光谱测定[10]。
原料乳在3 000 g下离心5 min,收集顶层脂肪层在模拟乳超滤液中分散使其含20%的脂肪含量,再稀释十倍。在共聚焦拉曼光谱的测定和光谱信号的收集中,样品必须保持静止状态。稀释的脂肪样品(25 μL)置于凹形载玻片中,加入50 μL的低熔点琼脂糖(0.5%,w/v)以固定样品,后迅速轻缓地盖上一片盖玻片。
JY-T64000拉曼散射仪(JY公司, 法国)用来收集拉曼光谱信号。二极管激光器的激发波长为532 nm,物镜处功率5 mW,每毫米1 200槽光栅。测定时采用较低的激光功率以避免样品过热从而改变液态/结晶态脂肪的比例。光谱区域记录为500~3 500 cm-1,各频谱每10 s曝光一次,室温下测定。各峰的强度测定信号均为相同大小的3个脂肪球的平均强度。
1.4 数据分析
所有分析测量均重复两次。单因素方差分析采用Duncan新复极差法(p<0.05),用SPSS软件(版本16.0,SPSS公司)分析。
2 结果与讨论
2.1 不同品种牛乳天然乳脂肪球的粒径分布
不同品种的牛乳脂肪球粒径分布图如图1所示。在黑白花牛乳和牦牛乳中,10 μm以下的脂肪球占脂肪总体积的绝大部分,且牦牛乳脂肪球粒径分布较为集中(3.5~4.6 μm),而水牛乳的脂肪球直径则较为分散,从1~18 μm不等,这个结果也可以从表1中多分散指数中看出。

Fig.1 Size distribution of native milk fat globules of varions breeds
Table 1 Volume mean diameter (d43), polydispersity indices (PDI) and specific surface area (S) of bovine, buffalo and yak native milk fat globule

d43/μmPDIS/(m2·g-1)黑白花牛乳3.87±0.07a1.124±0.15b1.818±0.017a水牛乳4.89±0.12b1.423±0.26c1.600±0.021b牦牛乳4.39±0.05c0.865±0.08a1.670±0.012c
注:采用Duncan分析法,同行数据标注有不同上标字母者表示有显著差异(p<0.05)
如表1所示,水牛乳的粒径大于牦牛乳也大于黑白花牛乳,脂肪球的比表面积则成相反趋势。因为较小的比表面积有利于脂肪的消化[11]。由此可以推断,黑白花牛乳的脂肪球最易于消化。
2.2 不同品种的天然脂肪球化学指纹图谱比较
主要的拉曼峰和信息根据Gallier等的研究结果识别[10]。为保证所观测不同品种牛乳的脂肪球粒径保持一致,研究分别选取4和9 μm的脂肪球进行观测比较。如图2和图3所示,不同品种乳脂肪球之间脂质含量的差异显著。

Fig.2 Raman spectra of bovine, buffalo and yak native milk fat globules with a diameter of 4M(a.u., arbitrary unit)


Fig.3 Raman spectra of bovine, buffalo and yak native milk fat globules with a diameter of 9 μm(a.u., arbitrary unit)
乳脂肪在40 ℃以上是液体状态,而在-40 ℃下处于绝对的固体状态[14]。因此,在实验温度(20 ℃)下,乳脂肪是一种液态和晶态共同存在的混合状态。1 064和1 081 cm-1的信号条带(图3)和在2 850和2 885 cm-1的信号条带(图2和图3)分别代表了C—C和C—H基团的移动性[15]。拉伸区域的非对称性伸展振动与结晶相对应,而对称拉伸振动控制其液晶相[16]。2 885/2 850 cm-1的比例越高,表明脂肪球膜更多的处于结晶态并紧密排布,而脂内核更多的处于液态[17]。不同品种脂肪球在2 885/2 850 cm-1条带的信号比值如图4所示,显现出该比值随黑白花牛乳、水牛乳、牦牛乳依次增大的趋势。因此可以推断,牦牛乳的脂肪球膜流动性比水牛乳和黑白花牛乳低,而甘油三酯内核的流动性则高于后两者,即牦牛乳的脂肪球趋于形成结晶态脂肪球膜包裹流动态甘油三酯内核的结构,而黑白花牛乳更易于形成一个流动态脂肪球膜包裹着结晶态甘油三酯内核的结构,水牛乳的结构变化趋势介于两者之间。根据这一特性可知,用牦牛乳分离而得的稀奶油在熔化时较其他牛乳脂肪球难熔化,搅拌耗时更多,但形成的黄油更加柔软。

Fig.4 Quantitative evaluation of the fluid state of native milk fat globules of various breeds and sizes
注:采用Duncan分析法,在同一系列数据中,a—c,a′—c′相同则表示差异不显著,不同则表示差异显著(p<0.05)


Fig.5 Quantitative evaluation of the unsaturation level of native milk fat globules of various breeds and sizes
注:采用Duncan分析法,在同一系列数据中,a—c,a′—c′相同则表示差异不显著,不同则表示差异显著(p<0.05)
此外,乳脂肪球中的脂肪酸链长可以用I1 440/I1 746或I1 460/I1 746来判断,这两个比值和链中CH2的数量成正比[18]。I1 440∶I1 746定量分析结果如图6所示。可以看出,4 μm粒径的黑白花牛乳的该比值大于牦牛乳,水牛乳的链长最小;而在9 μm的大脂肪球中,水牛乳的脂肪酸链长则大于其他两种牛乳,黑白花牛乳仍高于牦牛乳。该比值还会随脂肪球大小的变化而不同。三种牛乳的1 440和1 746 cm-1信号峰比值都随着脂肪球粒径的增加而增加,这表明长链脂肪酸在较大脂肪球中所占比例更高。这一结果也和此前学者用气相色谱法得到的结果相同,即与大脂肪球相比,小脂肪球脂质内核中的月桂酸等中链脂肪酸更多,而硬脂酸等长链脂肪酸则明显较少[19-20]。总之,黑白花牛乳中的长链脂肪酸比例高于牦牛乳,而水牛乳的脂肪酸链长受粒径影响较大。
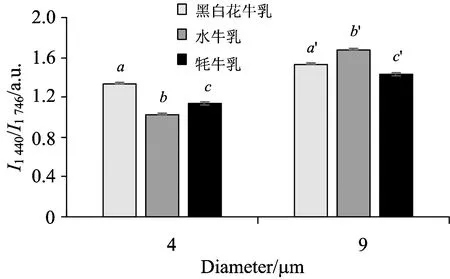
Fig.6 Quantitative evaluation of the chain length of native milk fat globules of various breeds and sizes
注:采用Duncan分析法,在同一系列数据中,a—c,a′—c′相同则表示差异不显著,不同则表示差异显著(p<0.05)
3 结 论
尽管乳脂肪球具有非常重要的意义,但关于其各组分的具体组成和功能特性仍知之甚少。乳品种不同影响着脂肪球的物理化学性质,进而对乳制品特性有着至关重要的作用,尤其是黄油、奶油和干酪等高脂乳制品。本研究发现,不同品种的天然脂肪球,其脂质组分存在差异。牦牛乳脂肪球趋于形成结晶态脂肪球膜包裹流动态甘油三酯内核的结构,饱和程度也比黑白花牛乳要低。而水牛乳由于高脂、脂肪球粒径大的特点,因此特别适用于奶油的加工。通过了解不同品种脂肪球的特性差异,能够在制作对产品品质及加工性能有特殊需求的乳制品时,为原料选择提供理论依据,同时有助于对工艺流程的控制。
[1] Heid H W, Keenan T W. European Journal of Cell Biology, 2005, 84(2-3): 245.
[2] Grummer R R. Journal of Dairy Science, 1991, 74(9): 3244.
[3] Auldist M J, Johnston K A, White N J, et al. Journal of Dairy Research, 2004, 71(1): 51.
[4] Tavaria F K, Dahl S, Carballo F J, et al. Journal of Dairy Science, 2002, 85(10): 2462.
[5] Auldist M J, Walsh B J, Thomson N A. Journal of Dairy Research, 1998, 65(3): 401.
[6] Maurice-Van Eijndhoven M H, Hiemstra S J, Calus M P. J Dairy Sci., 2011, 94(2): 1021.
[7] Badertscher R, Berger T, Kuhn R. International Dairy Journal, 2007, 17(1): 20.
[8] Evers J M, Crawford R A, Wightman L M, et al. International Dairy Journal, 1999, 9(10): 675.
[9] El-Abassy R M, Eravuchira P J, Donfack P, et al. Vibrational Spectroscopy, 2011, 56(1): 3.
[10] Gallier S, Gordon K C, Jiménez-Flores R, et al. International Dairy Journal, 2011, 21(6): 402.
[11] D’Urso S, Cutrignelli M I, Calabrò S, et al. Journal of Animal Physiology and Animal Nutrition, 2008, 92(3): 405.
[12] Ozaki Y, Cho R, Ikegaya K, et al. Applied Spectroscopy, 1992, 46(10): 1503.
[13] Larqué E, Zamora S, Gil A. Early Human Development, 2001, 65(Supplement 2): S31.
[14] Mulder H, Walstra P. The Milk Fat Globule. Emulsion Science as Applied to Milk Products and Comparable Foods: Wageningen, Netherlands, Centre for Agricultural Publishing and Documentation., 1974.
[15] Forrest G. Chemistry and Physics of Lipids, 1978, 21(3): 237.
[16] Faiman R, Larsson K, Long D A. Journal of Raman Spectroscopy, 1976, 5(1): 3.
[17] Larsson K. Raman Spectroscopy for Studies of Interface Structure in Aqueous Dispersions, 1976.
[18] Beattie J R, Bell S E, Moss B W. Lipids, 2004, 39(5): 407.
[19] Fauquant C, Briard V r, Leconte N, et al. European Journal of Lipid Science and Technology, 2005, 107(2): 80.
[20] Briard V, Leconte N, Michel F, et al. European Journal of Lipid Science and Technology, 2003, 105(11): 677.
*Corresponding author
Lipid Composition of Different Breeds of Milk Fat Globules by Confocal Raman Microscopy
LUO Jie1, WANG Zi-wei2, SONG Jun-hong3, PANG Rui-peng4,REN Fa-zheng1*
1. Key Laboratory of Functional Dairy, China Agricultural University, Beijing 100083, China
2. Beijing Higher Institution Engineering Research Center of Animal Product, Beijing 100083, China
3. Beijing Laboratory of Food Quality and Safety, Beijing 100083, China
4. Qinhuangdao Entry-Exit Inspection and Quarantine Bureau, Qinhuangdao 066000, China
Different breeds of cows affect the form of fat exist in dairy products and the final functionality, which depended mainly on the composition of the milk fat globules(MFG). However, the relationship between the composition and breeds has not been illuminated. In our study, differences in the lipid content and fatty acid composition of native bovine, buffalo and yak MFG were investigated by confocal Raman spectroscopy. The research offers the possibility of acquisition and analysis of the Raman signal without disruption of the structure of fat globule. The results showed that yak MFG had a higher ratio of band intensities at 2 885/2 850 cm-1, indicating yak MFG tend to have a triglyceride core in a fluid state with a milk fat globule membrane in a crystalline state. The buffalo and yak MFG had a higher level of unsaturation compared to bovine MFG, shown by a higher ratio of band intensities at 1 655/1 744 cm-1. The results indicate that small MFG of buffalo is more unsaturated than yak, while the large MFG of buffalo is less unsaturated than the yak. Thus, selective use of cream with yak MFG would allow a harder and more costly churning process but lead to a softer butter. Buffalo milk which contains larger MFG is more suitable for cream and MFG membrane separation.
Milk fat;Breed;Confocal Raman spectroscopy;Lipid composition
Sep. 1, 2014; accepted Jan. 20, 2015)
2014-09-01,
2015-01-20
中央高校基本科研业务费专项资金项目(2015SP001);国家“十二五”科技支撑计划项目(2012BAD12B08)资助
罗 洁,女,1987年生,中国农业大学教育部功能乳品重点实验室博士研究生 e-mail:lizzyj925@hotmail.com 通讯联系人 e-mail:renfazheng@263.net
O657.3
A
10.3964/j.issn.1000-0593(2016)01-0125-05
- 光谱学与光谱分析的其它文章
- Determination of Component Contents of Blend Oil Based on Characteristics Peak Value Integration
- Identification of Haploid Maize Kernel Using NIR Spectroscopy in Reflectance and Transmittance Modes: A Comparative Study
- 基于光谱吸收法和荧光法的甲烷和二氧化硫检测系统的研究
- 基于TDLAS-WMS的痕量甲烷气体检测仪
- 推扫误差对计算光谱成像数据重构的影响分析
- ICP-MS用于云南南部四种特色蜂蜜的植物源鉴别分析

