绿原酸协同抗氧化机理的电化学和光谱-色谱学研究
杨剀舟, 翟晓娜, 王佳良, 柴 智, 任发政, 冷小京,2*
1. 中国农业大学食品科学与营养工程学院, 食品质量与安全北京实验室, 北京 100083
2. 现代农业产业技术体系北京市奶牛创新团队, 北京 100083
3. 北京茱古拉咖啡有限公司, 北京 100085
绿原酸协同抗氧化机理的电化学和光谱-色谱学研究
杨剀舟1,3, 翟晓娜1, 王佳良1, 柴 智1, 任发政1, 冷小京1,2*
1. 中国农业大学食品科学与营养工程学院, 食品质量与安全北京实验室, 北京 100083
2. 现代农业产业技术体系北京市奶牛创新团队, 北京 100083
3. 北京茱古拉咖啡有限公司, 北京 100085
利用循环伏安法、 油水分配系数和红外光谱(FTIR)、 XRD射线粉末衍射以及圆二色谱(CD)对于绿原酸协同抗氧化的机理进行了研究, 并通过ABTS自由基清除能力对于绿原酸单体和复配混合物的抗氧化活性进行了测定。 结果表明, 复配绿原酸分子之间抗氧化活性差距越大, 抗氧化活性高的绿原酸含量越高, 协同效果越好; 协同过程中并未发现绿原酸复配混合物氧化电势的改变, 说明协同作用时分子间的氧化偶联作用并不存在; 转移电量与抗氧化指标之间具有很高的相关性(0.92), 协同作用发生时体系的实际转移电量高于理论转移电量, 证明了高抗氧化活性绿原酸分子即双咖啡酰奎宁酸的重生; 油水分配系数绝对值差为0.13时的绿原酸复配组合具有良好的界面效应和高的协同效果; 红外光谱、 XRD射线粉末衍射以及圆二色谱并未发现绿原酸复配混合物中反映绿原酸分子相互作用和规则性排列的信息。 因此绿原酸分子之间重生机制和体系的界面效应是绿原酸发生协同抗氧化现象的主要原因。
绿原酸; 协同抗氧化; 循环伏安法; FTIR; XRD; CD
引 言
绿原酸作为咖啡中最重要的一类多酚类化合物, 以其良好的抗氧化活性、 抗菌消炎、 调节机体糖脂代谢和保护心脑血管等功效越来越被人们所熟知[1-3]。 绿原酸是由一系列桂酸如咖啡酸、 阿魏酸及香豆酸等与奎宁酸酯化而形成的多酚类化合物, 其主要成分包括5-咖啡酰奎宁酸(5-CQA)、 4-咖啡酰奎宁酸(4-CQA)及3-咖啡酰奎宁酸(3-CQA)以及3,4-二咖啡酰奎尼酸(3,4-diCQA)、 3,5-二咖啡酰奎尼酸(3,5-diCQA)和4,5-二咖啡酰奎尼酸(4,5-diCQA)等(分子结构如图1所示)[4]。 大量的实验研究发现, 绿原酸尤其是3-CQA具有较广泛的体外协同抗氧能力, 如与α-生育酚、 没食子酸、 儿茶酸、 原儿茶酸、 表儿茶酸、 槲皮素和芦丁等抗氧化剂复配研究时, 可将体系对DPPH·(1,1’-二苯基-2-三硝基苯肼)和ABTS·(2,2’-连氮-二(3,-乙基苯并噻唑啉-6-磺酸)等自由基的清除能力提高3%~45%左右[5-8]。 对于协同抗氧化现象发生的机理, 有研究报道称可能是来自于抗氧化剂之间的重生[9-10]和氧化偶联机制[11], 体系的界面效应[12-13]和抗氧化剂分子间相互作用[14], 即抗氧化剂分子间通过传递e-和H+得到重生以及抗氧化剂复配混合物氧化电势的降低使得反应更易发生, 体系中抗氧化剂相分配系数的差异使得抗氧化剂在界面两侧自发排列分布, 抗氧化剂分子之间相互作用使得重生过程有序进行, 而目前对于上述协同机理的验证和解释还缺乏深入系统的研究。
抗氧化反应作为氧化还原反应的一种, 反应过程中涉及到e-和H+的传递, 而电化学尤其是循环伏安法可以对氧化反应过程中的氧化电势和转移电量进行系统完整的分析, 并且有研究发现与抗氧化指标之间具有很高的相关性[15], 因此可以对抗氧化剂的协同重生理论进行合理准确的解释。 XRD粉末衍射、 红外光谱和圆二色谱作为分析分子结构和分子间相互作用常用的光谱色谱手段, 可以对绿原酸分子之间在复配前后可能存在的一系列相互作用进行分析鉴定。 因此本实验采用ABTS自由基清除能力对六种同源绿原酸衍生物进行抗氧化实验和协同实验研究, 然后分别采用循环伏安法、 油水分配常数和红外光谱、 XRD射线粉末衍射以及圆二色谱对绿原酸协同抗氧化的机理进行验证和解释。

图1 咖啡中主要的绿原酸异构体分子结构式
1 实验部分
1.1 材料与试剂
六种绿原酸单体(3-咖啡酰奎宁酸(3-CQA), 4-咖啡酰奎宁酸(4-CQA), 5-咖啡酰奎宁酸(5-CQA), 3,4-二咖啡酰奎宁酸(3, 4-CQA), 3,5-二咖啡酰奎宁酸(3, 5-CQA), 4,5-二咖啡酰奎宁酸)(4,5-CQA), 购买于成都普瑞法科技开发有限公司, 纯度≥98%。 β-类胡萝卜素(≥97%)购买于合肥博美生物科技有限公司。 α-亚油酸(≥97%)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(≥98%)购买于美国sigma公司。 其他试剂为色谱纯或分析纯。
1.2 仪器与设备
紫外-可见分光光度计(Cary 50 spectrophotometer, 美国Varian 公司); 红外光谱仪(GX, 美国Perkin-Elmer公司); Advance X射线衍射仪(D8, 德国Bruke公司); 圆二色谱仪(Pistar n-180, 英国Applied Photophysics 公司); 电化学工作站(CHI 620C, 上海辰华仪器有限公司); 液相色谱(LC-20AT, 日本岛津); 冷冻干燥机(LGJ-10B, 北京四环科学仪器厂)。
1.3 方法
1.3.1 绿原酸溶液的配制
将上述六种绿原酸溶液溶解于0.2 mol·L-1的Britton-Robinson的缓冲液中, 其中缓冲液的pH 为7.4, 离子强度采用电导率仪固定到0.1。
1.3.1 ABTS自由基清除能力测定[16]
分别配置7 mmol·L-1ABTS溶液和 2.45 mmol·L-1的过硫酸钾溶液, 将两者混合后置于避光处16~24 h制备ABTS自由基溶液, 采用超纯水对ABTS自由基溶液稀释至在波长734 nm下的吸光度在0.70±0.20备用; 分别取10 μL的绿原酸缓冲液和990 μL的ABTS自由基溶液于避光离心管中反应4 min, 并于波长734 nm下测定吸光度, 超纯水作为空白对照。 ABTS自由基清除率(%)=(A0-A)/A0×100%, 其中A0是空白对照反应后的吸光度,A是绿原酸缓冲液反应后的吸光度。 实验结果取三次平行实验的平均值。
1.3.2 协同实验设计[17]
协同实验设计基于等辐射分析理论, 并作出一定的改进。 首先采用ABTS自由基清除能力和β-胡萝卜素漂白抑制能力对不同浓度绿原酸溶液的抗氧化活性测定并通过曲线拟合得到IC50, 然后对任意两种绿原酸溶液在9个比例(0.1~0.9)下进行两两复配并测定抗氧化活性, 通过对复配后绿原酸溶液的理论抗氧化值和实际抗氧化值进行比较得出协同程度, 具体计算公式如下。 协同度=AB/(A+B) , 其中AB是任意两种绿原酸的混合物。 如果协同度大于1则表明两种绿原酸之间发生了协同作用, 如果等于1则表明发生的加和作用, 如果小于1则表明发生了拮抗作用。
1.3.3 傅里叶变换红外光谱分析[18]
将绿原酸缓冲液通过冷冻干燥方法除去水分得到干燥的粉末放置于干燥器中待用, 取少量绿原酸干燥样品和光谱纯KBr研磨均匀后制成透明薄片测定。 红外光谱采用Spectromeer GX FTIR红外光谱仪测得, 扫描信号累加16次, 光谱分辨率4 cm-1, 测量范围4 000~400 cm-1。
1.3.4 X射线粉末衍射分析[19]
室温下采用Bruck D8 Advance型多晶X射线衍射仪对绿原酸粉末进行晶态分析, X射线源为陶瓷X光管Cu 靶, X射线波长为1.540 6 Å, 电压为40 kV, 电流为40 Ma, 扫描角度(2θ)为5~80°, 扫描速度0.1 s/步, 步长0.01°。 粉末衍射后的衍射数据与衍射数据国际中心(international centre for diffraction data, ICDD)中的衍射数据进行比对, 确定绿原酸粉末的晶体特征和结构信息。
1.3.5 圆二色谱分析
圆二色谱(CD)是测定有机化合物绝对构型的常用方法, 利用在特定波长范围上的Cotton效应的正、 负与旋光谱的左、 右旋一样, 对手性对映体的特征进行宏观标识。 绿原酸的最佳吸收波长为325 nm, 因此在CD光谱紫外区(200~400 nm)对绿原酸样品进行测试, 每点扫描时间为2.5 μs, 狭缝宽设置为1 nm, 重复描5次。
1.3.6 循环伏安法分析[15]
采用三相电极体系的电化学工作站对绿原酸的氧化还原行为进行分析, 其中玻碳电极作为工作电极, Ag/AgCl电极作为参比电极, 铂丝电极作为辅助电极。 玻碳电极每次使用前分别采用1, 0.3和0.05 μm的纳米氧化铝进行抛光打磨, 采用离子浓度为0.1, pH 7.4和浓度为0.2 mol·L-1的Britton-Robinson缓冲液作为电解液, 每次检测前的样品采用超声脱气30 s。 循环伏安法扫描参比Ag/AgCl电极以400 AgCl mV·s-1的扫描速率从-0.2 V开始到不同的反转电势进行扫描, 反转电势的范围为0.2~1.2 V, 其中氧化峰下的积分面积(Q)代表氧化过程中的电量转移量, 氧化电势(Epa)代表抗氧化剂的抗氧化能力。 每个样品重复扫描3次取平均值。
1.3.7 绿原酸油水分配系数测定[20]
为了使萃取前后的水相和油相的性质保持不变, 水相采用正辛醇进行饱和, 油相采用水饱和了的正辛醇。 将100 mL 超纯水和100 mL正辛醇在分液漏斗中充分混合后静置24 h, 然后分从上面吸取油相和从下面流出水相待用。 称取3 mg的绿原酸样品溶解于10 mL正辛醇饱和的水溶液中, 取其中4 mL进行液相色谱检测。 另取4 mL转移到试管中, 加入4 mL水饱和了的正辛醇, 在恒温摇床中振荡2 h, 然后静置30 min, 吸尽上层正辛醇, 离心取下层水溶液进行液相色谱检测。 液相色谱检测条件如下[21]: 流动相A为含有1%色谱纯甲酸的超纯水, 流动相B为色谱纯乙腈; 梯度洗脱参数为A/B=95∶5(0 min)到75∶25 (60 min); 流速为1.0 mL·min-1; 进样量为10 μL, 检测波长为325 nm。 绿原酸的油水分配系数计算公式如下: logP=log(A正辛醇/A水), 其中A正辛醇和A水分别为绿原酸在油相和水相中的含量, 采用液相色谱峰面积积分值表示。
2 结果与讨论
2.1 抗氧化实验
采用ABTS自由基清除能力对绿原酸的抗氧化活性进行评价, 并进行曲线拟合求出自由基清除效果达到50%的绿原酸浓度(IC50), 实验结果如表1所示。

表1 六种绿原酸异构体ABTS自由基清除能力
Regression equation:y=0.360 8x+2.223 3,R2=0.99 (3-CQA);y=0.347 5x+2.122 1,R2=0.99 (4-CQA);y=0.369 3x+2.203 1,R2=0.98 (5-CQA);y=0.787 8x-2.390 7,R2=0.99(3.4-DICQA);y=0.772 3x-2.725 7,R2=0.99 (3.5-DICQA);y=0.879x+1.668 2,R2=0.99 (4.5-DICQA)
从表1可以看出, 六种绿原酸对于ABTS自由基的清除能力随着浓度的增加逐渐增加, 单咖啡酸奎宁酸(3-CQA, 4-CQA, 5-CQA)的抗氧化活性显著低于双咖啡酰奎宁酸(3,4-DICQA, 3,5-DICQA, 4,5-DICQA), 这主要是由于双咖啡酰奎宁酸比单咖啡酰奎宁酸具有更多的酚羟基来清除自由基; 单咖啡酸奎宁酸IC50大约是双咖啡酰奎宁酸的一半, 这正好与两者的酚羟基个数比值相一致, 因此可推断绿原酸的抗氧化活性与绿原酸的酚羟基个数成正比, 这个结论与Xu等[22]的在甲醇作为溶剂体系下对两大类绿原酸的抗氧化活性研究结果相一致。
2.2 协同实验
采用ABTS自由基清除能力抗氧化实验中得到的六种绿原酸的IC50值进行复配协同实验研究, 实验结果如图2所示。 研究发现, 三种单咖啡酰奎宁酸之间两两复配在复配比例从0.1~0.9区间内都出现了弱的拮抗效应(0.93~0.99), 而与三种双咖啡酰奎宁酸复配时, 出现了从拮抗效应到加和效应再到协同效应的现象, 其中3-CQA对三种双咖啡酰奎宁酸在复配比例大于0.5时相比较于4-CQA和5-CQA具有更高的协同效应(1.15), 而5-CQA的协同效应最差(1.02); 三种双咖啡酰奎宁酸之间进行复配时, 只有3,4-DICQA+3,5-DICQA在复配比例大于0.3时出现了明显的协同效应, 而3,4-DICQA+4,5-DICQA和3,5-DICQA+4,5-DICQA在复配比例0.1~0.9范围内均出现加和效应。 Heo等[5]采用清除ABTS自由基能力对3-CQA和三种黄酮类化合物进行复配后抗氧化活性进行评价, 研究发现3-CQA在浓度为28.25×10-5mol·L-1时对三种黄酮具有很高的协同抗氧化活性(1.09~1.19), 而在本研究中出现最高协同度时的3-CQA 浓度为13.0×10-5mol·L-1, 可能是由于作者采用的甲醇溶剂体系与本研究中的水体系的差异所引起的。 贾贵东等[7]在采用清除DPPH自由基能力对3-CQA和芦丁的复配体系进行评价时, 也发现在3-CQA 处于低浓度时对于芦丁出现了良好的协同抗氧化活性。 由于上述双咖啡酰奎宁酸和黄酮类物质的抗氧化活性均高于3-CQA, 因此绿原酸发生协同作用时不仅与抗氧化剂之间的复配比例有关, 还与两种抗氧化剂的抗氧化活性差异度有关。 由于3-CQA+3,5-DICQA和5-CQA+3,5-DICQA是绿原酸协同抗氧化实验中整体协同度的两个极端, 因此选择这两组来进行下一步协同抗氧化机理的探讨。
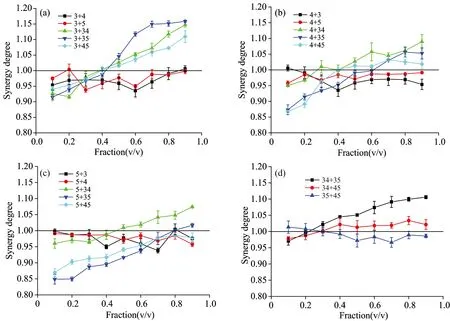
图2 六种绿原酸异构体二元复配体系ABTS自由基清除能力相互作用变化规律
Take 3-CQA for example, fraction 0.1 refers to the amount of 3-CQA (1/10) to another five CQAs isomers (9/10) in the binary compound combination. Data are expressed as the mean of 3 separate experiments ±SDs
2.3 协同实验电化学研究
采用循环伏安法对3-CQA+3,5-DICQA和5-CQA+3,5-DICQA两个绿原酸复配体系的电化学氧化特性进行研究, 通过氧化电势和转移电量对氧化偶联理论和重生理论进行研究。 氧化偶联理论是指两种抗氧化剂复配后降低了彼此的氧化电位, 从而使抗氧化剂能更好越过氧化反应能垒, 有利于反应的发生[11]。 3-CQA+3,5-DICQA和5-CQA+3,5-DICQA不同复配比例下的循环伏安图谱如图3所示。 从图3中可以看到, 不同复配比例下的绿原酸混合物均具有两个氧化峰, 不同的氧化峰代表着绿原酸分子上不同位置羟基的氧化, 其中第一个氧化峰来自于咖啡酸基团上的酚羟基的氧化, 第二个氧化峰则来自于奎宁酸糖环上羟基的氧化[15,23], 氧化电势分别为0.45和0.75 V, 不同复配比例下的绿原酸混合物的氧化电势并没有显著性差别, 因此可以推断出氧化偶联理论并不是解释绿原酸协同抗氧化产生的机理。

图3 最优和最差的ABTS自由基清除能力二元复配协同体系的循环伏安图,
不同复配比例下的传递电量和抗氧化活性以及协同抗氧化效果如图4所示。 从图4-A1可知, 随着3-CQA和5-CQA含量的增加, 绿原酸混合体系的抗氧化活性逐渐增加, 转移电量也逐渐增加, 两者具有较好的线性相关性, 相关性系数分别高达0.91(3-CQA+3,5-DICQA)和0.88(5-CQA+3,5-DICQA), 因此说明ABTS自由基清除能力抗氧化评价方法和转移电量具有高度的统一性, 抗氧化的过程就是电子传递猝灭自由基的过程。 Di等[15]在用循环伏安法对14种黄酮类物质的电化学行为和ABTS自由基清除能力抗氧化评价方法进行比对研究发现两者具有高度的相关性, 相关性系数高达0.85, 与本研究结论相一致, 因此可以采用转移电量的变化代替抗氧化活性来解释协同现象发生的机理。 从图4(A2)可知, 随着3-CQA和5-CQA含量的逐渐增加, 绿原酸相互作用从拮抗作用到加和作用中再到协同作用, 3-CQA对于3,5-DICQA的协同效果明显好于5-CQA, 此外转移电量的协同度和抗氧化活性的协同度变化也具有高度一致性(0.92, 0.92)。 按照理论计算, 在不同复配比例下的绿原酸的酚羟基摩尔总数是固定不变的, 因此转移电量和抗氧化活性也是固定的, 但是转移的电量和抗氧化活性却出现了一直增加的趋势, 这表明在此过程中出现了自由基诱导下的绿原酸相互之间作用, 发生了绿原酸分子之间的重生现象。 Zhu等[10]采用低密度脂蛋白抗氧化评价方法对绿茶儿茶酚和α-生育酚的协同抗氧化抗氧化活性研究时发现, 当体系中单独存在α-生育酚时, α-生育酚含量随着诱导时间的增加逐渐下降, 而随着绿茶儿茶酚在不同时间点的加入后, α-生育酚含量下降趋势减缓并接着出现缓慢增加的趋势, 这说明在抗氧化过程中出现了α-生育酚的重生。
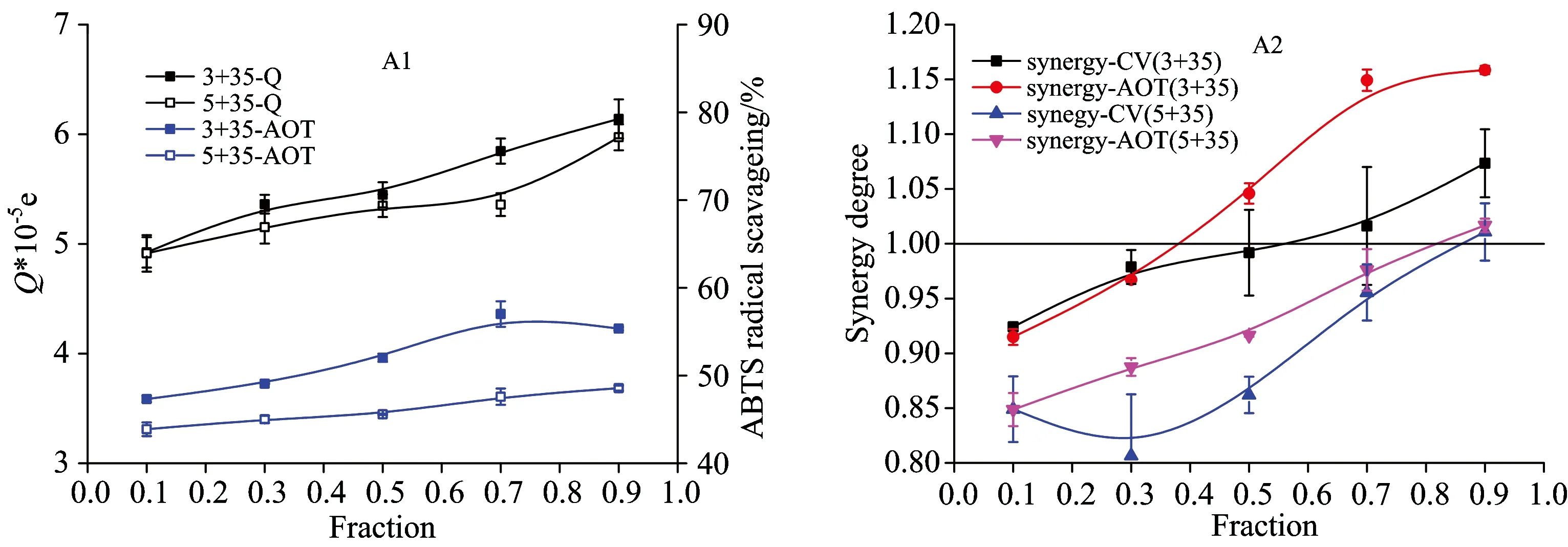
图4 绿原酸异构体二元复配体系Q值(转移电量)和抗氧化活性及其协同度在不同复配比例下的变化规律, Q值代表绿原酸异构体的抗氧化活性, 通过扣除样品相应电势下空白缓冲液的氧化峰面积积分来表示
Fig.4 The profiles of Q values and antioxidant activity (A1) and their synergistic effect (A2) of the binary compound combination of CQAs isomers under different proportion at the reverse potentials ranging from 0.2 to 1.2 V. The Q values that represented the antioxidant activity of CQAs through the integral area under anodic wave subtracting the blank buffer at corresponding potentials
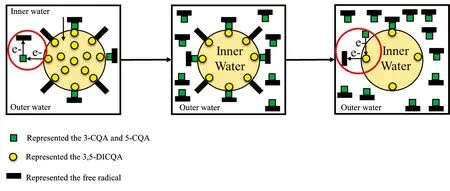
图5 3-CQA/5-CQA和3,5-DICQA不同比例下(低、 中、 高)二元复配体系猝灭自由基的示意图,
Fig.5 The schematic illustration of 3-CQA or 5-CQA+3,5-DICQA quenching the free radical under different proportion(low, middle and high from left to right). Inner water phase and outer water phase simulated the dispersions diversity of 3-CQA and 5-CQA with 3,5-DICQA in the water system
绿原酸在不同比例下的混合物猝灭自由基的过程如图5所示。 由图5可知, 当3-CQA(5-CQA)处于低浓度时, 由于3,5-DICQA在水中分散度相比较于前者较小, 因此3-CQA和自由基处于一相, 3,5-DICQA则聚集成为另一相, 此外体系中3,5-DICQA的含量相对较高, 存在一部分3,5-DICQA通过双水相界面去重生3-CQA, 出现高抗氧化活性的抗氧化剂去重生低抗氧化活性的抗氧化剂, 发生拮抗效应; 当3-CQA处于中浓度时, 抗氧化剂的含量与体系中的自由基数量达到饱和, 双水相界面效应不会影响自由基与3,5-DICQA的接触程度, 因此出现加和效应; 当3-CQA处于高浓度时, 存在一部分的3-CQA去重生3,5-DICQA, 出现低抗氧化活性的抗氧化剂去重生高抗氧化活性的抗氧化剂, 发生协同效应。 Nogala等[24]采用AAPH诱导的脂质过氧化对槲皮素、 芦丁和生育三烯酚之间的复配抗氧化活性进行研究时发现, 抗氧化剂的活性, 抗氧化剂的浓度, 体系中的分散度直接决定了复配抗氧化剂的协同抗氧化效果; 低浓度时低抗氧化活性的槲皮素和芦丁可以重生较高抗氧化活性的生育三烯酚发生协同效应; 高抗氧化活性的抗氧化剂越分散于自由基产生的一相, 低抗氧化活性的抗氧化剂越位于两相界面时, 协同效果越好。
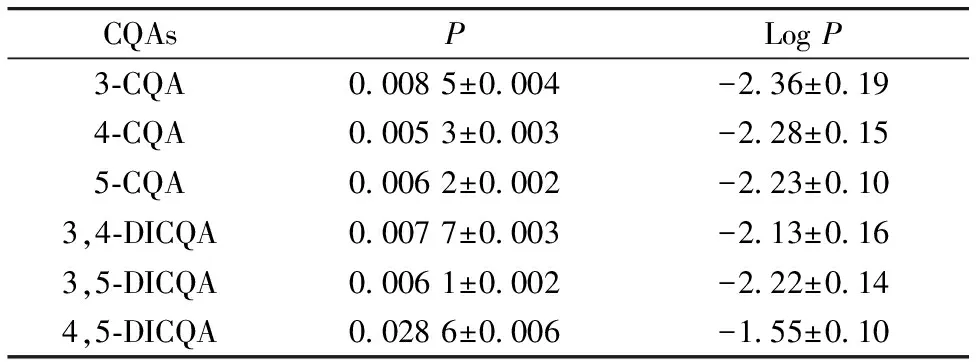
表2 六种绿原酸异构体的油水分配系数
3-CQA对于3,5-DICQA的协同抗氧化效果和协同度都明显优于5-CQA, 但是两者的抗氧化活性并不具有显著性差异, 这说明绿原酸分子之间分散度的差异是影响协同抗氧化活性的另外一个原因。 对于六种绿原酸的油水分配系数P进行了测定, 结果如表2所示。 从表2中可以看出, 六种绿原酸衍生物的分散度(水体系)大小顺序为3-CQA>4-CQA>5-CQA>3,5-DICQA>3,4-DICQA>4,5-DICQA, 3-CQA相比较与5-CQA, 与3,5-DICQA更容易形成双水相分散体系, 界面效应产生的自发性分配使得猝灭自由基的过程更具有秩序性, 减少反应发生的随机性因素, 使得具有更好的协同效应, 这从4-CQA和3,5-DICQA的协同作用也可以得到论证实。 此外, 绿原酸复配混合物之间的分散度差异并不是越大越好, 应该维持在一定的范围内。 六种绿原酸的油水分配系数绝对差值如表3所示, 结合图2分散度对于协同抗氧化活性的影响进行分析, 研究发现, 3-CQA, 4-CQA和5-CQA对于三种双咖啡酰奎宁酸协同度整体最好的分别是3,5-DICQA, 3,4-DICQA和3,4-DICQA, 而整体协同度最好的复配组合的油水分配系数的绝对差值平均值为0.13±0.01, 而低于或者高于这一绝对值范围的复配组合的整体协同度均较差, 可能具有这一分散度差值的绿原酸组合具有最合适的界面效应, 更有益于协同反应的发生。
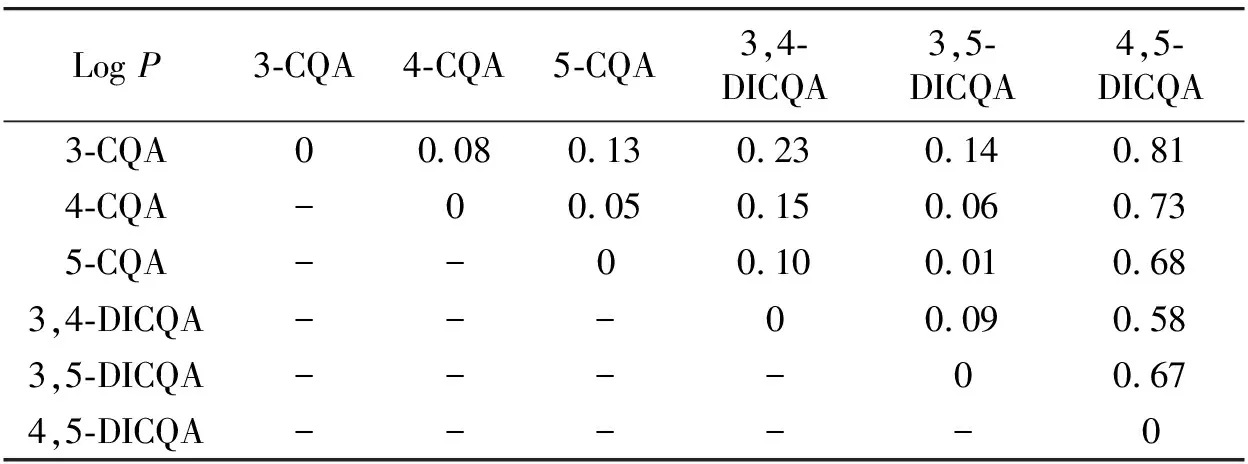
表3 六种绿原酸异构体的油水分配系数差值
2.3 协同实验光谱学分析
对于协同抗氧化机理的研究, 有报道称[14]除了氧化偶联理论, 重生理论和界面效应外, 黄酮多酚类物质分子之间也可能通过π—π堆积和氢键形成稳定的复合物, 从而使得抗氧化剂之间的重生更易发生, 因此通过色谱和光谱手段对影响协同抗氧化机理的分子间相互作用进行探讨。
2.3.1 红外光谱

2.3.2 X射线粉末衍射
通过X射线粉末衍射可以对绿原酸单体和复配后冻干样品的晶体情况进行表征, 进而确定绿原酸在复配前后分子之间排列是否具有规则性排列, 对分子排列学说进行验证。 由图7观察可知, 绿原酸的XRD谱图中除几个尖锐峰外整体体现为无定型形态, 利用MDI JAD软件对XRD谱图进行分析, 可得尖锐峰表征氯化钠分子的晶体, 而绿原酸分子在复配前后并未形成排列有序的晶体结构, 绿原酸分子均为杂乱无章的无定形态, 因此并不支持分子排列理论对于协同抗氧化机理的解释。 吴玲玲等[19]对绿原酸标样进行X射线粉末衍射发现在2θ为15°~30°范围内出现大量的尖锐峰, 通过计算比对分析得到绿原酸属于斜方晶系, 具有排列有序的晶体结构, 而本实验中的绿原酸样品为溶解于缓冲液后再进行冷冻干燥制得, 因此可能制备过程并不有利与晶体结构的生长, 因此并未出现文献报道的晶体结构。
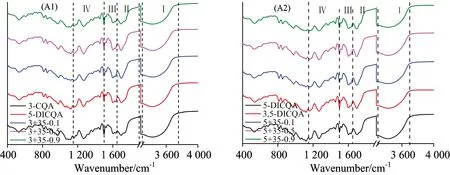
图6 绿原酸异构体及其二元复配体系的红外光谱谱图
图7 绿原酸异构体及其二元复配体系XRD谱图
2.3.4 圆二色谱
圆二色谱作为研究有机化合物构型和构象的常用方法, 主要是基于有机化合物在平面偏振光下特有的旋光特性即圆二色性, 分子之间如果发生相互作用必然会引起圆二色性的改变, 因此圆二色谱也可以作为分子之间相互作用研究的检测方法。 绿原酸单体和复配混合物的圆二色谱如图8所示。
从图8-A1和8-A2可以看出, 3-CQA和5-CQA与3,5-DICQA并不具有类似的圆二色性, 3,5-DICQA在363 nm处出现负的科顿效应, 在295和325 nm处出现正的科顿效应, 而3-CQA和5-CQA在最大吸收波长325 nm附近并没有明显的科顿效应, 仅在220 nm处存在较弱的正的圆二色性。 对比复配后的绿原酸混合物的圆二色谱发现原有的旋光特性未发生改变, 圆二色性信号的强弱与浓度呈现一定相关性, 因此在复配前后绿原酸分子间并未出现比如氢键等非共价键相互作用, 协同抗氧化的机理主要来自于绿原酸分子间的重生机制和体系的界面效应。

图8 绿原酸异构体及其二元复配体系CD谱图
A1: CD spectra of 3-CQA, 3,5-DICQA and their binary compound combination; A2: CD spectra of 5-CQA, 3,5-DICQA and their binary compound combination
3 结 论
采用循环伏安法、 油水平衡常数和FTIR, XRD粉末衍射以及圆二色谱对绿原酸二元复配体系的协同抗氧化机理进行了研究, 绿原酸之间抗氧化活性差距越大, 高抗氧化活性的绿原酸含量越高, 两者之间的油水平衡常数维持在0.13左右时的二元复配组合具有更高的协同抗氧化效果。 重生理论和抗氧化剂之间的界面效应是发生协同抗氧化作用的主要机理, 低抗氧化活性的绿原酸通过电子传递重生抗氧化活性高的绿原酸, 不同分散度的绿原酸在体系有序自动分布使得协同反应更有利进行, 此外并未在协同作用中发现绿原酸之间的氧化偶联作用和分子之间的非共价键相互作用。
[1] Clifford M N. Journal of the Science of Food and Agriculture, 1999, 79: 362.
[2] Sroka Z, Cisowski W. Food and Chemical Toxicology, 2003, 41(6): 753.
[3] Ong K W, Hsu A,Tan B K H. Biochemical Pharmacology, 2013, 85(9): 1341.
[4] Mullen W, Nemzer B, Ou B, et al. Journal of Agricultural and Food Chemistry, 2011, 59(8): 3754.
[5] Heo H J, Kim Y J, Chung D, et al. Food Chemistry, 2007, 104(1): 87.
[6] Palafox-Carlos H, Gil-Chávez J, Sotelo-Mundo R R, et al. Molecules, 2012, 17(11): 12657.
[7] JIA Gui-dong, YANG Jian-xiong, WANG Li, et al(贾贵东, 杨建雄, 王 莉, 等). Journal of Shaanxi Normal University·Natural Science Edition(陕西师范大学学报·自然科学版), 2010, (5): 61.
[8] Sim W L S, Han M Y,Huang D. Journal of Agricultural and Food Chemistry, 2009, 57(9): 3409.
[9] Graversen H B, Becker E M, Skibsted L H, et al. European Food Research and Technology, 2008, 226(4): 737.
[10] Zhu Q Y, Huang Y, Tsang D, et al. Journal of Agricultural and Food Chemistry, 1999, 47(5): 2020.
[11] HU Xiu-fang, MAO Jian-mei(胡秀芳, 毛建妹). Journal of Tea(茶叶), 2000, 26(2): 66.
[12] Panya A, Kittipongpittaya K, Laguerre M L, et al. Journal of Agricultural and Food Chemistry, 2012, 60(41): 10320.
[13] Yin J, Becker E M, Andersen M L, et al. Food Chemistry, 2012, 135(4): 2195.
[14] Peyrat-Maillard M, Cuvelier M,Berset C. Journal of the American Oil Chemists' Society, 2003, 80(10): 1007.
[15] Zhang D, Chu L, Liu Y, et al. Journal of Agricultural and Food Chemistry, 2011, 59(18): 10277.
[16] Re R, Pellegrini N, Proteggente A, et al. Free Radical Biology and Medicine, 1999, 26(9): 1231.
[17] Thoo Y Y, Abas F, Lai O-M, et al. Food Chemistry, 2013, 138(2): 1215.
[18] Fang R, Jing H, Chai Z, et al. European Food Research and Technology, 2011, 233(2): 275.
[19] WU Ling-ling, HAN Muo, GE Er-ning, et al(吴玲玲, 韩 墨, 葛尔宁, 等). Chinese Journal of Experimental Traditional Medical Formulae(中国实验方剂学杂志), 2010, 17: 96.
[20] Han R M, Tian Y X, Becker E M, et al. Journal of Agricultural and Food Chemistry, 2007, 55: 2384.
[21] Stalmach A, Mullem W, Nagai C, et al. Brazilian Journal of Plant Physiology, 2006, 18(1): 253.
[22] Xu J G, Hu Q P, Liu Y. Journal of Agricultural and Food Chemistry, 2012, 60(40): 11625.
[23] HE Jian-bo, DU Jia-qi, YUAN Sheng-jie(何建波, 独家启, 袁圣杰, 等). Food Science(食品科学), 2009, (9): 37
[24] Nogala-Kalucka M, Dwiecki K, Siger A, et al. Acta Alimentaria, 2013, 42(3): 360.
*Corresponding author
Study on the Synergistic Antioxidant Mechanism of Chlorogenic Acids (CQAs) with Electrochemical and Spectroscopy Property
YANG Kai-zhou1,3, ZHAI Xiao-na1, WANG Jia-liang1, CHAI Zhi1, REN Fa-zheng1, LENG Xiao-jing1,2*
1. Beijing Laboratory for Food Quality and Safety, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China
2. Beijing Innovation Team of Modern Agricultural Industry Technology System, Beijing 100083, China
3. Beijing Zhugula Coffee Co., Ltd., Beijing 100085, China
The synergistic antioxidant mechanism of chlorogenic acids (CQAs) was studied in this paper through cyclic voltammograms (CV), oil-water partition coefficient (P), FT-IR, XRD and circular dichroism (CD). The antioxidant capability of CQAs isomers and their mixture was determined by using ABTS free radical quenching ability assay. The results showed that the bigger the antioxidant activity disparity between the CQAs molecules was, the higher the content of high antioxidant activity CQAs was, the better the synergistic effect of the CQAs combination mixture became; The oxidation potential (Epa) of CQAs combination mixture kept constant in the synergistic experiments, which indicted the oxidative coupling interaction don't exist between the CQAs; The charge transferred (Q) and antioxidant activity exhibited high correlation (0.92); the practicalQwas higher than the theoreticalQin the synergistic process and this confirmed that the CQAs (dicaffeoylquinic acids) regeneration of high antioxidant activity happened; the CQAs mixture with the absolute difference value of oil-water partition coefficient of 0.13 gave the good interface effect and high synergistic degree; the interaction and the regular arrangement between the CQAs combination were not discovered through FT-IR, XRD and CD. Therefore, the regeneration mechanism of CQAs molecules and the interface effect of reaction system were the main cause of the phenomenon of the synergistic antioxidant of CQAs.
Chlorogenic acids; Synergistic Antioxidant; Cyclic Voltammetry; FTIR; XRD; CD
Apr. 3, 2015; accepted Aug. 11, 2015)
2015-04-03,
2015-08-11
国家科技支撑计划项目(2011BAD23B04); 国家自然科学基金项目(31171771)资助
杨剀舟, 1986年生, 中国农业大学食品科学与营养工程学院博士研究生 e-mail: beyondykz1986@163.com *通讯联系人 e-mail: lengxiaojingcau@163.com
O657.3
A
10.3964/j.issn.1000-0593(2016)08-2405-09

