慢性阻塞性肺疾病患者支气管肺泡灌洗液中HMGB1的表达及意义*
章俊强,梅晓冬
(安徽医科大学附属安徽省立医院呼吸科,合肥 230001)
慢性阻塞性肺疾病患者支气管肺泡灌洗液中HMGB1的表达及意义*
章俊强,梅晓冬
(安徽医科大学附属安徽省立医院呼吸科,合肥 230001)
[摘要]目的通过测定慢性阻塞性肺疾病(COPD)患者的支气管肺泡灌洗液(BALF)中高迁移率族蛋白B1(HMGB1)的含量并分析HMGB1和气流受限的关系,初步探讨HMGB1在COPD发病机制中的作用。方法将研究对象分为COPD组(COPD稳定期20例)和对照组(上气道咳嗽综合征20例),均行支气管镜检查并行支气管肺泡灌洗术,检测并比较两组BALF中的细胞总数、中性粒细胞百分比;用ELISA法测定并比较两组HMGB1、白细胞介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α)的含量,分析COPD组HMGB1和IL-1β、TNF-α间的关系及HMGB1和肺功能(FEV1%预计值)的关系。结果在BALF中,COPD组细胞总数、中性粒细胞百分比高于对照组(P<0.01);COPD组HMGB1、IL-1β、TNF-α的含量高于对照组(P<0.01、P<0.05、P<0.01),COPD组HMGB1的含量和IL-1β、TNF-α呈正相关(r=0.79,P<0.01及r=0.48,P<0.05);COPD组HMGB1和肺功能值(吸入支气管舒张剂后FEV1%预计值)呈负相关(r=-0.70,P<0.01)。结论HMGB1参与和促进COPD气道炎症的发生、发展,BALF中HMGB1水平和COPD严重程度相关。
[关键词]慢性阻塞性肺疾病;高迁移率族蛋白B1;气道炎症
慢性阻塞性肺疾病(COPD)的特征性病理表现为气道慢性炎症,其气道内能检测到大量炎症细胞和炎症因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1α、IL-1β、IL-6、IL-8等,这些早期炎症介质对于气道炎症的形成和维持具有重要作用。高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种重要的晚期炎症因子,在炎性反应中分泌时间较晚,维持时间较长。主动分泌和被动释放的HMGB1在复杂的炎症网络中扮演重要角色,在脓毒血症、急性肺损伤、休克及自身免疫性疾病等多种疾病的发病过程中多有涉及。HMGB1在COPD 的发病机制中发挥什么作用,如何参与其中目前尚不明确,相关研究也比较少。2009年,Nassima等[1]在COPD患者外周气道上皮组织中检测到高表达的HMGB1,并阐述了HMGB1在COPD患者气道炎症形成及气道重塑中发挥着重要作用。代灵灵等[2]在COPD患者诱导痰中的检测到高表达的HMGB1,进一步验证了HMGB1在COPD气道炎症中的作用。相比于血液和痰液等标本,支气管肺泡灌洗液(BALF)更接近肺泡衬液,其检测更能体现COPD气道及肺泡本身炎症的特征。本研究通过检测COPD患者支气管肺泡灌洗液中HMGB1的水平,并分析其与典型早期炎症因子IL-1β、TNF-α的关系,初步探讨HMGB1在COPD特征性炎症中的作用,并分析HMGB1的表达和气流受限程度的关系,进一步探索HMGB1的水平和疾病严重程度的关系。
1资料与方法
1.1一般资料
1.1.1入选标准(1)COPD组:安徽省立医院呼吸内科2010年9月至2012年12月因COPD就诊的COPD稳定期病例20例。COPD稳定期指COPD患者咳嗽、咳痰、气短等症状稳定或症状较轻,其诊断标准见中国《慢性阻塞性肺疾病诊治指南》(2007年修订版)[3]。(2)对照组:因亚急性或慢性咳嗽症状至安徽省立医院呼吸内科门诊和住院部诊治的患者20例,经相应检查诊断为上气道咳嗽综合征。上气道咳嗽综合征的诊断标准符合中国《咳嗽诊治与治疗指南2009版》[4]。
1.1.2排除标准合并有社区获得性肺炎、院内获得性肺炎、间质性肺炎、恶性肿瘤、全身严重感染者如败血症、脓毒症、类风湿关节炎等可引起血清HMGB1升高的疾病;有纤维支气管镜检查禁忌证者如严重低氧血症、呼吸困难、恶性心律失常、凝血功能异常等。
1.2检测方法征得每个患者的同意,并签订知情同意书后给患者行电子支气管镜检查及支气管肺泡灌洗术,收集灌洗液。支气管肺泡灌洗术参照中华医学会呼吸病分会2002年制定的支气管肺泡灌洗液细胞学检测技术规范[5]。将灌洗液离心,留取上清液于血细胞计数板中测定白细胞总数,并离心沉淀,用沉渣细胞制备细胞涂片,瑞氏染色行中性粒细胞分类计数。用酶联免疫吸附法检测BALF上清液中HMGB1、IL-1β、TNF-α的含量(ELISA试剂盒均购自美国R&D公司),检测方法严格按试剂盒说明书操作。COPD患者肺功能检查前吸入沙丁胺醇气雾剂200 μg,15 min后用肺功能仪(德国圣迪斯)测定第1秒用力呼气容积(FEV1)及FEV1占预计值的百分比(FEV1%预计值)。
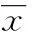
2结果
2.1人口学特征两组性别、年龄、吸烟状况无显著差异,见表1。
2.2BALF中白细胞计数、中性粒细胞比值及各细胞因子浓度COPD组BALF中白细胞计数及中性粒细胞比值分别为(6.09±4.56)×109/L和0.44±0.15,高于对照组(1.13±0.94)×109/L和0.08±0.05,差异有统计学意义(P<0.01);COPD组BALF中HMGB1的含量为(64.10±37.40)μg/L,显著高于对照组[(7.79±4.46)μg/L,t=6.69,P<0.01];COPD组BALF中IL-1β、TNF-α含量为(3.38±3.52)μg/L和(3.92±4.09)μg/L,高于对照组(1.44±1.83)μg/L和(1.18±1.53)μg/L,差异有统计学意义(P<0.05、P<0.01),见图1。
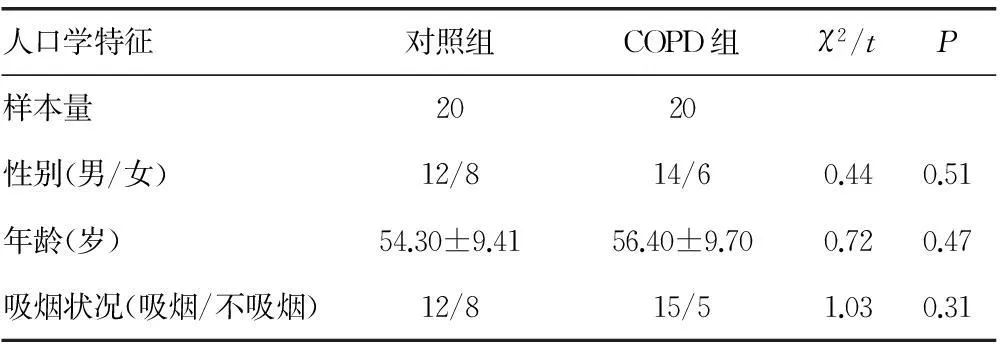
表1 COPD组及对照组人口学特征

图1 BALF中白细胞计数、中性粒细胞比值及各细胞因子浓度

图2 BALF中HMGB1含量和IL-1β、TNF-α及FEV1%预计值散点图
2.3BALF中HMGB1含量和IL-1β、TNF-α及FEV1%预计值COPD组BALF中HMGB1的含量和IL-1β含量呈正相关(r=0.79,P<0.01);和TNF-α呈正相关(r=0.48,P<0.05);20例COPD患者吸入支气管扩张剂后肺功能检查FEV1%预计值为0.56±0.01,与BALF中HMGB1的含量呈负相关(r=-0.70,P<0.01),见图2。
3讨论
COPD是呼吸系统疾病中重要疾病,其发病机制不甚清楚,目前认为COPD是一种以多种炎症细胞浸润、多种炎症介质共同参与的气道慢性炎症。以IL-1β、TNF-α等为代表性的早期炎症因子在COPD发病机制中的作用已被广泛研究和阐述,但对于晚期炎症因子的代表HMGB1在COPD炎症应答中究竟起何作用目前研究甚少。有研究发现COPD支气管肺组织中上皮细胞、炎症细胞及平滑肌细胞均高表达HMGB1,且HMGB1表达阳性细胞数目显著多于健康对照组[1,6-7]。HMGB1在启动和维持炎症瀑布式反应中具有核心作用,它可以诱导炎症细胞分泌IL-1β、TNF-α,同时在其他细胞因子的参与下,IL-1β、TNF-α也可以促进炎症细胞释放HMGB1,二者呈相互调节,相互促进,形成一个以HMGB1和IL-1β、TNF-α为核心的炎症激活正反馈环路,反复激活NF-κB途径,调节其他炎症因子和趋化因子的转录和表达,导致大量炎症因子在气道和肺泡及血管周围聚集,参与COPD气道特异性炎症的形成。Hou等[8]及代灵灵等[2]在COPD患者的诱导痰中检测到高表达的HMBG1,并发现HMGB1的表达量和病情严重程度密切相关,再次验证了气道内HMGB1表达与COPD气道炎症的内在联系。肺泡衬液为贴覆在细支气管和肺泡表面的一层液体,其内容物主要来源于支气管肺泡上皮细胞、支气管及肺泡巨噬细胞及中性粒细胞的主动分泌或被动释放,能够较真实和准确反映气道和肺泡的炎症状态。本研究将支气管肺泡灌洗液作为检测对象,相较于血液和痰液,关联性更好,但难点在于对照组的选择。常规将健康体检者作为对照组在本研究中难以实现,本研究将亚急性和慢性咳嗽(大于4周)的门诊患者纳入初筛组,经相关检查排除肺炎、肺结核、肿瘤等可引起血清或气道内HMGB1升高的疾病(设立严格排除条件),诊断考虑为上气道综合征的患者纳入对照组,行支气管镜检查。现有的资料尚未发现这种上气道疾病会导致血清或下气道局部HMGB1水平升高。同时不明原因的慢性咳嗽有行支气管镜检查的指征,不违背诊疗常规。
本研究结果显示COPD组气道内HMGB1和TNF-α、IL-1β的水平显著高于对照组,且HMGB1的水平和TNF-α、IL-1β水平正相关,这也验证了HMGB1和TNF-α、IL-1β在炎症网络中存在正反馈环路,其相互促进和激活的正向调节的关系,维持着气道和肺泡内大量炎症因子的聚集,放大炎症效应[1,7]。TNF-α和IL-1β是气道炎性反应中非常重要的早期炎症因子,既往的干预研究着重于TNF-α、IL-1β、IL-6、IL-8这些早期炎症因子的阻断,其抗炎效果短暂而有限。同时阻断晚期炎症介质HMGB1的炎症通路,可能比单纯阻断早期炎症因子更为有效和持久。这提示可以将HMGB1作为治疗COPD新的靶点,相关的动物实验也已开展[9]。
本研还发现,在COPD患者中,BALF中 HMGB1含量和肺功能FEV1%预计值呈负相关,提示气道内HMGB1的含量和气流受限的严重程度有一定的关系。这也符合既往的研究结果[10-11]。HMGB1在慢性气道炎症中的作用不仅在于启动炎性反应,放大炎症信号,还能促进小气道纤维化导致气道重塑,引起气流受限和肺气肿,机制目前尚不明确,可能在于:(1)HMGB1在组织修复中充当化学吸引剂的作用,吸引成纤维细胞、内皮细胞和平滑肌细胞。(2)通过转化成长因子β(TGF-β)介导小气道的纤维化和重塑。在COPD病理生理机制中,气道纤维化和重塑对于疾病的防治和预后非常重要,其涉及多种多种炎症细胞和结构细胞,分子机制复杂。HMGB1如何参与其中,发挥什么作用尚需进一步研究。
综上所述,HMGB1作为晚期炎症分子,广泛地参与COPD病理生理的多个方面,如气道炎症、肺实质破坏、气道纤维化及重塑等。其关键环节在于启动、放大并维持气道慢性炎症状态,而这个过程需要HMGB1和其他炎症因子相互协调、促进,共同形成复杂的炎症因子网络来实现。HMGB1在COPD炎症中的确切调控机制及以HMGB1为靶点的干预措施仍需进一步研究。
参考文献
[1]Nassima F,Severine L,Alexander K.Expression of high-mobility group Box 1 and of receptor for advanced glycation end products in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2010(181):917-927.
[2]代灵灵,程哲,康燕,等.慢性阻塞性肺疾病患者诱导痰中细胞因子HMGB1的变化及临床意义[J].中国老年学杂志,2012,3(5):896-898.
[3]中华医学会呼吸病分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华内科杂志,2007,30(3):254-261.
[4]中华医学会呼吸病学分会哮喘学组.咳嗽的诊断与治疗指南(2009年版)(二)[J].全科医学临床与教育,2009,32(6):573-575.
[5]中华医学会呼吸病分会.支气管肺泡灌洗液细胞学检测技术规范(草案)[J].现代实用医学,2003,25(4):256.
[6]Zhang YH,Li SJ,Wang GZ,et al.Changes of HMGB1 and sRAGE during the recovery of COPD exacerbation[J].J Thorac Dis,2014,6(6):734-741.
[7]Ko HK,Hsu WH,Hsieh CC,et al.High expression of high-mobility group box 1 in the blood and lungs is associated with the development of chronic obstructive pulmonary disease in smokers[J].Respirology,2014,19(2):253-261.
[8]Hou C,Zhao H,Liu L,et al.High mobility group protein B1 (HMGB1) in Asthma:comparison of patients with chronic obstructive pulmonary disease and healthy controls[J].Mol Med,2011,17(7/8):807-815.
[9]Wang CM.The role of high mobility group box1 in pulmonary brosis[J].Am J Respir Cell Mol Biol,2008,39(3):499-502.
[11]Bierhaus A,Humpert PM,Morcos M,et al.Understanding RAGE,the receptor for advanced glycation end products[J].J Mol Med,2005,83(5):876-886.
[10]Porto A,Palumbo R,Pieroni M,et al.Smooth muscle cells in human atherosclerotic plaques secrete and proliferate in response to high mobility group box 1 protein[J].FASEB J,2006,20(14):2565-2566.
[11]He Y,Zhou X,Zheng X,et al.Exogenous high-mobility group box 1 protein prevents postinfarction adverse myocardial remodeling through TGF-β/Smad signaling pathway[J].J Cell Biochem,2013,114(7):1634-1641.
Expression and significance of high mobility group box 1 protein in BALF of patient with COPD*
Zhang Junqiang,Mei Xiaodong
(Department of Respiration,Affiliated Anhui Provincial Hospital,Anhui Medical University,Hefei,Anhui 230000,China)
[Abstract]ObjectiveTo preliminarily investigate the effect of high mobility group box 1 (HMGB1) in the pathogenesis of chronic obstructive pulmonary disease (COPD) by detecting the HMGB1 level in bronchoalveolar lavage fluid(BALF) of the COPD patients and analyzing the relation between HMGB1 and airway limitation.MethodsThe research subjects were divided into the COPD group (stable COPD,20 cases) and control group[20 cases of upper airway cough syndrome(UACS)].All subjects were performed the bronchoscopic examination as well as bronchoalveolar lavage.The total cell counting and percentage of neutrophilic granulocytes in BLAF were detected and compared between the two groups.The HMGB1,IL-1β and TNF-α levels in BLAF were detected by using ELISA and compared between the two groups.The relation between HMGB1 with IL-1β and TNF-α and the relation between HMGB1 with pulmonary function(FEV1% predicted value) in the COPD group was analyzed.ResultsThe total cell counting and percentage of neutrophilic granulocytes of BLAF in the COPD group were higher than those in the control group (P<0.01).The levels of HMGB1,IL-1β,TNF-α of BALF in the COPD group were higher than those in the control group(P<0.01,P<0.05,P<0.01).In the COPD group,the HMGB1 level in BALF was positively correlated with the IL-1β and TNF-α levels(r=0.79,P<0.01;r=0.48,P<0.05),while negatively related with the pulmonary function value(FEV1% predicted value,r=-0.70,P<0.01).ConclusionHMGB1 participates in and promotes the occurrence and development of COPD airway inflammation and the HMGB1 level in BALF is correlated with the severity of COPD.
[Key words]chronic obstructive pulmonary disease;high mobility group box 1;airway inflammation
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.08.006
* 基金项目:2009年安徽省教育厅省级自然科学研究项目(KJ2009B025Z)。
作者简介:章俊强(1980-),博士在读,主治医师,主要从事气道炎症性疾病的研究。
[中图分类号]R563
[文献标识码]A
[文章编号]1671-8348(2016)08-1026-03
(收稿日期:2015-09-16修回日期:2015-11-26)

