麻黄碱对TNF-α诱导人支气管上皮细胞eotaxin表达的影响*
李中燕,邓 俊,熊 彬,熊 瑛,王宋平△
(1.四川省达州市中心医院呼吸内科 635000;2.泸州医学院附属医院呼吸内一科,四川泸州 646000)
麻黄碱对TNF-α诱导人支气管上皮细胞eotaxin表达的影响*
李中燕1,邓俊2,熊彬2,熊瑛2,王宋平2△
(1.四川省达州市中心医院呼吸内科635000;2.泸州医学院附属医院呼吸内一科,四川泸州 646000)
[摘要]目的观察麻黄碱对肿瘤坏死因子-α(TNF-α)诱导的人支气管上皮细胞(16HBE)中嗜酸性粒细胞趋化因子(eotaxin)表达的影响,探讨中药麻黄治疗哮喘的机制。方法将体外培养的16HBE细胞随机分为对照组、TNF-α刺激组(TNF-α 20 ng/mL)、TNF-α+麻黄碱组(TNF-α 20 ng/mL+麻黄碱300 μg/mL),每组细胞均设3个复孔培养18 h;荧光定量PCR检测各组细胞eotaxin mRNA的表达;免疫细胞化学染色法和Western blot检测各组细胞eotaxin蛋白的表达;双抗体夹心酶联免疫吸附法(ELISA)测定各组细胞培养上清液中eotaxin的浓度。结果与对照组比较,TNF-α刺激组上皮细胞eotaxin mRNA及蛋白表达、细胞培养上清液中eotaxin的浓度明显增高,差异均有统计学意义(P<0.01);与TNF-α刺激组比较,TNF-α+麻黄碱组以上各项指标均明显降低,差异有统计学意义(P<0.01)。结论麻黄碱能抑制前炎症因子TNF-α诱导的16HBE中eotaxin的表达及分泌,这可能是中药麻黄治疗哮喘的机制之一。
[关键词]麻黄碱;哮喘;支气管上皮细胞;嗜酸性粒细胞趋化因子
中药麻黄是中医用于治疗咳喘病之要药,近年来人们对麻黄所含成分、药理作用进行了深入研究,其中麻黄碱是其平喘的主要成分,但其平喘机制尚未完全阐明[1-2]。肿瘤坏死因子-α(TNF-α)是一种前炎症因子,可刺激气道上皮细胞合成和释放多种炎症介质和细胞因子,在哮喘的气道炎性反应和气道重塑中起着重要作用[3-4]。本研究以体外培养的人支气管上皮细胞(16HBE)为研究对象,加入含TNF-α的培养基,模拟哮喘气道炎性反应条件,观察一定浓度的麻黄碱对TNF-α致敏的16HBE表达嗜酸性粒细胞趋化因子(eotaxin)的影响,探讨麻黄治疗哮喘的机制。
1材料与方法
1.1材料正常人支气管上皮细胞(16HBE)株购于上海复祥生物科技有限公司。
1.2仪器与试剂胎牛血清购于杭州四季青生物工程公司,DMEM高糖培养基购于美国HyClone公司,TNF-α购于美国派普泰克公司,β-actin一抗购于美国Santa Cruz公司,10%山羊血清封闭液、荧光二抗(FITC标记羊抗兔IgG)购于北京中杉金桥生物公司,eotaxin 抗体购于北京博奥森生物技术公司,DAPI染色液、抗荧光淬灭封片液购于碧云天生物技术研究所,逆转录试剂盒购于天根生化科技(北京)有限公司,eotaxin引物购于上海生工生物工程有限公司,eotaxin ELISA试剂盒购于苏州卡尔文有限公司,TaKaRa SYBR Premix Ex TaqTM Ⅱ购于大连宝生物工程有限公司,麻黄碱由泸州医学院附属医院药房提供。细胞培养箱:美国Thermo公司;低温离心机:美国Sigma公司;酶联免疫检测仪:美国BIO-RAD公司;倒置相差显微镜:日本Olympus公司;实时定量PCR 仪:美国Applied Biosystem 公司;荧光显微镜:德国Leica公司;ABI StepOne Plus Real-time PCR System:美国ABI公司。
1.3方法
1.3.1细胞培养与分组将16HBE以1×106个/mL接种于25 cm2细胞培养瓶中,用含10%胎牛血清DMEM高糖完全培养基置于37 ℃,5% CO2培养箱中培养。待细胞长满80%时,以1×105个/mL接种于6孔板培养,每孔体积2 mL,当细胞长满70%左右时,随机分为3组。(1)对照组:无血清DMEM高糖培养基继续培养18 h;(2)TNF-α刺激组:无血清DMEM高糖培养基中加入TNF-α(20 ng/mL)培养18 h[5-6];(3)TNF-α+麻黄碱组:无血清DMEM高糖培养基中加入TNF-α(20 ng/mL)和麻黄碱(300 μg/mL)培养18 h[7],每组均设3个复孔,培养结束后收集培养上清液及细胞用于后续实验。
1.3.2荧光定量PCR测定各组细胞eotaxin mRNA的表达(1)提取细胞总RNA:收集各组细胞按Trizol说明书提取总RNA,测量每组RNA的浓度、纯度后,用RNase-free ddH2O将所有标本RNA浓度调至40 ng/mL;(2)逆转录反应:各组取10 μL RNA,按照说明书各自配成20 μL逆转录反应体系,混匀,25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,将反应产物置于-20 ℃冰箱保存;(3)实时荧光定量PCR:取逆转录反应产物2.0 μL为模板,以GAPDH(产物263 bp)为内参,eotaxin对应的PCR引物进行荧光定量PCR扩增。eotaxin上游引物:5′-CCA ACC ACC TGC TGC TTT AAC CTG-3′,下游引物5′-GCT TTG GAG TTG GAG ATT TTT GG-3′,产物长度为205 bp。反应条件:95 ℃ 30 s 1个循环,95 ℃ 5 s,58 ℃ 34 s 40个循环,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s 1个循环。结果以2-△△CT作为被测因子mRNA的相对表达量(RQ值)。
1.3.3免疫细胞化学染色法观察各组细胞eotaxin蛋白的表达(1)将16HBE细胞制成浓度为1×103个/mL的细胞悬液,每孔50 μL接种于有盖玻片的6孔板中,加入完全培养基培养,待细胞长满载玻片70%左右时,如前所述方法将细胞随机分为3组并更换为无血清培养基培养18 h;(2)取出细胞爬片按照说明书进行漂洗、4%多聚甲醛室温固定20 min,10%山羊血清封闭液室温封闭15 min,加入一抗(eotaxin 1∶100稀释)100 μL 4 ℃过夜(用PBS液代替一抗作阴性对照);加入FITC荧光标记的二抗(1∶1 00稀释)100 μL 37 ℃避光孵育1 h,染色封片后荧光显微镜摄像。
1.3.4Western blot检测各组细胞eotaxin蛋白的表达裂解液RIPA裂解16HBE细胞,离心后用蛋白浓度微量检测仪检测裂解液总蛋白浓度,在总蛋白液中加入5×SDS凝胶上样缓冲液40 μL,沸水煮6~10 min,-80 ℃保存。裂解液样品经SDS-PAGE电泳、转膜、5%牛血清清蛋白封闭、一抗孵育、洗膜、HRP标记的二抗孵育等过程后,加入化学发光显色液显色,成像保存。每组设置3个复孔,用增强化学发光法发光、显影,凝胶图像分析系统对所得条带吸光度半定量,计算待测条带的吸光度与内参照吸光度比值,得出相对表达量。
1.3.5ELISA测定各组细胞上清液中eotaxin的含量按照ELISA试剂盒说明书操作测定各组细胞上清液中eotaxin蛋白的含量,于酶标仪450 nm波长测定各孔样品的吸光度(OD)值,按标准曲线计算出各样品中eotaxin的浓度。
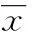
2结果
2.1各组16HBE的eotaxin mRNA表达荧光定量PCR显示内参GADPH和目的基因eotaxin 融解曲线均为单峰曲线(图1、2),曲线峰值分别在86.62 ℃、83.19 ℃,融解温度均一,峰的形状较为尖锐,表明无非特异性产物及引物二聚体生成,引物特异性良好,退火温度适中。与对照组细胞的eotaxin mRNA相对表达量(0.99±0.01)比较,TNF-α刺激组(3.03±0.32)明显升高,差异有统计学意义(P<0.01);而TNF-α+麻黄碱组eotaxin mRNA相对表达量(1.82±0.23)明显低于TNF-α组,差异有统计学意义(P<0.01)。

图1 GAPDH融解曲线

图2 eotaxin融解曲线
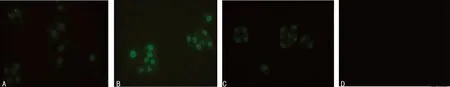
A:对照组;B:TNF-α刺激组;C:TNF-α+麻黄碱组;D:阴性对照组。
图3荧光显微镜观察各组16HBE的eotaxin蛋白表达(×200)
2.2免疫细胞化学染色检测各组16HBE的eotaxin蛋白表达免疫细胞化学染色后荧光显微镜下观察eotaxin绿色荧光主要表达在16HBE的胞质中,对照组细胞eotaxin绿色荧光呈现弱表达,TNF-α刺激组表达明显增强,TNF-α+麻黄碱组eotaxin绿色荧光表达较TNF-α刺激组明显减弱,而阴性对照组细胞染色为阴性(图3)。
2.3Western blot检测各组16HBE的eotaxin蛋白表达Western blot法检测结果见图4,与对照组细胞的eotaxin蛋白的相对表达量(1.27±0.25)比较,TNF-α刺激组eotaxin蛋白的相对表达量(3.87±0.60)明显升高,差异有统计学意义(P<0.05);而TNF-α+麻黄碱组(2.77±0.35)明显低于TNF-α组,差异有统计学意义(P<0.05)。

A:对照组;B:TNF-α组;C:TNF-α+麻黄碱组。
图4Western blot检测各组16HBE的eotaxin蛋白表达
2.4各组16HBE培养上清液中eotaxin的浓度与对照组上清液中eotaxin的浓度(1.72±0.16)pg/mL比较,TNF-α刺激组eotaxin的浓度(4.05±0.20)pg/mL明显升高,差异有统计学意义(P<0.01);而TNF-α+麻黄碱组eotaxin的浓度(3.70±0.21)pg/mL明显低于TNF-α刺激组,差异有统计学意义(P<0.01)。
3讨论
支气管哮喘是由多种细胞和细胞组分参与的气道慢性炎症[8]。近年来的研究表明,气道上皮细胞在哮喘发病机制中起着重要作用,气道上皮损伤与气道慢性炎症、气道高反应性和气道重塑密切相关,当气道受到环境激发因子刺激时,气道上皮细胞首先受累,可合成和释放多种炎症介质和细胞因子[9-10]。嗜酸性粒细胞是哮喘气道炎性反应中的主要炎症细胞,嗜酸性粒细胞释放的炎症介质可引起支气管平滑肌收缩,微血管渗漏和黏液分泌增加[5]。eotaxin在嗜酸性粒细胞的募集和脱颗粒过程中发挥重要作用,在哮喘发病过程中,eotaxin可趋化嗜酸性粒细胞从血液募集到气道上皮并活化、释放各种炎症介质导致气道上皮损伤[11]。而气道上皮细胞在受到各种抗原和致炎因子刺激后释放eotaxin,促进气道炎性反应的发生发展。本实验TNF-α刺激组气道上皮细胞表达和释放的eotaxin明显高于对照组,表明TNF-α作为一种促炎因子,可刺激体外培养的人支气管上皮细胞表达并分泌eotaxin。
中药麻黄具有发汗解表、宣肺平喘之功效,是中医常用于治疗咳喘病之要药[12]。其主要成分麻黄碱可直接兴奋支气管平滑肌细胞的β受体,激活腺苷酸环化酶,升高细胞内和血浆环磷酸腺苷(cAMP)水平,舒张支气管平滑肌[13]。近年来的研究表明,含麻黄的中药汤剂具有抗炎作用和免疫调节作用[14-15]。本课题组前期研究也发现麻黄水提物雾化吸入能减轻哮喘小鼠气道炎症,抑制支气管肺组织中IL-13、eotaxin的表达[16]。为了进一步阐明麻黄治疗哮喘的机制,本实验从细胞水平进一步观察麻黄碱对促炎因子TNF-α致敏的16HBE表达eotaxin的影响,结果显示TNF-α+麻黄碱组气道上皮细胞eotaxin蛋白表达较TNF-α刺激组弱,eotaxin mRNA相对表达量明显低于TNF-α刺激组,细胞培养上清液中eotaxin的浓度亦明显低于TNF-α刺激组,差异均有统计学意义(P<0.01)。本研究结果表明,麻黄碱能抑制前炎症因子TNF-α诱导的16HBE中eotaxin的表达及分泌,这些研究结果为临床上使用中药麻黄治疗哮喘提供了新的理论依据。
参考文献
[1]Lee MR.The history of Ephedra (ma-huang)[J].J R Coll Physicians Edinb,2011,41(1):78-84.
[2]Wei P,Huo HL,Ma QH,et al.Pharmacokinetic comparisons of five ephedrine alkaloids following oral administration of four different Mahuang-Guizhi herb-pair aqueous extracts ratios in rats[J].J Ethnopharmacol,2014,155(1):642-648.
[3]Hardyman MA,Wilkinson E,Martin E,et al.TNF-α-mediated bronchial barrier disruption and regulation by src-family kinase activation[J].J Allergy Clin Immunol,2013,132(3):665-675.
[4]Paplińska-Goryca M,Nejman-Gryz P,Chazan R,et al.The expression of the eotaxins IL-6 and CXCL8 in human epithelial cells from various levels of the respiratory tract[J].Cell Mol Biol Lett,2013,18(4):612-630.
[5]Gong JH,Shin D,Han SY,et al.Kaempferol suppresses eosionphil infiltration and airway inflammation in airway epithelial cells and in mice with allergic asthma[J].J Nutr,2012,142(1):47-56.
[6]Paplinska M,Chazan R,Grubek-Jaworska H.Effect of phoshpodiesterase 4 (PDE4) inhibibtors on eotaxin expression in humen bronchial epithelial cells[J].J Physiol Pharmacol,2011,62(3):303-311.
[7]景红娟,汪长东,宋苏,等.麻黄碱对支气管平滑肌细胞增殖的影响[J].生物学杂志,2008,25(3):27-29.
[8]Juncadella IJ,Kadl A,Sharma AK,et al.Apoptotic cell clearance by bronchial epithelial cells critically influences airway inflammation [J].Nature,2013,493(7433):547-551.
[9]Proud D,Leigh R.Epithelial cells and airway diseases[J].Immunol Rev,2011,242(1):186-204.
[10]Holgate ST.The airway epithelium is central to the pathogenesis of asthma[J].Allergol Int,2008,57(1):1-10.
[11]Paplińska M,Grubek-Jaworska H,Chazan R.Role of eotaxin in the pathophysiology of asthma[J].Pneumonol Alergol Pol,2007,75(2):180-185.
[12]马勇,徐暾海,徐海燕,等.麻黄研究进展[J].吉林中医药,2008,28(10):777-779.
[13]Jia JJ,Zeng XS,Li Y,et al.Ephedrine induced thioredoxin-1 expression through β-adrenergic receptor/cyclic AMP/protein kinase A/dopamine-and cyclic AMP-regulated phosphoprotein signaling pathway[J].Cell Signal,2013,25(5):1194-1201.
[14]Wu Z,Kong X,Zhang T,et al.Pseudoephedrine/ephedrine shows potent anti-inflammatory activity against TNF-α-mediated acute liver failure induced by lipopolysaccharide/D-galactosamine[J].Eur J Pharmacol,2014,724(2):112-121.
[15]Ma CH,Ma ZQ,Fu Q,et al.Ma Huang Tang ameliorates asthma though modulation of Th1/Th2 cytokines and inhibition of Th17 cells in ovalbumin-sensitized mice[J].Chin J Nat Med,2014,12(5):361-366.
[16]王娇,熊瑛,熊彬,等.麻黄水提物雾化吸入对小鼠气道炎症的影响[J].重庆医学,2013,42(3):304-307.
Effect of ephedrine on expression of eotaxin in human bronchial epithelial cells stimulated by tumor necrosis factor-α*
Li Zhongyan1,Deng Jun2,Xiong Bin2,Xiong Ying2,Wang Songping2△
(1.Department of Respiratory Medicine,Dazhou Municipal Central Hospital,Dazhou,Sichuan 635000,China;2.First Department of Respiratory Medicine,Affiliated Hospital of Luzhou Medical College,Luzhou,Sichuan 646000,China)
[Abstract]ObjectiveTo observe the effect of ephedrine on the expression of eotaxin in human bronchial epithelial cells (16HBE) stimulated by tumor necrosis factor-α(TNF-α) and to explore the mechanism of Chinese medicine ephedra in treating asthma.MethodsThe in vitro cultured 16HBE were randomly divided into the control group,TNF-α stimulation group(TNF-α 20 ng/mL) and TNF-α plus ephedrine group (TNF-α 20 ng/mL plus ephedrine 300 μg/mL).Three complex holes in each group were set to culture for 18 h,the eotaxin mRNA expression was measured by real time fluorescent quantified PCR and protein level was detected by immunocytochemical stain and Western blot.The eotaxin concentration in cells culture supernatant was quantified by ELISA.ResultsCompared with the the control group,the expression level of eotaxin mRNA and protein,and the concentration of eotaxin in cell culture supernatant in the TNF-α stimulation group were increased obviously,there being statisticaly significant difference between them(P<0.01);however,all above these parameters in the TNF-α plus ephedrine group showed decreased obviously as compared with the TNF-α group,the difference between them was statistically significant (P<0.01).ConclusionEphedrine can inhibit the expression and secretion of eotaxin in TNF-α induced 16HBE inflammatory model,which may be one of the mechanisms of Chinese medicine ephedra in treating asthma.
[Key words]ephedrine;asthma;bronchial epithelial cells;eotaxin
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.08.003
* 基金项目:四川省卫生厅科研项目(110341)。
作者简介:李中燕(1986-),硕士,住院医师,主要从事支气管哮喘的基础与临床研究。△通讯作者,E-mail:wang4816@sina.com。
[中图分类号]R562.2
[文献标识码]A
[文章编号]1671-8348(2016)08-1016-03
(收稿日期:2015-09-16修回日期:2015-11-20)

