人胎盘源间充质干细胞的分离、培养及生物学鉴定*
赖 平,陈懿建,罗耀玲,张敏鸿,杨建琼,邱悦群
(赣南医学院 1.2014级研究生;2.第一附属医院 a.血液科;b.临床科研中心,江西 赣州 341000)
人胎盘源间充质干细胞的分离、培养及生物学鉴定*
赖平1,陈懿建2a,罗耀玲2b,张敏鸿2b,杨建琼2b,邱悦群2
(赣南医学院 1.2014级研究生;2.第一附属医院 a.血液科;b.临床科研中心,江西赣州341000)
摘要:目的:探讨机械剪碎组织加酶液消化法分离、培养人胎盘间充质干细胞的可行性,并对间充质干细胞进行生物学鉴定。方法:取足月产人胎盘,采用机械剪碎组织加酶液消化法分离,密度梯度离心法提纯胎盘组织中的细胞,利用细胞生长特性对细胞进行进一步分离、纯化并传代培养,倒置显微镜观察细胞形态,流式细胞术鉴定细胞表面标记。结果:在倒置显微镜下,细胞为贴壁生长,形态呈长梭形,少数为多角形,胎盘组织来源间充质干细胞在体外可稳定长期传代培养,应用流式细胞仪检测结果显示CD73、CD90、CD105 表达阳性, CD34、CD45、HLA-DR 表达阴性。结论:联合利用机械剪碎胎盘组织和酶消化法可高效获取胎盘间充质干细胞,获取的胎盘间充质干细胞在体外培养过程中生长稳定,增殖能力强,可长期传代或冻存。
关键词:人胎盘间充质干细胞;机械剪碎;酶消化;干细胞培养
间充质干细胞在一定的条件下可以被诱导分化为多种类型的组织细胞,一直被认为是极佳的进行科学研究和医用资源[1]。干细胞可通过骨髓、脂肪组织、脐带血等途径获取。以往的获取途径因受到道德及伦理的限制不能广泛开展。虽来源广泛,不同来源的干细胞获取、分离、纯化困难也大大限制了其应用。胎盘中有大量的滋养细胞及丰富的胚外中胚层的间充质和血管[2],从中获取的干细胞可以很好的解决干细胞缺乏的现状。胎盘是医疗废物,分娩结束后对胎儿及产妇无影响,不受道德约束,并且含有丰富的干细胞。本研究拟采用机械剪碎组织加酶液消化法从胎盘绒毛层获取间充质干细胞,并且用淋巴细胞分离液及间充质干细胞贴壁生长的特性进一步纯化细胞,从而进一步观察其生物学特性,与以往获取方法相比具有简单、高效、获取细胞数量多等特点,为以后的研究奠定一定的基础。
1材料及方法
1.1主要材料及仪器足月顺产胎儿胎盘来自赣南医学院第一附属医院妇产科,遵守相关医学伦理学规定并经家属同意获得,母血经传染病检测均为阴性。淋巴细胞分离液(Ficoll),Ⅱ型胶原酶,低糖DMEM(Gibco公司),胎牛血清(Hyclone公司),细胞培养箱(Thermo 公司,型号Forma 311),倒置显微镜(Olympus 公司,型号 CKX 41),超净工作台(上海博迅公司,型号 SW-CJ-2FD),低速离心机(江苏环宇公司,型号80-2型),高精度恒温水浴箱(上海博迅公司,型号 SSW-600-2S)。
1.2胎盘间充质干细胞的分离及培养细胞分离纯化于不同的时间段重复三次,由相同的实验人员在超净台中进行,具体操作如下:取保持无菌状态的新鲜足月顺产胎儿胎盘一个,胎儿面朝向手心,母体面朝上,减去上层厚约2~3 mm的母体面。获取深部呈网状的胎盘组织约50 g置于无菌的培养皿中[3],用生理盐水反复冲洗至无血迹,用已消毒处理的剪刀将组织尽可能剪碎,呈肉糜状(以能用吸管吸取为标准),转移至15 mL的离心管中,按体积比约1∶6加入Ⅱ型胶原酶(0.1%)[4],置于37 ℃恒温水浴箱中消化30 min,间隔5 min适当混匀组织与消化液。多层纱布过滤取滤液,置于离心管中, 1 000 r·min-1,常温下离心5 min,弃上清,用PBS约5 mL重悬细胞。将细胞悬液缓慢加至已配好的淋巴细胞分离液中。1 500 r·min-1,4 ℃离心20 min,离心后可见“白膜层”[5],小心吸取该区域细胞,并加入4倍于该体积的PBS稀释,1 000 r·min-1,常温下离心5 min。重复一次,弃上清,用6 mL完全培养基(含10%的胎牛血清的低糖DMEM)充分混悬细胞,平均接种于细胞3个培养瓶中,置于37 ℃,5%CO2的细胞培养箱中培养,3天后首次换液,去除未能贴壁的细胞,之后每3~4天换液一次[6]。待细胞生长达80%~90%融合度时可用胰蛋白酶消化贴壁细胞进行传代培养或冻存。在重复实验中均能获取大量的细胞,倒置显微镜下进行细胞计数发现细胞数量有一定差别,经培养后的细胞在细胞活性,传代培养后的细胞性状经倒置显微镜观察无明显差异。
1.3细胞表面标志鉴定在三次培养的细胞中分别取第3代生长良好的胎盘间充质干细胞,去除旧培养基,用PBS洗一遍后加入胰酶消化3 min,加入双倍的完全培养基终止消化,离心弃上清,再用PBS洗涤离心处理两次后,经细胞筛过滤后,加入PBS制成约1×106个·mL-1的细胞悬液,加入CD105,HLA-DR, CD34相关抗体后避光保存至少15 min后进行流式细胞检测。间充质干细胞的特征性检测指标是不表达造血干细胞的CD34和HLA-DR,而CD105持续阳性[7-9]。
2结果
2.1细胞观察实验重复三次的结果均发现,于倒置显微镜下均可见经淋巴细胞分离液分离后获取的细胞以圆形为主,可见部分红细胞或小组织块(如图1A所示);接种于培养12 h左右细胞出现贴壁生长,呈梭形;72 h后细胞贴壁牢固,长梭形(如图1B所示);7天后可见细胞数量较多,呈贴壁生长,长梭形,类似成纤维细胞,与大部分干细胞形态相似,有的胞浆突起,少数呈多角形(如图1C所示);传代后的细胞生长速度较快,镜下观察形态均一,少数呈多形性,呈平行排列或漩涡状生长(如图1D所示)。

A:刚接种至培养瓶中的细胞,细胞未贴壁,呈圆形×10;
B:培养72 h后的P1代细胞呈贴壁生长,长梭型×10;C:培养7天后的P1代细胞,细胞数量较多,部分生长较快×10;
D:经传代后的P3代细胞培养7天后生长密集,平行排列或呈漩涡状×10。
图1胎盘间充质干细胞获取及培养不同时期的形态学变化
2.2细胞表面标志鉴定分别取适量三次重复实验的P3代细胞,经流式检测结果示均为表达CD105(>80%),不表达HLA-DR(<1%), CD34(<1%),CD45(<2%),符合胎盘间充质干细胞表面标记情况[7-9],三次检测结果在阳性细胞比例上有一定差异,证实了经上述方法获取的细胞是胎盘间充质干细胞,鉴定结果如下(图2、3)。
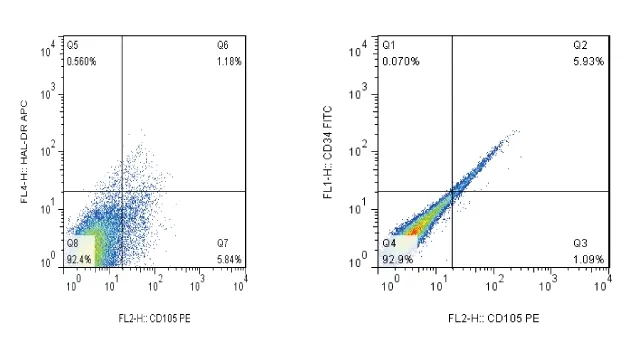
CD105,CD34,HLA-DR表达均为阴性。
图2未染色胎盘间充质干细胞流式细胞检测结果

CD105表达阳性,CD34,HLA-DR表达均为阴性。
图3经染色处理的胎盘间充质干细胞流式细胞检测结果
3讨论
间充质干细胞自首次分离出来就引起了研究者的极大兴趣,也是目前干细胞研究方向的一个新热点[10],间充质干细胞在一定的诱导条件下可以分化为多种人体组织细胞,具有非常广泛的临床应用前景[11-12]。但有分离纯化困难的缺点,探索一种新的获取途径和更好的分离培养技术具有重要的意义。骨髓、脂肪组织等途径均可获取间充质干细胞,两种方法获取的细胞数量较少,且与供者的身体状况,身体机能,年龄等相关[13],并且从骨髓中获取干细胞给提供者带来较大的痛苦。相比于其他获取途径,胎盘是获取间充质干细胞的可靠而且丰富的来源,分离获得的细胞具有容易分离,增殖快速,分化能力强等特点,同时具有提取方便,无痛苦,感染机会少等优势,且不涉及伦理道德问题[14-15]。不同来源的间充质干细胞具有不同的生长能力[16],胎盘间充质干细胞活性较其他来源的间充质干细胞活性较好。以往的研究多采用胰蛋白酶或多种消化酶联合消化组织后获取干细胞,但胰蛋白酶消化能力强,联合消化常会过度消化损伤细胞膜成分[8],容易影响细胞的成活率和增殖能力,甚至导致细胞死亡,给后续培养带来困难。Ⅱ型胶原酶消化能力相对较弱,但对细胞膜损害较小,既能充分的分离细胞,又能避免细胞的损伤。利用组织块法也能获得一定数量的间充质干细胞,但因其中可能混杂血管内皮细胞等细胞成分,在后期的分离过程中,组织块的清除也有一定的困难,难以保证所培养细胞的纯度[17]。胎盘组织中含有血管内皮细胞,血细胞及其他细胞,传统酶消化后结合高速离心的方法将间充质干细胞与其他细胞分离效果不理想。本研究采用淋巴细胞分离液进行细胞分离,操作简单并且获取的细胞成分比较单一,为后续的培养带来了方便。胎盘间充质干细胞呈贴壁生长,可以利用此特性与其他杂细胞进一步分离,但在培养早期,胎盘间充质干细胞贴壁不牢固,第一次换液时间过早将损失获取的胎盘间充质干细胞。在重复的三次实验中,由于组织的剪碎程度有差异及不同时间配制的消化酶浓度及环境温度的影响,可能导致在初始阶段获取的细胞数量有一定差异,但经培养及传代后,细胞活性未见明显差异。
胎盘来源的间充质干细胞表面标志有一定的特异性,三次重复实验的结果在表达上无明显差异,在检测的细胞比例上有一定的差异,这与实验过程中细胞纯化程度有关系,但获取的细胞表达均>80%,可以满足一般实验的要求。有研究发现,胎盘来源的间充质干细胞还可表达部分胚胎干细胞表面标志物,这可能提示胎盘来源的多能间充质干细胞可能是非常原始的细胞群,与普通干细胞相比具有更加广泛的多系分化能力[18],应用前景将更加广泛。进一步探索一种更加高效地从胎盘中获取间充质干细胞的方法显得非常有必要。
通过对胎盘源间充质干细胞的生物学特性观察及经流式细胞鉴定提示采用0.1%的Ⅱ型胶原酶消化已充分剪碎的胎盘组织可获取较多数量的胎盘间充质干细胞,且活性较好。0.1%的Ⅱ型胶原酶消化30 min即可获得大量细胞,延长时间至60 min,两者间在细胞数量上无明显差别,但消化时间的延长可能对细胞膜造成影响,后续的培养发现较长时间组增殖速度前期较慢,传代后无明显差异。所以通过机械剪碎胎盘组织结合使用Ⅱ型胶原酶消化可以缩短消化酶作用时间,更快捷的获得胎盘源间充质干细胞,有利于提高细胞成活率,生长活性、扩增和传代培养。对于以上结果,本研究进行了三次实验验证,说明通过机械剪碎胎盘组织,再使用0.1%的Ⅱ型胶原酶消化获得胎盘源间充质干细胞的方法可靠性高,对比与之前获取胎盘间充质干细胞的途径有简单、高效、获取细胞数量多、细胞活性好等优点。这给临床应用提供了良好的基础。
本研究虽然为胎盘间充质干细胞的分离、培养及传代探索了一种相对于传统的方法更加简单、快捷、高效的方法。但仍存在一定的缺陷,如对传统不同消化酶的比较,同种酶不同浓度的比较等。对于这些缺陷,需要进一步的实验进行探索和验证,最终寻找到一种可靠性更强、效率更高的胎盘间充质干细胞分离、培养体系,为胎盘间充质干细胞的临床应用提供扎实的基础。
参考文献:
[1]袁文佶,黄颖芝,高璎,等.人胎盘间充质样干细胞的分离、培养及其生物学特性分析[J].浙江大学学报(理学版),2011,38(3):315-320.
[2]卢遥,邓力,李秀群,等.胎盘间充质干细胞与骨髓间充质干细胞分离培养和生物学特性研究[J].中国修复重建外科杂志,2007,21(9):989-993.
[3]孙晓娟.人足月胎盘间充质干细胞体外分离纯化及生物学性状的研究[D].青岛:青岛大学,2010.
[4]沙文琼,王自能,王冬菊.人胚胎滋养细胞和胎盘间充质干细胞的分离与纯化[J]. 中国组织工程研究与临床康复,2010,10:1833-1837.
[5]韩之波,杨舟鑫,池颖,等.人脐带、胎盘绒毛膜来源间充质干细胞的生物学特性比较研究[J].中国实验血液学杂志,2012,20(3):692-696.
[6]刘洋,李艳琪,王洪一,等.胎盘源间充质干细胞分离提取的新方法[J].中国组织工程研究,2015(10):1608-1612.
[7]Koo BK,Park IY,Kim J,et al.Isolation and characterization of chorionic mesenchymal stromal cells from human full term placenta [J].J Korean Med Sci,2012,27(8):857-863.
[8]Chan TM,Harn HJ,Lin HP,et al. Improved human mesenchymal stem cell isolation[J].Cell Transplant,2014,23(4-5): 399-406.
[10]Patel J,Shafiee A,Wang W,et al. Novel isolation strategy to deliver pure fetal-origin and maternal-origin mesenchymal stem cell (MSC) populations from human term placenta[J]. Placenta,2014,35(11):969-971.
[11]Ni L,Liu X,Sochacki KR,et al. Effects of hypoxia on differentiation from human placenta-derived mesenchymal stem cells to nucleus pulposus-like cells[J].Spine J,2014,14(10):2451-2458.
[12]牛婷,李爱斌,曹景云,等.胎盘间充质干细胞的应用研究[J].中国组织工程研究,2015(32):5236-5242.
[13]张睿婷,韩之波,王涛,等.人胎盘绒毛膜来源间充质干细胞的生物学特性[J].中国组织工程研究与临床康复,2011,15(10):1823-1826.
[14]Zhu SF,Zhong ZN,Fu XF,et al.Comparison of cell proliferation, apoptosis, cellular morphology and ultrastructure between human umbilical cord and placenta-derived mesenchymal stem cells[J]. Neurosci Lett,2013,541:77-82.
[15]王敬龙,金巨楼,杜冰,等.胎盘源间充质干细胞的分子生物学特性[J].中华细胞与干细胞杂志(电子版),2013,3(1):27-30.
[16]于艳秋.间充质干细胞的生物学特性、临床试验与应用现状[J].中国病理生理杂志,2015(10):1832-1832.
[17]马海英,李丽,马玲,等.组织块贴壁法提取胎盘、脐带和胎膜间充质干细胞效果观察[J].山东医药,2011,51(15):39-41.
[18] In 't Anker PS,Scherjon SA,Kleijburg-van der Keur C,et al.Amniotic fluid as a novel source of mesenchymal stem cells for therapeutic transplantation[J].Blood,2003,102(4):1548-1549.
Abstact:Objective:To investigate the feasibility of the combined use of mechanical minced placenta and enzymatic digestion to get and culture human placenta mesenchymal stem cells, and the biological identification of mesenchymal stem cells. Methods: Full-term human placenta was taken to seperate placental tissue cells by mechanical minced tissue joined with enzyme digestion. Placental tissue cells were purified by density gradient centrifugation, and further separated and purified with the growth characteristics of cells. Cells were observed under inverted microscope morphology and flow cytometry was adopted to identify cell surface markers. Results:Under inverted microscope, cells adherent growth, fusiform morphology, a small number of polygons were found. Placental tissues derived from mesenchymal stem cells in vitro could be long-term cultured stably. Flow cytometry showed that the expressions of CD73,CD90,CD105 were positive; the CD34,CD45,HLA-DR expressions were negative. Conclusion:Placenta derived mesenchymal stem cells can be efficiently obtained by the combined use of mechanical minced placenta and enzymatic digestion, can be cultured in vitro stably with high proliferative capacity, and can be long-term passed down or frozen.
Isolation, Cultivation and Biological Identification of Human Placenta Mesenchymal Stem Cells
LAIPing1,CHENYi-jian2a,LUOYao-ling2b,ZHANGMin-hong2b,YANGJian-qiong2b,QIUYue-qun2
(1.GraduateStudentinGrade2014,Gannanmedicaluniversity; 2.a.Dept.ofHematology;b.ClinicalResearchCenter,theFirstAffiliatedHospitalofGannanMedicalUniversity,Ganzhou,Jiangxi341000)
Key words:human placenta mesenchymal stem cells; mechanically minced; enzymatic digestion; stem cells culture
*基金项目:江西省科技支撑计划项目(编号20141BBG70069)
通讯作者:邱悦群,男,主任医师,教授,硕士生导师。E-mial:qiuyuequn66@sohu.com
中图分类号:Q813.1
文献标志码:A
文章编号:1001-5779(2016)02-0183-04
DOI:10.3969/j.issn.1001-5779.2016.02.005
(收稿日期:2015-12-04)(责任编辑:敖慧斌)

