13个中国葡萄优新品种的分子身份证构建
王慧玲闫爱玲孙磊张国军王晓玥徐海英
(1.北京市农林科学院林业果树研究所,北京 100093;2.北京市落叶果树工程技术研究中心,北京 100093;3.农业部华北地区园艺作物生物学与种质创制重点实验室,北京 100093)
13个中国葡萄优新品种的分子身份证构建
王慧玲1,2闫爱玲1,2孙磊1,3张国军1王晓玥1徐海英1
(1.北京市农林科学院林业果树研究所,北京 100093;2.北京市落叶果树工程技术研究中心,北京 100093;3.农业部华北地区园艺作物生物学与种质创制重点实验室,北京 100093)
以近年来选育的13个葡萄优新品种为试材,进行亲缘关系分析,构建分子身份证,为中国葡萄品种鉴定和新品种保护提供一定的参考。利用国际通用的9对引物对供试葡萄品种进行SSR分析,并根据引物对不同品种扩增条带分子量的大小进行赋值编码。结果表明,该9对引物在供试葡萄品种间共检测出48个等位基因,每对引物平均检测到等位基因数为5.3个;期望杂合度的范围在0.435-0.811之间;多态性信息含量变幅为0.401-0.784。同时基于SSR分析结果得到编码各异的品种分子身份证,该分子编码可以将13个葡萄品种进行有效区分。聚类分析显示13个品种根据亲缘关系远近聚为不同类别。
葡萄;优新品种;SSR;分子身份证
葡萄属葡萄科(Vitaceae)葡萄属(Vitis L.),是全球性果树之一,品种繁多,分布广泛。我国是世界上葡萄栽培面积较大的国家之一,目前全国入圃保存的葡萄种质资源也有2 000份左右[1],并且每年都会有多个新品种出现,因此进行品种保护、品种鉴定及谱系分析等工作不仅对苗木繁育具有重要意义,也是保护这些品种知识产权的需要。
SSR(Simple sequence repeat)分子标记技术具有重复性好、多态性丰富、稳定性高及简便快速等特点[2],近年来被广泛应用于葡萄种质鉴别[3]、遗传多样性分析[4,5]、亲缘关系鉴定[6,7]及分子遗传图谱构建[8]等方面,同时也成为葡萄指纹图谱构建的有效工具[9]。尹玲等[10]对我国近年来新育成的24个鲜食葡萄品种,利用6对国际通用的SSR荧光标记引物对其进行扩增,并利用毛细管电泳技术对产物进行分离,建立了这些葡萄品种的指纹图谱。近几年,研究者在遗传图谱基础上提出了“分子身份证”的概念,并将它赋予品种本身作为识别品种的一个标准。分子身份证是在指纹图谱的基础上将种质的特征数字化,即每个种质都拥有一个属于自己的字符串形式的代码,达到更加简单明了区分种质的目的。在果树方面,研究者利用SSR标记分别构建了甜樱桃、香蕉和桃等的分子身份证[11-13]。2013年,杜晶晶等[14]以国家葡萄品种资源圃内保存的80份葡萄种质为试材,对利用SSR标记构建葡萄种质分子身份证的方法进行了探讨,证明SSR标记可以用于进行葡萄的分子身份证构建。
本研究选取北京市农林科学院林业果树研究所选育的13个葡萄优新品种为试材,通过SSR标记分析技术,分析它们的亲缘关系,尝试构建13个品种的分子身份证,旨在为保护中国葡萄优新品种的知识产权,并为育成品种的分子鉴定奠定理论基础,对中国葡萄遗传育种及品种保护提供帮助。
1 材料与方法
1.1 材料
本研究所用材料均为北京市农林科学院林业果树研究所选育的优新品种,共13份(表1),分别种植于所内资源圃和温室。在四月中旬采集各个葡萄品种幼叶液氮速冻,保存于-80℃冰箱,用于基因组DNA的提取。
1.2 方法
1.2.1 基因组DNA提取 基因组DNA提取参照Marsal等[15]的方法。从葡萄幼叶中提取基因组DNA,1%琼脂糖凝胶电泳检测,利用Eppendorf公司生产的Bio-Photometer核酸检测仪检测DNA溶液的浓度与纯度,并将浓度稀释至50 ng/μL。
1.2.2 DNA扩增和电泳 本研究选取9对国际通用的SSR引物进行扩增(表2),其中6个标记(VVMD5、VVMD7[16]、VVMD27、VVS2[17]、VRZAG62及VRZAG79[18])曾被This等[19]推荐为葡萄品种筛选的核心标记。引物由上海生工合成,每对引物合成2OD,-20℃冰箱保存备用。
DNA扩增采用20 μL体系。其中含:10×PCR buffer,引物0.25 μmol/L,模板DNA 50 ng,dNTP 0.2 mmol/L,rTaq DNA 聚合酶0.5 U。用于SSR-PCR 反应的dNTP、Taq酶、DNA Marker购自TaKaRa公司。
PCR扩增程序:95℃预变性5 min;95℃变性15 s,65℃-55℃退火15 s,72℃延伸1 min,10个循环;95℃变性15 s,55℃退火15 s,72℃延伸1 min,25个循环;4℃保存。PCR反应在美国Bio-Rad公司生产的9600 Thermal Cycler型PCR仪上进行。然后取PCR产物4 μL进行点样,6%聚丙烯酰胺凝胶电泳,银染显色,胶干后在清华紫光e100 扫描仪上成像保存。
1.2.3 数据分析 采用Powermarker软件(Version 3.25)[20]对9个SSR标记的遗传多样性指数进行分析。数据标准化处理方法参考陈昌文等[11]的方法。根据每对引物对不同种质扩增片段对应的分子量大小,按从小到大依次编码为1-8。同时参考桃分子身份证的构建方法,当引物扩增的某一品种等位基因有2个时,按等位基因碱基数较小的条带编码进行赋值。并通过非加权配对算术平均法(UPGMA)进行聚类分析,建立亲缘关系图。
2 结果
2.1 SSR引物扩增多态性
通过改进的CTAB方法提取全部实验材料的基因组DNA,通过电泳和紫外分光光度计检测,基因组DNA的浓度和纯度均符合SSR实验要求。聚丙烯酰胺凝胶电泳结果显示,SSR扩增条带清晰。本实验所选用的9对SSR引物在供试葡萄品种中共检测到48个等位基因,平均每对引物扩增的等位基因数是5.3个。最少的VVMD6和VrZAG29引物分别扩增出3个等位基因,VrZAG79扩增的等位基因数最多为8个,其中有5对引物的等位基因数超过平均数(表2)。等位基因数越多,表明该引物更能反应品种之间的差异。其中VVMD5和VVMD7对13个品种扩增结果(图1)显示,13个品种分别有6个等位基因。尽管9对引物的多态性不高,但是足以区分这13个葡萄品种。
利用Powermaker软件对9个SSR标记在13个葡萄品种中的主等位基因频率、期望杂合度、观测杂合度及扩增位点的多态信息含量等进行了计算分析。结果(表3)表明,扩增位点的观测杂合度在0.385-0.846之间,平均值为0.641。期望杂合度的范围在0.435-0.811之间,平均值为0.638。多态性信息含量PIC变幅为0.401-0.784,平均为0.598。 VrZAG79引物的PIC值最高,结合期望杂合度值及等位基因数值,该引物对本研究供试葡萄品种的区分能力最强。

表1 13个葡萄品种名称及分子身份证编码
2.2 分子身份证构建
根据电泳结果,对9对引物在供试种质扩增的等位基因谱带大小分布范围进行赋值。因为本实验中引物扩增最多的等位基因数为8,所以赋值范围为1-8(表4)。为了保证分子身份证字符串的每位上只有1个字符,对同一引物下的扩增条带只选择位点较小的进行分子编码。
根据表4中等位基因的赋值标准和各引物对品种的扩增结果,对13份供试葡萄品种进行分子编码,结果(表1)显示,用选取的9对引物可以将13个品种进行有效区分。但是因为品种亲缘关系较近,进行分子编码最少也需要8对引物才能够将所有品种区分开,如瑞都红玫和瑞都早红的分子编码比较相似,在第8对引物时才区分开。另外在所构建的13个品种分子身份证中,有7个品种具有至少一个特异等位基因。紫珍珠、早玫瑰香和瑞都脆霞各具有一个特异等位基因,艳红、早玛瑙和峰后各具有2个特异等位基因,瑞都无核怡则具有3个特异等位基因。
2.3 供试葡萄品种亲缘关系分析
根据本研究所用的9对SSR引物扩增结果进行数据统计,利用POWERMAKER软件,采用UPGMA法对所有品种进行聚类分析,聚类结果(图2)显示,亲缘关系近的多聚为一类,如父母本相同的瑞都红玫、瑞都早红、瑞都脆霞和瑞都香玉聚在一起,而瑞都红玉为瑞都香玉的芽变,也聚为一类。紫珍珠和早玫瑰香亲本相同聚为一类。艳红、早玛瑙爱神玫瑰与香妃聚为一个大类,他们都有相同的亲本玫瑰香。该聚类结果清楚地反应了品种间亲缘关系的远近。
3 讨论
采用9对SSR引物对13个葡萄品种进行了分子身份证构建和亲缘关系分析。平均等位基因数(5.3)、期望杂合度(0.435-0.811)和引物多态性信息含量(0.401-0.784)方面显示,本实验结果都较低(表3)。Guo等[21]利用相同引物在32个中国葡萄品种扩增平均位点数11.5,期望杂合度0.740-0.915,多态性信息含量0.716-0.908。本研究结果也低于Moreno-Sanz等[22]采用相同引物在西班牙品种中的扩增结果。可能是由于13个供试葡萄品种来源于相同的育种单位,许多品种父母本相同,亲缘关系较近,选育品种的性状相似,导致品种遗传多样性较低。但是通过这9个分子标记,也可以将13个葡萄品种完全区分开。同时我们发现标记VrZAG79在本研究所用的13个中国葡萄品种中扩增等位基因数最多,多态信息含量最高,这与Guo等[21]在32个中国葡萄品种的实验结果一致,表明VrZAG79可以作为区分中国葡萄品种的核心标记之一。

表2 9对SSR引物的碱基序列及扩增结果
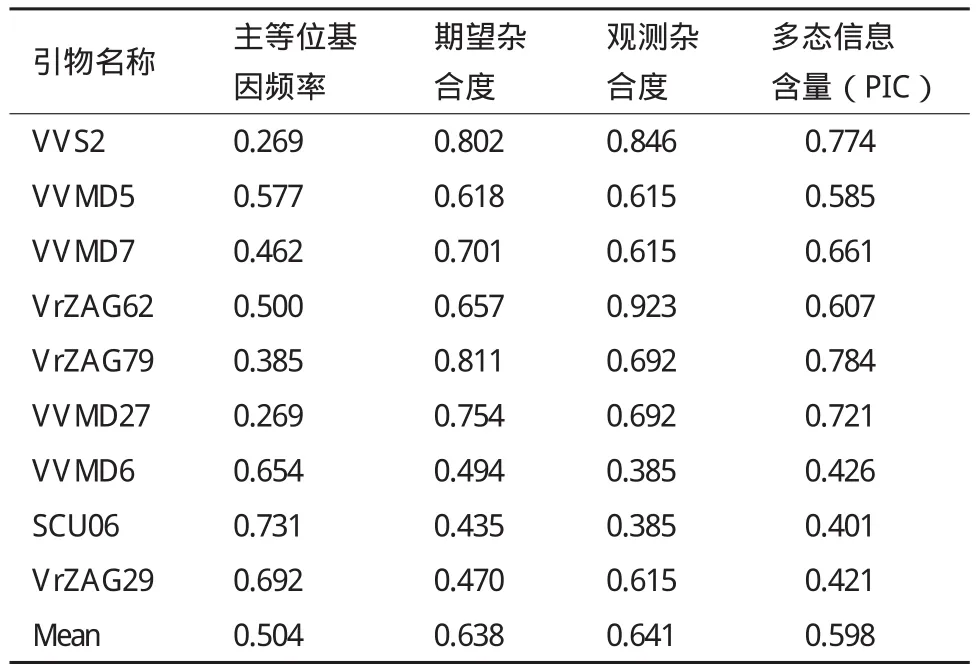
表3 9个SSR标记在13个供试葡萄品种的遗传多样性
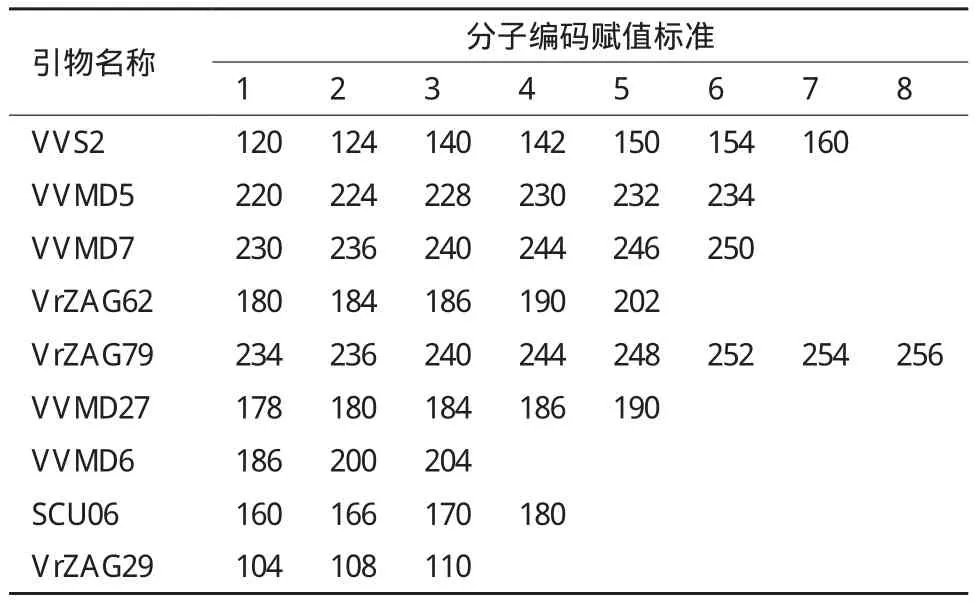
表4 SSR引物扩增基因谱带大小/bp
在引物扩增结果的基础上,我们采取最小等位基因编码法[13]对13个葡萄品种进行分子编码。得到了13个葡萄品种编码各异的分子身份证。在桃编码中发现亲缘关系较近的品种很难区分[13],而本研究中,对于亲缘关系较近的品种通过增加引物也得到了有效区分,如瑞都红玫和瑞都早红的区分等。本研究对来自同一育种单位亲缘关系相同或较近的品种均可被有效区分,充分说明我们所选取的引物足以区分亲缘关系很近的不同材料,亦即利用SSR标记构建葡萄分子身份证具有较强的可靠性,可作为鉴别葡萄品种的一种有效方法。本实验得出的结果在一定程度上可以作为供试品种鉴定的依据,但在后期的大量鉴定中的适用性还需进一步的验证。如果能将分子标记和品种来源及表型性状相结合来研究制定它们的分子身份证将会得到更加科学客观的实验结果。

图1 VVMD5和VVMD7扩增的等位基因特征
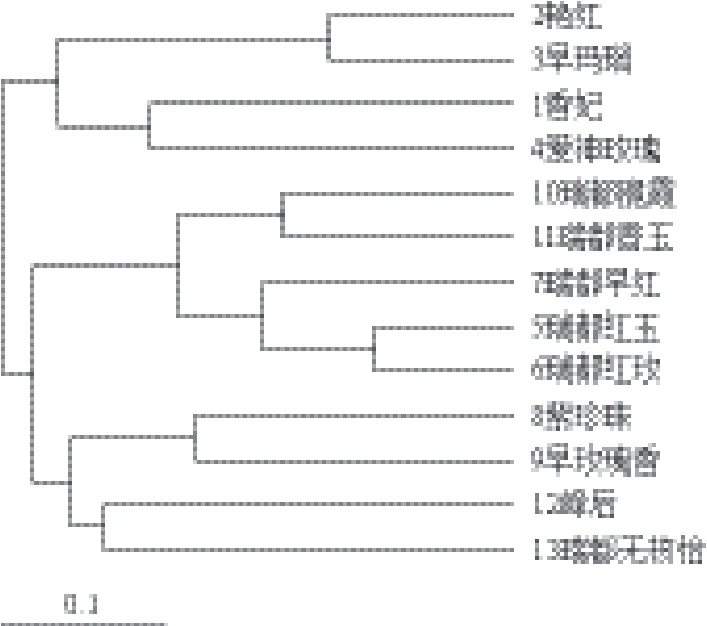
图2 13个葡萄品种基于SSR的聚类分析
4 结论
本研究采用国际通用的9对SSR引物,对13份中国葡萄优新品种进行了亲缘关系分析,构建了它们的有效分子身份证,再一次表明SSR分析技术可以作为葡萄品种分子身份证构建的有效技术手段。
[1] 刘崇怀, 马小河, 武岗. 中国葡萄栽培品种[M]. 北京:中国农业出版社, 2014.
[2] Morgante M, Olivieri A. PCR-amplified microsatellites as markers in plant genetics[J]. The Plant Journal, 1993, 3(1):175-182.
[3] 吴子龙, 王军, 沈育杰, 路文鹏. 8个山葡萄及山欧杂种葡萄品种的SSR分析[J]. 植物资源学报, 2008, 9(1):105-109.
[4] 邹瑜, 杨柳, 黄大辉, 等. 70份毛葡萄种质资源遗传多样性的SSR分析[J]. 南方农业学报, 2013, 44(12):1943-1948.
[5] Emanuelli F, Lorenzi S, Grzeskowiak L, et al. Genetic diversity and population structure assessed by SSR and SNP markers in a large germplasm collection of grape[J]. BMC Plant Biology, 2013, 13:39
[6] 李慧, 罗正荣, 张青林. 基于SSR和IRAP标记的‘关口葡萄’亲缘关系分析[J]. 果树学报, 2014, 31(6):1024-1027.
[7] 温景辉, 申海林, 邹利人, 等. 20 份葡萄种质亲缘关系的SSR分析[J]. 果树学报, 2011, 28(5):782-786.
[8] Vezzulli S, Troggio M, Coppola G, et al. A reference integrated map for cultivated grapevine(Vitis vinifera L.)from three crosses, based on 283 SSR and 501 SNP-based markers[J]. Theoretical and Applied Genetics, 2008, 117:499-511.
[9] Karata H, Değirmenci D, Velasco R, et al. Microsatellite fingerprinting of homonymous grapevine(Vitis vinifera L. )varieties in neighboring regions of South-East Turkey[J]. Scientia Horticulturae, 2007, 114:164-169.
[10] 尹玲, 张晨, 向江, 等. 我国新育成葡萄品种SSR 指纹图谱的建立[J]. 果树学报, 2015, 32(3):366-373.
[11] 艾呈祥, 张力思, 魏海蓉, 等. 甜樱桃品种SSR指纹图谱数据库的建立[J]. 中国农学通报, 2007, 23(5):55-58.
[12] 王静毅, 陈业渊, 黄秉智, 等. 部分香蕉品种SSR指纹图谱的构建[J]. 果树学报, 2009, 26(5):733-738.
[13] 陈昌文, 曹珂, 王力荣, 等. 中国桃主要品种资源及其野生近缘种的分子身份证构建[J]. 中国农业科学, 2011, 44(10):2081-2093.
[14] 杜晶晶, 刘国银, 魏军亚, 等. 基于SSR 标记构建葡萄种质资源分子身份证[J]. 植物研究, 2013, 33(2):232-237.
[15] Marsal G, Baiges I, Canals JM, et al. A fast, efficient method for extracting DNA from leaves, stems, and seeds of Vitis vinifera L. [J]. American Journal of Enology and Viticulture, 2011, 62:376-381.
[16] Bowers JE, Dangl GS, Vignani R, Meredith CP. Isolation and characterization of new polymorphic simple sequence repeat loci in grape(Vitis vinifera L. )[J]. Genome, 1996, 39:628-633.
[17] Thomas MR, Scott NS. Microsatellite repeats in grapevine reveal DNA polymorphisms when analyzed as sequence-tagged sites(STSs)[J]. Theoretical Applied Genetics, 1993, 86:985-990.
[18] Sefc KM, Regner F, Turetschek E, et al. Identification of microsatellite sequences in Vitis riparia and their applicability for genotyping of different Vitis species[J]. Genome, 1999, 42(3):367-373.
[19] This P, Jung A, Boccacci P, et al. Development of a standard set of microsatellite reference alleles for identification of grape cultivars[J]. Theoretical and Applied Genetics, 2004, 109(7):1448-1458.
[20] Liu K, Muse SV. PowerMarker:an integrated analysis environment for genetic marker analysis[J]. Bioinformatics, 2005, 21:2128-2129.
[21] Guo DL, Zhang Q, Zhang GH. Characterization of grape cultivars from China using microsatellite markers[J]. Czech Journal of Genetics and Plant Breeding, 2013, 49:164-170.
[22] Moreno-Sanz P, Loureiro MD, Suárez B. Microsatellite characterization of grapevine(Vitis vinifera L. )genetic diversity in Asturias(Northern Spain)[J]. Scientia Horticulturae, 2011, 129:433-440.
(责任编辑 马鑫)
Molecular ID Establishment of 13 Chinese Newly-developed Grape Cultivars
WANG Hui-ling1,2YAN Ai-ling1,2SUN Lei1,3ZHANG Guo-jun1WANG Xiao-yue1XU Hai-ying1
(1. Institute of Forestry and Pomology,Beijing Academy of Agricultural and Forestry Sciences,Beijing 100093;2. Beijing Engineering Research Center for Deciduous Fruit Tree,Beijing 100093;3. Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(North China),Ministry of Agriculture of P. R. China,Beijing 100093)
Using 13 newly-developed grape cultivars as experimental materials,the phylogenetic relationship among them were analyzed and their molecular IDs were established,which aimed to provide the references for identifying the grape cultivar and protecting the new ones. SSR analysis was carried out on the tested grape cultivars with the international commonly-used 9 pairs of primers,and the codes of each cultivar was assigned according to the molecular weight of the amplified band of different cultivar by the primer. The results showed:a total of 48 alleles and an average of 5.3 alleles per primer were detected by 9 pairs of primers. The expected heterozygosity varied between 0.435-0.811,and the information content of polymorphism ranged from 0.401 to 0.784. After alleles assignment and coded,the molecular IDs of cultivars were established,by which the 13 grape cultivars can be identified. According to the clustering analysis,13 cultivars showed clear separations due to their different parents.
grape;new cultivars;SSR;molecular ID
10.13560/j.cnki.biotech.bull.1985.2016.04.018
2015-07-21
科技创新能力建设专项(KJCX20140110,KJCX20140202)
王慧玲,女,博士,助理研究员,研究方向:葡萄分子遗传育种;E-mail:whlhappy@aliyun.com
徐海英,女,研究员,研究方向:葡萄遗传育种;E-mail:haiyingxu63@sina.com

