Mecp2在斑马鱼胚胎神经发育中对NOTCH信号通路的调控
何丽番 高海
(山西农业大学动物科技学院,太谷 030801)
Mecp2在斑马鱼胚胎神经发育中对NOTCH信号通路的调控
何丽番 高海
(山西农业大学动物科技学院,太谷 030801)
旨在探讨Mecp2在斑马鱼胚胎神经发育过程中的调控及机制。利用Notch转基因鱼,通过原位杂交技术和激光共聚焦显微技术发现Mecp2在胚胎发育过程前期广泛表达,随后逐渐表达在脑部。在敲低Mecp2的胚胎中,Notch信号的表达明显降低,注射Mecp2-RNA和胞内NICD-RNA均能够恢复这种表型,标记神经成熟的神经因子Ngn1、Pax2、Pax3、Eno2、Map和RNA结合蛋白HUC表达下调。在敲低Mecp2后其靶分子转录抑制因子Hey2表达下调,敲低Mecp2阻碍了神经细胞的正常分化成熟,结果表明Mecp2能够通过Notch-Hey2信号通路来调控斑马鱼神经细胞的分化。
Mecp2;斑马鱼;神经发育;Notch信号通路;神经细胞分化
Mecp2基因突变导致瑞氏综合征[1](Rett syndrome,RTT),是一种神经系统发育异常性疾病,典型RTT的临床特征为,出生后6-18个月生长发育基本正常,随后出现神经发育停滞或倒退。到目前为止,人们尚不清楚Mecp2在细胞中的功能。Bird[2]推测其在保护或维持细胞功能完整性起作用。Mecp2基因敲除小鼠可正常出生,但寿命较短,会出现一些RTT的症状[3,4]。Notch信号通路在神经细胞分化过程中扮演着重要角色,维持着神经细胞增殖、分化、凋亡之间的平衡,对细胞分化命运起决定性作用。Notch信号的产生是通过相邻细胞的Notch配体与受体相互作用,Notch蛋白经过3次剪切,由胞内段(NICD)释放入胞质,并进入细胞核与转录因子CSL结合,形成NICD/CSL转录激活复合体,从而激活Hey、Hers、Hes等碱性-螺旋-环-螺旋转录抑制因子家族的靶基因,发挥生物学作用[5-8]。本实验选用斑马鱼作为研究对象,探讨Mecp2在斑马鱼胚胎发育过程中对Notch通路中的调控作用。
1 材料与方法
1.1 材料
表达质粒:pGEX-4T-1载体。斑马鱼:实验用斑马鱼野生型品系为TL与AB。转基因斑马鱼品系NotchTg(Tp1bglob:hmgb1-mCherry),Tg(neurod:EGFP)。Mecp2-MO(morpholino oligo):GeneTools公司,5'-TCTGCGGCGGCCATTTTTATTTAAA-3'。Mecp2原位杂交探针序列:F:5'-CGGGATCCGGCAGGGGAAGCCCG-3',R:5'-GTTGAATTCATTTTCCTGGA CTCTTTTCTATGACGCG-3'。
Mecp2抗体:中国医学科学院药用植物研究所胡克平实验室惠赠[9]。
1.2 方法
1.2.1 斑马鱼的饲养 斑马鱼生长于28.5℃环境下,以丰年虾为食,循环水使用紫外灭菌水,水盐度维持在450-500 μs/cm,pH值为7左右。在每晚喂食后与熄灯前,将雌鱼和雄鱼放于同一交配盒中,并用隔板将雌雄鱼分开,放入约1/3的系统循环水。待第2天亮灯后,移除挡板,雌雄鱼分别产下卵细胞和精子,并在水中受精。胚胎使用E3培养液,以保证胚胎的生理平衡。用于原位杂交的斑马鱼胚胎在受精后24 h左右换入含有0.0045% PTU(Sigma P7629)的1 × E3水溶液,以防止胚胎色素的生成。1.2.2 斑马鱼胚胎的显微注射 显微注射采用气压注射仪,用普通氮气驱动,压力设为0.3 PSI,从而防止液体回流。使用无齿镊在体视镜下将针头折断,尽量断成斜切面,以便于注射。
1.2.3 斑马鱼胚胎免疫荧光染色 胚胎发育到所需时间,置于4% PFA在4℃过夜。PBST洗涤3次后,用30%蔗糖溶液置换。放入OCT包埋剂中,置于-80℃中冷却样品。将切片加入到预冷的丙酮于-20℃处理10 min。加入封闭液,室温孵育1 h。加入一抗,4℃过夜,洗涤,再加入二抗,用含有DAPI的封片剂封片,避光保存。胚胎成像使用 Zeiss 700激光共聚焦显微镜的20倍水镜,并用Imaris7.0(Bitplane)软件处理拍摄的3D图像。
1.2.4 斑马鱼胚胎原位杂交 制备 RNA探针,用杂交液将RNA探针稀释10倍作为储存液-80℃冻存。胚胎收集与固定,每管加入1 mL多聚甲醛固定,4℃过夜。次日进行胚胎脱水,依次用25%甲醇的PBS溶液3-5 min、50%甲醇的PBS溶液3-5 min、75%甲醇的水溶液3-5 min、100%甲醇处理并在-20℃放置至少2 h,也可存放-20℃。经过胚胎复水,洗涤,蛋白酶K处理,预杂交,杂交,封闭,洗涤,染色,杂交后胚胎信号采集等过程。
2 结果
2.1 Mecp2在斑马鱼神经发育过程中的表达
原位杂交结果显示,Mecp2在斑马鱼胚胎发育过程中,随时空变化,在脑部呈现高表达,Mecp2从单细胞到24 h表达广泛(图1-A-D),48 h Mecp2在斑马鱼头部高表达(图1-E),且主要在细胞核表达,通过免疫荧光和蛋白印迹再次证实敲低Mecp2的胚胎中Mecp2蛋白表达明显减少,同时也证明Mecp2-MO特异性显著[9]。
2.2 注射Mecp2-MO斑马鱼表型变化
将Mecp2-MO稀释成2 mmol/L 贮存液,注射时4倍稀释,每胚注射2.3 nL。注射斑马鱼Mecp2-MO(图2-D),28 h侧观相比野生型(图2-C),个体变小,头部结构纹理不清晰,眼睛轮廓变小,尾部弯曲等各种表型变化;背观头部(图2-F),28 h相比野生型(图2-E),前脑、中脑、后脑结构纹理模糊;15 d后,注射斑马鱼Mecp2-MO的鱼(图2-B),有部分死亡,存活下来大部分畸形,貌似正常的相比野生型(图2-A),发育迟缓。
2.3 注射Mecp2-MO后NOTCH信号的表达变化
实验结果显示,敲低Mecp2(图3-B、D、F)相对野生型(图3-A、C、E),观察发现NOTCH转基因鱼胚胎头部(前脑、中脑、后脑)和躯干部表达明显下调,共注射Mecp2-RNA(鼠源,图4-D)和Mecp2-MO后能够使Mecp2-MO敲低的表型得到恢复,但单一注射RNA-Mecp2(鼠源,图4-C)与野生型Tg(Tp1bglob:hmgb1-mCherry)转基因鱼胚胎相比较,其前脑、中脑表达明显下调,但其后脑的表达变化不明显。观察到同时注射NICD-RNA和Mecp2-MO也能够使Mecp2-MO敲低的表型得到恢复(图4-H),但只注射NICD-RNA(图4-G)与野生型(图4-E)NOTCH转基因鱼胚胎相比较,头部表达显著提高。
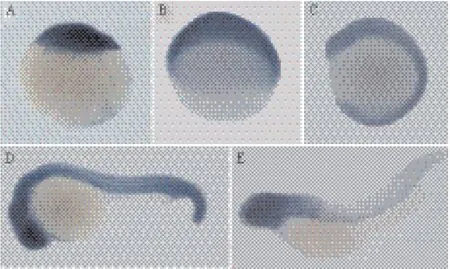
图1 Mecp2在斑马鱼胚胎发育过程中的时空表达
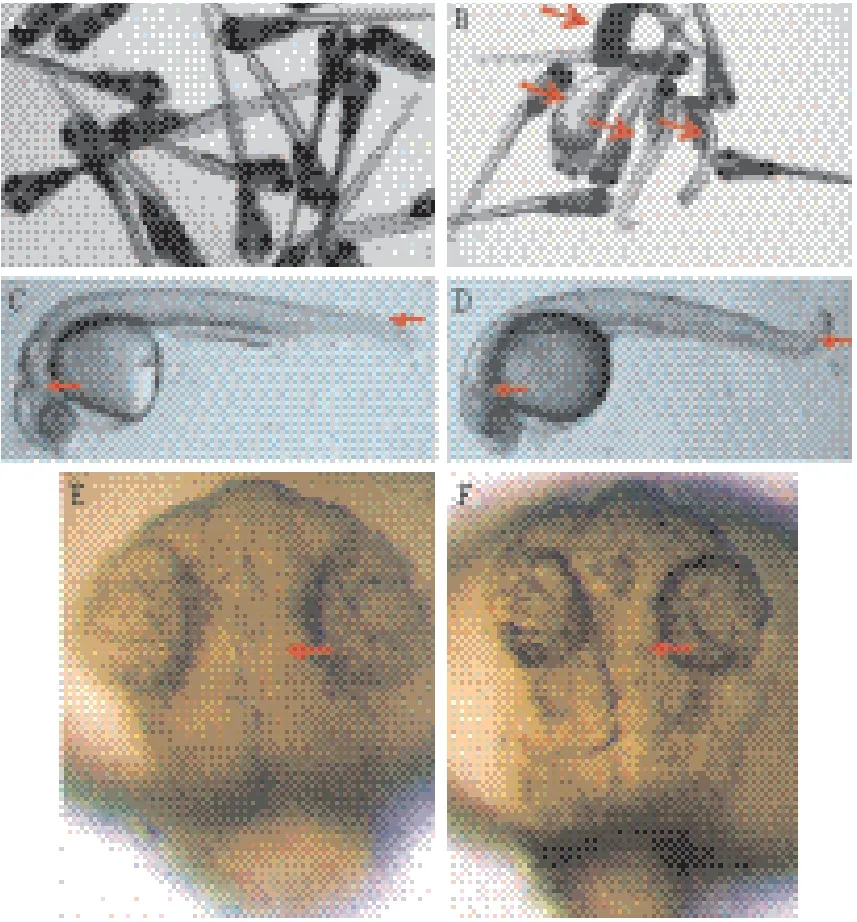
图2 注射Mecp2-MO后斑马鱼的表型变化
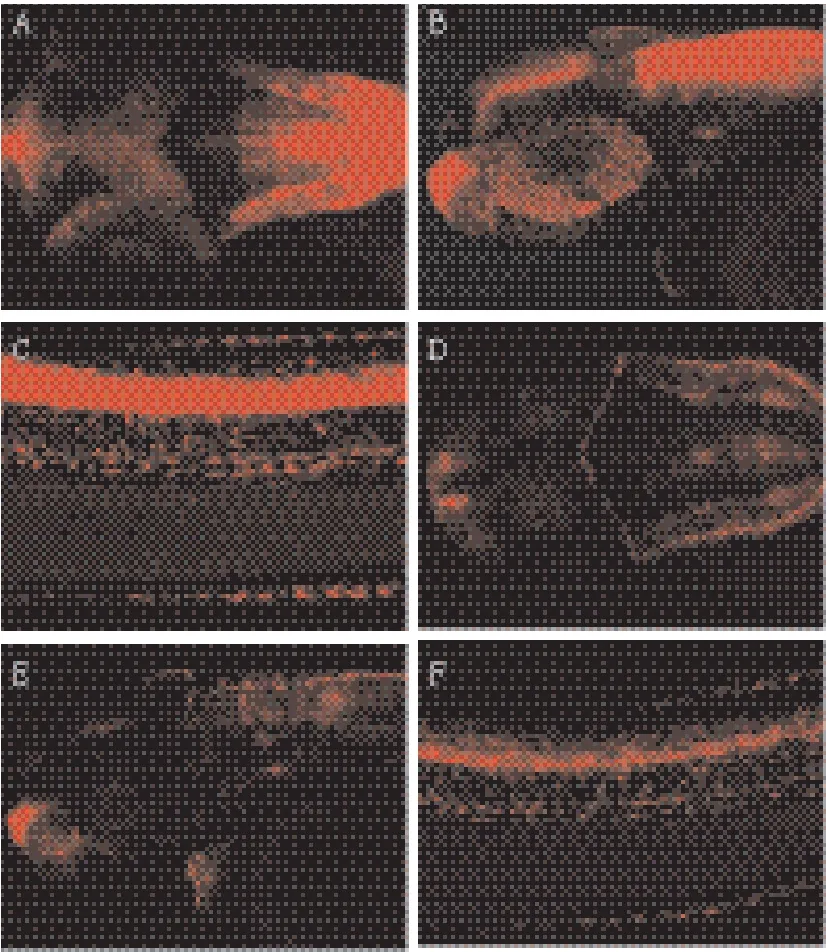
图3 Mecp2对NOTCH信号表达影响
2.4 敲低Mecp2的胚胎,对神经因子表达影响
注射Mecp2-MO后,胚胎免疫荧光显示(图5-A-F),在敲低Mecp2的胚胎中标记分化成熟神经细胞的蛋白Huc的表达与野生型胚胎相比明显减少。标记神经细胞分化成熟的神经因子Neurod Tg(neurod:GFP)相比野生型neurod的表达明显减少(图6-C),注射NICD-RNA后,相比野生型Neurod的表达并没有明显的变化(图6-B),但共同注射NICD-RNA和Mecp2-MO后,其表型可恢复到正常状态(图6-D)。原位杂交结果显示,敲低Mecp2的胚胎中相关神经因子Ngn1、Pax2、Pax3、Eno2、Map(图7-B、D、F、H、J)表达与野生型(图7-A、C、E、G、I)相比较明显减少。以上这些实验结果表明,敲低Mecp2虽然没有造成斑马鱼脑部发育出现明显的缺陷,但是神经细胞分化成熟过程受到影响,神经细胞处于分化不完全或迟缓的状态。
2.5 注射Mecp2-MO后转录抑制因子Hey2的表达变化
原位杂交结果显示,Hey家族成员hey2,在敲低Mecp2的胚胎中的表达与野生型胚胎(图8-A)相比也明显降低(图8-B),背部神经管消失。注射NICD-RNA(图8-C)与野生型相比,没有明显变化,当共同注射NICD-RNA+Mecp2-MO时发现背部神经管能部分得到恢复(图8-D),有一定比例胚胎的表达回到了正常水平。实验表明敲低Mecp2胚胎中,Hey2的表达也降低,抑制Mecp2的低表达相应hey2的表达也得到提高。
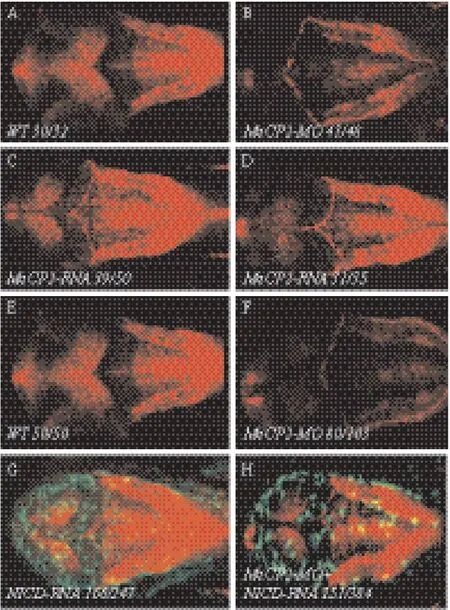
图4 Mecp2-RNA-和NICD-RNA能够rescue敲低Mecp2-Tg(Tp1bglob∶hmgb1-mCherry)转基因鱼的表型
3 讨论
有研究表明[10,11],Notch信号通路对于神经细胞发育至关重要。在斑马鱼突变体mind bomb(mib)中,Notch信号通路活性减弱,标记分化成熟神经细胞的基因如huc表达明显增加。Notch信号对于激活许多Hairy and Enhancer-of-split[H/E(Spl)]基因是必需的,这些基因通过抑制神经发育相关的基因转录从而影响了神经细胞正常的分化成熟过程。本实验发现,抑制Mecp2的胚胎中Notch信号本身减弱,以及NICD(Notch intracellular domain)直接的靶基因hey2,在斑马鱼脑部的表达与野生型胚胎相比都明显降低(图3-B、D),这些实验结果说明,敲低Mecp2后Notch信号通路活性减弱。
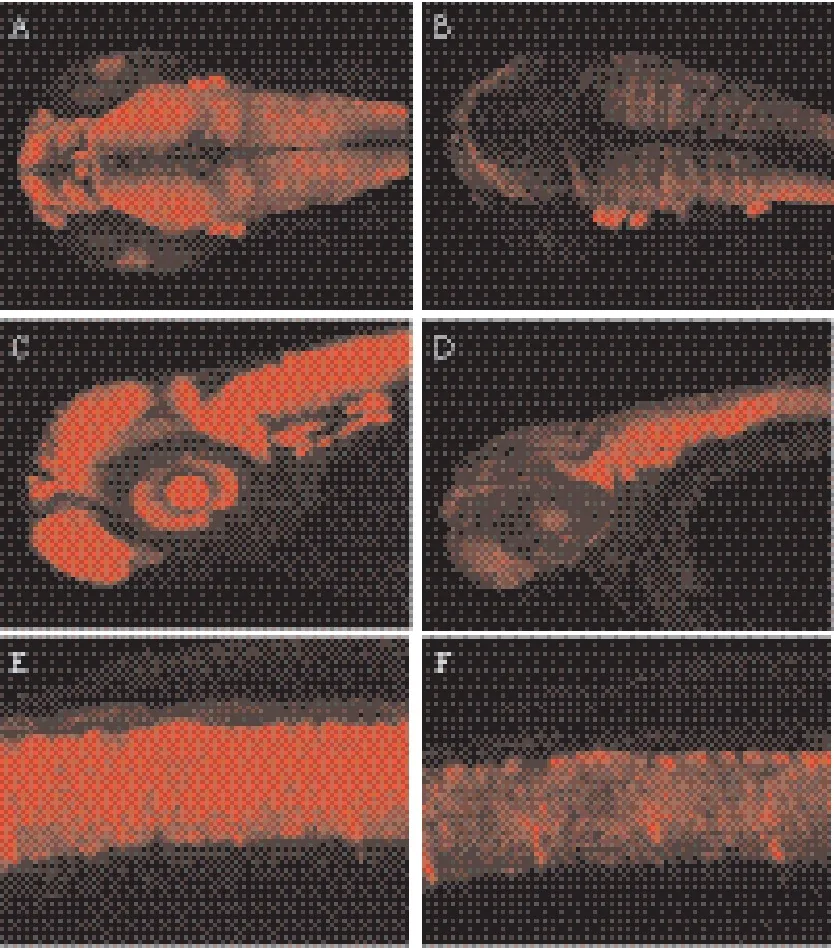
图5 敲低Mecp2对RNA结合蛋白HUC表达的影响
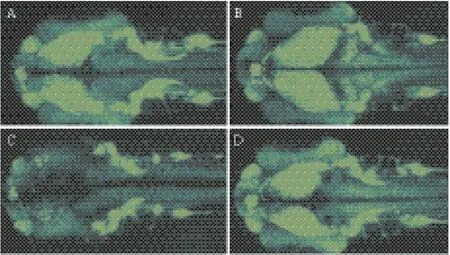
图6 Mecp2对Neurod Tg(Neurod:GFP)信号表达的影响
实验结果显示,敲低Mecp2后(图3-B),观察到Tg(Tp1bglob:hmgb1-mCherry)转基因鱼胚胎头部前脑、中脑、后脑表达明显下调,共注射Mecp2-RNA(鼠源,图3-C)和Mecp2-MO后能够使Mecp2-MO敲低的表型得到恢复,但注射 Mecp2-RNA(鼠源,图4-C)与野生型Notch转基因鱼胚胎相比较,其前脑、中脑表达明显下调,但其后脑的表达变化不明显。同时也观察到,同时共注射RNA-NICD和Mecp2-MO也能够使Mecp2-MO敲低的表型得到恢复(图4-H),但只注射NICD-RNA(图4-G)与野生型Notch转基因鱼胚胎相比较,头部表达显著提高。注射Mecp2-RNA和NICD-RNA都能够恢复Mecp2-MO敲低的表型,说明Mecp2在神经发育过程中起非常重要的作用,并对Notch信号通路具有调控作用。从而激活HEY家族碱性-螺旋-环-螺旋(Basichelix-loop-helix,bHLH)转录抑制因子家族的靶基因,发挥生物学作用。
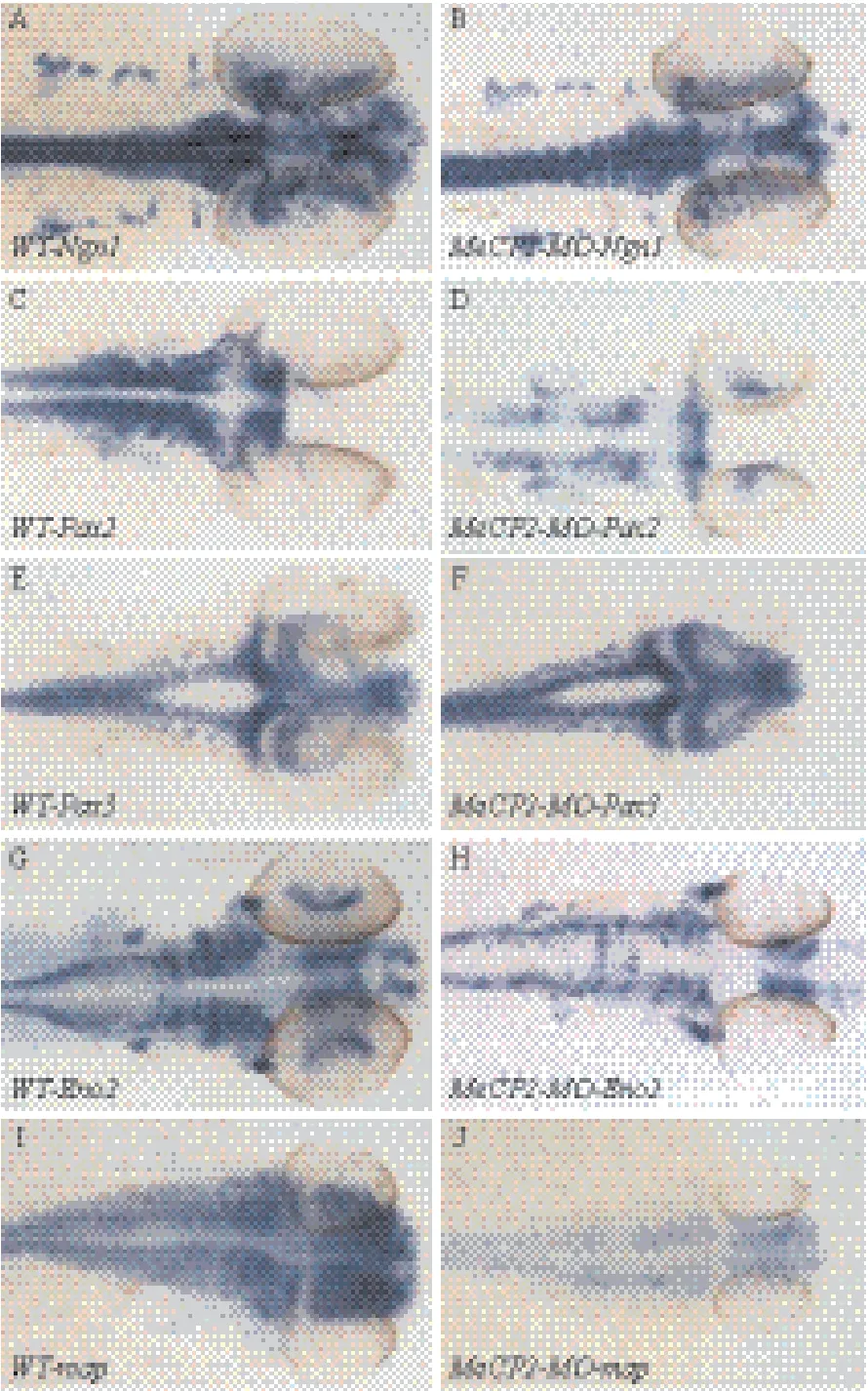
图7 Mecp2对Ngn1、Pax2、Pax3、Eno2、Map不同神经因子表达的影响
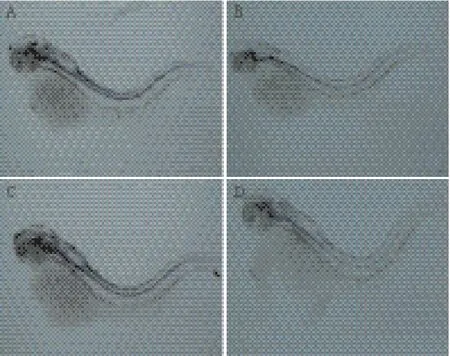
图8 Mecp2对Hey2表达的影响
本实验研究发现斑马鱼Mecp2存在母源表达,发育早期广泛表达,从胚胎受精后24 h表达开始增加,随着发育的进程逐渐集中在脑部,到受精后48 h表达集中于头部(图1)。敲低Mecp2影响斑马鱼神经细胞的分化成熟;从而实现对神经细胞分化成熟的精细调控。敲低Mecp2的斑马鱼胚胎脑部发育正常但是总体积变小,能够正确分隔成为前脑、中脑和后脑;神经细胞的增殖正常;标记神经细胞的基因如ngn1、pax2、pax3、neurod、map2、eno2和蛋白Huc的表达明显减少(图7)。Mecp2基因敲除小鼠神经细胞增殖正常,树突分支复杂度降低,电生理活性降低[12];最新研究表明,敲除Mecp2后小鼠神经细胞胞核以及胞体变小,单个神经细胞的RNA转录和蛋白质合成都减少[13];但抑制Mecp2表达的斑马鱼神经细胞增殖也正常;树突分支复杂度和电生理活性本实验没有分析;运动神经元的胞体大小需统计定量才能得出结论;标志成熟神经细胞的基因如map2的表达也明显减少。因此认为,Mecp2对于不同物种神经系统发育的影响还是存在一定差异的。这种功能上的差异可能是因为Mecp2在不同物种发育过程中表达的时空差异造成的。
在实验中也发现敲低Mecp2后,观察到Tg(Tp1bglob:hmgb1-mCherry)转基因鱼胚胎头部前脑、中脑、后脑表达明显下调,共注射RNA-Mecp2和Mecp2-MO后能够使Mecp2-MO敲低的表型得到恢复,共注射RNA-NICD和Mecp2-MO也能够使Mecp2-MO敲低的表型得到恢复,说明Mecp2或其复合物在notch信号通路中起抑制作用。之前的文献报道,Mecp2能够与转录活化因子cAMP 反应元件结合蛋白1(CREB1)相互作用,介导基因启动子区的活化[14]。Mecp2还能够和Y盒结合蛋白1(YB-1)[15],PRPF3(pre-mRNA processing factor 3)[16]相互作用,调节基因mRNA的剪切,找到的Mecp2结合蛋白具有明确的转录激活功能和mRNA剪切功能,将进一步验证结合蛋白在神经细胞发育中的功能,但hey2如何调控notch信号通路活性的,尚不清楚,这是下一步需要认真研究的问题。
4 结论
Mecp2在胚胎神经发育前期广泛表达,敲除Mecp2能延缓胚胎神经细胞发育,Mecp2能够通过Notch-Hey2信号通路来调控斑马鱼神经细胞的分化。
[1]Amir RE, Van den Veyver IB, Wan M, et al. Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2[J]. Nature Genetics, 1999, 23:185-188.
[2]Gitschier J. On the Track of DNA Methylation:An Interview with adrian bird[J]. PLoS Genet, 2009, 5(10):e1000667.
[3]Chen RZ, Akbarian S, Tudor M, Jaenisch R . Deficiency of methyl-CpG binding protein-2 in CNS neurons results in a Rett-like phenotype in mice[J]. Nature Genetics, 2001, 27:327-331.
[4]Guy J, Hendrich B, Holmes M, et al. A mouse Mecp2-null mutation causes neurological symptoms that mimic Rett syndrome[J]. Nature Genetics, 2001, 27:322-326.
[5]Weng AP, Ferrando AA, Lee W, et al. Activating mutations of Notch1 in human T cell acute lymphoblastic leukemia[J]. Science, 2004, 306(5694):269-271.
[6]Radtke F, Schweisguth F, Pear W. The Notch ‘gospel’-workshop on notch signalling in development and cancer[J]. EMBO Reports, 2005, 6(12):1120-1125.
[7]De Strooper B, Annaert W, Cupers P. A presenilin-1-dependent r-secretase-like protease mediates release of Notch intraCellular domain[J]. Nature, 1999, 398(6727):518-522.
[8]Iso T, Kedes L, Hamamori Y. HES and HERP families:multiple effectors of the Notch signaling pathway[J]. Journal of Cellular Physiology, 2003, 194(3):237-255.
[9] Gao H, Bu Y, Wang X, et al. Mecp2 regulates neural cell differentiation by suppressing the Id1-Her2/Hes5 axis in zebrafish[J]. Journal of Cell Science, 2015, 128(12):2340-2350.
[10] Louvi A, Artavanis-Tsakonas S. Notch signalling in vertebrate neural development[J]. Nature Reviews Neuroscience, 2006, 7(2):93-102.
[11] Fortini ME. Notch Signaling:The core pathway and its posttranslational regulation[J]. Developmental Cell, 2009, 16(3):633-647.
[12]Kishi N, Macklis JD. MECP2 is progressively expressed in postmigratory neurons and is involved in neuronal maturation rather than cell fate decisions[J]. Molecular and Cellular Neuroscience, 200, 27:306-321.
[13] Li Y, Wang H, Muffat J, et al. Global transcriptional and translational repression in human-embryonic-stem-cell-derived rett syndrome neurons[J]. Cell Stem Cell, 2013, 13:446-458.
[14]Chahrour M, Jung SY, Shaw C, et al. Mecp2, a key contributor to neurological disease, activates and represses transcription[J]. Science, 2008, 320:1224-1229.
[15]Young JI, Hong EP, Castle JC, et al. Regulation of RNA splicing by the methylation-dependent transcriptional repressor methyl-CpG binding protein 2[J]. Proc Natl Acad Sci USA, 2005, 102:17551-17558.
[16]Long SW, Ooi JY, Yau PM, Jones PL. A brain-derived Mecp2 complex supports a role for Mecp2 in RNA processing[J]. Bioscience Reports, 2011, 31:333-343.
(责任编辑 李楠)
The Regulation of Mecp2 on Notch Signaling Pathway During Early Neural Development of Zebrafish Embryos
HE Li-fan GAO Hai
(College of Animal Science and Veterinary Medicine,Shanxi Agricultural University,Taigu 030801)
This study aims to explore the regulation role and mechanism of Mecp2 during early neural development of zebrafish embryos. By the techniques of confocal laser scanning microscopy and in situ hybridization,and using Notch transgenic fish,it was found that Mecp2 widely expressed in the early embryonic development,then gradually expressed in the brain. In the embryos with Mcep2 knockdown,the expression of Notch signal decreased,and both the injection of Mcep2-RNA and intracellular INCD-RNA restored the phenotype. The expression of neural factors of Ngn1,Pax2,Pax3,Eno2,and Map labelling for neural maturation as well as HUC binding with RNA were downregulated. After Mecp2 knocked down,the expression of transcriptional repressor Hey2 downregulated because the knockdown hindered the differentiation and maturation of neural cells. Our study showed that Mecp2 regulated the differentiation of nerve cells of zebrafish through Notch-Hey2 signaling pathways.
Mecp2;zebrafish;neurodevelopmental;Notch signaling pathway;neural cell differentiation
10.13560/j.cnki.biotech.bull.1985.2016.04.031
2015-09-17
国家自然科学基金项目(2011CB504700)
何丽番,女,硕士研究生,研究方向:分子信号转导调控;E-mail:helifan89@163.com
高海,博士,副教授,研究方向:蛋白功能及信号转导;E-mail:scaugh@163.com

