滇龙胆1-脱氧-D-木酮糖5-磷酸合酶基因的克隆与表达分析
张海晨李彩霞王元忠张晓东
(1. 玉溪师范学院资源环境学院,玉溪 653100;2. 云南省农业科学院药用植物研究所,昆明 650223)
滇龙胆1-脱氧-D-木酮糖5-磷酸合酶基因的克隆与表达分析
张海晨1李彩霞1王元忠2张晓东1
(1. 玉溪师范学院资源环境学院,玉溪 653100;2. 云南省农业科学院药用植物研究所,昆明 650223)
旨在克隆滇龙胆1-脱氧-D-木酮糖5-磷酸合酶基因GrDXS,并进行表达分析。以滇龙胆转录组为基础,采用RTPCR技术从滇龙胆幼叶克隆GrDXS基因,并进行原核表达和组织特异性表达分析。滇龙胆GrDXS基因(登录号:KJ624995)全长2 145 bp,编码714个氨基酸;GrDXS蛋白相对分子质量76.75 kD,pI为6.93;属于DXS家族成员,可能定位于叶绿体;主要由α-螺旋和无规则卷曲构成;具有DXS蛋白的4类保守结构域:焦磷酸硫胺素结合折叠域(IPR029061,69-425、366-555、87-268、315-407、407-558)、类转酮酶嘧啶结合结构域(IPR005475,394-559、394-555)、转酮酶C端/丙酮酸铁氧还蛋白氧化还原酶结构域II(IPR009014,568-704,572-704)、转酮酶C端结构域(IPR005476,573-696)和1个转酮酶结合位点(IPR020826,500-516);与长春花CrDXS蛋白亲缘关系最近;GrDXS基因在大肠杆菌中表达的重组蛋白相对分子质量约为100 kD,与预期蛋白大小一致;GrDXS基因主要在叶中表达。
滇龙胆;1-脱氧-D-木酮糖5-磷酸合酶;生物信息学;表达模式
滇龙胆Gentiana rigescens Franch. ex Hemsl.是云南特色药材,也是200多种中药的主要原料[1]。近年来,随着龙胆需求量逐年递增,导致其野生资源遭到大肆破坏[1]。为此,2013年云南省启动了龙胆草航天育种工程,其主要目标是培育高产、高抗、高龙胆苦苷含量、适合机械化种植和扩大种植范围的龙胆草新品种[2]。滇龙胆主要活性成分为龙胆苦苷,要从根本上解决龙胆药源问题和提高其龙胆苦苷含量,首先必须探明龙胆苦苷生物合成途径及其调控机理,为通过现代生物技术手段生产龙胆苦苷奠定基础。
龙胆苦苷属于裂环环烯醚萜类化合物。在植物中,裂环环烯醚萜类骨架部分主要是通过质体2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径合成的[3]。1-脱氧-D-木酮糖5-磷酸合酶(1-deoxy-D-xylulose 5-phosphate synthase,EC:4.1.3.37)是MEP途径中的第一个催化酶,在焦磷酸硫胺素的存在下,能够将丙酮酸与D-甘油醛3-磷酸缩合生成1-脱氧-D-木酮糖5-磷酸(DXP),同时释放二氧化碳,该反应依赖于Mg2+或Mn2+等二价阳离子[4-6]。研究表明DXS催化丙酮酸的脱羧速率能够被甘油醛3-磷酸所加速[7]。采用LC-MS-MS方法,通过检测DXP的产生而测定植物粗提取物中DXS酶活性的方法已被报道[8]。目前,1-脱氧-D-木酮糖5-磷酸合酶基因已从水稻[9]、玉米[10]、苜蓿[11]、云杉[12]、沉香[13]、熊胆草[14]、甜瓜[15]、印度人参[16]等多种植物中分离。DXS基因的表达具有组织特异性,并被生物和非生物因素诱导。在生物诱导剂(100 mg/mL酵母提取物)和非生物诱导剂(30 mmol/L Ag+)共同诱导36 h,丹参SmDXS基因在诱导后其表达量逐渐升高,在36 h时表达量达到最高[17]。在葡萄中,VvDXS基因与麝香葡萄香味相关联,其表达受染色质状态和不同发育时期的影响[18]。
在日本,龙胆是重要的鲜切花,其研究主要集中于花色改良方面[19,20]。在中国,龙胆是重要的大宗药材,其研究主要集中于种子萌发[21,22]、DNA条码[23]、育种[2]等方面,尚未对滇龙胆GrDXS基因进行研究。本研究根据滇龙胆转录组中GrDXS基因序列,设计一对特异性引物,通过RT-PCR技术从滇龙胆幼叶中扩增到GrDXS基因,并进行序列分析、原核表达和组织表达特异性分析,以期为滇龙胆GrDXS基因功能和龙胆苦苷生物合成途径的解析奠定基础。
1 材料与方法
1.1 材料
滇龙胆无菌组培苗和盆栽苗均采自于玉溪师范学院分子生物学实验室,由云南省农业科学院药用植物研究所金航研究员鉴定为滇龙胆Gentiana rigescens Franch. ex Hemsl.。基因克隆所用材料为滇龙胆无菌苗幼叶,基因组织特异性表达分析所用材料为盆栽3年生滇龙胆的根和叶,采样日期为2014年5月17日。
1.2 方法
1.2.1 叶片总RNA提取及GrDXS基因ORF的克隆 按照多糖植物组织提取试剂RNAiso(TaKaRa,大连)说明书提取滇龙胆幼叶总RNA;按照逆转录试剂盒(TaKaRa,大连)说明书合成cDNA。根据原核表达载体pGEX-4T-1多克隆酶切位点和滇龙胆转录组中GrDXS基因序列,设计一对特异引物 GrDXSBamHI-F:5'-GGATCCATGGCAGTTTC AGGATCTCTC-3'(下划线为BamH I酶切位点),GrDXSXhoI-R:5'-CTCGAGTTACTTAAGCTGAAGAG CTTCTTTAGG-3'(下划线为Xho I酶切位点,引物由上海捷瑞生物工程有限公司合成)。以cDNA为模板进行PCR扩增,反应体系为:PrimeSTAR Max Premix(2×)(TaKaRa,大连)25 μL,正反向引物(10 μmol/L)各1 μL,cDNA模板3 μL,加ddH2O补足50 μL。PCR反应条件为:98℃变性10 s,55.4℃退火15 s,72℃延伸10 s,30循环。PCR产物经1.0%琼脂糖凝胶电泳分离、割胶,使用胶回收试剂盒(Qiagen,德国)对目的片段进行回收;使用dATP(TaKaRa,大连)和Taq DNA Polymerase(天根,北京)进行加尾,72℃反应30 min;加尾产物经1.0%琼脂糖凝胶电泳分离、割胶,使用胶回收试剂盒(Qiagen,德国)对目的片段进行回收,然后将其连接到pMD19-T载体(TaKaRa,大连)。转化大肠杆菌DH5α(TaKaRa,大连)后进行蓝白筛选,挑取12个白斑摇菌;使用碱裂解法提取质粒,经酶切检测正确后选取3个克隆进行测序(上海生工,上海),获得重组质粒pMD19-GrDXS。
1.2.2 GrDXS基因原核表达载体构建 对质粒pGEX-4T-1(Amersham,瑞典)和pMD19-GrDXS分别进行BamH I(TaKaRa,大连)和Xho I(TaKaRa,大连)双酶切,回收载体片段和目的基因,按摩尔比1∶4进行过夜连接,然后转化大肠杆菌DH5α感受态细胞(TaKaRa,大连),涂布于添加100 mg/L氨苄青霉素(TaKaRa,大连)+ IPTG(TaKaRa,大连)+ X-gal(TaKaRa,大连)的LB固体平板,12 h后挑取克隆;摇菌后,提取质粒,经酶切检测正确后,获得原核表达载体pGEX-4T-1-GrDXS。
1.2.3 GrDXS基因的生物信息学分析 使用NCBI网站BLAST程序进行序列比对,应用Genetyx 6.1.8进行翻译,使用DNAMAN 7进行多序列比对;使用Clustal X2.1进行比对,然后使用MEGA6.0软件内置的NJ法构建系统进化树,设置Bootstrap=1 000;利用在线数据库(http://molbiol. edu.ru/eng/scripts/01_11. html)进行稀有密码子分析。使用ChloroP服务器v1.1进行叶绿体转运肽预测;Interpro软件进行保守结构域预测;ProtScale软件进行疏水性分析;PredictProtein对二级结构进行预测;Swiss-Model自动模式对三级结构进行预测;利用ExPASy中的TMHMM工具预测蛋白的跨膜螺旋区;利用在线工具WOLF PSORT预测蛋白的亚细胞定位情况。
1.2.4 GrDXS基因的原核表达 使用热激法将重组质粒pGEX-4T-1-GrDXS转化大肠杆菌Rosetta(DE3)感受态细胞(全式金,北京),挑取单菌落接种于3 mL含100 mg/L氨苄青霉素的LB液体培养基中,37℃、250 r/min培养12 h。然后以1∶100比例接种到无抗生素的LB液体培养基中,37℃、250 r/min培养3 h(OD600≈0.8),在37℃、终浓度为1 mmol/L IPTG诱导下进行表达,同时以相同条件的pGEX-4T-1转化菌作对照;分别诱导0、2、4和6 h后,收集菌液2 mL。4℃、10 000 r/min离心1 min集菌,弃上清,加入100 μL ddH2O、25 μL的5×SDSPAGE上样缓冲液,震荡悬菌,沸水煮5 min。4℃、13 000 r/min离心5 min。取20 μL上清上样,进行SDS-PAGE(5%浓缩胶和12%分离胶)电泳检测。4℃、6 000 r/min离心10 min,将诱导表达6 h的菌液50 mL进行收集,使用1×PBS对菌体进行洗涤1次。然后加入5 mL 1×PBS进行悬菌,使用JY92-IIDN型超声细胞破碎仪(新芝,宁波)进行细胞破碎。条件为:冰浴,超声时间30 min,工作3 s,间隔3 s,能量30%。4℃、18 000 r/min离心30 min,分离上清和沉淀。使用SDS-PAGE检测目的蛋白。
1.2.5 GrDXS基因的实时定量分析 分别取3年生滇龙胆的根和叶,提取总RNA,使用DNase I处理除去基因组DNA。使用反转录试剂盒(TaKaRa,大连)合成第一链cDNA。以转录组中GrGAPDH基因(GenBank登录号KM061807)作为内参设计引物GrGAPDH-F(5'-AAGGGAGGTGCGAAGAAAGT-3')和GrGAPDH-R(5'-AAGGAGCAAGACAGTTGGTTGT-3'),PCR反应条件为:95℃ 3 min,95℃ 15 s,60℃ 31 s。根据GrDXS基因的cDNA序列设计特异性引物GrDXS-F(5'-TGATAGTGATGGCACCTTCTGA-3')和GrDXS-R(5'-TTCTTCCCTTACCAACCTCAAA-3')。使用SuperReal PreMix Plus试剂盒(天根,北京)进行qPCR,PCR反应条件为:95℃ 3 min,95℃ 15 s,60℃ 31 s。每个反应重复3次。反应在ABI7000荧光定量PCR仪(Applied Biosystems,美国)上进行扩增,扩增曲线、熔解曲线、标准曲线由定量PCR仪软件自动生成。使用内参基因GrGAPDH表达校准后,计算根茎叶中GrDXS基因相对表达量。采用比较Ct值的“2-△△Ct”的方法进行定量数据的分析处理。
2 结果
2.1 滇龙胆GrDXS基因序列的克隆
以滇龙胆幼叶cDNA为模板,使用特异性引物扩增出约2 000 bp的片段(图1)。通过TA克隆获得重组质粒pMD19-GrDXS,酶切检测结果表明双酶切获得的两片段大小之和等于单酶切片段大小,与预期结果相符。
2.2 GrDXS基因的生物信息学分析
利用Genetyx和DNAMAN软件对GrDXS基因cDNA序列进行分析,结果显示GrDXS基因ORF全长2 142 bp,编码713个氨基酸。值得注意的是,本研究中克隆到的GrDXS基因与转录组拼接的GrDXS核苷酸序列不完全一致,二者相似性为99.53%。将该序列上传至GenBank数据库,获得登录号KM974886。

图1 GrDXS基因的PCR扩增
使用GenBank数据库中的BLASTp程序对GrDXS蛋白进行比对分析,结果表明滇龙胆GrDXS与长春花CrDXS蛋白序列相似性最高(87.96%),与高良姜(Alpinia officinarum)AoDXS(AEK69519.1)蛋白相似性稍低(74.40%)。利用DNAMAN 7将GrDXS蛋白序列与从NCBI中挑选的相似性较高的部分序列进行多序列比对分析,结果(图2)表明GrDXS蛋白与已知蛋白相似性很高。利用Mega 6.0将GrDXS蛋白序列与已发表文献中相似性较高的序列进行系统发育分析,结果(图3)显示,编码滇龙胆GrDXS蛋白与长春花CrDXS2a处于同一进化枝,表明二者亲缘关系较近。
使用ExPASy ProtParam tool对GrDXS蛋白进行理化性质分析,结果表明GrDXS蛋白单体相对分子质量为76.75 kD,pI为6.93;带正电氨基酸残基(Arg+Lys)为74,带负电氨基酸残基(Asp+Glu)为76。不稳定指数为35.27,属于稳定蛋白;脂肪指数为90.90,总平均疏水性(GRAVY)为-0.072,为亲水蛋白。GrDXS蛋白含有20种基本氨基酸,其中丙氨酸含量最高,为10.40%;其次是亮氨酸和甘氨酸,分别为9.70%和9.40%;色氨酸含量最低,为0.3%。
利用SSpro方法对GrDXS蛋白进行二级结构分析,结果表明该蛋白二级结构中α-螺旋(H)占34.45%,无规则卷曲(C)占47.06%,延伸带(E)占18.49%。利用Swiss-Model Workspace使用自动模式预测GrDXS蛋白的三级结构,结果如图4所示,该模型是以耐辐射球菌1-脱氧木酮糖-5-磷酸合酶[2o1x.1]为模板,在第69-705位氨基酸处建模,序列相似度为41.50%,其二聚体配基为Mg2+或焦磷酸硫胺素。使用InterPro在线工具对GrDXS蛋白的保守结构域进行分析,结果表明GrDXS蛋白包含4类保守结构域:焦磷酸硫胺素结合折叠域(IPR029061,69-425、366-555、87-268、315-407、407-558)、类转酮酶嘧啶结合结构域(IPR005475,394-559、394-555)、转酮酶C端/丙酮酸铁氧还蛋白氧化还原酶结构域II(IPR009014,568-704,572-704)、转酮酶C端结构域(IPR005476,573-696)和1个转酮酶结合位点(IPR020826,500-516)。
利用SignalP 4.1服务器分析GrDXS蛋白,未发现信号肽,表明该蛋白为非分泌型蛋白。利用TMHMM工具预测GrDXS蛋白的跨膜螺旋区,结果表明GrDXS蛋白不含跨膜螺旋区域,为非膜蛋白。使用ChloroP 1.1 Server对GrDXS蛋白的叶绿体转运肽进行预测,结果表明GrDXS蛋白含35氨基酸组成的叶绿体转运肽,因此该蛋白定位于叶绿体。
对GrDXS基因进行稀有密码子分析,结果表明GrDXS基因中稀有密码子仅占0.84%,且无二联或三联稀有密码子连续出现的情况,因此可选用大肠杆菌表达菌BL21或Rosetta(DE3)进行原核表达。
2.3 GrDXS基因原核表达载体的构建
使用BamH I和Xho I双酶切质粒pGEX-4T-1-GrDXS,可获得目的片段和载体(图5),表明GrDXS基因已成功插入载体pGEX-4T-1中。
2.4 GrDXS基因的原核表达
将重组质粒pGEX-4T-1-GrDXS转化大肠杆菌Rosetta(DE3)后,使用IPTG进行诱导表达。在37℃、终浓度为1 mmol/L IPTG下,分别诱导表达0、2、4和6 h后,提取细菌总蛋白进行SDS-PAGE分析。结果表明,与对照相比,pGEX-4T-1-GrDXS转化菌经IPTG诱导后,在相对分子质量约100 kD(含GST蛋白26 kD)处有1条蛋白条带,并且随诱导时间增加其蛋白含量逐渐增加,表明重组质粒pGEX-4T-1-GrDXS在大肠杆菌Rosetta(DE3)中成功诱导表达了GrDXS蛋白。当温度为37℃、诱导时间为6 h时,蛋白表达量最大(图6)。为检测GrDXS融合蛋白的存在形式,对诱导表达6 h的菌体进行超声破碎,然后使用SDS-PAGE检测,结果(图7)表明GrDXS蛋白全部以包涵体形式存在。

图2 GrDXS蛋白与其它植物DXS蛋白的多序列比对结果
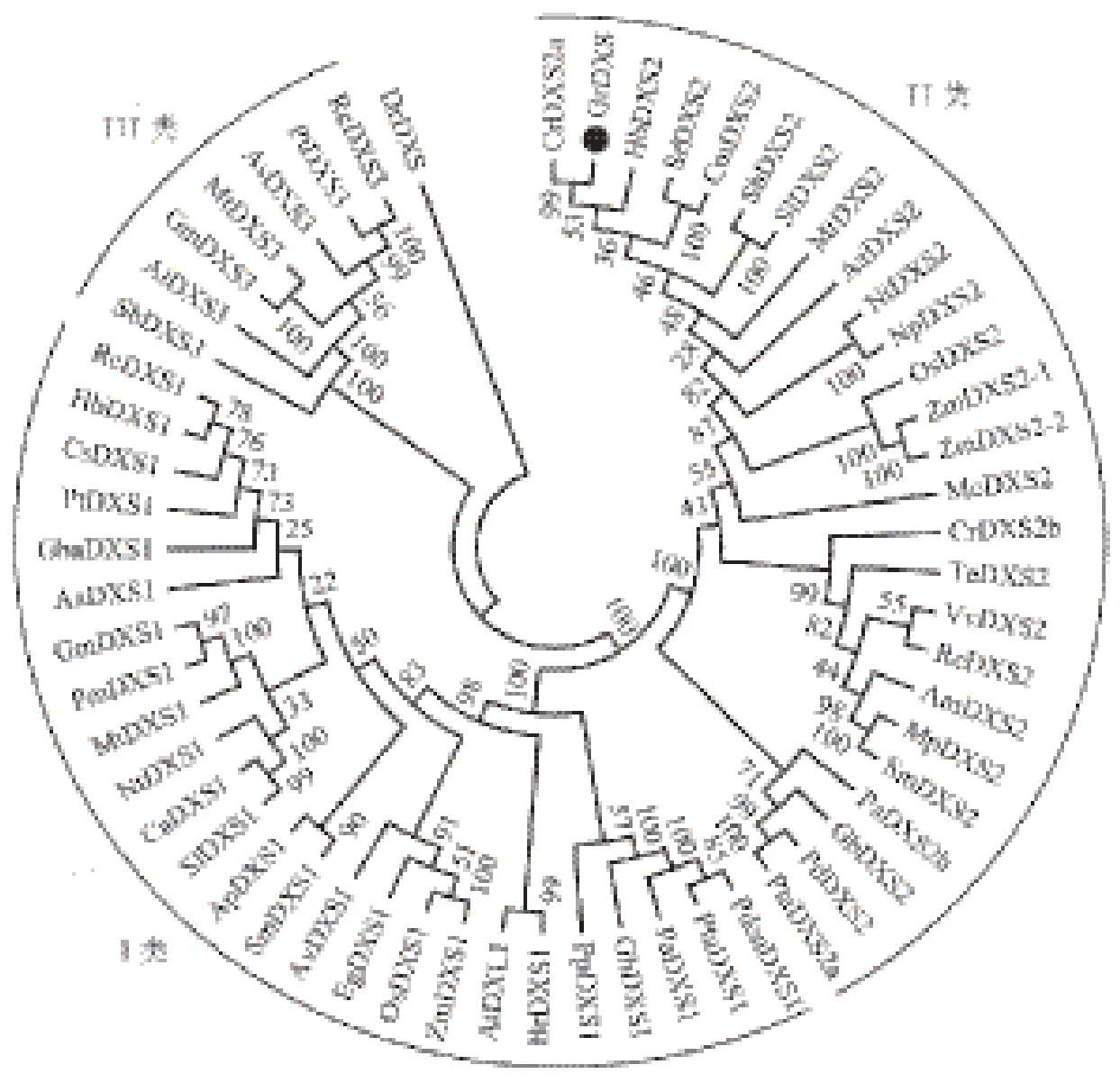
图3 GrDXS蛋白与植物中其它DXS蛋白的系统发育分析
2.5 GrDXS基因的组织表达分析
取3年生滇龙胆的根和叶,通过qRT-PCR分析GrDXS基因在不同组织中的表达情况。结果(图8)表明,GrDXS基因在叶中表达量远高于其在根中表达量。
3 讨论
代谢途径中终产物的量取决于该途径的流量,而流量本身又取决于转换相应中间产物的每个酶反应步骤的速率[8]。鉴定对代谢通量起重要作用的酶,将有助于对萜类化合物生物合成调控机制的阐明[8]。滇龙胆的主要药效成分龙胆苦苷属于裂环环烯醚萜类,主要通过MEP途径合成。在植物中,1-脱氧木酮糖5-磷酸合酶被认为是MEP途径的一个限速酶[14,24]。因此,滇龙胆中GrDXS基因的表达情况直接或间接影响龙胆苦苷的生物合成。本研究对滇龙胆GrDXS基因进行克隆和生物信息学分析,结果表明所克隆的GrDXS基因ORF全长2 142 bp,编码713个氨基酸,pI为6.93,这分别与印度人参WSDXS蛋白和牛巴贝斯虫BbDXS蛋白类似[16,25];GrDXS蛋白具有DXS蛋白中4类保守结构域:焦磷酸硫胺素结合折叠域、类转酮酶嘧啶结合结构域、转酮酶C端/丙酮酸铁氧还蛋白氧化还原酶结构域II、转酮酶C端结构域,与长春花CrDXS蛋白序列相似性高达87.96%,因此所克隆基因为GrDXS基因。
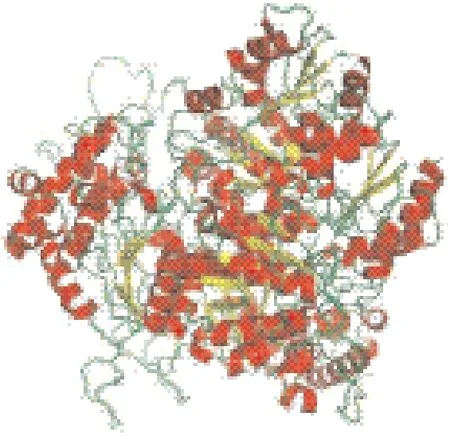
图4 GrDXS蛋白二聚体的三维结构预测

图5 质粒pGEX-4T-1-GrDXS酶切检测
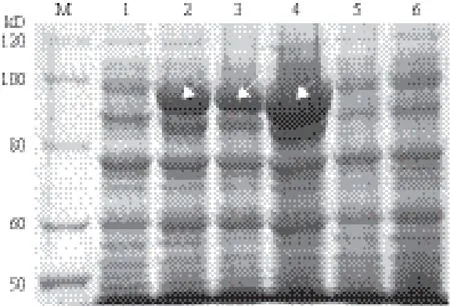
图6 37℃下诱导时间对GrDXS蛋白表达量的影响

图7 GrDXS融合蛋白存在形式的检测

图8 GrDXS基因在根和叶中的相对表达
在植物中,DXS基因是以家族形式存在的[26]。根据系统发育分析、生化特征和基因表达特征,DXS蛋白可分为3类:第I类是在绿色组织中组成型表达,能够为持家代谢物或光合作用代谢物如类胡萝卜素和叶绿素的合成提供前体;第II类是在特定组织中表达,如与菌根共生累积前胡萝卜素的根或小蠹或真菌感染针叶松树脂道表皮细胞;第III类是最近几年才提出的,其功能还未被最终确定[15]。在本研究中,系统发育分析结果表明GrDXS蛋白属于第II类DXS蛋白,由于其又包含35个氨基酸的叶绿体转运肽,推测其在叶绿体中参与MEP途径。
DXS基因的表达具有组织和时空特异性,并与萜类的生物合成相关联。在熊胆草中,CbDXS基因的表达水平与其药效成分二萜苦蒿素的浓度高度相关[14],而在拟南芥中AtDXS能够通过MEP途径控制二氧化碳的代谢流量[6]。在烟草中,过表达SlDXS和香叶基焦磷酸合成酶基因NtGPPS2导致二萜产量加倍[27]。在滇龙胆中,龙胆苦苷是在植物绿色组织(叶和茎)合成,然后通过茎转运到根中进行储藏的[28]。对滇龙胆GrDXS基因组织表达特异性检测结果表明,GrDXS基因在叶中的表达量远远高于根,这与上述报道相一致。
本研究为滇龙胆GrDXS基因功能的解析奠定基础。下一步将对GrDXS蛋白进行纯化和多克隆抗体制备、通过过表达或互补实验研究GrDXS基因的功能,为龙胆苦苷生物合成途径的阐明奠定基础。
4 结论
本研究成功克隆滇龙胆GrDXS基因,并可表达出gst-DXS蛋白,且该基因在叶中表达量远远高于根中。
[1] 金航, 张霁, 张金渝, 等. 滇龙胆[M]. 昆明:云南科技出版社, 2013:1-5.
[2] Gu Y. The gentian returned after travelling by spacecraft Shenzhou-10 which suggested that space breeding project has been started in Yunnan Province[DB/OL]. Available from:http://www. chinane ws. com/gn/2013/07-12/5037538. shtml, 2013-7-12.
[3] Hua W, Zheng P, He Y, et al. An insight into the genes involved in secoiridoid biosynthesis in Gentiana macrophylla by RNA-seq[J]. Mol Biol Rep, 2014, 41(7):4817-4825.
[4] Lois LM, Campos N, Putra SR, et al. Cloning and characterization of a gene from Escherichia coli encoding a transketolase-like enzyme that catalyzes the synthesis of D-1-deoxyxylulose 5-phosphate, a common precursor for isoprenoid, thiamin, and pyridoxol biosynthesis[J]. Proc Natl Acad Sci USA, 1998, 95(5):2105-2110.
[5] Xiang S, Usunow G, Lange G, et al. Crystal structure of 1-deoxy-D-xylulose 5-phosphate synthase, a crucial enzyme for isoprenoids biosynthesis[J]. J Biol Chem, 2007, 282(4):2676-2682.
[6] Wright LP, Rohwer JM, Ghirardo A, et al. Deoxyxylulose 5-phosphate synthase controls flux through the methylerythritol 4-phosphate pathway in Arabidopsis[J]. Plant Physiol, 2014, 165(4):1488-1504.
[7] Patel H, Nemeria NS, Brammer LA, et al. Observation of thiaminbound intermediates and microscopic rate constants for their interconversion on 1-deoxy-D-xylulose 5-phosphate synthase:600-fold rate acceleration of pyruvate decarboxylation by D-glyceraldehyde-3-phosphate[J]. J Am Chem Soc, 2012, 134(44):18374-18379.[8] Rodríguez-Concepción M. Plant isoprenoids[M]//Wright L, Phillips M. Measuring the activity of 1-deoxy-D-xylulose 5-phosphate synthase, the first enzyme in the MEP pathway, in plant extracts. New York:Springer, 2014:9-20.
[9] Kim BR, Kim SU, Chang YJ. Differential expression of three 1-deoxy-D-xylulose-5-phosphate synthase genes in rice[J]. Biotechnol Lett, 2005, 27(14):997-1001.
[10] Cordoba E, Porta H, Arroyo A, et al. Functional characterization of the three genes encoding 1-deoxy-D-xylulose 5-phosphate synthase in maize[J]. J Exp Bot, 2011, 62(6):2023-2038.
[11] Floβ DS, Hause B, Lange PR, et al. Knock-down of the MEP pathway isogene 1-deoxy-d-xylulose 5-phosphate synthase 2 inhibits formation of arbuscular mycorrhiza-induced apocarotenoids, and abolishes normal expression of mycorrhiza-specific plant marker genes[J]. Plant J, 2008, 56(1):86-100.
[12] Phillips M, Walter M, Ralph S, et al. Functional identification and differential expression of 1-deoxy-d-xylulose 5-phosphate synthase in induced terpenoid resin formation of Norway spruce(Picea abies)[J]. Plant Mol Biol, 2007, 65(3):243-257.
[13] Xu Y, Liu J, Liang L, et al. Molecular cloning and characterization of three cDNAs encoding 1-deoxy-d-xylulose-5-phosphate synthase in Aquilaria sinensis(Lour. )Gilg[J]. Plant Physiol Biochem, 2014, 82:133-141.
[14] Sun R, Liu S, Gao JL, et al. Cloning and expression analysis of 1-deoxy-D-xylulose-5-phosphate synthase gene from the medicinal plant Conyza blinii H. Lév[J]. Turk J Biol, 2014, 38(5):664-670.
[15] Saladie M, Wright LP, Garcia-Mas J, et al. The 2-C-methylerythritol 4-phosphate pathway in melon is regulated by specialized isoforms for the first and last steps[J]. J Exp Bot, 2014, 65(17):5077-5092.
[16] Gupta P, Agarwal AV, Akhtar N, et al. Cloning and characterization of 2-C-methyl-D-erythritol-4-phosphate pathway genes for isoprenoid biosynthesis from Indian ginseng, Withania somnifera[J]. Protoplasma, 2013, 250(1):285-295.
[17] Gao W, Sun HX, Xiao H, et al. Combining metabolomics and transcriptomics to characterize tanshinone biosynthesis in Salvia miltiorrhiza[J]. BMC Genomics, 2014, 15:73.
[18] Battilana J, Emanuelli F, Lorenzi S, et al. IX international symposium on grapevine physiology & biotechnology[C]. Chile:La Serena, 2013.
[19] Nakatsuka T, Yamada E, Saito M, et al. Heterologous expression of gentian MYB1R transcription factors suppresses anthocyanin pigmentation in tobacco flowers[J]. Plant Cell Rep, 2013, 32(12):1925-1937.
[20] Nakatsuka T, Saito M, Yamada E, et al. Isolation and characterization of GtMYBP3 and GtMYBP4, orthologues of R2R3-MYB transcription factors that regulate early flavonoid biosynthesis, in gentian flowers[J]. J Exp Bot, 2012, 63(18):6505-6517.
[21] Zhang J, Zhang J, Wang Y, et al. Effects of tree species on seed germination and seedlings growth of Chinese medicinal herb Gentiana rigescens[J]. Allelopathy J, 2012, 29(2):325-332.
[22] Zhang J, Wang Y, Yang T, et al. Use of gibberellic acid to overcome the allelopathic effect of a range of species on the germination of seeds of Gentiana rigescens, a medicinal herb[J]. Seed Sci Technol, 2012, 40(3):443-447.
[23] Wong KL, But PP, HShaw PC. Evaluation of seven DNA barcodes for differentiating closely related medicinal Gentiana species and their adulterants[J]. Chin Med, 2013, 8(1):16.
[24] Estévez JM, Cantero A, Reindl A, et al. 1-Deoxy-D-xylulose-5-phosphate synthase, a limiting enzyme for plastidic isoprenoid biosynthesis in plants[J]. J Biol Chem, 2001, 276(25):22901-22909.
[25] Wang J, Shen YM, Li B, et al. Characterization of a functionally active recombinant 1-deoxy-D-xylulose-5-phosphate synthase from Babesia bovis[J]. J Vet Med Sci, 2014, 76(7):1021-1027.
[26] Peng G, Wang C, Song S, et al. The role of 1-deoxy-d-xylulose-5-phosphate synthase and phytoene synthase gene family in citrus carotenoid accumulation[J]. Plant Physiol Biochem, 2013, 71:67-76.
[27] Brückner K, Tissier A. High-level diterpene production by transient expression in Nicotiana benthamiana[J]. Plant Methods, 2013, 9(1):46.
[28] 朱宏涛, 郑传伟, 赵平, 等. 野生坚龙胆及其组培苗中龙胆苦苷的含量分析[J]. 天然产物研究与开发, 2011, 23(3):482-485.
(责任编辑 马鑫)
Cloning and Expression Analysis of Gene Encoding 1-Deoxy-D-xylulose 5-Phosphate Synthase in Gentiana rigescens
ZHANG Hai-chen1LI Cai-xia1WANG Yuan-zhong2ZHANG Xiao-dong1
(1. College of Resources and Environment,Yuxi Normal University,Yuxi 653100;2. Institute of Medicinal Plants,Yunnan Academy of Agricultural Sciences,Kunming 650223)
The aims of this study are to clone the gene GrDXS encoding 1-deoxy-D-xylulose 5-phosphate synthase from Gentiana rigescens,and to analyze its expression. Based on the transcriptome of G. rigescens,a GrDXS gene was cloned from young leaves of G. rigescens by RT-PCR technology,and its prokaryotic and tissue-specific expression were also performed. The GrDXS gene(GenBank accession number:KJ624995)had a length of 2 145 bp coding for 714 amino acids,and the relative molecular weight of GrDXS protein was 76.75 kD with its pI of 6.93. GrDXS protein belonged to the member of DXS superfamily,and may localize in chloroplast,GrDXS protein composed of mainly random coil(47.06%)and α-helix(34.45%). Four kinds of conserved domains: Thiamin diphosphate-binding fold(IPR029061,69-425,366-555,87-268,315-407,407-558),Transketolase-like,pyrimidine-binding domain(IPR005475,394-559,394-555),Transketolase C-terminal/Pyruvate-ferredoxin oxidoreductase,domain II(IPR009014,568-704,572-704),and Transketolase binding site(IPR020826,500-516),were all existing in GrDXS protein. GrDXS protein was the closest with CrDXS in Catharanthus roseus. The recombinant protein of GrDXS gene in Escherichia coli was approximately 100.00 kD(containing GST tag protein 26 kD),which was consistent with the anticipated size. GrDXS gene was primarily expressed in leaf.
Gentiana rigescens;1-deoxy-D-xylulose 5-phosphate synthase;bioinformatics;expression pattern
10.13560/j.cnki.biotech.bull.1985.2016.04.017
2015-05-16
云南省大学生创新训练项目(201411390001)
张海晨,女,研究方向:植物分子生物学;E-mail:1285290757@qq.com
张晓东,男,博士,副教授,研究方向:植物代谢基因工程;E-mail:zxd95@126.com

