FGFR-1、cyclinD1在乳腺癌中的表达及其临床意义
邓敏 解瑞飞 王惠.杭州市富阳区第一人民医院病理科,浙江杭州3400;.杭州市肿瘤医院信息科,浙江杭州3000
FGFR-1、cyclinD1在乳腺癌中的表达及其临床意义
邓敏1解瑞飞2王惠1
1.杭州市富阳区第一人民医院病理科,浙江杭州311400;2.杭州市肿瘤医院信息科,浙江杭州310002
[摘要]目的探讨成纤维生长因子受体(fibroblast growth factor receptor,FGFR-1)及细胞周期蛋白D1(cyclinD1)在乳腺癌组织中的表达及其临床意义。方法应用原位杂交及免疫组织化学S-P法检测乳腺癌、乳腺纤维腺瘤和正常乳腺组织中FGFR-1、cyclinD1 mRNA及蛋白水平的表达。结果在乳腺癌中,FGFR-1蛋白和FGFR-1基因的阳性率分别为70.0%(21/30)、70.0%(21/30),cyclinD1蛋白和cyclinD1基因的阳性率分别为66.7%(20/30)、76.7% (23/30),明显高于纤维腺瘤与正常乳腺组织(P<0.05),FGFR-1表达与cyclinD1表达一致。结论FGFR-1的过表达在人类乳腺癌的发生、发展中起重要作用,其机制可能通过上调cyclinD1的表达发挥作用,FGFR-1、cyclinD1的过度表达可作为判断乳腺癌预后的重要指标。
[关键词]FGFR-1;cyclin D1;乳腺癌;免疫组化;原位杂交
[Key woeds]FGFR-1;Cyclin D1;Breast carcinoma;Immunohistochemistry;In situ hybridization
成纤维细胞生长因子受体(FGFR)是由糖蛋白的胞外免疫球蛋白(Ig)样结构域、疏水跨膜区和含有酪氨酸激酶结构域的细胞质部分组成。研究发现FGFR-1、FGFR-2基因表达于许多肿瘤细胞,与患者的预后密切相关。在甲状腺癌、结直肠癌、胃癌等肿瘤中均可见FGFR-1的高表达[1,2]。
细胞周期蛋白(cyclin)对细胞周期进行正调控,与细胞生长、发育及肿瘤的发生关系极其密切。研究发现:在原发性乳腺肿瘤中,cyclinD1和FGFR-1的共同扩增与患者存活显著减少相关,表明这两种蛋白之间存在相互作用[3,4]。然而目前FGFR-1在乳腺癌中的表达及其高表达是如何促进肿瘤细胞增殖、与cyclinD1的关系如何,国内尚无报道。本文采用原位杂交及免疫组织化学技术,对30例乳腺癌组织中cyclinD1和FGFR-1的mRNA及蛋白表达进行研究。现报道如下。
1 资料与方法
1.1一般资料
收集我院2007年3月~2014年8月手术切除的乳腺纤维腺瘤患者15例、乳腺癌患者30例。所有标本术前均未进行放化疗,术后病理诊断为乳腺癌、纤维腺瘤。另取15例癌旁正常乳腺组织作对照。患者年龄35~63岁,平均(46.0±3.2)岁,乳腺癌组伴有淋巴结转移18例,无淋巴结转移者12例。30例乳腺癌标本中,获得满5年随访者24例,其中已死亡病例6例,尚生存病例18例。
1.2实验仪器和试剂
(1)主要仪器:莱卡DM-3000显微镜、莱卡切片机RM2235、莱卡脱水机ASP300S等。
(2)主要试剂:FGFR-1、cyclinD1免疫组化和mRNA原位杂交试剂盒,均购自武汉博士德。
1.3方法
分别采用免疫组化和原位杂交法检测FGFR-1、cyclinD1蛋白和mRNA的表达,免疫组化及原位杂交染色具体操作方法参照文献[5,6]并严格按照试剂盒说明进行。用己知阳性片作阳性对照,用磷酸盐缓冲液分别代替一抗作阴性对照。
1.4结果判断
FGFR-1、cyclinD1 mRNA阳性表达定位于细胞膜或细胞质,cyclinD1免疫组化阳性表达定位于细胞核,综合染色强度和阳性肿瘤细胞的百分比进行分级[5]。将染色强度分为:无着色为0分,浅黄色为1分,黄色为2分,棕黄色为3分。将阳性肿瘤细胞的百分比分为:<10%为0分,10%~50%为1分,51%~75%为2分,>75%为3分。两项相加后分阴性(-)和阳性(+):0~1分为(-),2分以上为(+)。
1.5统计学分析
采用SPSS19.0统计学分析软件,计数资料采用χ2检验法和Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1cyclin D1、FGFR-1 mRNA在各组中的表达
2.1.1cyclin D1在各组中的表达cyclin D1 mRNA 在30例乳腺癌中有23例呈阳性表达(图1),正常对照组、纤维腺瘤组、乳腺癌组逐步增高,阳性率分别为20.0%(3/15)、33.3%(5/15)、76.7%(23/30),纤维腺瘤组与对照组差异无统计学意义(P>0.05);乳腺癌组与纤维腺瘤组及对照组之间,差异均有统计学意义(P<0.05)(表1)。
2.1.2FGFR-1 mRNA在各组中的表达FGFR-1 mRNA在30例乳腺癌中有21例呈阳性表达(图2),正常对照组、纤维腺瘤组、乳腺癌组逐步增高,阳性率分别为13.3%(2/15)、20.0%(3/15)、70.0%(21/30),纤维腺瘤组与对照组差异无统计学意义(P>0.05);乳腺癌组与纤维腺瘤组及对照组之间,差异均有统计学意义(P< 0.05)(表1)。
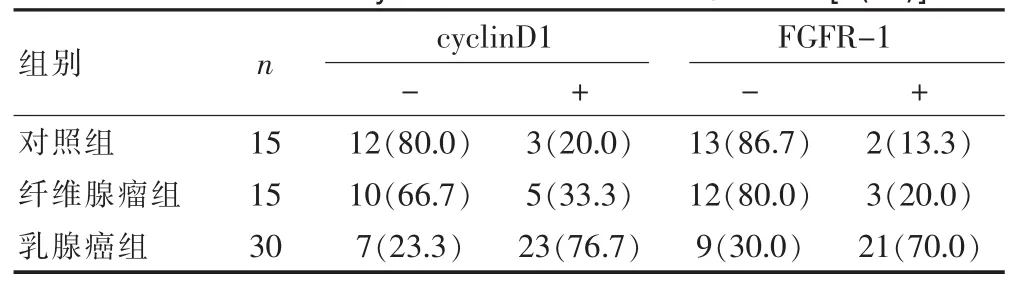
表1 FGFR-1和cyclinD1 mRNA的各组中的表达[n(%)]
2.2cyclin D1、FGFR-1蛋白在各组中的表达
2.2.1cyclin D1蛋白在各组中的表达cyclin D1蛋白在30例乳腺癌中有20例呈阳性表达(图3),正常对照组、纤维腺瘤组、乳腺癌组逐步增高,阳性率分别为26.7%(4/15)、33.3%(5/15)、66.7%(20/30),纤维腺瘤组与对照组差异无统计学意义(P>0.05);乳腺癌组与纤维腺瘤组及对照组之间,差异有统计学意义(P<0.05)(表2)。
2.2.2FGFR-1蛋白在各组中的表达FGFR-1蛋白在30例乳腺癌中有21例呈阳性表达(图4),正常对照组、纤维腺瘤组、乳腺癌组逐步增高,阳性率分别为6.7%(1/15)、26.7%(4/15)、70.0%(21/30),纤维腺瘤组与对照组差异无统计学意义(P>0.05);乳腺癌组与纤维腺瘤组及对照组之间,差异有统计学意义(P<0.05)(见表2)。
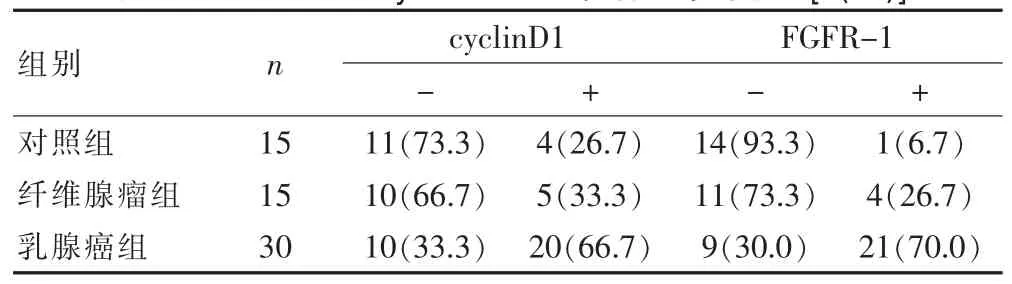
表2 FGFR-1和cyclinD1蛋白在各组中的表达[n(%)]
3 讨论
乳腺癌在染色体8p11-8p12和11q12-11q14的共扩增时常发生,表明在肿瘤形成过程中这些区域的基因之间可能存在合作。FGFR-1所在的染色体区域8p11.2,在肾癌、肺癌、前列腺癌中均扩增[7]。多项研究已经证实FGFR-1在乳腺癌中扩增(8p11.2~p12扩增)[8,9],FGFR-1和FGFR-2均为受体型酪氨酸激酶,主要分布于细胞膜表面。在细胞表面酪氨酸激酶受体呈单二聚体形式,在受体内的蛋白具有酪氨酸激酶活性。当FGFR与特异的酪氨酸激酶受体结合后,会导致形成稳定的二聚体,随后其下游信号通路的受体自身磷酸化和活化,导致细胞增殖调节发生紊乱,激活细胞内多种信号通路,从而导致癌的发生[10],与本研究一致,乳腺癌组织中FGFR-1蛋白的表达明显增高[11],显著高于正常乳腺组织和良性乳腺腺瘤组织,差异具有统计学意义(P<0.05)。
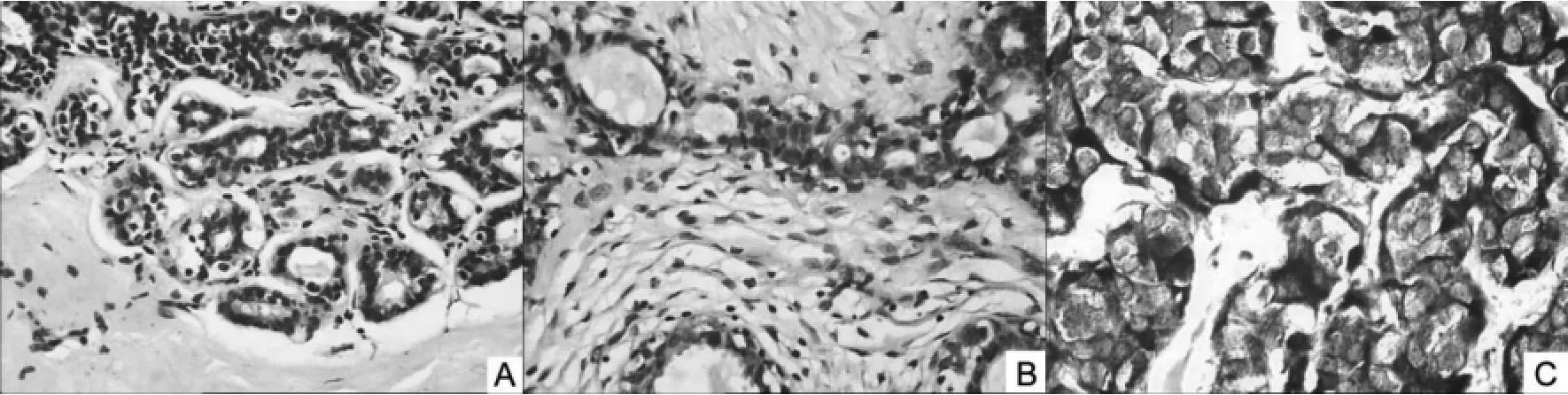
图1 (10x20)cyclin D1 mRNA在各组中的表达(A:对照组;B:纤维腺瘤组;C:乳腺癌组)
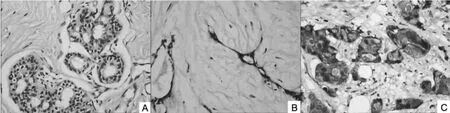
图2 (10x20)FGFR-1 mRNA在各组中的表达(A:对照组;B:纤维腺瘤组;C:乳腺癌组)
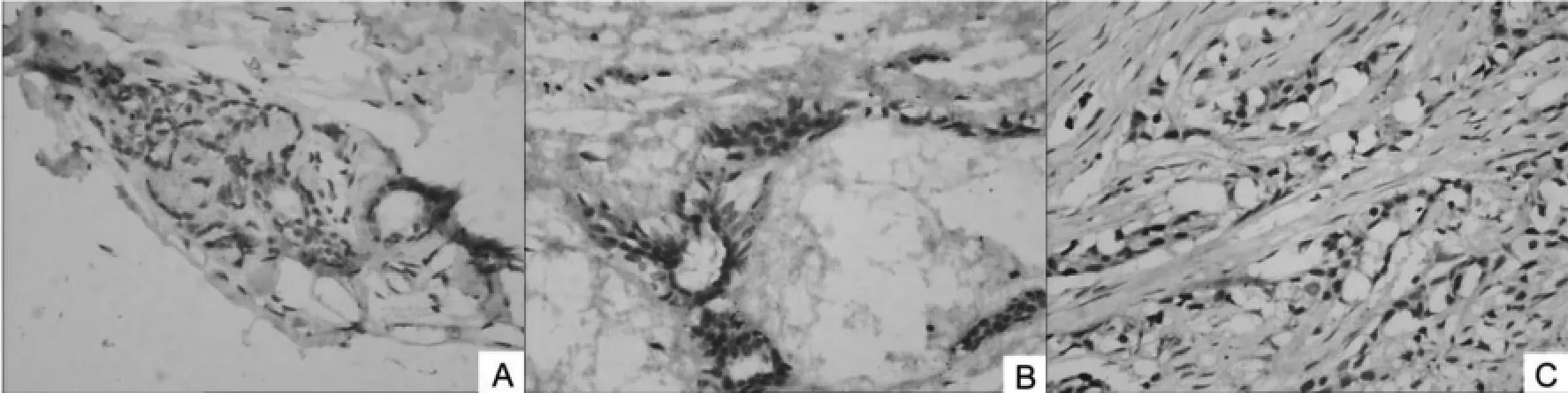
图3 (10x20)cyclin D1蛋白在各组中的表达(A:对照组;B:纤维腺瘤组;C:乳腺癌组)
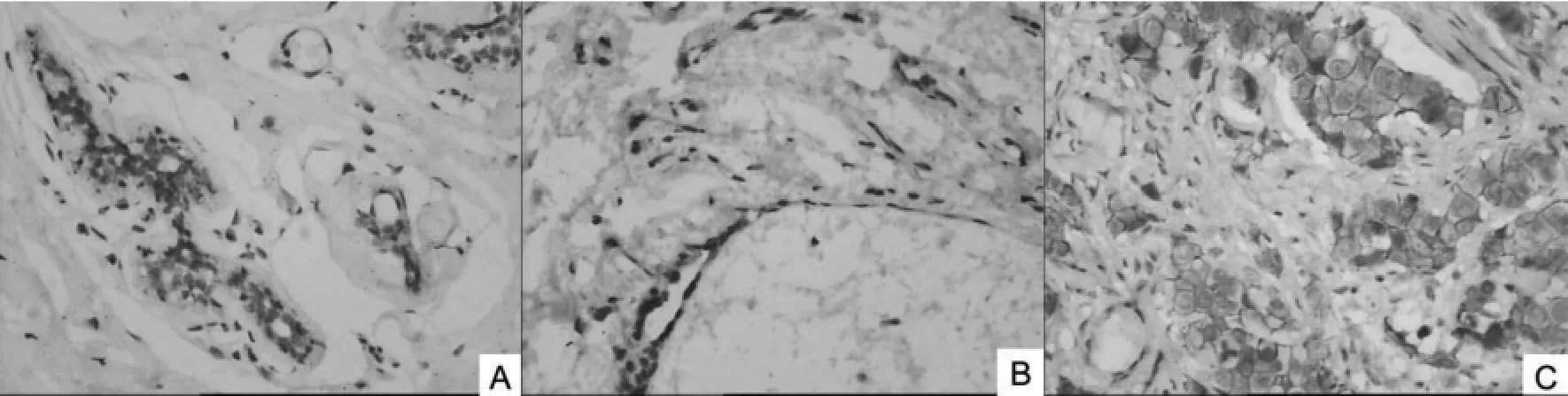
图4 (10x20)FGFR-1蛋白在各组中的表达(A:对照组;B:纤维腺瘤组;C:乳腺癌组)
cyclinD1又名CCND1,定位于11q13区,即原癌基因,根据大量研究结果显示:多种人类肿瘤存在11q13区扩增现象[12],而cyclinD1位于该区中间部位。cyclin D1转基因鼠引起乳腺增生和乳腺上皮肿瘤,乳腺癌组织中cyclin D1的高表达将使肿瘤细胞增殖,从而使得肿瘤持续生长[13]。本研究发现乳腺癌组织中cyclin D1蛋白的表达明显增高,显著高于正常乳腺组织和良性乳腺腺瘤组织,差异具有统计学意义(P<0.05)。Etsu等[14]体外实验研究中发现:FGFR-1表达增加通过cyclin D1过表达激活pRB/E2F通路而参与乳腺癌的发生,首次提出cyclin D1/pRB/E2F通路参与调节成纤维生长因子受体的表达。有学者指出cyclin D/cdk4复合物可使FGFR的795号丝氨酸pRB激活磷酸化,使用FGFR抑制剂后,位于795号染色体的丝氨酸pRB磷酸化减弱,cyclin D/cdk4复合物活性被抑制。异位cyclin D1表达能够拮抗FGFR-1抑制剂的抗增殖作用,与本实验结果一致,因此本实验指出:FGFR-1介导的信号可能通过细胞周期蛋白D的调节连接于细胞周期,调控pRB磷酸化参与肿瘤发生、发展。为了增加实验的科学性和严谨性,本实验还采用原位杂交方法,检测各组cyclin D、FGFR-1的mRNA表达水平,结果显示两种因子表达呈一致性,进一步说明FGFR-1在转录和翻译水平对cyclinD1进行调节。我们的研究结果提供证据表明:FGFR-1扩增是高度增生乳腺癌的驱动力之一,为乳腺癌新的治疗靶点提供了理论依据,FGFR-1抑制剂可能是有效的治疗药,不仅能抑制血管的生成,而且还抑制乳腺癌的生长[15-20]。
[参考文献]
[1]Kohler L,Mireskandari M,Knosel T,et al.FGFR-1 expression and gene copy numbers in human lung cancer[J].Virchows Archiv,2012,461(1):49-57.
[2]Amit D,Ramos A,Hammerman P,et al.Inhibitor-sensitive FGFR-1 amplification in human non-small cell lung cancer[J].Plos One,2011,6(6):9408-9413.
[3]Kwek S,Roy R,Zhou H,et al.Co-amplified genes at 8p12 and 11q13 in breast tumors cooperate with two major pathways in oncogenesis[J].Oncogene,2009,28(17):1892-1903.
[4]Koziczak M,Holbro T,Hynes N.Blocking of FGFR signaling inhibits breast cancer cell proliferation through downregulation of D-type cyclins[J].Oncogene,2004,23(20):3501-3508.
[5]郭峻莉,郑少江,郑少萍,等.Ag43/FGFR-1嵌合蛋白疫苗抗小鼠纤维肉瘤血管生成的实验研究[J].海南医学院学报,2009,15(15):403-406.
[6]郑少江,吴焕明,王伟,等.LRP在非小细胞肺癌中的表达及其临床相关性研究[J].海南医学院学报,2004,10 (2):78-81.
[7]Seo A,Jin Y,Lee H,et al.FGFR-1 amplification is asso ciated with poorprognosis and smoking innon-small-cell lungcancer[J].Virchows Archiv,2014,465(5):547-558.
[8]Andre F,Job B,Dessen P,et al.Molecular characterization of breast cancer with high-resolution oligonucleotide comparative genomic hybridization array[J].Clinical Cancer Research,2009,15(2):441-451.
[9]Kadota M,Sato M,Duncan B,et al.Identification of novel gene amplifications in breast cancer and coexistence of gene amplification with an activating mutation of PIK3CA[J].Cancer Research,2009,69(18):7357-7365.
[10]Nicholas T,Alex P,Rachel S,et al.FGFR-1 amplification drives endocrine therapy resistance and is a therapeutic target in breast cancer[J].Cancer Research,2010,70(5):2085-2094.
[11]Ye T,Wei X,Yin T,et al.Inhibition of FGFR signaling by PD173074 improves antitumor immunity and impairs breast cancer metastasis[J].Breast Cancer Research& Treatment,2014,143(3):435-446.
[12]Min H,Kim E,Choi Y,et al.FGFR-1 is amplified during the progression of in situ to invasive breast carcinoma[J].Breast Cancer Research,2012,14(4):1-12.
[13]Bilalovie N,Vranic S,Basic H,et al.Immunohistochemical evaluation of cyclinD1 in breast cancer[J].Croatian Medical Journal,2005,46(3):382-388.
[14]Etsu T,Ayako T.Functions of cyclin D1 as an oncogene and regulation of cyclin D1 expression[J].Cancer Science,2007,98(5):629-635.
[15]王阳,徐细明,邓君健,等.p16及cyclin D1在乳腺癌组织中的表达及其临床意义[J].医学综述,2014,20 (23):4358-4360.
[16]姜影,佟丹丹,张颖.乳腺癌中RUNX3、cyclinD1和p27^kip1蛋白的表达及其意义[J].中国肿瘤,2007,16(6):442-444.
[17]陆劲松,沈镇宙,吴炅.细胞周期蛋白D1、CDK4在乳腺癌中的表达及其临床意义[J].中国癌症杂志,2001,11(2):105-108.
[18]周素梅,吴亚群,张筱骅.细胞周期蛋白D1在浸润性乳腺癌中的表达及其临床意义[J].实用癌症杂志,2003,18(5):460-462.
[19]何艳姣,乔超,刘朝霞.乳腺癌中-βcatenin、cyclinD1、c-myc表达及意义[J].首都医科大学学报,2011,(4):549-552.
[20]邓敏,顾永平.乳腺癌中p16,CyclinD1基因蛋白的表达及意义[J].江苏大学学报:医学版,2002,12(3):242-243.
Expression and clinical significance of FGFR-1,cyclinD1 in breast carcinoma
DENG Min1XIE Ruifei2WANG Hui1
1.Department of Pathology,the First People's Hospital of Fuyang District in Hangzhou City,Hangzhou311400,China;
2.Department of Information,Hangzhou Cancer Hospital,Hangzhou310002,China
[Abstract]Objective To study the expression and significance of FGFR-1,cyclinD1 in breast carcinoma.Methods In situ hybridization and immunohistochemistry S-P method were adopted to detect the expression of FGFR-1,cyclinD1 mRNA and protein level in cases of breast cancer,cases of breast fibroadenoma and cases of normal breast tissue.Results In breast carcinoma,the positive rates of FGFR-1 protein and FGFR-1 mRNA were 70.0%(21/30),70.0%(21/30), the positive rates of cyclinD1 protein and cyclinD1 mRNA were 66.7%(20/30),76.7%(23/30),respectively.It was found that the expression of FGFR-1,cyclinD1 in breast carcinoma was obviously higher than in fibroadenoma and normal tissue(P<0.05).The expression of FGFR-1 was coincidence with the cyclinD1.Conclusion The abnormal expression of FGFR-1 plays an important role in the carcinogenesis and progression of human breast carcinoma,the mechanism of which may be up-regulating the expression of cyclinD1.Abnormal expression of FGFR-1 and the overexpression of cyclinD1 could be considered as the useful makers for determining metastasis and prognosis of human breast carcinoma.
[中图分类号]R737.9
[文献标识码]A
[文章编号]1673-9701(2016)04-0001-04
[基金项目]浙江省公益性技术应用研究计划项目(2015C 33268);浙江省富阳市科技项目(富科[2011]22号)
收稿日期:(2015-11-11)

