先天性心脏病大动脉转位小鼠模型的建立
高仕君,聂宇,廉虹,胡盛寿
先天性心脏病大动脉转位小鼠模型的建立
高仕君,聂宇,廉虹,胡盛寿
摘要
目的:尝试建立一种先天性心脏病大动脉转位小鼠模型,为探讨该类疾病发生、发展的相关机制提供条件。
方法:20只8~10周大的SPF级ICR孕鼠随机分为对照组(n=5)和实验组(n=15)。实验组孕鼠在E8.5天给予单次剂量全反式视黄酸(70 mg/kg)腹腔注射,对照组孕鼠在E8.5天给予单次剂量二甲基亚砜(70 mg/kg)腹腔注射。注射完毕后继续饲养至E18天后取出胚胎,在体式显微镜下观察心脏表型。
结果:与对照组相比,实验组胚胎的早产、流产、胚胎吸收的发生率显著增加;大动脉转位表型明显,发生率为61.2%,同时合并突眼、神经管畸形等多种心外表型发生。
结论:全反式视黄酸可以诱导小鼠胚胎发生大动脉转位,是一种可行的疾病动物模型。
关键词心脏缺损,先天性;大血管错位;全反式视黄酸;模型,动物
作者单位:100037北京市,北京协和医学院中国医学科学院国家心血管病中心阜外医院心血管疾病国家重点实验室
(Chinese Circulation Journal,2016,31:499.)
完全性大动脉转位(Transposition of great arteries,TGA)是一种严重的先天心脏发育缺陷,发病率为0.2‰~0.3‰,男女比例为1.5~3.2:1[1],占先天性心脏病的7%~8%。TGA的主要解剖结构改变是主动脉起源于右心室,而肺动脉起源于左心室。绝大多数TGA患儿出生后病情危重,其异常的解剖结构使得患儿出生后一个月生存率为55%,6个月生存率为15%,1年内生存率仅为10%,10岁以上的患者罕见[2]。在我国,尽管一部分患儿可以通过手术治愈,但大部分患儿由于就医时间较晚、合并心内畸形较多,生存率较低。因此,阐明TGA的发病机制对于该类严重心脏畸形的预防和治疗有重要意义。目前,绝大多数TGA发病机制的研究依赖于患儿的临床表型和正常哺乳动物的胚胎作为对照。而利用哺乳动物,特别是小鼠建立TGA模型的研究在国内尚属空白,现将我们的建模方法、结果和经验报道如下。
1 材料与方法
1.1 主要材料
SPF级雌性和雄性ICR小鼠(8~10周)购自北京市维通利华公司。相关动物实验操作按照《北京实验动物管理条例(1996)》的相关规定规范执行。全反式视黄酸(美国SIGMA公司),二甲基亚砜(美国SIGMA公司),显微手术器械[上海医疗器械(集团)有限公司手术器械厂],体式显微镜(德国Carl Zeiss公司)。
1.2 实验方法
小鼠准备:每日晚5点将3只雌性小鼠与1只雄性合笼,次日早8点将雌、雄小鼠分笼,并检查雌鼠阴道内阴栓形成情况。有阴栓形成的雌鼠,取出做好标记后,单笼饲养,并开始记录妊娠天数,以发现阴栓形成当日计为E0.5天。
药品准备:全反式视黄酸(500 mg规格)溶于20 ml二甲基亚砜中,配制成浓度为25 mg/ml的工作液,分装保存。
动物模型制备:将20只8~10周大的SPF级ICR孕鼠随机分为对照组(n=5)和实验组(n=15)。实验组孕鼠在E8.5天给予单次剂量全反式视黄酸(70 mg/kg)腹腔注射,对照组孕鼠在E8.5天给予单次剂量二甲基亚砜(70 mg/kg)腹腔注射。注射完毕后继续饲养至E18天。
表型判定:将E18天孕鼠脱颈处死,剖腹取出全部成型的胚胎(发育不完全的胚胎舍弃,不计入统计)。在体式显微镜下观察主动脉和肺动脉分别于左、右心室的连接情况。
1.3 统计学分析
应用 SPSS 19.0统计学软件处理实验数据。所有数据以均数±标准差(±s)表示。组间比较应用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 高剂量全反式视黄酸对胚胎发育的影响
全反式视黄酸注射后,实验组孕鼠的孕期不良事件(包括孕早期流产、孕晚期早产和胚胎终止发育并被母体吸收)的发生率显著提高(P<0.01),15只孕鼠中有7只发生不良事件,其中3只早产,2只流产,2只胚胎吸收;对照组无不良事件发生。在实验组,孕早期流产的小鼠在剖腹探查时,子宫内未见胚胎;孕晚期早产(<E18天)的胎鼠不能成活,出生后即死亡;胚胎吸收的孕鼠腹部膨隆的程度显著低于对照组孕鼠,剖腹探查显示子宫内胚体明显小于对照组相应日龄,几乎所有胚胎发育不健全。
2.2 视黄酸诱导TGA表型发生情况(表1、图1)
实验组孕鼠给药后的平均造模成功率可达61.2%。在体式显微镜下可见,对照组胚胎小鼠心脏呈正位,主动脉起自左心室、肺动脉起自右心室,主动脉位于肺动脉的后方(心脏正面观);而TGA表型胚胎小鼠心脏呈正位,主动脉起自右心室,肺动脉起自左心室,主动脉位于肺动脉的前方(心脏正面观)。
除外心脏表型,在TGA小鼠胚胎中,所有胚胎表现出特殊体型、下肢发育不健全、突眼畸形,另有7枚胚胎表现出严重的神经管发育畸形,表现为脊柱裂或无脑畸形。
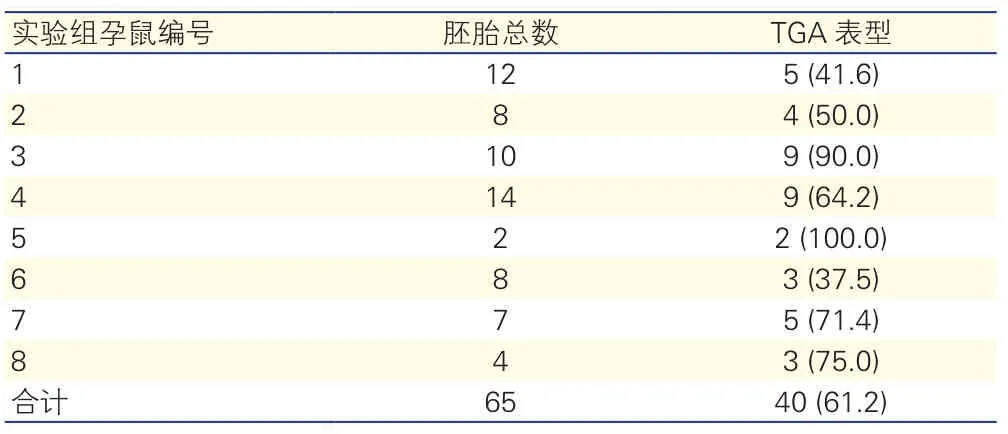
表1 实验组各个孕鼠胚胎总数和大动脉转位表型发生情况[枚(%)]
3 讨论
视黄酸是维生素A在体内的代谢产物,1985年就有人发现视黄酸对胚胎的致畸作用[3],在之后的研究中逐渐发现全反式视黄酸对细胞的增殖、分化和早期胚胎器官的形成有着显著影响[4,5]。在心脏发育过程中,视黄酸与第二生心区的发育调控有着密切的关系[6]。国外的研究团队在之前的一些研究中已经探讨了视黄酸对心脏致畸作用并描述了产生的大动脉转位表型,但在国内仅仅在斑马鱼模型上有所尝试,而未涉及利用哺乳动物建立模型[7,8]。
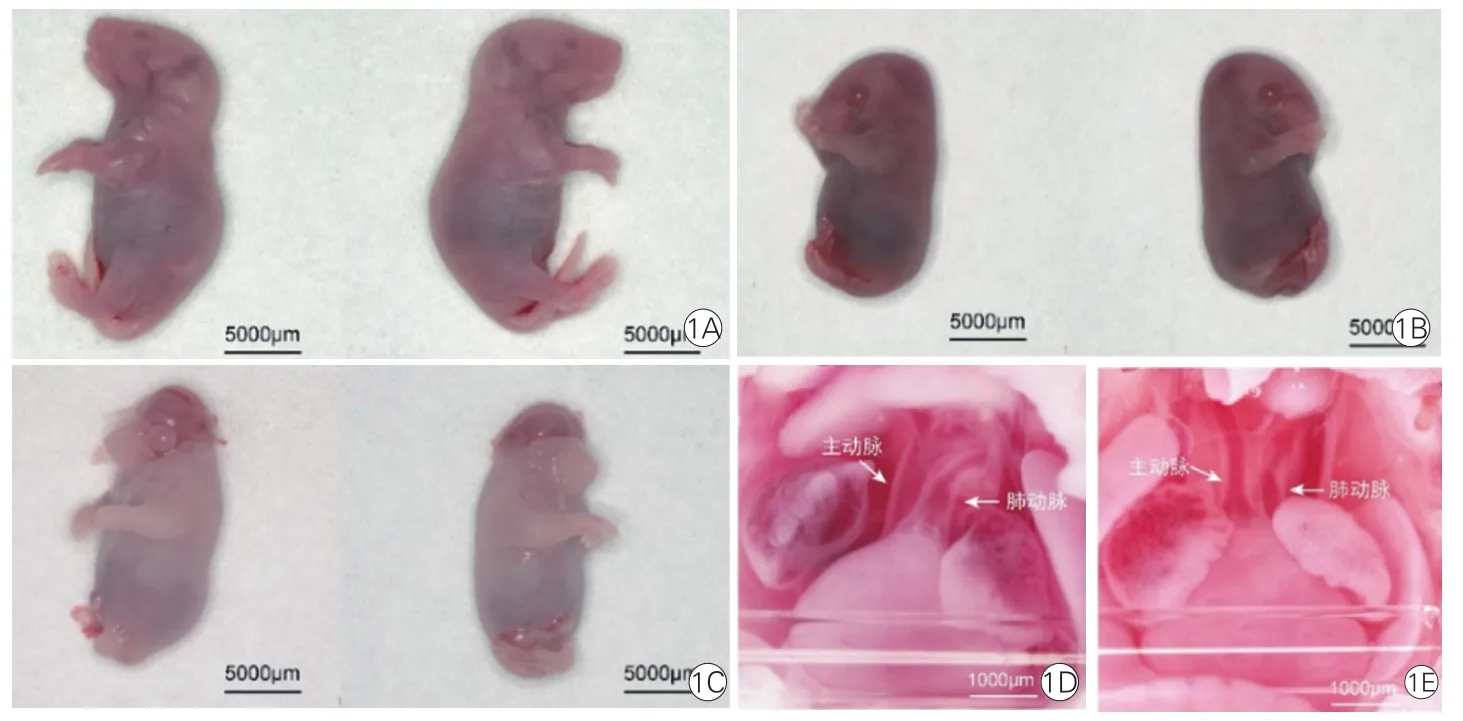
图1 对照组与实验组胎鼠的大动脉转位表型和心外表型
本文利用高浓度的全反式视黄酸诱导胚胎产生TGA表型,其表型产生的机制至今不明。目前有研究报道的可能的作用途径包括:神经嵴细胞的迁移、视黄酸受体及视黄酸相关蛋白功能改变。神经嵴细胞参与了流出道发育及分隔过程,因此神经嵴细胞在迁移方向、迁移数量上出现的任何改变都可能引起流出道发育畸形,其中大动脉转位就是主要结果之一[9]。视黄酸受体主要有RAR、RXR两种,其与视黄酸结合蛋白(cellular retinoic acid-binding protein,CRABP)共同调控胚胎发育过程中细胞的增殖过程。视黄酸在CRABP与视黄酸受体RAR结合后可以导致发育中的细胞周期停滞和凋亡,从而抑制流出道局部的发育。这也是可能导致TGA的原因之一[10]。
同时,鉴于视黄酸强大的胚胎毒性作用,TGA表型常常伴随其它心外畸形的出现,如突眼、肢体发育畸形、神经管发育畸形、无脑等。这些心外畸形的出现与国外其他团队的研究一致,充分提示视黄酸的致畸作用是系统性的,可能同时影响多条发育相关的分子信号通路,如Notch通路、左右不对称发育通路等[11]。由此,在利用全反式视黄酸构建小鼠TGA模型的实际操作中有如下两方面需要尤其关注:第一,给药时间点的把握。由于小鼠胚胎的心脏发育时间窗为8.5~10.5天,在此期间心脏发育过程迅速。因此给药时间点的偏移将影响药物对心脏的致畸作用,表现为大动脉转位表型获得率低。第二,腹腔注射部位的选定。小鼠为双角子宫,子宫位置大致分布于腹部两侧。本研究选用高浓度的全反式视黄酸,给药后药物扩散和吸收速率差异易造成局部药物浓度过高,因此腹腔注射部位应选择靠近腹中线部位。
总之,本文描述的这种大动脉转位动物模型可以为疾病提供一种良好的哺乳动物模型,从而可以更契合、便捷、深入地研究疾病的发病机制。
参考文献
[1]Martins P,Castela E.Transposition of the great arteries.Orphanet J Rare Dis,2008,3:27.
[2]Friedberg DZ,Nadas AS.Clinical profile of patients with congenital corrected transposition of the great arteries:A study of 60 cases.N Engl J Med,1970,282:1053-1059.
[3]Lammer EJ,Chen DT,Hoar RM,et al.Retinoic acid embryopathy.N Engl J Med,1985,313:837-841.
[4]Wanek N,Gardiner DM,Muneoka K,et al.Conversion by retinoic acid of anterior cells into ZPA cells in the chick wing bud.Nature,1991,350:81-83.
[5]Noji S,Ohno T,Koyama E,et al.Retinoic acid induces polarizing activity but is unlikely to be a morphogen in the chick limb bud.Nature,1991,350:83-86.
[6]Lucile R,Zengxin W,Nicolas B,et al.Retinoic acid deficiency alters second heart field formation.Proc Natl AcadSci USA,2008,105:2913-2918.
[7]Yasui H,Nakazawa M,Morishima M,et al.Morphological observations on the pathogenetic process of transposition of the great arteries induced by retinoic acid in mice.Circulation,1995,1:2478-2486.
[8]Cipollone D,Amati F,Carsetti R,et al.A multiple retinoic acid antagonist induces conotruncal anomalies,including transposition of the great arteries,in mice.Cardiovasc Pathol,2006,15:194-202.
[9]Yamagishi H,Maeda J,Uchida K,et al.Molecular embryology for an understanding of congenital heart diseases.Anat SciInt,2009,84:88-94.
[10]Schug TT,Berry DC,Shaw NS,et al.Opposing effects of retinoic acid on cell growth result from alternate activation of two different nuclear receptors.Cell,2007,129:723-733.
[11]Kawakami Y,Raya A,Raya RM,et al.Retinoic acid signalling links left-right asymmetric patterning and bilaterally symmetric somitogenesis in the zebrafish embryo.Nature,2005,435:165-171.
(编辑:许菁)
Establishment of Congenital Heart Disease Transposition of Great Arteries in Experimental Mice Model
GAO Shi-jun,NIE Yu,LIAN Hong,HU Sheng-shou.
State Key Laboratory of Cardiovascular Disease,Cardiovascular Institute and Fu Wai Hospital,CAMS and PUMC,Beijing (100037),China
Abstract
Objective:To establish a mice model of congenital heart disease transposition of great arteries in order to provide a research reference for the occurrence and development of transposition of great arteries.
Methods:A total of 20 pregnant ICR mice at 8-10 weeks of age were divided into 2 groups:Control group,the mice received a single dose of DMSO 70 mg/kg at 8.5 days of gestation,n=5 and Experiment group,the mice received a single dose of all-trans retinoic acid 70 mg/kg at 8.5 days of gestation,n=15.All animals were treated for 18 days and then the embryos were taken to observe cardiac morphology under stereomicroscope.
Results:Compared with Control group,Experiment group had obviously increased occurrence rates of premature delivery,abortion and embryo absorption,and 61.2% phenotype for transposition of great arteries; meanwhile,combining with non-heart defect phenotypeas exophthalmos and spinal malformation.
Conclusion:All-trans retinoic acid may induce transposition of great arteries in mice embryos,which is a feasible animal model in experimental research.
Key wordsHeart delects,congenital; Transposition of great arteries; All-trans retinoic acid; Model,animals
基金项目:国家自然科学基金项目(81441010,81430006,81500239)
作者简介:高仕君硕士研究生主要从事先天性心脏病和心脏再生的科研工作Email:dr.gaoshijun@hotmail.com通讯作者:胡盛寿Email:shengshouhu@yahoo.com
中图分类号:R54
文献标识码:A
文章编号:1000-3614(2016)05-0499-03
doi:10.3969/j.issn.1000-3614.2016.05.019
Corresponding Author:HU Sheng-shou,Email:shengshouhu@yahoo.com
收稿日期:(2015-11-06)

