一株产酯酶菌的分离鉴定及其酶学性质研究
段 俐,赵 一,王崇慧,王丽丽
(河北科技大学生物科学与工程学院,河北 石家庄 050018)
一株产酯酶菌的分离鉴定及其酶学性质研究
段俐,赵一,王崇慧,王丽丽
(河北科技大学生物科学与工程学院,河北 石家庄 050018)
摘要:从土壤中分离得到一株产酯酶菌,经16S rDNA 序列测定,属于嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia),命名为S.mal SF-H。对该菌株产酶的诱导效应及其酶学性质进行了研究。结果表明,培养基中加入5 g·L-1柠檬酸三正丁酯塑化剂,可以有效诱导该菌株产生酯酶,所产酯酶对短链脂肪酸酯的水解活性有明显底物特异性和差异性。以对硝基苯乙酸酯为底物时,酶液表现出良好的耐温性,最适温度为80 ℃,且70 ℃保温2 h的相对酶活力为95%,最适pH值为9.0,在pH值为8.0时稳定性最好;以对硝基苯丁酸酯为底物时,酶的最适温度为70 ℃,70 ℃保温2 h的相对酶活力为51%,最适pH值为8.0,在pH值为8.0~10.0时稳定性最好。所产酯酶的耐溶剂性表现基本一致,在66%丁醇和66%乙醇中相对酶活力均约为60%。
关键词:酯酶;柠檬酸三正丁酯;16S rDNA;嗜麦芽寡养单胞菌
酯酶(esterase,EC3.1.1.1)是一类特异水解短链脂肪酸酯的水解酶类,广泛存在于动物、 植物和微生物中。研究发现,酯酶可以在有机相中完成酯化、转酯、酯交换等多种反应[1],特别是可专一性地制备许多化学法难以合成的手性化合物和聚合物[2-3]。阎家麒[4]采用牛肝酯酶催化了紫杉醇侧链的手性合成。王博[5]筛选得到了一种高活性和高选择性的水解酶(酯酶Escherichia coliBioH),该酶对仲醇类化合物具有非常好的手性选择性,在水溶液中可以将一系列仲醇乙酸酯较好地拆分,ee值最高可达98%。鞠鑫[6]筛选得到了一株以高活力和高对映选择性催化S-乙酰基扁桃酸水解的假单胞菌Pseudomonassp.ECU1011,其能以乙酰基扁桃酸及扁桃酸甲酯和乙酯为目标底物酶促水解生成手性扁桃酸。Li等[7-8]从古生物球菌中提取了一种嗜热酯酶,在甲苯溶液中于70 ℃催化ε-己内酯开环聚合反应,反应24h时产率达到99%。与化学法相比,酯酶催化反应的条件温和,可避免使用有毒催化剂。
塑化剂,也称增塑剂,是在塑料加工中添加的一种高分子助剂,以增强塑料的柔韧性和可加工性。目前,塑化剂的生产都是通过化学法完成的,探索酶法合成柠檬酸酯类塑化剂的途径,是绿色生物技术的研究方向之一。由于酯酶具有水相分解、有机相催化合成的功效,因此,作者在此筛选能够水解柠檬酸酯类塑化剂的酯酶,并对其进行鉴定和酶学性质研究。
1实验
1.1材料、试剂与培养基
土壤样本,取自多地。
对硝基苯乙酸酯、对硝基苯丁酸酯、对硝基苯辛酸酯、对硝基苯月桂酸酯、对硝基苯棕榈酸酯,北京百灵威科技有限公司;塑化剂柠檬酸三正丁酯(LM30),江苏雷蒙化工科技有限公司。
ZM-CD液体基础培养基(1L):(NH4)2SO44g、KH2PO41g、MgSO4·7H2O1g、NaCl0.5g、Fe2+1mg、Zn2+1mg、Mn2+0.5mg、Cu2+0.5mg,调pH=7.0,121 ℃下高温灭菌,无菌GF(1mL/400mL)。
筛选固体培养基(1L):ZM-CD液体基础培养基中加入琼脂22g及LM30 10g。
富集液体培养基(1L):ZM-CD液体基础培养基中加入LM30 10g及溴甲酚紫0.04g(变色pH值范围:5.2~6.8,黄色~紫色),pH=7.0。
发酵液体培养基(1L):ZM-CD液体基础培养基中加入不同浓度的蛋白胨、酵母粉、碳源、LM30等。
1.2方法
1.2.1菌株的富集与筛选
将100份土壤样品稀释后,分别涂布到筛选固体培养基平板上,30 ℃下培养3d;挑取生长良好的菌落,分别接种到50mL/250mL富集液体培养基中,30 ℃、180r·min-1下培养3d,淘汰溴甲酚紫不变色的摇瓶,保留变成黄色的摇瓶;10%接种,转接到新的富集液体培养基中,连续富集培养5代。每一代均保留变色时间短、生长快的摇瓶,将最后一代富集液梯度稀释分离,得到纯化优势菌株。
1.2.2菌株的鉴定
扩增菌株后,进行16SrDNA的PCR扩增及序列分析,测序结果在NCBI数据库中进行Blastn搜索[9],获得与其同源性相近的序列,再使用MEGA6.0 软件构建系统发育进化树。
1.2.3酯酶酶活力的测定
菌株液体培养30h后,于6 500r·min-1下离心10min,取上清液作为粗酶液,参照文献[10-11]方法测定酯酶酶活力。
酶活力单位:每分钟释放出1μmol对硝基苯酚所需要的酶量定义为一个酶活力单位。
相对酶活力:处理样品的酶活力与最大酶活力的百分比。
1.2.4酶液的浓缩及SDS-PAGE凝胶电泳
使用10kDa的截止离心膜过滤器(Millipore公司,美国)对上清液进行超滤浓缩[12],12mL粗酶液在5 000g、4 ℃的条件下离心40min,得到200μL的粗酶浓缩液。将所得粗酶浓缩液处理后进行SDS-PAGE凝胶电泳。
1.2.5酶学性质分析
以粗酶液为检测对象,测定反应温度、pH值、有机溶剂等对酶活力的影响。
2结果与讨论
2.1菌株的筛选及鉴定
培养基以塑化剂LM30作为唯一碳源,若胞外酯酶分解LM30,会使柠檬酸的羧基游离,溶液pH值下降,酶活力提高,分解速度加快,当培养基pH值下降到5.2以下时会由紫色变成黄色。因此,对变色最快的菌株进行多轮富集培养,再稀释分离纯化,并经液体培养基分别培养3 d后,测定酯酶酶活力,筛选出酶活力较高的菌株,作进一步的鉴定[13-14],并将其命名为SF-H。
菌株SF-H在固体培养基上于30 ℃下培养24 h后,菌落呈灰黄色,圆形,表面较黏稠而湿润,不透明,边缘整齐。显微镜下个体形态为杆状,革兰氏染色为阴性。
对菌株SF-H进行16S rDNA的PCR扩增、序列分析,结果表明,该菌株与嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)16S rDNA的一致性为99%,鉴定为嗜麦芽寡养单胞菌SF-H(StenotrophomonasmaltophiliaSF-H,缩写为S.malSF-H),利用MEGA 6.0软件构建系统发育进化树,如图1所示。
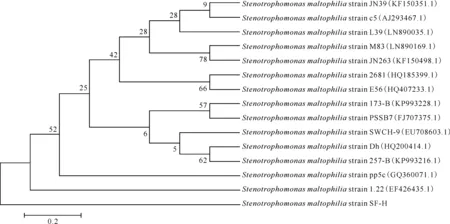
图1 菌株S.mal SF-H与Stenotrophomonas maltophilia属内各菌种间基于16S rDNA序列的系统发育分析
2.2S.mal SF-H菌株生长与酯酶产生关系的研究
菌株S.malSF-H在液体培养基中培养48 h,每隔6 h取样测定其在600 nm下的吸光度(OD600值)及上清液酶活力,以菌株生长和相对酶活力(以最高值为100%)对时间作图得到S.malSF-H菌株生长曲线和酯酶产生曲线,如图2所示。
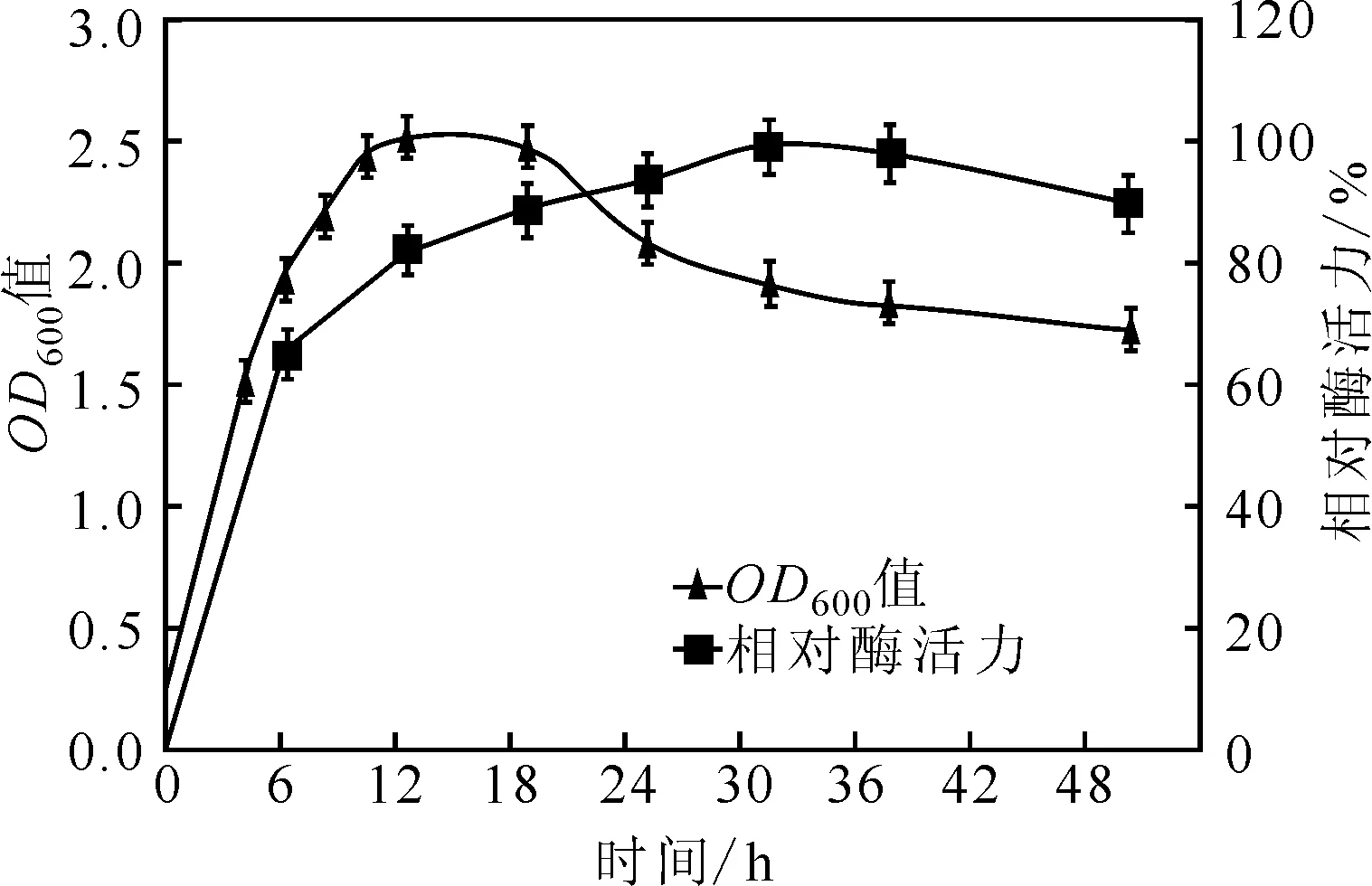
图2 S.mal SF-H菌株生长曲线与酯酶产生曲线
由图2可知,菌株在12 h时达到最大菌体量,18 h后菌体量开始逐渐减少;在0~30 h时,相对酶活力逐渐增大,30 h时达到最大值,超过30 h后,相对酶活力逐渐降低。因此,发酵周期定为30 h。
2.3塑化剂LM30对产酶的诱导效应
将菌株S.malSF-H分别在含有和不含有塑化剂LM30的发酵培养基(含麦芽糖、酵母粉、蛋白胨3种有机物)中培养30 h后,离心获得上清液,分别超滤浓缩60倍后,进行SDS-PAGE凝胶电泳,结果如图3所示。
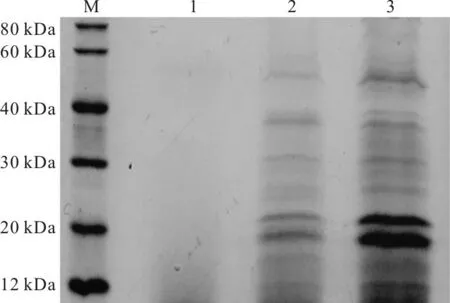
M.上样Marker 1.空白培养基 2.未加
由图3可知,加入LM30后胞外蛋白产物明显增多,特别是分子量大小在20 kDa左右的两条蛋白带。NCBI数据库的基因组信息显示,Stenotrophomonasmaltophilia含有6个酯酶基因,其中有2个基因产物的分子量大小都在20 kDa左右,可推测图3中20 kDa的蛋白带为酯酶的2个基因表达产物,表明LM30有明显的产酯酶诱导作用。
2.4S.mal SF-H菌株所产酯酶的酶学性质研究
2.4.1酯酶的底物特异性
用0.05 mol·L-1Tris-HCl缓冲液(pH=8.0)分别配制5种底物溶液:对硝基苯乙酸酯(pNPC2)、对硝基苯丁酸酯(pNPC4)、对硝基苯辛酸酯(pNPC8)、对硝基苯月桂酸酯(pNPC12)、对硝基苯棕榈酸酯(pNPC16)。用等量酶液分别水解5种底物,在pH=8.0、37 ℃下水浴5 min后,测定产物对硝基苯酚的产量,进而比较酶活力大小,结果见图4。
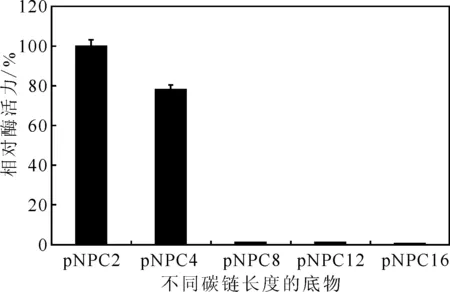
图4 S.mal SF-H菌株所产酯酶的底物特异性
由图4可知,对硝基苯乙酸酯作为底物的相对酶活力最大,对硝基苯丁酸酯作为底物的相对酶活力次之,其它3种底物的相对酶活力很小,有明确的底物特异性。表明,菌株S.malSF-H产生的胞外蛋白均为酯酶,而非脂肪酶。
2.4.2酯酶的最适反应温度
分别以对硝基苯乙酸酯、对硝基苯丁酸酯为底物,测定不同反应温度(30~80 ℃)下的相对酶活力(以最大值为100%),结果见图5。
由图5可知,随着反应温度的升高,相对酶活力逐渐升高;当反应温度为80 ℃时,以对硝基苯乙酸酯为底物的相对酶活力仍在升高,而以对硝基苯丁酸酯为底物的相对酶活力开始下降,但仍有92%。说明该酯酶有较高的温度耐受性[15-16],以对硝基苯乙酸酯为底物时,酶的最适温度为80 ℃,以对硝基苯丁酸酯为底物时,酶的最适反应温度为70 ℃。
2.4.3反应温度对酯酶稳定性的影响
将酶液分别置于30 ℃、40 ℃、50 ℃、60 ℃、 70 ℃和80 ℃的水浴中,反应2 h后恢复到37 ℃,分别测定以对硝基苯乙酸酯和对硝基苯丁酸酯为底物的相对酶活力(以4 ℃下保存的酶活力为最大值100%),结果见图6。
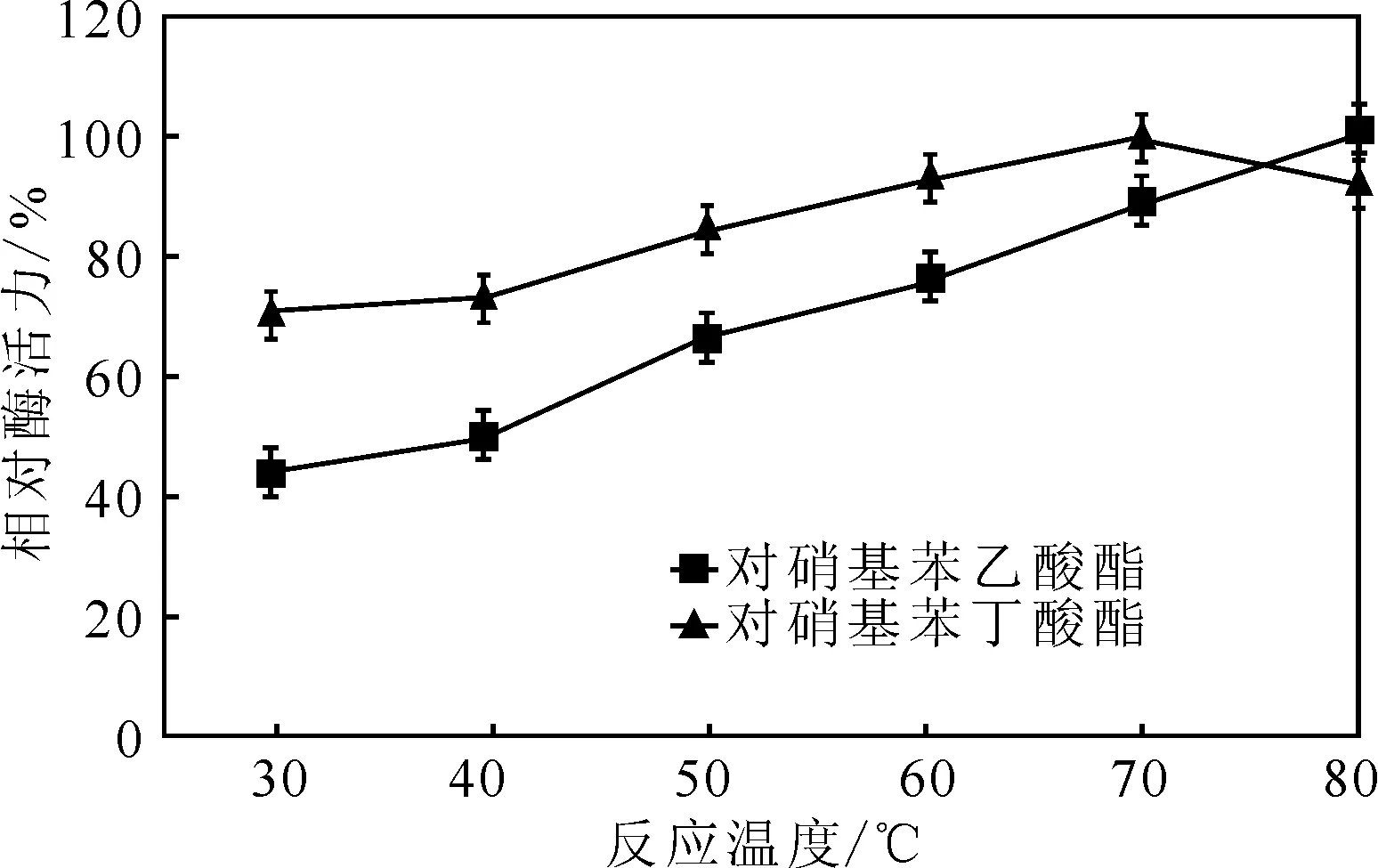
图5 反应温度对酯酶活力的影响
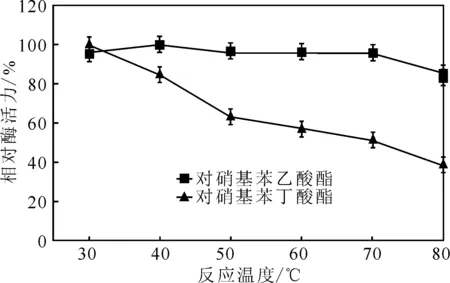
图6 反应温度对酯酶稳定性的影响
由图6可知,在50 ℃下,以对硝基苯乙酸酯为底物的相对酶活力为96%,以对硝基苯丁酸酯为底物的相对酶活力为63%;在70 ℃下,以对硝基苯乙酸酯为底物的相对酶活力为95%,以对硝基苯丁酸酯为底物的相对酶活力为51%;在80 ℃下,以对硝基苯乙酸酯为底物的相对酶活力为85%,以对硝基苯丁酸酯为底物的相对酶活力为39%。该结果进一步表明,菌株S.malSF-H产生的酯酶的耐温性对不同底物有明显差别。
2.4.4酯酶的最适pH值
分别配制pH值为5.0~10.0的缓冲液(磷酸氢二钠-柠檬酸缓冲液pH值为5.0~8.0,硼砂-氢氧化钠缓冲液pH值为9.0~10.0)[17],测定不同pH值下的相对酶活力(以最大值为100%),结果见图7。
由图7可知,当pH=9.0时,以对硝基苯乙酸酯为底物的相对酶活力最高为100%;当pH=8.0时,以对硝基苯丁酸酯为底物的相对酶活力最高为100%。表明,菌株S.malSF-H产生的酯酶以对硝基苯乙酸酯、对硝基苯丁酸酯为底物时的最适反应pH值分别为9.0、8.0。
2.4.5pH值对酶稳定性的影响
将酶液室温下分别置于不同pH值(5.0~10.0)的缓冲液中作用2 h后,恢复到正常条件下测定相对酶活力(以最高值为100%),结果见图8。
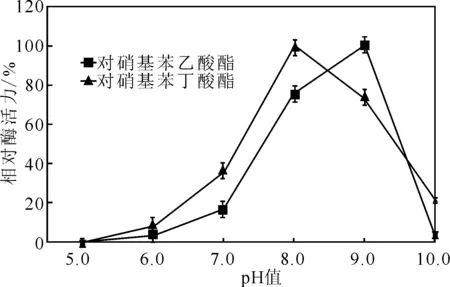
图7 pH值对酯酶活力的影响
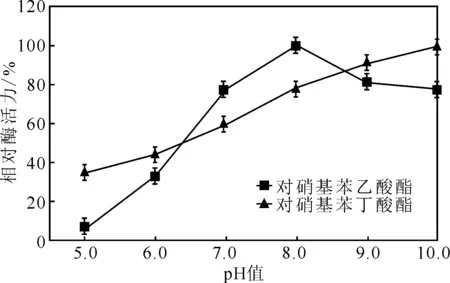
图8 pH值对酯酶稳定性的影响
由图8可知,以对硝基苯乙酸酯为底物时,在pH=8.0时,相对酶活力最高为100%,稳定性最好,在pH值为9.0~10.0时,相对酶活力在75%以上,在pH<8.0之后相对酶活力明显下降,在pH≤7.0之后,相对酶活力低于75%;在以对硝基苯丁酸酯为底物时,相对酶活力随pH值的增大而升高,在pH=10.0时相对酶活力最高100%。说明该酯酶有较好的耐碱性,在碱性条件下酶活力更高[18-20]。
2.4.6酯酶对有机溶剂的耐受性
酶液分别与99%正丁醇、99%乙醇、50%乙醇以1∶2(体积比,下同)混合,混合后实际有机溶剂含量分别为66%正丁醇、66%乙醇、33%乙醇。稳定2 h后,在37 ℃水浴、pH=8.0的条件下测定相对酶活力(以酶液与水1∶2混合液作对照为100%),结果见图9。
由图9可知,在加入有机溶剂后,2种底物的相对酶活力均明显降低,在66%正丁醇、66%乙醇条件下,相对酶活力只有约60%,而且在有机溶剂中2种底物表现基本一致。但总的说来,该酯酶具有较强的有机溶剂耐受性。
3结论
从土壤中分离到一株酯酶产生菌,经16S rDNA序列测定,属于嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia),命名为S.malSF-H。该菌培养基中加入5 g·L-1塑化剂柠檬酸三正丁酯,可以有效诱导该菌株产生酯酶,SDS-PAGE凝胶电泳结果显示,诱导后胞外酶蛋白明显增多,且存在对短链脂肪酸酯的底物特异性和差异性。以对硝基苯乙酸酯为底物时,酶液表现出良好的耐温性,最适温度为80 ℃,且70 ℃保温2 h的相对酶活力为95%,最适pH值为9.0,在pH值为8.0时稳定性最好;以对硝基苯丁酸酯为底物时,酶的最适温度为70 ℃,70 ℃保温2 h的相对酶活力为51%,最适pH值为8.0,在pH值为8.0~10.0时稳定性最好。所产酯酶在不同有机溶剂中的耐受性基本一致,在66%丁醇和66%乙醇中相对酶活力均约为60%。但总的说来,该菌产生的酯酶都有较高的耐温性和耐有机溶剂性,为今后在柠檬酸酯类塑化剂合成的应用奠定了基础。
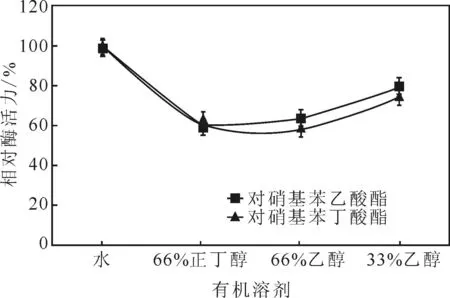
图9 酯酶对有机溶剂的耐受性
参考文献:
[1]滕霞,孙曼雾.羟酸酯酶研究进展[J].生命科学,2003,15(1):31-35.
[2]帅慧慧,薛屏,夏维涛.酯酶在化学合成中的应用进展[J].化学研究与应用,2015,27(7):946-950.
[3]张敏文,刘悦,李荷.微生物酯酶的研究进展[J].广东第二师范学院学报,2012,32(3):66-71.
[4]阎家麒.牛肝酯酶催化紫杉醇侧链手性合成的研究[J].药物生物技术,2005,12(2):90-92.
[5]王博.具有手性选择性酯酶/脂肪酶的筛选、催化特点及应用研究[D].杭州:浙江大学,2011.
[6]鞠鑫.假单胞菌酯酶的发现及其在制备手性扁桃酸中的应用[D].上海:华东理工大学,2011.
[7]LI Q S,LI G Q,MA F Q,et al.Highly efficient ring-opening polymerization of caprolactone catalyzed by a recombinantEscherichiacoliwhole-cell biocatalyst[J].Process Biochemistry,2011,46:477-481.
[8]LI Q S,YANG Y,YU Y,et al.Lipase/esterase-catalyzed ring-opening polymerization:a green polyester synthesis technique[J].Process Biochemistry,2011,46:1900-1908.
[9]董伟,郭立忠,李翠翠,等. 一株高产酯酶中度嗜盐菌的分离、鉴定及酯酶部分酶学性质的研究[J].微生物学通报,2009, 36(4): 479-483.
[10]王欢,何腊平,周换景,等.脂肪酶活力测定方法及其在筛选产脂肪酶微生物中的应用[J].生物技术通报,2013(1):203-208.
[11]江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较与改进[J].化学与生物工程,2007,24(8):72-75.
[12]LI M,YANG L,XU G,et al.Screening,purification and characterization of a novel cold-active and organic solvent-tolerant lipase fromStenotrophomonasmaltophiliaCGMCC 4254[J].Bioresource Technology,2013,148:114-120.
[13]覃拥灵,何海燕,李楠,等.酯酶产生菌株的分离筛选[J].微生物学通报,2007,34(3):549-552.
[14]鄢洪德,汪钊,李光伟.产酯酶微生物菌种的筛选研究[J].工业微生物,2007,37(6):44-48.
[15]KIM J,DENG L,HONG E,et al.Cloning and characterization of a novel thermostable esterase fromBacillusgelatiniKACC 12197[J].Protein Expression and Purication,2015,116:90-97.
[16]GHATI A,PAUL G.Purification and characterization of a ther-mohalophilic, alkali-stable and extremely benzene tolerant esterase from a thermo-halo tolerantBacilluscereusstrain AGP-03, isolated from ‘Bakreshwar’ hot spring,India[J].Process Biochemistry,2015,50(5):771-781.
[17]萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南[M].第3版.黄培堂,译.北京:科学出版社,2008.
[18]齐勇,王际辉,叶淑红,等.一株产酯酶海洋细菌的筛选及酯酶性质的研究[J].食品研究与开发,2011,32(7):133-136.
[19]侯颖,秦翠丽,宫强,等.酯酶产生菌的分离与酶学性质研究[J].微生物学杂志,2012,32(4):35-39.
[20]吕梅.Lichtheimia属HSM菌株酯酶发酵条件及酶学特性研究[D].武汉:湖北工业大学,2014.
Isolation and Identification of An Esterase-Producing Strainand Its Enzymatic Properties
DUAN Li,ZHAO Yi,WANG Chong-hui,WANG Li-li
(CollegeofBioscience&Bioengineering,HebeiUniversityofScienceandTechnology,Shijiazhuang050018,China)
Abstract:An esterase-producing strain was isolated from the soil.It was identified as Stenotrophomonas maltophilia by 16S rDNA sequence analysis and named as S.mal SF-H.The inductive effects of esterase producing and the enzymatic properties of the strain were studied.Results showed that adding 5 g·L-1tributyl citrate(TBC) to the medium could effectively induce the strain to produce esterases.The esterases had significant substrate specificity and diversity on hydrolytic activity among short-chain aliphatic esters.When using p-nitrophenyl acetate as a substrate,S.mal SF-H exhibited great temperature tolerance.The optimum temperature was 80 ℃,and the relative enzyme activity was 95% after water bath at 70 ℃ for 2 h,the optimum pH value was 9.0,and enzyme stability was the best at pH=8.0.When using p-nitrophenyl butyrate as a substrate,the optimum temperature was 70 ℃,and the relative enzyme activity was 51% after water bath at 70 ℃ for 2 h,the optimum pH value was 8.0,and enzyme stability was the best at pH=8.0~10.0.However,the solvent resistance for all esterases were similar,the relative enzyme activities were about 60% in 66% butanol or 66% ethanol solvents.
Keywords:esterase;tributyl citrate;16S rDNA;Stenotrophomonas maltophilia
基金项目:国家863计划资助项目(2014AA022102)
收稿日期:2016-01-13
作者简介:段俐(1990-),女,河北石家庄人,硕士研究生,研究方向:工业微生物及其应用,E-mail:byzzywyfwz2426@163.com;通讯作者:王丽丽,教授,E-mail:88632wanglili@163.com。
doi:10.3969/j.issn.1672-5425.2016.05.005
中图分类号:Q 556
文献标识码:A
文章编号:1672-5425(2016)05-0020-06

